真菌生长会导致储存的商品谷物和坚果的质量和营养价值显著降低。花生中的真菌腐败还会导致有毒次生代谢产物的污染,尤其是黄曲霉毒素。黄曲霉毒素B1(AFB1)是1a类致癌物质。采前的干旱胁迫或干燥和储存不当会导致黄曲霉和寄生曲霉在花生和树生坚果的定殖,并伴随AFB1污染。事实上,20%~25% 的损失可能都是由腐败霉菌和真菌毒素造成的[1-2]。
为了卫生目的消除真菌污染物和害虫,使用气调贮藏、监测挥发性有机化合物和化学熏蒸,特别是采后储存期对筒仓都进行检测使用[3]。然而,从食品安全的角度看,由于残留问题和消费者接受度的问题,气体熏蒸剂的使用受到限制。因此,已考虑采用替代方法来减少产真菌毒素物种的真菌污染,并尝试减少采后损失[3]。
气体系统中关键检测二氧化硫(SO2)和臭氧(O3)。SO2是一种气态食品添加剂,多年来一直是通过燃烧硫磺产生的烟雾作为消毒剂[4-5]。由于其抗菌特性,SO2也被归为食品级防腐剂(E220)。它也被用作抗真菌剂,用于保存葡萄和一系列加工食品,包括干果、烘焙产品、早餐麦片和包括白葡萄酒在内的饮品[6]。然而,高浓度的 SO2会对人体产生影响,包括肝脏和心血管疾病、皮疹和呼吸系统问题[7]。为了控制谷物中的霉菌和真菌毒素,Serre[8]报道,用 SO2处理小麦需要较高的浓度,因为SO2会被吸收并结合到小麦上,从而将抗真菌活性降至最低。
Magan[4-5]研究表明,在0.995和0.95的水分活度(aw)下,50 ppm溶解的SO2可阻止产毒素真菌(例如黄曲霉、赭曲霉和土曲霉)的生长。然而,在 0.96和 0.92 aw条件下,通常需要至少200 ppm 的 SO2才能将谷物中的真菌数量减少1~2 log CFU。Pezley[9]发现 SO2与食物的营养成分结合使酵母对较高浓度的SO2具有更强的抵抗力。SO2在水中的溶解产物很大程度上取决于pH水平[10]。他们建议用于控制 OTA的SO2的焦亚硫酸钠的有效剂量,在 0.985 aw时约为 650~700 ppm,在 0.965 aw时约为 400~500 ppm,0.93 aw时约为 400~450 ppm。
臭氧(O3)是一种强氧化剂和不稳定的三原子化合物,可在低层大气中分解为正常的氧气(O2),而没有任何残留物[11]。气态O3是一种无色气体,在食品工业中被用作微生物和化学品的高效氧化剂和消毒剂[12]。O3气体通过两种方法自然产生,包括太阳紫外线和闪电。也可通过三种方法人工生产,包括紫外线、电晕放电法(CDM)和电解 O3产生法(EOG)。电晕放电法是当今最常用的O3产生方法[3,13]。
O3气体已广泛用于食品行业,用于对包装材料、原材料和存储设施的消毒[14]。与食品中使用的其他化学品相比,O3最重要的优势是它无残留。由于其半衰期很短,在大气中约为20~50 min,在水中约为1~10 min,它会迅速分解为双原子氧[15]。研究还发现 O3可有效破坏毒素和进行真菌毒素脱毒,包括黄曲霉毒素[16]。
O3虽然对微生物有效,特别是应用于水基系统,但在食品生产链应用时还是需要注意。O3会导致质量和营养价值发生负面变化,特别是与脂质氧化、颜色损失、某些维生素和酚类化合物降解有关[16-17]。它还被用于医疗应用,包括治疗糖尿病患者的足部溃疡[18]。然而,需要注意,暴露高于自然水平的高剂量O3会有害健康,例如呼吸系统[19]和心血管疾病[20]。根据联邦职业安全与健康管理局(OSHA)规定[21],FDA对O3的限量是0.1 ppm 连续 8 h 或 0.3 ppm 15 min 使用。
真菌种类对O3具有不同的敏感性和耐受性,这取决于浓度(ppm)×暴露时间、孢子形态以及底物类型和水分含量的影响[11]。El-Desoky等[22]发现,随着O3浓度和暴露时间的增加,黄曲霉在(PDA)培养基中产生的 AFB1量逐渐减少。他们还发现,暴露于 40 ppm O3 5~20 min 后,黄曲霉在谷物(如小麦)中产生的AFB1降低了55%~77%。Sahab等[23]报道,花生种子在 40 ppm O3中暴露 10 min可抑制 95%的 AFB1和 99%的AFB2。然而,在这些研究中没有控制可用水条件。在最近对咖啡进行 O3处理以减少赭曲霉和炭黑曲霉的数量以及赭曲霉毒素 A(OTA)污染的研究中发现,即使浓度为 600 ppm,也难以有效降低该商品中的OTA水平[11]。
本研究的目的是:(a)研究气态 O3在 YES培养基不同水分活度(aw)条件下,对两株黄曲霉(从花生中分离的EGP-B07,参考菌株SRRC-G 1907)的孢子萌发、菌丝生长和 AFB1 产生的影响;(b)评估 O3处理对接种不同初始孢子浓度(103,105 CFUS/mL)的储存花生中黄曲霉种群的影响;(c)对储存花生AFB1污染影响的量化。
1 材料与方法
1.1 实验材料
Miracloth:德国,默克公司;商品 MEA:Oxoid,英国汉普郡贝辛斯托克;55 mm培养皿:英国莱斯特郡拉夫堡,赛默飞世尔科技公司;电晕放电臭氧发生器,C-Lasky,型号CL-010-DS:空气树臭氧技术有限公司,台湾台北 22150;O3分析仪:美国新墨西哥州圣达菲,生态传感器公司,型号UV 100;KS 501数字振荡器:德国,艾卡公司;黄曲霉毒素混合标准品的甲醇母液:美国宾夕法尼亚,Supelco公司;aflaprep柱:Neogene Europe,宽口径;Agilent 1200 系列系统:英国伯克斯,安捷伦公司;C18 柱(Luna 5 micron,150×4.6 mm)、保护柱(4×3 mm 柱):美国飞诺美公司;Statistica 9:美国俄勒冈州塔尔萨,StatSoft 公司。
1.2 真菌菌株
从埃及花生中分离到的黄曲霉EGP-B07用于体外或体内接种实验。在 MEA检测前对真菌菌株进行传代培养。用10 mL含0.05%吐温-20的无菌蒸馏水从菌落表面洗下孢子至25 mL瓶。所得孢子悬浮液过两层Miracloth滤布过滤。真菌孢子浓度用血细胞计数器测定,并调整至 106个孢子/mL,用于培养基培养或花生接种。黄曲霉模式菌株SRRC-G1907作为参考菌株进行实验比较。
1.3 研究用培养基
麦芽浸膏培养基(MEA):商品MEA根据供应商说明使用,其中加入少量氯霉素(250 μg/mL)以抑制细菌生长,各组分混合均匀,在121 ℃,1 atm条件下高压灭菌15 min。培养基冷却至约50 ℃时,倒入无菌的90 mm直径培养皿中。冷却凝固的平板放入密封袋,在4 ℃下最长可保存21 d。
酵母浸膏蔗糖培养基(YES):在885 mL蒸馏水中加入20 g酵母提取物和琼脂、150 g蔗糖和 0.5 g MgSO4·7H2O 制备成 YES。各组分混合均匀,高压灭菌后,倒入55 mm培养皿中。4 ℃保存在密封袋中。使用前先在25 ℃下平衡。
用甘油(9.2、23和 36.8 g/100 mL)调整 YES培养基的水分活度。充分混合,调整水分活度至0.95、0.92 和 0.89 aw(=19.5%~13.1% m.c.)。将培养基倒入直径为55 mm培养皿。使用Aqualab TE3仪器检查所有培养基 aw水平,误差控制在0.003 aw 以内。
1.4 臭氧的制备方法
臭氧气体由实验室电晕放电臭氧发生器产生,流速为6 L/min[11]。将装有花生的盘子或容器(无盖)置于O3暴露室(Kilner玻璃罐)中并密封。臭氧气体通过一根管子和腔室盖中的相关阀门加入,并控制所需的浓度。由第二个管和 O3分析仪测量出口气体中O3 的浓度。确保在O3暴露期间获得准确的O3浓度。
1.5 臭氧暴露对黄曲霉分生孢子萌发的影响
将100 μL黄曲霉106孢子/mL等份地涂布在不同的aw水平(0.89、0.92、0.95和0.97 aw)的YES培养基上,并将平板放置在无盖的O3反应器中保持无菌。调节 O3发生器使反应室内持续30 min 产生 20、40、100 和 250 ppm O3,流速为6 L/min。处理后,平板在 25 ℃培养 48 h。每隔12 h取下两块(直径 0.8 cm)置于载玻片用乳酚棉蓝染色,小心地盖上盖玻片,并检查萌发情况。检查四个随机显微区域以确定两种菌株的孢子萌发情况。所有实验均进行3次生物学重复和技术操作重复1次。当芽管长度等于或大于孢子直径时,认为孢子已经萌发[24]。计数萌发孢子数,并记录其占总孢子数的百分比。
1.6 臭氧暴露对菌丝生长和AFB1产生的影响
在不同 aw水平的 YES培养基平板中,接种每株菌株的孢子悬浮液(106/mL)5 μL,并在 25 ℃下培养。当两黄曲霉菌株的菌落直径达到 0.6~0.8 cm 时,将菌落分别暴露于 75、100、150和300 ppm 的 O3 6 L/min 中 30 min。随后将处理过的平板置于25 ℃中培养72 h。每12 h在成直角的两个方向上测量菌落直径。利用菌落生长与时间的关系和线性生长阶段的斜率来获得径向生长率mm/day。
1.7 O3对黄曲霉 EGP-B07和带壳花生 AFB1产量的原位影响
带壳花生最初在12~15 KGys(参照)下进行伽马辐照,以杀死所有污染微生物。通过水分吸附曲线来计算花生样品在目标 aw水平中所需的准确水量[25]。将带壳花生样品(25 gms)置于带微孔盖的玻璃罐中,将其分成2组并加水以获得0.93 aw (=16.5% m.c.)。在密封的环境室中 4 ℃下平衡过夜,期间定期混合以实现有效平衡,然后在25 ℃下平衡,每克花生接种103或105个孢子。三个重复样品25 ℃下在通风橱中以6 L/min的流速经100、200和400 ppm的气态O3中,无菌暴露 30 min。对照组以相同方式暴露于空气中30 min。处理分别在密封的环境室进行。每个环境室包括 2×500 mL 0.93 aw的甘油/水溶液,以保持大气平衡相对湿度与带壳花生的一致。
25 ℃储存4 d,处理前和处理后分别测定储存带壳花生中黄曲霉数量和AFB1水平。在MEA板上计数,每个重复取5 mg样品连续稀释,用无菌水+吐温80(0.125%)稀释为多个梯度(10-2~10-6),并取0.1 mL涂布于MEA培养基。将这些平板在25 ℃下培养5~7 d,并根据干重(g/花生)对黄曲霉种群数量进行量化。
1.8 使用高效液相色谱法(HPLC)从培养基和花生样品中提取和定量AFB1
1.8.1 从培养基取样
将暴露于不同 O3浓度的 YES培养基上菌丝菌落(5~6 块,直径 5 mm)转移到 2 mL Eppendorf管中并称重[26]。将 800 μL氯仿等量加入每个Eppendorf管,使用KS 501数字振荡器振荡1 h。将氯仿提取物转移到新的液相小瓶中,空气中干燥后使用AOAC[27]的衍生方法,然后使用HPLC进行定量分析。将200 µL黄曲霉毒素混合标准品的甲醇母液,含有 200 ng B1、60 ng B2、200 ng G1和60 ng G1,氮吹干燥并衍生化。制备四种浓度HPLC上样注射液,绘制标准曲线。HPLC的AFB1检测限为 0.8 ng/g。
1.8.2 花生中黄曲霉毒素B1的分析
使用 aflaprep柱对来自每个处理的花生样品的三个重复进行AFB1分析。将5 g研磨样品与1 g盐(NaCl)和 25 mL 60%甲醇混匀(高速 1 min)。然后通过Whatman 1号滤纸过滤,滤液收集在干净的容器中。用磷酸盐缓冲液(PBS)1∶1稀释10 mL 过滤物。稀释的提取物(20 mL=2 g 样品)以约1.5~2.0 mL/min的速率通过适配器连接到柱上的50 mL玻璃注射器储液罐中,在不干燥的情况下过aflaprep柱。移除50 mL玻璃注射器和适配器,将柱子完全充满25%甲醇,然后将储液器重新连接到适配器上。20 mL 25%甲醇以 2 mL/min的速率通过色谱柱(直到空气通过色谱柱)。将2 mL甲醇小心推过色谱柱,并收集在 2 mL Eppendorf管中。洗脱液氮吹轻轻干燥,进行衍生化,然后进行 HPLC分析。花生种子 AFB1的检测限为 0.012 ng/g。
1.8.3 黄曲霉毒素的衍生化
将 200 μL 己烷和 50 μL 三氟乙酸(TFA)添加到装有样品或标准品的小瓶中。将小瓶盖上盖子,剧烈混合(30 s)并将混合物静置5 min。然后向混合物中加入 950 mL H2O∶乙腈(9∶1)并剧烈摇晃30 s,静置10 min形成两层。过滤下层水层用于分析(AOAC,2005)。
1.8.4 HPLC 条件
用于黄曲霉毒素的HPLC系统是Agilent 1200系列系统,带有荧光检测器(FLD G1321A)、自动进样器ALS G1329A、控温模块FC/ALS therm G1330B、脱气器 G1379B、Bin Bump G1312A、C18柱和保护柱。流动相为甲醇∶水∶乙腈(30∶60∶10, v/v/v),在 360 nm 激发波长和 440 nm 发射波长下以1 mL/min的流速运行25 min进行AFs分析。对于OTA分析,乙腈(57%)∶水(41%)∶乙酸(2%)以相同的流速在333 nm激发、460 nm发射波长下使用样品的运行时间为15 min,OTA检测时间为 5.75 min。
1.9 数据分析
统计显著性使用Statistica 9确定。黄曲霉的CFU和 AFB1水平(ng/g)的值对数化后用于分析。增长率平均值、黄曲霉的log10 CFUs和log10 AFB1浓度通过方差分析(ANOVA,二元和三元分析)确定(P<0.05)。Fisher’s LSD 方法(α=0.05)也用于比较处理组和对照组之间的显着差异。
2 结果与分析
2.1 臭氧处理对在培养基中黄曲霉孢子萌发的影响
图1显示了接种培养48 h前一黄曲霉菌株经不同浓度O3处理30 min的效果。两菌株都显示相似的结果,总体来说,除 0.92 aw外,孢子萌发率随着O3剂量的增加而逐渐降低,并随着培养时间的延长而增加,尤其是黄曲霉SRRC-G 1907菌株。培养 36 h内,该菌株在 O3的 40 ppm(46%~64%)下的萌发率高于 20 ppm(23%~34%)。0.92 aw下24 h后的萌发孢子情况,可以通过显微镜镜检和两菌株平板给予证实。黄曲霉SRRC-G 1907的孢子萌发对臭氧较之EGP-B07更敏感。除了在 0.89 aw 和 100 ppm 48 h 后的情况,在所有aw水平下,两菌株在100和250 ppm的培养期间内,孢子均未能萌发。统计上,培养时间(h)、aw、菌株类型及他们之间二、三和四方的相互作用对黄曲霉孢子萌发(%)的影响是显着的。气态 O3处理、时间和 aw对两菌株的孢子萌发率都有最显著影响。
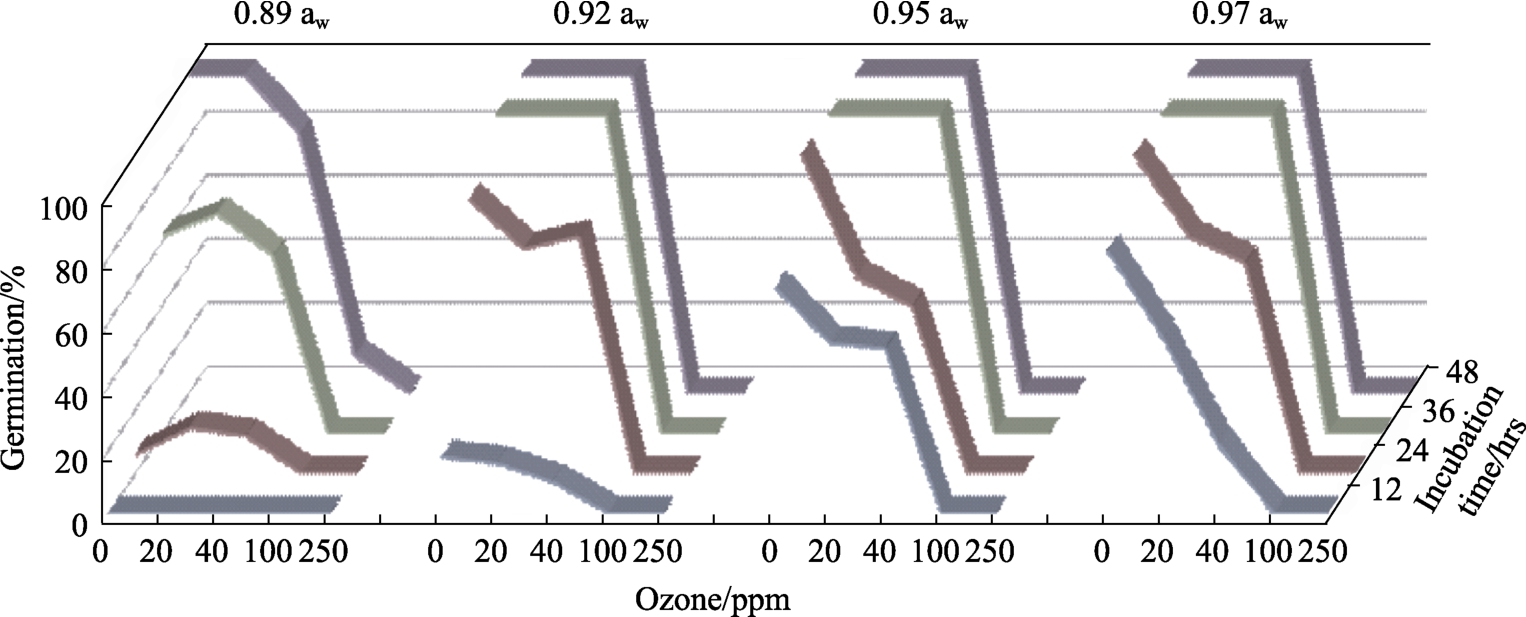
图1 臭氧浓度(ppm)对YES培养基黄曲霉EGP-B07的孢子萌发48 h的影响
Fig.1 Effect of ozone concentration (ppm) on spore germination of A. flavus EGP-B07 on YES media over periods of 48 hrs
注:培养前臭氧中6 L/min暴露30 min。
Note: Ozone exposure was for 30 min at 6 L/min prior to incubation.
2.2 臭氧暴露对菌丝生长的影响
图2显示了100和300 ppm O3对两黄曲霉菌株菌落生长和菌丝体扩展的影响。处理后 3 d,O3对两菌株的菌丝扩展延伸的影响相对较小,但在较低的aw水平(0.89和0.92 aw)下效果更明显。在 0.89和 0.92 aw时,O3的处理使黄曲霉菌株EGP-B07的生长速度显著降低,黄曲霉菌株SRRC-G 1907的生长仅在 0.92 aw下明显。统计结果表明 aw、菌株类型和 O3是影响菌丝延伸的重要因素。
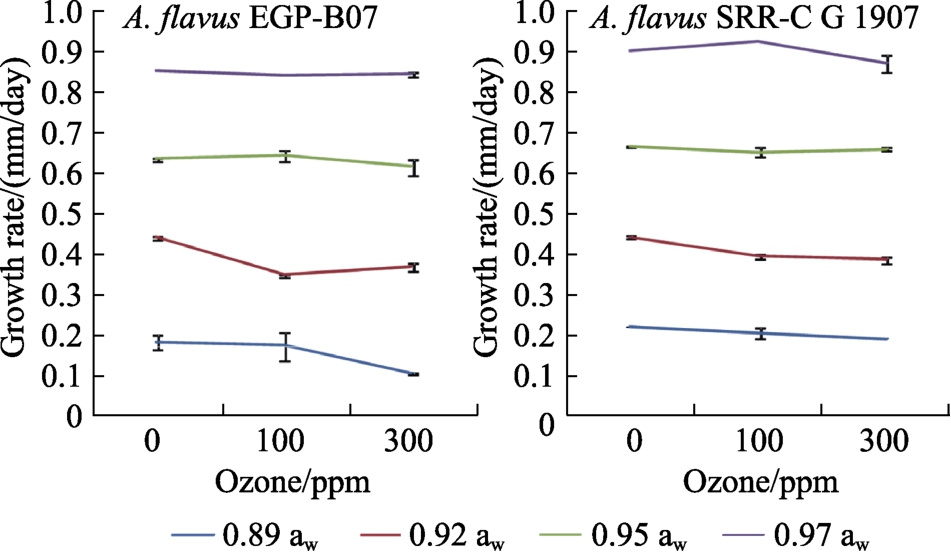
图2 黄曲霉EGP-B07和 SRRC-G 1907在YES上25 ℃培养3 d的相对生长率
Fig.2 Relative growth rate of A. flavus EGP-B07 and strain SRRC-G 1907 on YES media at 25 ℃ for 3 days
注:暴露于6 L/min的臭氧中 30 分钟。条形表示平均值的标准误差。
Note: Exposure to Ozone was for 30 min at 6 L/min. Bars indicate standard error of the means.
图3显示了在不同aw条件下培养3 d后,O3处理对黄曲霉EGP-B07和SRRC-G 1907的生长菌落产生AFB1的影响。与对照组(0 ppm)相比,使用300 ppm的O3剂量下,黄曲霉EGP-B07在0.89、0.95 aw下,SRRC-G 1907 在 0.89、0.97 aw下产 AFB1能力显著降低。AFB1最大减少量(2.3 log10 ng/g)发生在 0.89 aw 的黄曲霉 EGPB07中。黄曲霉在YES培养基中产AFB1水平的统计分析表明,除aw和菌株相互作用外,臭氧化、aw、菌株类型、两方和三方相互作用都具有统计学意义。主要影响由菌株、aw和O3决定。
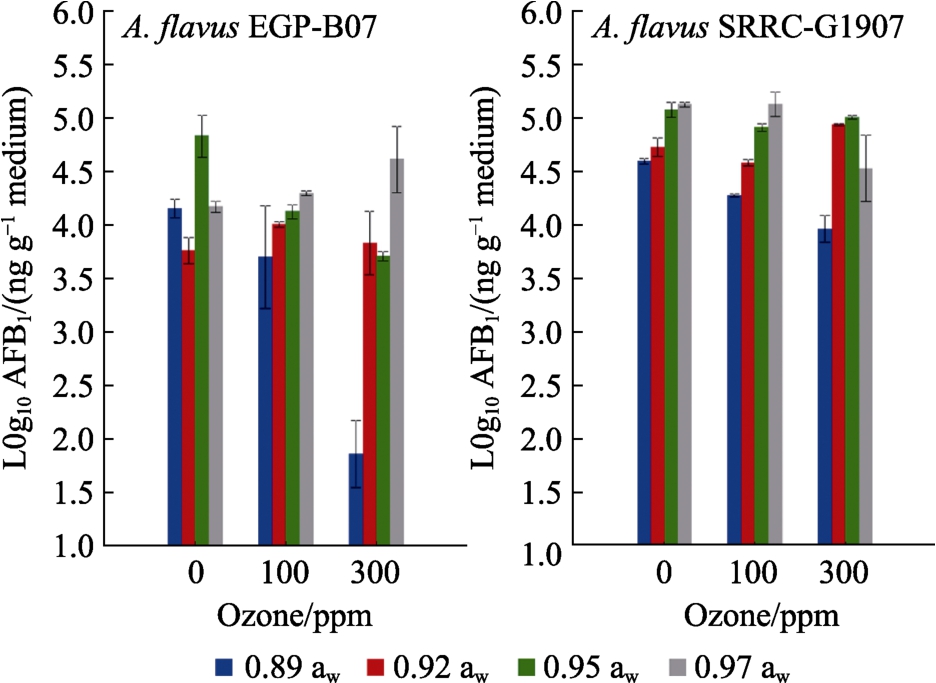
图3 臭氧暴露对黄曲霉EGP-B07和SRRC-G 1907菌株在YES上25 ℃培养3 d后产生AFB1的影响
Fig.3 Effect of ozone exposure on AFB1 produced by A. flavus EGP-B07 and SRRC-G 1907 strains on YES media at 25 ℃ after 3 days incubation
注:暴露于6 L/min臭氧30 min。条形表示平均值的标准误差。
Note: Ozone exposure was for 30 min at 6 L/min. Bars indicate standard error of the means.
2.3 臭氧对储存带壳花生的黄曲霉种群和黄曲霉毒素B1污染的原位影响
图4显示了不同初始气态 O3接种量对黄曲霉种群变化的影响。从花生中分离出的产毒素真菌数量显著减少,尤其是在200和400 ppm O3条件下。与处理前相比,减少量从 0.8到 2.2 log CFUs/g,特别是在更高初始接种量(105个孢子/g)的带壳花生中,表现更显著。统计学上,所有因素及其相互作用都显著影响了黄曲霉的种群数量(log10CFUs/g)。初始接种浓度是影响种群的主要因素,其次是O3处理。
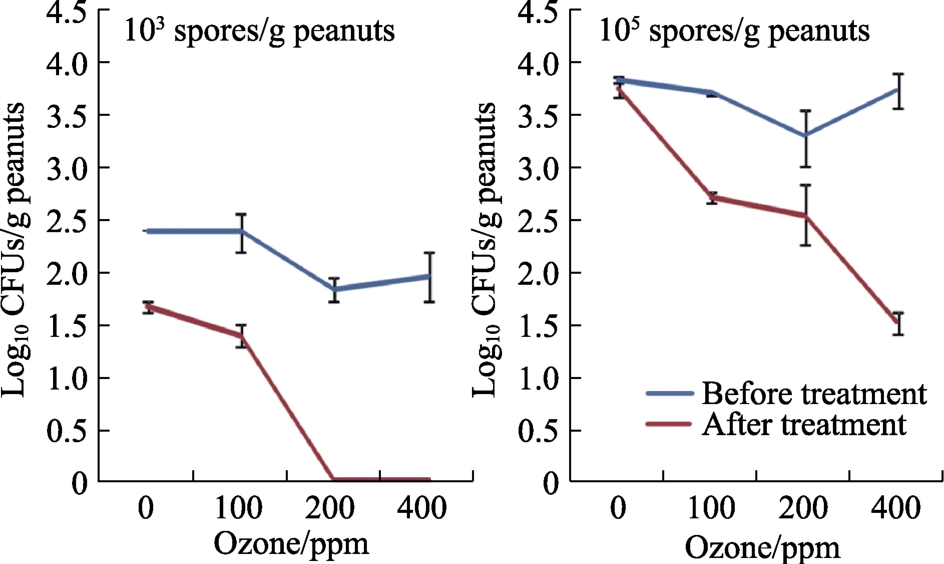
图4 臭氧处理30 min(6 L/min)对储存4 d前后带壳花生分离出的黄曲霉EGP-B07种群的影响
Fig.4 Effect of ozone treatment for 30 min at 6 L/min on isolation of viable populations of A. flavus EGP-B07 from shelled peanuts before and after storage for 4 days
注:条形表示平均值的标准误差。
Note: Bars indicate standard error of the means.
图5显示了储存前两种不同初始浓度黄曲霉孢子(103、105个孢子/g)的壳花生经O3处理后,其AFB1污染的情况。100和400 ppm的O3剂量显著降低了接种105个孢子/g的样品中的AFB1。然而,400 ppm O3,可显著减少接种103个孢子/g样品的 AFB1。结果统计表明,只有培养时间,O3和时间的相互作用显著(P<0.05)影响 AFB1的产生。
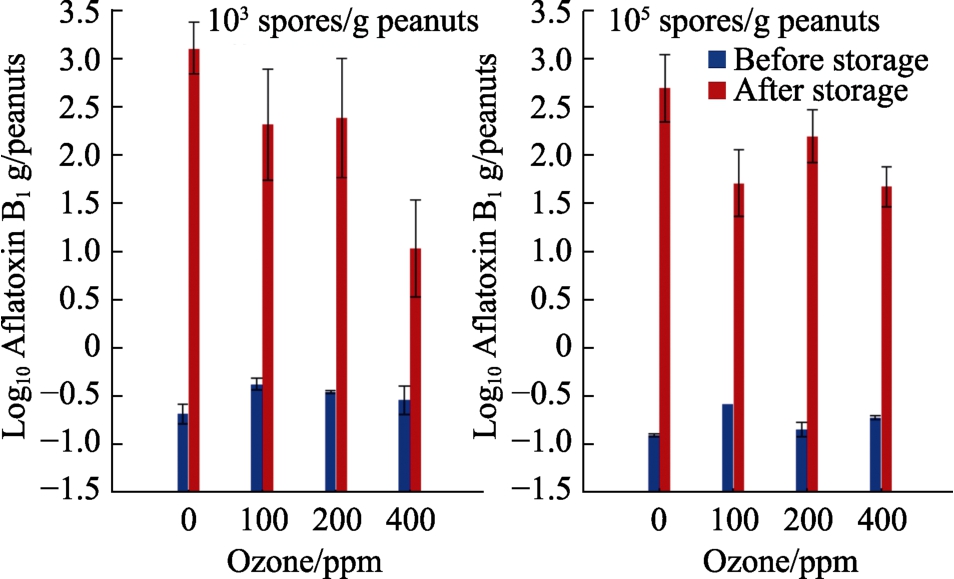
图5 带壳花生在0.93水活度下储存4 d后,以6 L/min的速度气态臭氧暴露30 min,对不同初始接种物AFB1污染的影响
Fig.5 Effect of gaseous ozone exposure of shelled peanuts for 30 min at 6 L/min on AFB1 contamination with different initial inoculums after 4 days storage at 0.93 water activity
注:条形表示平均值的标准误差。
Note: Bars indicate standard error of the means.
3 讨论与结论
3.1 对萌发的影响
本研究中使用了两株黄曲霉菌株来评估气态O3抑制孢子萌发的功效。黄曲霉EGP-B07是从埃及花生中分离出来的,黄曲霉SRRC-G 1907是参考菌株。暴露于O3气体能抑制分生孢子萌发,浓度>100 ppm 可在48 h完全抑制萌发。一般来说,与菌株 SRRC-G 1907相比,菌株 EGP-B07在<100 ppm的剂量下对O3暴露更具抵抗力。
很少有研究分析体外 O3对不同 aw水平下的丝状真菌的影响,对黄曲霉进行相关研究更少。Zotti等[28]报道,用 O3处理黄曲霉菌落(生长 3 d)3 h能完全抑制分生孢子的活力。然而,O3处理的效果随着菌落培养时间(6和9 d)的增加而降低。此外,发现黑曲霉比黄曲霉对O3处理更敏感。然而,最近的研究表明,来自曲霉属Circumdati和Niger类群的物种可耐受高达500 ppm的O3[11]。Hudson和 Sharma[29]将无菌塑料托盘盖表面上的13种不同真菌物种,包括黄曲霉和黑曲霉,暴露于臭氧(35 ppm)中 20 min。他们发现,经过 48 h的培养,大多数真菌的 3 log10 CFUs失活。Beuchat等[30]研究了臭氧对悬浮液中产毒黄曲霉和寄生曲霉的灭活作用。他们发现,在pH 5.5和7.0下,黄曲霉的D值(杀死90%分生孢子所需的时间)为1.72和1.54 min;寄生曲霉的D值分别为2.08和1.71 min。然而,液体悬浮液与干分生孢子或暴露于不同aw水平分生孢子有很大的不同,仅对极少数物种进行过验证[11,31]。事实上,Mylona等[31]发现,虽然O3暴露最初抑制轮枝镰孢菌分生孢子的萌发,但随后它们可以通过 DNA修复机制恢复,继续菌丝生长并产生伏马毒素。因此,可能需要进行长期实验来检查黄曲霉中的这些过程。
3.2 对体外生长和AFB1产生的影响
通常,无论浓度如何,无论aw水平如何,这两菌株的生长速度相对不受 O3暴露的影响,但aw水平似乎是一个更重要的非生物因素。黄曲霉EGP-B07 在 0.89、0.95 aw和黄曲霉 SRRC-G 1907在 0.89、0.97 aw 的较高 O3(300 ppm)剂量下,AFB1的产生受到显著影响。将黄曲霉 EGP-B07暴露在 0.89 aw,300 ppm 的 O3抑制效果最好(2.3 log10 ng/g)。Mason 等[15]将 O3(5 d)应用于黄曲霉和串珠镰刀菌培养物。他们发现琼脂表面上的孢子和菌丝生长完全被O3抑制。Vijayanandraj等[32]报道了O3抑制了黑曲霉营养菌丝体的生长,但对孢子萌发没有任何影响。这可能部分归因于色素沉着,可以保护分生孢子免受O3的损害。有人提出,在溶解有机和无机物质的情况下,O3的有效性会降低,因为它们对微生物具有抵抗 O3的保护作用[21]。
对AFB1生产的影响而言,Zotti等[28]报道,将黄曲霉菌落暴露于 O3可通过对黄色素的漂白作用间接减少毒素的产生。基于Shier等[33]研究,菌落的黄色蒽醌色素可能是合成黄曲霉毒素所需的生物中间体,或是未利用的分支途径产物。
3.3 臭氧对储存花生中黄曲霉种群和AFB1产量的原位影响
在本研究中,O3处理对带壳花生的初始孢子接种量的影响(103和105分生孢子/g)。一般来说,初始接种量越低,O3浓度越高,抑制效果越好。在较低的接种量水平下,200和400 ppm的剂量完全抑制了储存带壳花生中的分生孢子产生。同时,接种105个孢子/g的花生中,400 ppm显著降低了 2.2 log CFUs/g。Giordano 等[34]最近的研究表明,从应用之日起,31 ppm的O3处理5 h就能够成功抑制巴西坚果上产毒素的曲霉物种的活力。此前,对玉米的研究表明,用50 ppm O3处理玉米3 d后,玉米表面的寄生曲霉污染减少了63%[35]。
在接种 103/105分生孢子/g后立即用 O3处理花生样品,在接种和暴露于O3后的AFB1污染水平即刻影响相对较小。然而,储存4 d后,由于黄曲霉接种物的定殖,AFB1 污染显着增加。使用400 ppm的O3剂量预储存确实显著抑制了两种初始接种水平的带壳花生的 AFB1生产。有研究使用14和32.5 ppm的低O3浓度处理巴西坚果完全抑制了AFB1的产生,处理24 h后完全抑制了产黄曲霉毒素的真菌生长[34]。然而,没有研究初始aw的影响以及与O3暴露的相互作用。
Wang等[36]研究表明,在降解赭曲霉毒素 A(OTA)形成方面,湿法O3熏蒸谷物比干法更有效。OTA 暴露于 30 ppm O3 120 min 或暴露于60 ppm O3 90 min 后降解[37]。当暴露于 20~40 ppm O3 20 min 时,人工接种的受污染小麦(10 µg/kg)中AFB1的降解率为84%~86%[37]。
O3已被确认为用为食品加工的 GRAS[3,38]。此外,O3确实会迅速(半衰期20~50 min)分解为分子氧而不留下任何残留物[35]。然而,它可以有效延长不同商品的储存期[39]。需要注意处理富含脂质的商品,因为在高O3处理浓度下可能会出现一些污染。最好以较低浓度较长时间处理此类商品以获得所需效果。然而,O3使用上并不是很友好,需要有效的安全规程和设备,以确保在使用过程中不会降解。另外,O3可能对橡胶管和密封件具有很强的腐蚀性,因此 PTFE管和不锈钢或类似的容器材料可有效用于商业用途[3]。
[1]SAAD N. Aflatoxins: occurrence and health risks. 2001. [Available at: http://www.ansci.cornell.edu/plants/to xicants/aflatoxin/aflatoxin.html].
[2]ESKOLA M, KOS G, ELLIOTT C T, et al. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%[J]. Critical Reviews in Food Science and Nutrition, 2020, 60: 2773-2789.
[3]MAGAN N, GARCIA-CELA E, VERHEECKE-VAESSEN C, et al. Chapter 14-Advances in postharvest detection and control of fungal contamination of cereals. In: Maier D, ed. Advances in Postharvest Management of Cereals and Grains[M]. BDS Publishin, 2020, 339-362.
[4]MAGAN N. Chapter 7-Tolerance of fungi to sulphur dioxide. In:Jennings DH, ed. Stress tolerance of fungi[M]. Marcel Dekker,1993a, 173-187.
[5]MAGAN N. Use of sulphur dioxide to control fungi in stored grain. In: Navarro S & Donahaye E, eds. Proceedings of Int.Conference on Controlled Atmosphere and Fumigation in Grain Storages[M]. Capital Press, 1993b, 163-171.
[6]CHANDRA M, ORO I, FERREIRA-DIAS S et al. Effect of ethanol, sulfur dioxide and glucose on the growth of wine spoilage yeasts using response surface methodology[J]. PLoS ONE, 2015, 10: e0128702.
[7]CHEN T, KUSCHNER W G, GOKHALE J, et al. Outdoor air pollution: nitrogen dioxide, sulphur dioxide, and carbon monoxide health effects[J]. The American J. Med. Sci. 2007,333: 249-256.
[8]SERRE G. The use of sulphur dioxide to preserve moist wheat for human consumption[D]. U. K.: Cranfield University, 1991.
[9]PEZLEY M E. Production of free sulfur dioxide by wine yeasts[J]. Interdiscip. Undergrad. Res. J., 2015, 1: 27-32.
[10]PATERAKI M, DEKANEA A, MITCHELL D, et al. Influence of sulphur dioxide, controlled atmospheres and water availability on in vitro germination, growth and ochratoxin A production by strains of Aspergillus carbonarius isolated from grapes[J].Postharvest Biology and Technology, 2007, 44: 141-149.
[11]AKBAR A, MEDINA A, MAGAN N. Potential control of mycotoxigenic fungi and ochratoxin A in stored coffee using gaseous ozone treatment[J]. Microorganisms, 2020, 8 (10): 1462.
[12]KIM J G, YOUSEF A E, DAVE S. Application of ozone for enhancing the microbiological safety and quality of foods: A review. Journal of Food Protection, 1999, 62: 1071-1087.
[13]GONÇALVES A A. Ozone: an emerging technology for the seafood industry[J]. Brazilian Archives of Biology & Technology,2009, 52(6): 1527-1539.
[14]United States Food and Drug Administration. 2019. Code of Federal Regulations: Maximum Acceptable Level of Ozone;21CFR801. 415; United States Food and Drug Administration:Silver Spring: MD, USA, Volume 8. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=801.415.
[15]MASON L J, WOLOSHUK C P, MAIER D E. Efficacy of ozone to control insects, molds and mycotoxins. In: Navarro S, Varnava A. eds. Proceedings of the International Conference on Controlled Atmosphere and Fumigation in Stored Products[M]. Cyprus Printer Ltd., 1997, 665-670.
[16]MAEBA H, TAKAMOTO Y, KAMIMURA M, et al. Destruction and detoxification of aflatoxins with ozone[J]. Journal of Food Science, 1988, 53: 667-668.
[17]PATIL S, TORRES B, TIWARI B K, et al. 2010. Safety and quality assessment during the ozonation of cloudy apple juice[J].Journal of Food Science, 75(7): 437-443.
[18]LIU Y, PAN X, LI J. Current agricultural practices threaten future global food production[J]. Journal of Agricultural &Environmental Ethics, 2015, 28(2), 203-216.
[19]FILIPPIDOU E C, KOUKOULIATA A. Ozone effects on the respiratory system[J]. Progress in Polymer Science, 2011, 1:144-155.
[20]ROBERT B D, KELLY E D, MELANIE J, et al. Controlled exposure of healthy young volunteers to Ozone causes cardiovascular Effects[J]. Circulation, 2012, 126: 104-111.
[21]SUSLOW T V. Ozone applications for postharvest disinfection of edible horticultural crops[J]. ANS Publication, 2004, 8133:1-8.
[22]EL-DESOUKY T A, SHAROBA A M A, EL-DESOUKY A I, et al. Effect of ozone gas on degradation of aflatoxin B1 and Aspergillus flavus fungi[J]. Journal of Environmental & Analytical Toxicology, 2012, 2: 128.
[23]SAHAB A F, HASSANIEN F R, EL-NEMR S E, et al. Effect of ozone gaseous on aflatoxin degradation and fat and protein content in peanut seeds[J]. Journal of Applied Sciences Research, 2013, 9: 2170-2175.
[24]MAGAN N. Effects of water potential and temperature on spore germination and germ-tube growth in vitro and on straw leaf sheaths[J]. Transactions of the British Mycological Society,1988, 90: 97-107.
[25]GARCIA-CELA E, GARI SANCHEZ F J, VERHEECKEVAESSEN C, et al. Carbon dioxide production as an indicator of Aspergillus flavus colonisation and aflatoxins/cyclopiazonic acid contamination in shelled peanuts stored under different interacting abiotic factors[J]. Fungal Biology, 2019, 121: 1-7.
[26]FILTENBORG O, FRISVAD J C. A simple screening method for toxigenic moulds in pure cultures[J]. Lebensmittel-wissenschaft und-technologie-food Science and Technology, 13: 128-130.
[27]AOAC, Association of Official Analytical Chemist, Official methods of analysis[M]. Natural toxins, 18th edn., Chapter 49,Washington, D. C., 2005.
[28]ZOTTI M, PORRO R, VIZZINI A et al. Inactivation of Aspergillus spp. by ozone treatment[J]. Ozone-science &Engineering, 2008, 30: 423-430.
[29]HUDSON J B, SHARMA M. The practical application of ozone gas as an antifungal (anti-mold) agent[J]. Ozone-science &Engineering, 2009, 31: 326-332.
[30]BEUCHAT L R, CHMIELEWSKI R, KESWANI J, et al.Inactivation of Aflatoxigenic Aspergilli by treatment with ozone[J]. Letts. Appl. Microbiol. 1999, 29: 202-205.
[31]MYLONA K, KOGKAKI E, SULYOK M, et al. Efficacy of gaseous ozone treatment on spore germination, growth and fumonisin production by Fusarium verticillioides in vitro and in situ in maize[J]. Journal of Stored Products Research, 2014, 59:178-184.
[32]VIJAYANANDRAJ V R, NAGENDRA PRASAD D, MOHAN N et al. Effect of ozone on Aspergillus niger causing black rot disease in onion[J]. Ozone-science & Engineering, 2006, 28:347-350.
[33]SHIER W T, LAO Y, STEELE T W J, et al. Yellow pigments used in rapid identification of aflatoxin-producing Aspergillus strains are anthraquinones associated with the aflatoxin biosynthetic pathway[J]. Bioorganic Chemistry, 2005, 33: 426-438.
[34]GIORDANO B N E, SIMAO V, MANFIO D, et al. Reduction of in-shell Brazil nut (Bertholletia excelsa H. B. K.) aflatoxin conamination by ozone gas application during storage[J]. Julius-Kühn-Archive, 2010, 425: 574-580.
[35]KELLS A A, MASON L J, MAIER D E, et al. Efficacy and fumigation characteristics of ozone in stored maize[J]. Journal of Stored Products Research, 2001, 37: 371-382.
[36]WANG S, LIU H, LIU J, et al. Can ozone fumigation effectively reduce aflatoxin B1 and other mycotoxins contamination on stored grain?[J]. Julius Kuhn Archive, 2010, 425: 582-588.
[37]WU J N, DOAN H, CUENCA M A. Investigation of gaseous ozone as an anti-fungal fumigant for stored wheat[J]. Journal of Chemical Technology & Biotechnology, 2006, 81: 1288-1293.
[38]GRAHAM D M. Use of ozone for food processing[J]. AGRIS,1997, 51: 72-75.
[39]HORVÁTH M, BILITZKY L, HUTTNER J O. Topics in inorganic and general chemistry-monograph 20[J]. Elsevier, 1985,270.
备注:本文的彩色图表可从本刊官网(http://lyspkj. ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。