玫瑰(Rosa rugosaThunb.)属蔷薇目蔷薇科落叶性灌木,在我国具有悠久的栽培历史,目前在全国各地均有种植,其中以华北、西北、西南等地为主[1-2]。山东平阴县是中国最大的玫瑰花种植基地,玫瑰花资源十分丰富,其“平阴重瓣红玫瑰(Rose rugosa cv. Plena)”是原国家卫生部于2010 年认证的新资源食品和药食同源品种,在食品、医药等领域有着广阔的应用前景[3-4]。
重瓣红玫瑰花在提取玫瑰精油后剩余大量的固体花渣,这些花渣的营养成分丰富,但目前生产中大部分作为废弃物直接处理掉了,这不仅污染了环境,也是对资源的浪费[5-6]。研究发现,玫瑰精油的提取只是将玫瑰花的香气等可挥发性成分提取出来,而其他(如蛋白质、膳食纤维、矿物质、多酚类和黄酮类等)非挥发性成分都留在了提取后剩余的花渣中,具有很高的再利用价值[7-10]。因此,提取玫瑰花渣中的功效成分,提高花渣的再利用率具有重要的研究意义和应用前景。
目前,关于玫瑰花中功能性成分开发较多[11-12],但是从花渣中提取功能性成分的研究报道较少。玫瑰花渣成分复杂,含有多酚类、黄酮类等多种化学成分,具有减少和消除自由基、抗氧化活性、抗血栓、抗癌、抗炎、抗菌、免疫调节、降血脂和预防心脏病等生理活性[13-15]。同时,玫瑰花渣中还含有蛋白质、VC 和膳食纤维等多种营养成分,其中所含氨基酸中必需氨基酸所占比例较高,所含不饱和脂肪酸中亚油酸所占比例较高,总脂肪含量较低[7,9]。在花渣成分提取技术研究中,主要的提取方法有溶剂提取法[10,16]、碱提取[17]、加热提取[18]、酶辅助提取[19]、微波辅助提取[20]、超声波辅助提取[21-22]等。超声辅助提取法在多酚提取中表现出较高的提取效率,近年来被广泛应用于植物源化合物的提取。谢琼等[23]用超声提取了玫瑰花渣中的总黄酮,确定了超声提取的最佳工艺条件。张佳婵等[8]采用醇提法提取了玫瑰花和花渣中的黄酮成分,所得黄酮冻干粉对羟自由基、ABTS +自由基和DPPH 自由基均具有清除能力。马猛华等[9]提取了玫瑰花渣中的多糖和黄酮类化合物,优化了各自的提取工艺。
目前研究较多的是大马士革玫瑰花渣、苦水玫瑰花渣等的成分提取及其功能性分析,而对于重瓣红玫瑰花渣的研究相对较少[21,24-26]。基于此,本项目以重瓣红玫瑰花精油提取后产生的玫瑰残渣废弃物为原料,研究其中黄酮类化合物的提取工艺,同时考察黄酮类化合物的抗氧化活性和抑菌活性,以期为提高重瓣红玫瑰花的综合利用价值提供一定的理论基础。
1 材料与方法
1.1 实验材料
重瓣红玫瑰花渣:山东省平阴玫瑰精油生产基地;芦丁标准品(HPLC≥98%):北京索莱宝科技有限公司;DPPH(纯度>96%)、ABTS(纯度>98%):上海麦克林生化科技有限公司;羟自由基测试盒:南京建成生物工程研究所;氢氧化钠、过硫酸钾、硝酸铝、无水乙醇、亚硝酸钠,均为分析纯:国药集团化学试剂有限公司。
指示菌:金黄色葡萄球菌 Staphylococcus aureus ATCC 25923、蜡样芽孢杆菌Bacillus cereus ATCC 11778、大肠杆菌Escherichia coli ATCC 44752:河北科技大学酶工程实验室保存。
1.2 仪器与设备
紫外可见分光光度计(Evolution 220):美国Thermo 公司;全自动菌落计数仪(Scan-1200):法国Interscience 公司;超净工作台(SW-CJ-1FD):苏州安泰空气技术有限公司;恒温培养箱(SPX-150)、水浴恒温震荡器(SHZ-A)、数显鼓风干燥箱(GZX-9140MBE):上海博讯实业有限公司;电子天平(JJ-1000):常熟市双杰测试仪器厂;恒温摇床(ZHWY):上海智城分析仪器制造公司;牛津杯(内径6.0 mm,外径7.8 mm):武汉药科新技术开发公司;离心机(4-16KS):德国Sigma 公司。
1.3 实验方法
1.3.1 样品预处理
玫瑰花固体渣放置于40 ℃烘箱内恒温干燥4 h,烘干后粉碎,将所得粉末状样品后,低温密封保存备用。
1.3.2 黄酮标准曲线的绘制
本试验以芦丁为标准品对玫瑰花渣中总黄酮含量进行测定。配置不同浓度的芦丁溶液,利用亚硝酸钠、硝酸铝、氢氧化钠等试剂与芦丁标准品溶液进行反应,利用紫外分光光度计在510 nm处测得吸光值,并以吸光值为纵坐标,芦丁浓度为横坐标做标准曲线。
1.3.3 玫瑰花渣中总黄酮提取条件的优化
1.3.3.1 乙醇浓度的优化 准确称取重瓣红玫瑰花渣粉1.0 g,按照1∶15 的料液比,分别溶于体积分数为55%、60%、65%、70%、75%的乙醇溶液中,于40 ℃、120 r/min 水浴震荡1.5 h,离心除蛋白后得到样品,按照标准曲线方法进行操作,测定黄酮含量。
1.3.3.2 提取时间的优化 准确称取玫瑰花渣粉1.0 g,按照料液比1∶15 溶于体积分数60%的乙醇,将溶解好的溶液置于恒温震荡器中40 ℃、120 r/min 水浴震荡,设置时间为0.5、1.0、1.5、2.0、2.5 h,离心除蛋白后得到样品,按照标准曲线的测定方法测定黄酮含量。
1.3.3.3 提取料液比的优化 准确称量玫瑰花渣粉1.0 g,分别按照料液比为1∶15、1∶20、1∶25、1∶30、1∶35 溶解于体积分数为60%的乙醇,将溶解好的溶液置于恒温震荡器中,40 ℃、120 r/min水浴震荡1.5 h,离心除蛋白后得到样品,按照标准曲线的测定方法测定黄酮含量。
1.3.3.4 提取温度的优化 准确称取玫瑰花渣粉1.0 g,按照料液比为1∶30 的比例,溶于体积分数为60%的乙醇,分别置于40、50、60、70、80、90 ℃恒温震荡器,水浴震荡提取1.5 h,离心除蛋白后得到样品,按照标准曲线方法测定黄酮含量。
1.3.4 玫瑰花渣中总黄酮超声波辅助提取条件的正交实验
采用L25(56)正交实验对玫瑰花渣中总黄酮提取条件进行优化,确定最佳的提取工艺条件。正交表如表1 所示:
表1 正交表
Table 1 Orthogonal table

水平 A 超声时间/min B 超声功率/W C 超声温度/℃1 15 100 40 2 30 120 50 3 45 140 60 4 60 160 70 5 75 180 80
1.3.5 玫瑰花渣总黄酮的抗氧化性的测定
1.3.5.1 对 DPPH·自由基的清除效率 参照Ravindran 等[27]的方法,将上述条件下得到的黄酮提取液,稀释5 个合适梯度,分别对不同浓度的样品进行一组实验:在第一只试管中加入1 mL黄酮提取液和3 mL、50 µg/mL 的DPPH 溶液,充分混匀后于室温下避光反应30 min;在第二只试管中加入1 mL 黄酮提取液和3 mL 无水乙醇;在第三只试管中加入1 mL 无水乙醇和3 mL 的DPPH 溶液。蒸馏水调零后,于517 nm 下测定每组三支试管的吸光值,分别将吸光值记作Ac、Ad、Ak。按照公式(1)计算黄酮提取液对DPPH·自由基的清除率:
1.3.5.2 对ABTS+自由基的清除效率 参照Yan等[1]的方法,将7 mmol/L 的ABTS 和2.45 mmol/L的过硫酸钾按照1∶1(v/v)均匀混合后,室温下避光放置24 h 备用。用95%乙醇溶液稀释配置好的ABTS 溶液至波长734 nm 处的吸光度值在(0.7±0.02) nm 内,作为 ABTS+测定溶液。取制备好的黄酮提取液进行试验:0.4 mL 待测样液,加入ABTS+测定溶液3.6 mL,静置5 min,于734 nm波长处测定吸光度。按照如下(2)公式计算黄酮提取液对ABTS+自由基的清除率:
式中:Amax 为ABTS+测定溶液的吸光值;As 为样品管的吸光值。
1.3.5.3 对羟自由基清除效率 将提取后的黄酮提取液使用羟自由基测定试剂盒进行羟自由基(·OH)清除率的测定,将所得结果代入(3)公式,计算的羟自由基清除率:
抑制羟自由基能力(U/mL)=

式中:标准品浓度为8.824 mmol/L,取样量为1 mL,n 为样品测试前稀释倍数。
1.3.6 玫瑰花渣总黄酮的抑菌性研究
采用牛津杯扩散法[28],选用金黄色葡萄球菌Staphylococcus aureus ATCC 25923、蜡样芽孢杆菌 Bacillus cereus ATCC 11778、大肠杆菌Escherichia coli ATCC 44752 为指示菌进行抑菌实验。将指示菌的菌悬液(108 CFU/mL)按照1%的添加量加入到与营养琼脂培养基中,倾倒灭菌平板,在平板的牛津杯中添加50 µL 玫瑰花渣的黄酮提取液,预扩散后恒温培养箱培养,抑菌圈测量仪测定抑菌圈直径。
1.4 数据分析
每个实验组设三个平行,数据采用Microsoft Office Excel 2007 进行处理,正交设计助手专业版V3.1 破解绿色版对数据进行分析。
2 结果与分析
2.1 玫瑰花渣中总黄酮提取条件的优化
2.1.1 乙醇浓度对玫瑰花渣中黄酮提取的影响
不同浓度乙醇提取重瓣红玫瑰花渣中黄酮结果见图1。图1 结果显示,随着乙醇浓度的提高,黄酮提取量先增大后减小,这可能是因为乙醇浓度较大时,玫瑰花渣中的其他成分会被浸提出来从而影响了玫瑰黄酮的析出。在乙醇浓度为60%时黄酮含量最高,达到7.47 mg/g。周小琦[14]的实验结果为当乙醇浓度为65%时黄酮含量最高为3.68 mg/g。

图1 乙醇浓度对玫瑰花渣中黄酮提取的影响
Fig. 1 Effect of ethanol concentration on the extraction of flavonoids from rose residue
2.1.2 提取时间对玫瑰花渣中黄酮提取的影响
不同提取时间对玫瑰花渣黄酮提取的影响见图2。由图2 结果可知,随着提取时间的增大,黄酮提取量先增大后减小,可能是随着时间的延长,花渣中其它杂质也会浸出,因此最佳提取时间为1.5 h,黄酮含量达到11.48 mg/g。
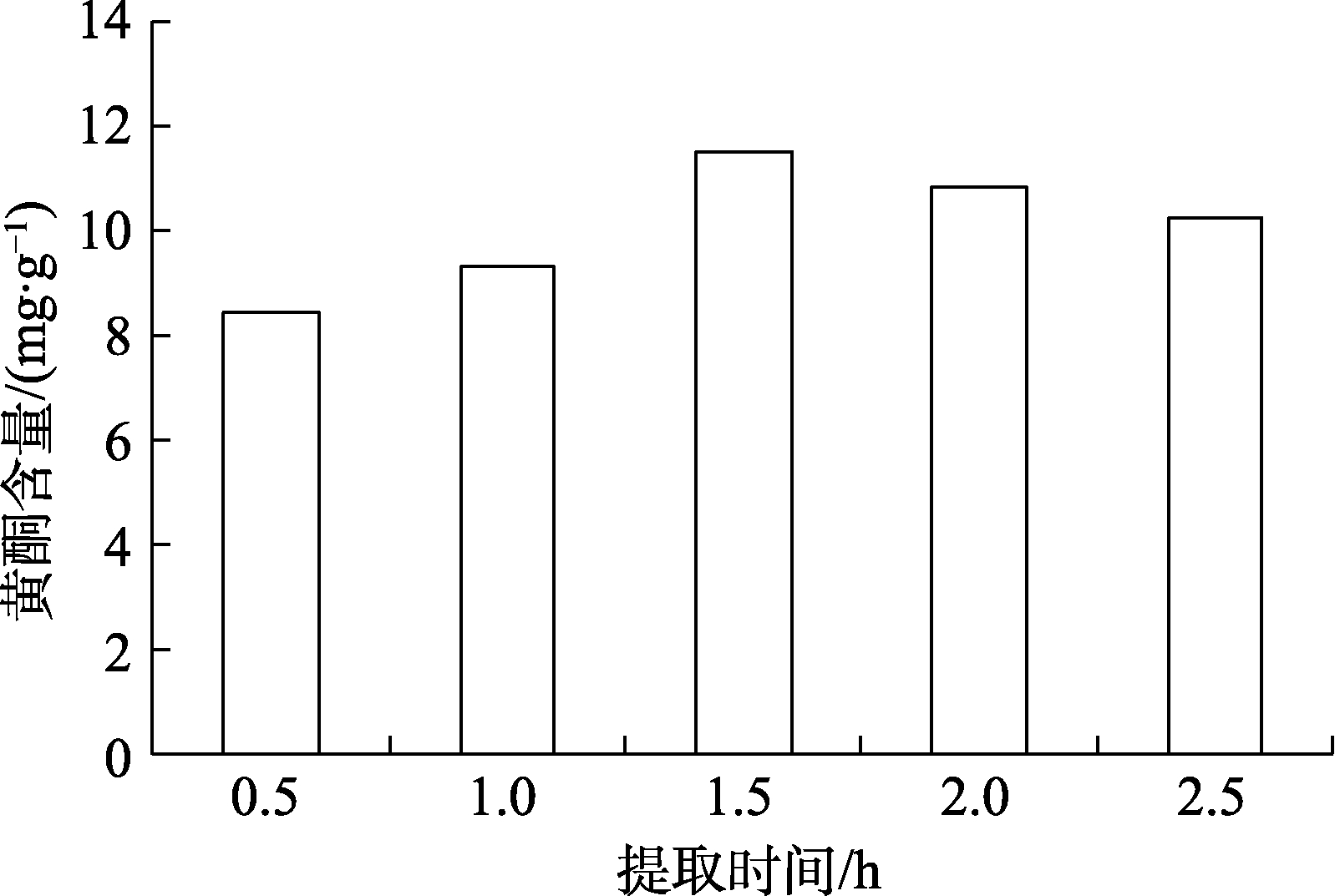
图2 提取时间对玫瑰花渣中黄酮提取的影响
Fig. 2 Effect of extraction time on the extraction of flavonoids from rose residue
2.1.3 提取料液比对玫瑰花渣中黄酮提取的影响
不同提取料液比对玫瑰花渣中黄酮提取的结果见图3。由图3 可知,料液比为1∶30 的时候,黄酮的提取量最高,达到了15.83 mg/g,这可能是因为溶剂量大时,黄酮溶出的较多。因此,本研究选择重瓣红玫瑰花渣黄酮的最佳提取料液比为1∶30。

图3 料液比对玫瑰花渣中黄酮提取的影响
Fig. 3 The effect of ratio of material to liquid on the extraction of flavonoids from rose residue
2.1.4 提取温度对玫瑰花渣中黄酮提取的影响
不同提取温度对玫瑰花渣黄酮影响的结果见图4。由图4 可知,黄酮提取量随温度的升高先增大后减小,可能温度过高会破坏黄酮结构,所以最适宜提取温度为80 ℃时,黄酮提取量达到22.43 mg/g。
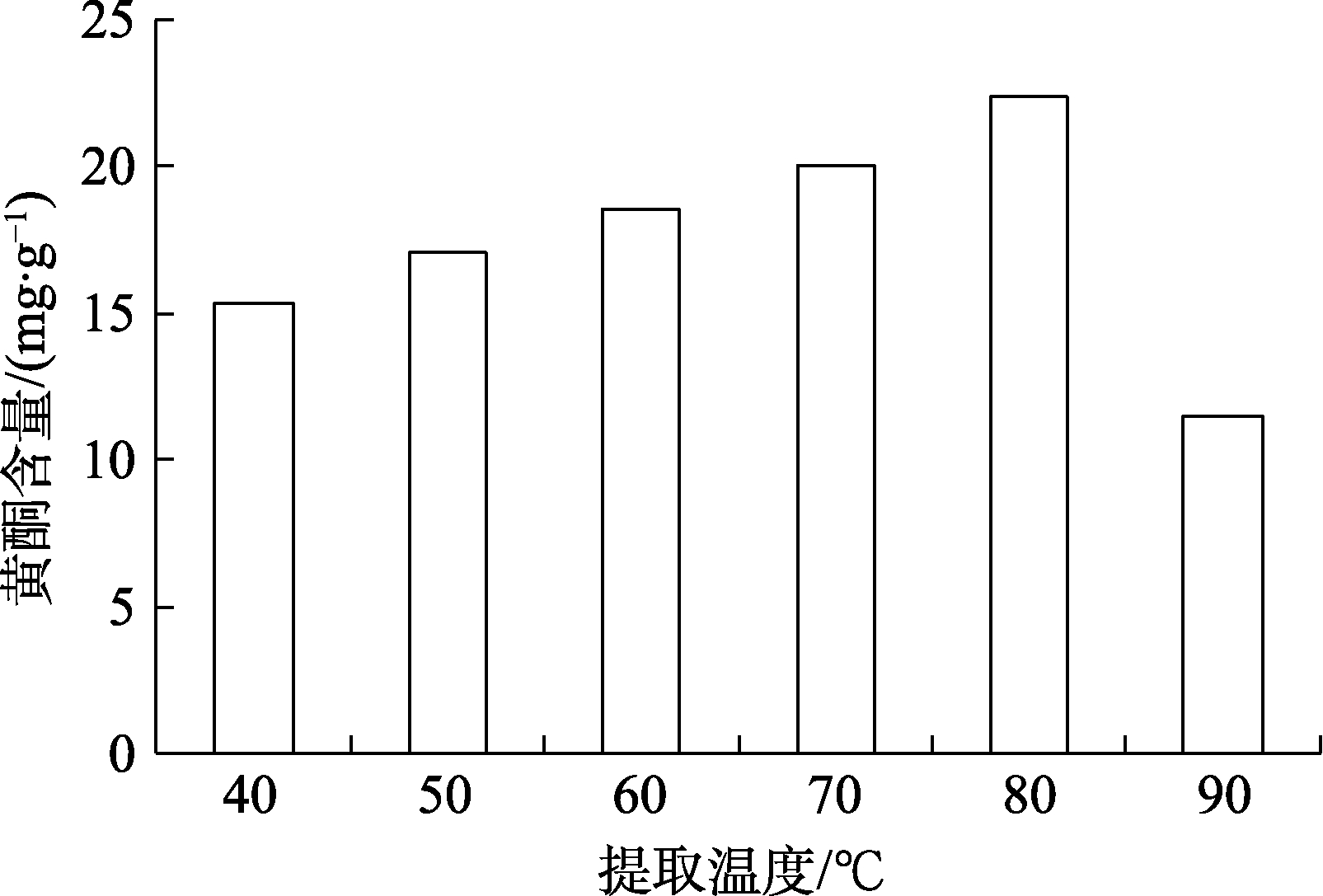
图4 提取温度对玫瑰花渣中黄酮提取的影响
Fig. 4 Effect of extraction temperature on the extraction of flavonoids from rose residue
2.2 玫瑰花渣中总黄酮超声波辅助提取条件的优化
对超声辅助提取的提取条件进行正交试验优化,优化的结果见表2。由表2 结果可得出最优组合为A3B3C3,即超声处理时间为45 min、超声温度为60 ℃、超声功率为140 W,在此条件下黄酮含量达到58.53 mg/g。宋可珂[29]筛得最优提取妙峰山玫瑰黄酮条件下,含量达到66.040 mg/g。牛元[30]采用紫外分光光度计法测定黄酮含量,苦水玫瑰花蕾中黄酮含量为93.056 mg/g。
表2 正交优化实验结果
Table 2 Results of orthogonal experiments
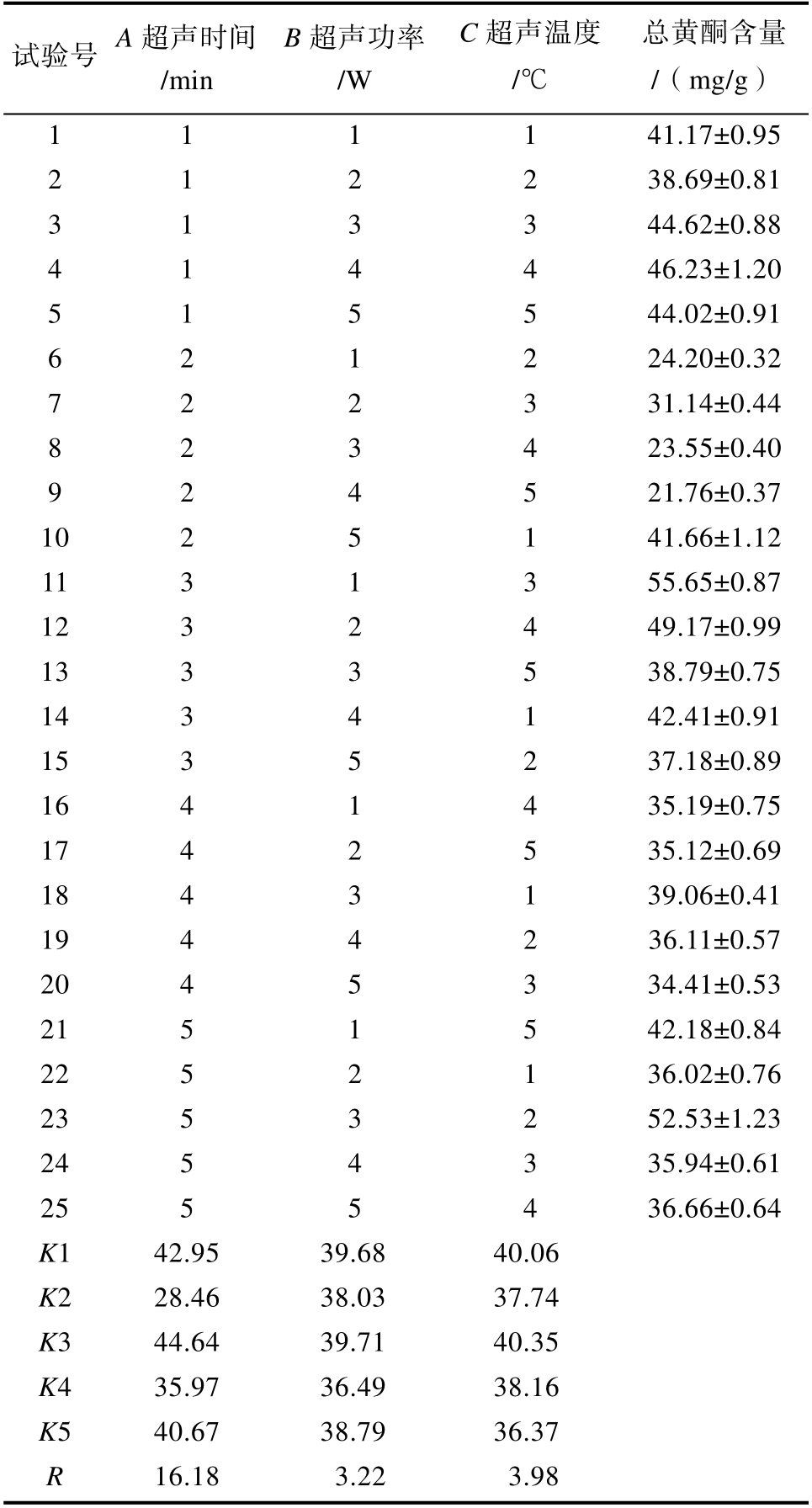
试验号 A 超声时间/min B 超声功率/W C 超声温度/℃总黄酮含量/(mg/g)1 1 1 1 41.17±0.95 2 1 2 2 38.69±0.81 3 1 3 3 44.62±0.88 4 1 4 4 46.23±1.20 5 1 5 5 44.02±0.91 6 2 1 2 24.20±0.32 7 2 2 3 31.14±0.44 8 2 3 4 23.55±0.40 9 2 4 5 21.76±0.37 10 2 5 1 41.66±1.12 11 3 1 3 55.65±0.87 12 3 2 4 49.17±0.99 13 3 3 5 38.79±0.75 14 3 4 1 42.41±0.91 15 3 5 2 37.18±0.89 16 4 1 4 35.19±0.75 17 4 2 5 35.12±0.69 18 4 3 1 39.06±0.41 19 4 4 2 36.11±0.57 20 4 5 3 34.41±0.53 21 5 1 5 42.18±0.84 22 5 2 1 36.02±0.76 23 5 3 2 52.53±1.23 24 5 4 3 35.94±0.61 25 5 5 4 36.66±0.64 K1 42.95 39.68 40.06 K2 28.46 38.03 37.74 K3 44.64 39.71 40.35 K4 35.97 36.49 38.16 K5 40.67 38.79 36.37 R 16.18 3.22 3.98
2.3 黄酮的抗氧化性的测定
2.3.1 黄酮对DPPH·自由基的清除效率
根据实验结果所得吸光值,代入计算公式,得到黄酮对于 DPPH·自由基的清除率最高为91.58%。杨虎[21]筛得最优提取玫瑰黄酮条件下,对DPPH·的清除率为88.28%。
2.3.2 黄酮对ABTS+自由基的清除效率
经计算,黄酮对 ABTS+自由基的清除率为73.71%。陆秀云[26]玫瑰废水中黄酮对ABTS+的最大清除率为98.96%。
2.3.3 黄酮对羟自由基清除效率
经计算,黄酮提取液对羟自由基的抑制能力为467.91 U/mL。
2.4 黄酮的抑菌性研究
由玫瑰花渣黄酮的抑菌实验结果见表3、图5。由表3、图5 可知,黄酮提取液对大肠杆菌没有明显的抑菌效果,对金黄色葡萄球菌和蜡样芽孢杆菌具有抑制性,尤其是对金黄色葡萄球菌的抑菌效果最好,其抑菌圈均大于14 mm。
表3 黄酮提取液对细菌的抑菌圈
Table 3 Bacteriostatic circle of flavonoid extract on bacteria

指示菌抑菌圈/mm黄酮提取液浓度/(mg/mL)对金黄色葡萄球菌对蜡样芽孢杆菌对大肠杆菌2 14.3±0.35 9.66±0.23 0 3 15.77±0.56 10.96±0.41 0
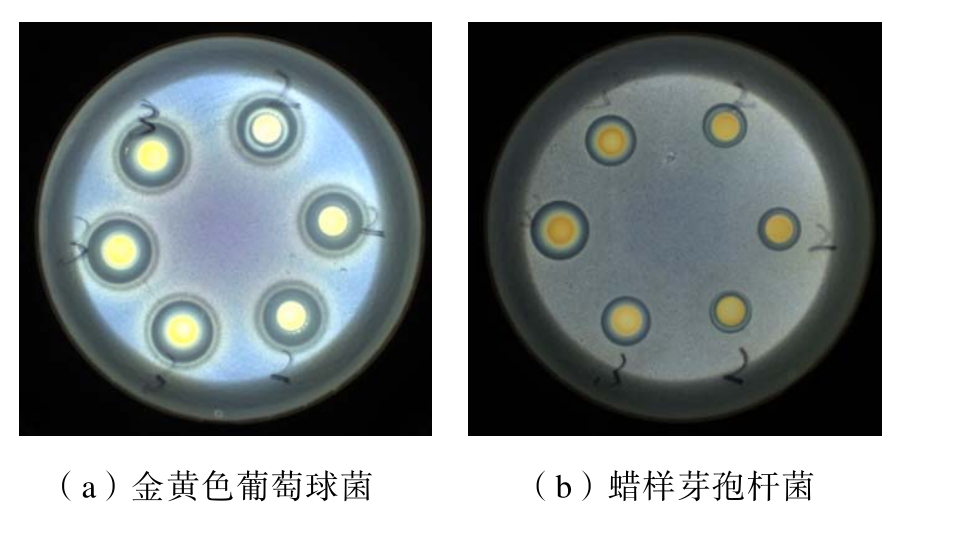
图5 黄酮提取液对蜡样芽孢杆菌(a)和金黄色葡萄球菌(b)的抑菌效果
Fig.5 Antibacterial effect of flavonoid extract on A (Bacillus cereus) and B (Staphylococcus aureus)
3 结论
根据上诉实验结果,可以得到结论:经过优化后得到黄酮提取的最佳工艺为在乙醇浓度为60%、料液比1∶30,80 ℃水浴震荡1.5 h,超声处理45 min,超声功率140 W,超声温度60 ℃,此时的所得黄酮提取量为58.53 mg/g,超声法具有提取时间短、提取率高、溶剂需要量少等优点[23]。此时黄酮对DPPH·自由基的清除率为91.58%,对ABTS+自由基的清除率为73.71%,对羟自由基的抑制能力为467.91 U/mL,且对蜡样芽孢杆菌和金黄色葡萄球菌具有良好的抑制效果。
[1] JUNXIN Y, YANAN D, JIAY, et al. A study on JA-and BTH-induced resistance of Rosa rugosa ‘Plena’ to powdery mildew (Sphaerothecapannosa)[J]. Journal of Forestry Research,2018, 29(3): 823-831.
[2] FAZAELI H,ZAHEDIFARM. Nutritive value of Damascus rose extraction residue ensiled with different effluent absorbents[J].Turkish Journal of Veterinary and Animal Sciences, 2009, 33(4):265-272.
[3] FENG Y, WU J. A study on the rules of nutritional requirements of rose (Rosa rugosa C.V Plena) in Pinyin County, Shandong Province [China][J]. Soils & Fertilizers, 1992.
[4] FRANCO D, PINELO M, SIEIRO J. Processing of Rosa rubiginosa: Extraction of oil and antioxidant substances[J].Bioresource Technology, 2007, 98(18): 3506-3512.
[5] 高玲美, 李志香, 丁淑燕, 等. 玫瑰花渣的研究进展[J]. 山东教育学院学报, 2010, 25(6): 43-45.GAO L M, LI Z X, DING S Y, et al. Research progress of rose dregs[J]. Journal of Shandong Institute of Education, 2010,25(6): 43-45.
[6] EREN E, CERENGOK E, NUR SEYHAN B, et al. Evaluation of anthocyanin, a rose residue extract, for use in dye-sensitized solar cell. Asian Journal of Chemistry[J]. 2015, 27(10): 3745-3748.
[7] 刘文亚. 玫瑰花渣化学成分及抗氧化、抑制酪氨酸酶活性研究[D]. 郑州: 郑州大学, 2018.LIU W Y. Chemical constituents and antioxidant and tyrosinase inhibitory activities of rose pomace[D]. Zhengzhou: Zhengzhou University, 2018.
[8] 张佳婵, 谢娅霏, 虞旦, 等. 玫瑰花及花渣中黄酮类物质的提取及其抗氧化活性研究[J]. 食品工业科技, 2014, 35(22): 226-230.ZHANG J C, XIE Y F, YU D, et al. Extraction and antioxidant activity of Flavonoids from rose and flower residue[J]. Food industry technology, 2014, 35(22): 226-230.
[9] 马猛华. 玫瑰花渣中有效成分的提取[D]. 济南: 山东轻工业学院, 2009.MA M H. Extraction of effective components from rose dregs[D]. Jinan: Shandong University of light industry, 2009.
[10] SLAVOV A, DENEVP, PANCHEVI, et al. Combined recovery of polysaccharides and polyphenols from Rosa damascena wastes[J]. Industrial Crops and Products, 2017, 100: 85-94.
[11] 杨虎, 张生堂, 高国强. 玫瑰黄酮的提取及其清除DPPH 自由基活性研究[J]. 食品科学, 2012, 33(24): 152-155.YANG H, ZHANG S T, GAO G Q. Extraction and DPPH radical scavenging activity of Flavonoids from Rosa rugosa[J]. Food science, 2012, 33(24): 152-155.
[12] 贺家勇, 魏琴, 李志强, 等. 玫瑰黄酮提取物对高脂血症大鼠血脂及单核细胞趋化因子1 表达的影响[J]. 新疆医科大学学报, 2018, 41(11): 1404-1407.HE J Y, WEI Q, LI Z Q, et al. Effects of rose flavonoids extract on blood lipid and monocyte chemoattractant factor-1 expression in hyperlipidemic rats[J]. Journal of Xinjiang Medical University,2018, 41(11): 1404-1407.
[13] 何熹, 韩宁. CO2 超临界萃取法提取玫瑰类黄酮及其保健功能研究[J]. 安徽农业科学, 2009, 37(26): 12699-12700.HE X, HAN N. Study on the extraction of Flavonoids from rose by CO2 supercritical fluid extraction and its health function[J].Anhui agricultural science, 2009, 37(26): 12699-12700.
[14] 周小琦, 方敏, 宫智勇. 玫瑰花中总黄酮提取工艺及其抗氧化与抑菌作用的研究[J]. 食品科学, 2010, 31(20): 102-105.ZHONG X Q, FANG M, GONG Z Y. Study on the extraction technology of total flavonoids from rose and its antioxidant and antibacterial activities[J]. Food science, 2010, 31(20): 102-105.
[15] WEDLER J, WESTON A, RAUSENBERGER J, et al. In vitro modulation of inflammatory target gene expression by a polyphenol-enriched fraction of rose oil distillation wastewater[J].Fitoterapia, 2016, 114: 56-62.
[16] KUMAR N, BHANDARI P, SINGH B, et al. Reversed phase-HPLC for rapid determination of polyphenols in flowers of rose species[J]. Journal of separation science, 2008, 31(2): 262- 267.
[17] RAJHA H N, JAOUDE N A, LOUKA N, et al. Industrial byproducts valorization through energy saving processes. Alkaline extraction of polyphenols from vine shoots[C]. International Conference on Renewable Energies for Developing Countries2014 IEEE, 2014, 89-94.
[18] BAYDAR N G, BAYDAR H. Phenolic compounds, antiradical activity and antioxidant capacity of oil-bearing rose (Rosa damascena Mill.) extracts[J]. Industrial Crops and Products, 2013,41: 375-380.
[19] ZHU Z, LI S, HE J, et al. Enzyme-assisted extraction of polyphenol from edible lotus (Nelumbo nucifera) rhizome knot:Ultra-filtration performance and HPLC-MS2 profile[J]. Food Research International, 2018, 111: 291-298.
[20] DAHMOUNE F, NAYAK B, MOUSSI K, et al. Optimization of microwave-assisted extraction of polyphenols from Myrtus communis L. leaves[J]. Food Chemistry, 2015, 166: 585-595.
[21] 徐洁, 李霁昕, 毕阳, 等. 超声波和微波辅助提取苦水玫瑰鲜花和花渣中原花青素的工艺优化及其比较[J]. 食品科学,2018, 39(12): 268-275.XU J, LI J X, BI Y, et al. Optimization and comparison of ultrasonic and microwave assisted extraction of Proanthocyanidins from fresh flowers and flower residue of Kushui rose[J]. Food science, 2018, 39(12): 268-275.
[22] 陈东明. 超声提取玫瑰花渣中多酚、多糖的工艺研究[D]. 郑州: 郑州大学, 2014.CHEN D M. Ultrasonic extraction of polyphenols and polysaccharides from rose dregs[D]. Zhengzhou: Zhengzhou University, 2014.
[23] 谢琼, 胡爽. 超声提取玫瑰花渣中的总黄酮[J]. 农产品加工,2018, (6): 18-22.XIE Q, HU S. Ultrasonic extraction of total flavonoids from rose dregs[J]. Agricultural products processing, 2018, (6): 18-22.
[24] SLAVOV A, DENEV P, PANCHEV I, et al. Combined recovery of polysaccharides and polyphenols from Rosa damascena wastes[J]. Industrial Crops and Products, 2017, 100: 85-94.
[25] DEMIRN, YILDIZ O, ALPASLAN M, et al. Evaluation of volatiles, phenolic compounds and antioxidant activities of rose hip (Rosa L.) fruits in Turkey[J]. LWT-Food Science &Technology, 2014, 57: 126-133.
[26] 陆秀云, 王波, 曹佳敏, 等. 响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺及抗氧化活性研究[J]. 食品工业科技, 2017, 38(11): 258-265.LU X Y, WANG B, CAO J M, et al. Optimization of separation and purification process and antioxidant activity of total flavonoids from waste after extraction of essential oil from bitter rose by Response Surface Methodology[J]. Food industry technology, 2017, 38(11): 258-265.
[27] RAVINDRAN R, DESMOND C, JAISWAL S, et al. Optimisation of organosolv pretreatment for the extraction of polyphenols from spent coffee waste and subsequent recovery of fermentable sugars[J]. Bioresource Technology Reports, 2018, 3: 7-14.
[28] KIMURA H, SASHIHARA T, MATSUSAKI H, et al. Novel Bacteriocin of Pediococcus sp. ISk-1 isolated from well-gedbed of fermented rice bran[J]. Annals of the New York Academy of Sciences. 1998, 864(1): 345-348.
[29] 宋可珂, 陈红艳, 廖蓉苏, 等. 不同品种玫瑰花中黄酮的提取及抗氧化性[J]. 中国农业大学学报, 2012, 17(5): 59-63.SONG K K, CHEN H Y, LIAO R S, et al. Extraction and antioxidant activity of Flavonoids from different rose varieties[J].Journal of China Agricultural University, 2012, 17(5): 59-63.
[30] 牛元, 徐琼, 庄健, 等. 苦水玫瑰与其变异品种中黄酮含量的测定与比较[J]. 中兽医医药杂志, 2018, 37(5): 53-55.NIU Y, XU Q, ZHUANG J, et al. Determination and comparisonof flavonoids in bitter rose and its variety[J]. Journal of Chinese Veterinary Medicine, 2018, 37(5): 53-55.