近年来,膳食纤维因具有调节糖脂代谢的功效已日渐成为研究热点[1]。流行病学研究表明,膳食纤维的摄入与糖脂代谢紊乱等慢性疾病的发病率呈负相关[2]。基于膳食纤维、肠道菌群和糖脂代谢三者之间的密切关联性,本文就膳食纤维的理化性质、微生物及其代谢产物介导的调控机制、与糖脂代谢的关系进行简要综述,并对未来的研究方向提出建议,以期为利用膳食纤维研发功能性食品提供新思考和理论依据。
1 膳食纤维的定义及其分类
膳食纤维(Dietary fiber,DF)是不能被人和动物小肠分泌的消化酶消化、进入大肠后被肠道细菌部分或全部发酵的碳水化合物聚合物,包括非淀粉多糖、抗性低聚糖、抗性淀粉和木质素(表1)[3-4]。DF 的每日推荐量是成年女性25 g和成年男性38 g[5]。
表1 膳食纤维的组成和分类
Table 1 Classification and composition of dietary fiber

?
2 膳食纤维的理化特性
不同种类的膳食纤维的生理作用取决于它们在体内的代谢方式,而代谢方式又取决于它们的理化特性。
2.1 水化性能
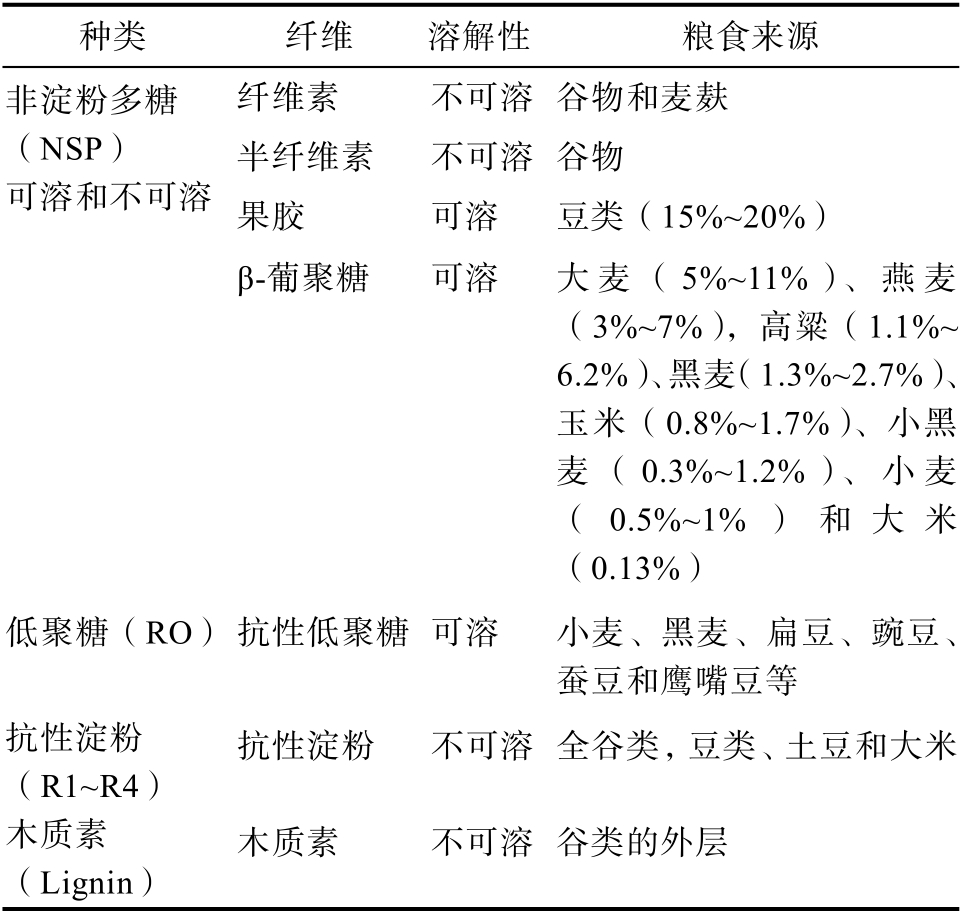
DF 的水化性能以吸水膨胀能力、水溶性和持水能力来表征。DF 的水化性能是纤维源将水整合进入其基质形成胶状悬浮体的能力[6]。其中根据溶解度的不同可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不可溶性膳食纤维(insoluble dietary fiber IDF)[7]。SDF 是可发酵并具有黏性的纤维,而IDF 是无黏性而且发酵不良的纤维,这种区别来源于纤维源的化学性质和分析定量,而不是他们的生理效应。SDF 包括果胶、瓜尔胶、葡聚糖、木车前草、阿拉伯木聚糖和菊粉等,IDF包括纤维素、一些半纤维素和木质素[8]。IDF 的最佳粮食来源是全谷类粮食,其中包括全谷物、麦麸和豆类等;富含SDF 的粮食有燕麦、大麦、黑麦等。表2 介绍了粮食来源中DF 的种类和成分。
表2 膳食纤维成分和粮食来源
Table 2 Ingredients and food sources of dietary fiber
?
2.2 黏性
黏性是影响DF 生理功能的一个重要的理化性质。黏性DF 包括可溶性多糖,如树胶、果胶、瓜尔豆胶以及β-葡聚糖等。一般SDF 较IDF 的黏性更强。黏性DF 与液体混合后变稠,黏稠的纤维使肠腔内的内容物变厚,减缓了营养物质向肠壁的迁移。因此,它们会减少肠道对胆固醇和糖的吸收,从而降低了血糖和胆固醇浓度[9]。另外,黏性纤维中含有许多活性基团,可以吸附螯合胆固醇,降低血液胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平[10]。
2.3 发酵性能
由于大多数DF 是可发酵的,因此现在普遍将纤维分为部分发酵、不良发酵和发酵良好。通常来讲,发酵良好的纤维可溶于水,而部分或发酵不良的纤维则不溶于水,可发酵DF 在结肠中发酵生成短链脂肪酸(short chain fatty acid,SCFAs),而不完全发酵的纤维可通过促进排便改善肠道健康[11]。不同来源的纤维由于理化性质的不同,其产生的生理活性也不同,单一的DF 不能提供全方位的生理功能。因此,建议在日常饮食中选择多种富含纤维的食物或纤维源,更广泛的利用DF 生理功能。
3 DF 调控糖脂代谢的作用途径
DF 在调控宿主糖脂代谢方面起到重要作用,其作用机制与DF 的理化性质有关,主要表现在以下四个方面:
3.1 降低餐后血糖/胰岛素血症
SDF 有助于增加胃内容物的黏度,可延长胃排空时间、减慢食物通过小肠的运输时间、降低淀粉消化和葡萄糖吸收速率,从而改变血糖和胆固醇的浓度[12]。仇菊等研究发现,当IDF 含量达到SDF 的5 倍时,能够和SDF 一样有效促进胰岛素分泌并改善糖耐量和血脂水平,说明IDF 对血糖和血脂的调控存在剂量依赖性,但机制尚不明确[13]。
3.2 降低胆固醇水平
DF 的降血脂的机制与血糖的作用机制相似。一方面DF 能够鳌合胆固醇,加速脂质物质的排泄,降低血清胆固醇水平;另一方面DF 可以降低胆汁酸的重吸收,促进胆固醇合成胆汁酸,增加胆汁酸的排出,降低血液中循环胆固醇浓度[14]。在高脂日粮喂养的大鼠饮食中加入DF 可以增加粪便甾醇和胆汁酸的浓度,降低了胆汁酸的重吸收,促进了胆汁酸合成酶基因的表达,从而显著降低了血清中TC 和LDL-C 水平[15]。Othman 等进行的系统性文献综述指出,每天摄入3 g 以上燕麦β-葡聚糖可以使正常胆固醇或高胆固醇血症受试者的血浆TC 和LDL-C 水平降低5%~10%,有效降低患冠心病的风险[10]。
3.3 增加短链脂肪酸生产
DF 在结肠酵解生成短链脂肪酸(SCFAs),SCFAs 都是弱酸,大部分以游离阴离子(SCFA–)形式存在于肠腔内,可迅速地被结肠黏膜吸收。SCFAs 一旦被结肠黏膜上皮细胞吸收就能被转运至肝脏和脂肪组织,通过参与胆固醇、三酰甘油及脂肪酸的关键代谢过程,来维持机体糖脂代谢的稳态[16]。同时SCFAs 可以作为有益微生物的底物,具有建立重要的微生物区系、改善糖脂代谢疾病发生的作用[17]。
3.4 增加饱腹感,调节体重
DF 能够吸水膨胀、降低40%的饥饿感,增加饱腹感,减少食物的摄入,从而起到预防超重和减少肥胖作用[18]。Hongchou 等试验发现,16 名受试者服用含β-葡聚糖的燕麦片后,平均体重减轻(2.08±2.05)kg,BMI 指数下降(0.81±0.80)kg/m2,体脂率下降0.93%±1.73%;同时显著降低血液TC和LDL-C 水平,调控脂质代谢稳态[19]。抗性淀粉和玉米麸皮DF 可以提高饱腹感,减少能量摄入,在减少脂肪堆积和肥胖方面起到良好效果[20]。这些结果表明IDF 和SDF 的摄入对增加饱腹感和控制体重都有积极的影响。通过DF 的摄入,有利于健康机体保持糖脂代谢稳态,对于糖脂代谢紊乱的预防和治疗具有重要意义。
4 DF 对肠道微生物的影响
近年来,越来越多研究发现肠道菌群作为影响宿主代谢的重要因子,与肥胖、Ⅱ型糖尿病和高脂血症等糖脂代谢紊乱慢性疾病的发生发展密切相关。肠道菌群会受到很多因素的影响,其中饮食作为重要的影响因子之一。肠道微生物群会随着饮食的变化而迅速改变,DF 通过影响肠道菌群的组成、多样性和代谢产物调节机体糖脂代谢。
4.1 DF 经肠道微生物途径调节糖脂代谢的作用
4.1.1 促进益生菌生长
益生菌通常是指那些具有增强肠道发育和消化能力,或改善宿主营养、免疫和抵抗肠道病原体感染功能的细菌,如双歧杆菌和乳酸杆菌等。益生菌可以调节肠道菌群并与之产生积极的相互作用,进而调节宿主的营养代谢和能量平衡[21]。动物实验表明益生菌可以改善糖尿病小鼠糖代谢紊乱状况[22],降低血清中胆固醇水平,调节脂质代谢[23]。人群试验显示益生菌可以有效降低血清胰岛素水平,胰岛素抵抗,胆固醇和甘油三酯的水平[24]。
DF 作为一种益生元,其在肠道中的生理作用之一是选择性的丰富有益菌的生长。喂食高脂肪饮食的小鼠补充可发酵纤维后,可增加肠道双歧杆菌数量,血液中脂多糖(lipopolysaccharide,LPS)水平恢复正常,并可改善葡萄糖耐量、胰岛素分泌及炎症反应等[25]。人群试验显示,与面粉和精玉米面相比,摄入富含纤维的全麦粉和玉米粗面粉后,粪便中双歧杆菌和乳酸杆菌的含量分别增加了 1.2(log 2 fold changes)和 0.19(log10 bacteria/g)拷贝数(P<0.05)[26-27]。基于动物和人群的研究结果发现,DF 可为肠道中的益生菌提供充足的底物,促进其生长,同时可减少致病菌含量,增强肠道屏障。此外,DF 还可促进肠道激素分泌,对控制食欲、机体糖脂代谢稳态及炎症反应具有有益作用[28]。
4.1.2 增加肠道菌群多样性
肠道菌群多样性降低会导致微生物生态系统紊乱,从而引发慢性代谢炎症反应,诱发机体糖脂代谢紊乱,引起糖尿病、心血管病和肥胖等慢性疾病。肠道微生物生态学在很大程度上受人类饮食的调节[29]。研究表明与肥胖个体相比,非肥胖个体肠道内拥有更多样化的微生物群[30]。非肥胖人群肠道细菌的数据和丰度高于肥胖人群,与高细菌丰富度的个体相比,低细菌丰富度的个体更容易表现为肥胖、胰岛素抵抗、血脂异常等。随着时间的推移,细菌丰富度较低的肥胖个体体重会持续增加[31]。
DF 可通过调节肠道菌群多样性影响宿主糖脂代谢。Velikonja 团队在一项平行设计的研究中研究了β-葡聚糖DF 对肠道菌群变化的影响,43名志愿者食用含有6 g/天大麦β-葡聚糖的面包(实验组)或等量不含β-葡聚糖的面包(对照组)连续四周后发现,摄入β-葡聚糖组的微生物多样性和丰富度增加,血浆TC 水平降低了0.26±0.54(P<0.05)[32]。De Filippo 比较了欧洲儿童和非洲农村儿童(高纤维饮食)的粪便微生物群,结果发现非洲儿童粪便中拟杆菌门丰度增加,厚壁菌门丰度减少,同时检测到普氏菌属和木菌属等独特丰富的细菌,在欧洲儿童中完全缺乏,其可分解木聚糖和其他植物纤维产生SCFAs,保护他们远离炎症和肠道疾病[33]。以上试验证明富含纤维的饮食有助于维护健康的肠道微生物群,增加菌群多样性和功能,促进人体健康。其可能机制是膳食纤维可以促进肠道内拟杆菌属,普氏菌属和木菌属等有益菌生长,并产生SCFAs。SCFAs可以调节肠黏膜细胞与免疫炎症、肠道屏障功能有关基因的转录,引发肠道菌群发生变化,进而调节糖脂代谢[17]。另外,SCFAs 可以增加胃肠道激素分泌,促进胰岛素分泌和糖脂代谢稳态。
4.2 肠道微生物代谢产物
DF 不仅能调节肠道菌群组成和多样性,还能调节微生物代谢产物短链脂肪酸(SCFAs)或者转化某些宿主代谢物质例如胆汁酸(bile acid,BA)组成等,改善肠道健康,影响机体代谢。
4.2.1 短链脂肪酸(SCFAs)
DF 是影响SCFAs 产生的主要食品成分。人类缺乏分解DF 的酶,因此食物纤维在通过上消化道时大部分未被消化,在盲肠和结肠中被厌氧微生物发酵产生SCFAs,包括乙酸、丙酸、丁酸以及琥珀酸盐等。SCFAs 可作为代谢底物和信号分子参与机体的能量代谢。SCFAs 主要通过以下途径参与机体糖脂代谢调节:
(1)SCFAs 的生成会降低肠腔中pH 值,利于益生菌和阻止病原菌生长[34]。付南燕等发现,高胆固醇饮食小鼠饲粮中加入5 g/kg DF 后,可显著增加小鼠粪便中SCFAs 的产量(2 倍以上)和肠道有益菌群和优势菌群相对丰度[35]。
(2)SCFAs 作为配体与受体结合,刺激激素分泌,改善机体代谢。研究表明,SCFAs 作为信号分子,与游离脂肪酸受体(FFAR2 和FFAR3)结合,从而刺激瘦素(脂肪细胞分泌)、胃肠肽类激素酪酪肽(peptide YY, PYY)及胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)等激素的释放,这些激素可以延迟胃排空和降低肠蠕动、降低食物摄入及胰岛素分泌、抑制脂肪组织中的脂肪堆积,从而改善机体代谢[36-38]。试验表明,膳食纤维摄入显著增加大鼠肠道中SCFAs 的含量,诱导肠道激素PYY 和GLP-1 分泌,减少摄食量,改善胰岛素敏感性和糖脂代谢紊乱症状[37]。
(3)SCFAs 通过弱化组蛋白去乙酰化酶(histone deacetylase,HDAC)活性,抑制LPS介导Toll 样受体4(TLR4)信号通路的炎症反应,改善胰岛素抵抗和糖脂代谢平衡[39-41]。LPS 被免疫细胞表面TLR4 识别,引起一系列非特异性炎症反应,从而干扰免疫系统,诱导系统性慢性低度炎症,导致肥胖、胰岛素抵抗及糖耐量异常等代谢性疾病的发生[42]。DF 可以通过增加SCFAs含量协同抑制促炎介质的产生,缓解炎症反应,促进机体代谢稳态[43]。患有Ⅱ型糖尿病和/或高血压的肥胖受试者摄入DF 后可以减少肠道内致病菌繁殖,改变肠道中SCFAs 水平,降低肠道炎症水平和血清中甘油三酯、TC、LDL-C 浓度,改善空腹血糖和餐后血糖水平,这项研究证明了DF 可以通过改变肥胖人群中肠道菌群组成和SCFAs 来减少肠道炎症,进而改善葡萄糖和脂质代谢[44]。
4.2.2 胆汁酸(BA)
BA 是肠道微生物代谢的另一个重要产物,在糖脂代谢中发挥重要作用。 一方面BA 作为膳食脂质的清洁剂对肠道中的脂肪消化和脂溶性维生素吸收起着重要的作用;另一方面BA 作为相关的信号分子和代谢调节因子与胆汁酸法尼醇 X受体(FXR)和G 蛋白偶联受体5(TGR5)结合参与调解糖脂代谢途径和能量稳态。
初级胆汁酸以胆固醇为原料在肝脏中合成、储存在胆囊中,食物摄取后排泄到十二指肠参与脂质乳化。肠道菌群通过胆酸盐水解酶和胆固醇7α-羟化酶,将初级胆汁酸转化为次级胆汁酸。初级胆汁酸主要包括胆酸(CA)、鹅脱氧胆酸(CDCA)和猪胆酸(HCA),次级胆汁酸主要有脱氧胆酸(DCA)、石胆酸(LCA)、猪脱氧胆酸(HDCA)和熊脱氧胆酸(UDCA)[45]。肠道菌群失调会改变胆汁酸谱的组成,降低胆汁酸受体活性,引起机体糖脂代谢紊乱。不同类型胆汁酸亲和不同受体,引发不同的激活效应。BA 激活FXR 的活性顺序为:CDCA>DCA>CA>LCA[46]。胆汁酸激活FXR,诱导小异源二聚体伴侣受体(SHP)表达,SHP 抑制转录因子固醇调节元件结合蛋白-1c 基因表达(调节脂肪酸和甘油三酯合成的关键转录因子,减少肝脏脂质合成[47]。FXR经BA 激活后诱导成纤维细胞生长因子FGF19 在肠内表达和分泌,调节机体葡萄糖动态平衡,改善胰岛素抵抗,增加能量消耗,减轻体重[48]。TGR5是研究最为深入的膜结合G 蛋白偶联受体,BA是目前已知的TGR5 的唯一内源性配体。BA 对TGR5 的结合能力排序为 LCA>DCA>CDCA>CA[46]。TGR5 信号激活可以调节GLP-1 的释放,改善肝脏和胰腺功能,刺激胰岛素分泌,调节脂质合成和储存。TGR5 激活还可以通过调节细胞内cAMP 和刺激脱碘酶活性,进而将肌细胞中的促甲状腺素转化为活性激素三碘甲状腺素,参与能量稳态的调节[49]。
DF 可以为微生物群和胆汁酸提供一个共同的平台,一方面胆汁酸可以通过受体直接调控宿主糖脂代谢,另一方面胆汁酸组成的改变也会对肠道微生物组成产生影响从而对机体代谢起到调节作用。David 等研究表明,缺乏纤维的动物性饮食或高脂肪饮食会影响肠道微生物生态和胆汁酸代谢,引起糖脂代谢紊乱[29]。作者前期研究发现DF 摄入可以增加回肠和盲肠中FXR 的表达,降低血清中TC、LDL-C 和甘油三酯浓度,调节脂质代谢[45]。Ginos 等进行了一项随机临床研究,80 名健康成年人接受了一项对照、交叉喂养试验,其中包括全谷物饮食,豆类、蔬菜、水果和精制的谷物饮食(高血糖负荷),研究结果发现,全谷物饮食显著增加了血清胆汁酸的水平,这些胆汁酸可激活FXR 和TGR5 受体,影响葡萄糖和脂质稳态[50]。目前,关于DF 介导的胆汁酸直接调控糖脂代谢的研究是有限的,还需要更多的工作阐明其分子机制。
5 小结与展望
DF 可通过其理化性质和肠道微生物途径有效的改善糖脂代谢稳态。DF 的理化性质对糖脂代谢调控发挥着重要作用,但由于DF 的种类和来源众多,其理化和生理特性各不相同,对糖脂代谢的调控起到不同的作用。因此,更好地理解每种DF 调节糖脂代谢的生理机制,对于加强预防和治疗糖脂代谢紊乱疾病具有决定性作用。DF 与肠道微生物群和宿主糖脂代谢之间存在紧密联系。饮食的变化直接影响肠道菌群,进而影响宿主代谢。通过摄入富含DF 的食物和功能性食品调节肠道菌群和代谢物,进而预防和治疗糖脂代谢紊乱疾病是目前和未来生物领域研究的一个重要方向。
就目前研究进展而言,还有一些问题有待研究:(1)IDF 对血糖和血脂的调控存在剂量依赖性,但具体的作用机理还不是很清楚,需要更多的实验探究其调控机理;(2)DF 对胆汁酸代谢的影响还主要集中在粪便胆汁酸排出量和肠道胆汁酸组成方面,缺乏与胆汁酸相应受体(FXR 和TGR5)参与宿主生理代谢的机制研究;(3)通过特定微生物或代谢产物判断糖脂代谢紊乱等疾病,并利用特定DF 实现靶向性预防和治疗,未来需要大量的实验积累工作去完成这一重点和难点,才能将DF 更好的应用于生物医学领域。
[1] FULLER S, BECK E, SALMAN H, et al. New horizons for the study of dietary fiber and health: a review [J]. Plant Foods for Human Nutrition, 2016, 71(1): 1-12. DOI: 10.1007/s11130-016-0529-6.
[2] OTLES S, OZGOZ S. Health effects of dietary fiber[J]. Acta Entiarum Polonorum, Technologia Alimentaria, 2014, 13(2):191-202. DOI: 10.17306/J.AFS.2014.2.8.
[3] PAPATHANASOPOULOS A, CAMILLERI M. Dietary fiber supplements: Effects in obesity and metabolic syndrome and relationship to gastrointestinal functions[J]. Gastroenterology,2010, 138(1): 65-72. DOI: 10.1053/j.gastro.2009.11.045.
[4] KAISA R, JENNI L, MYKKÄNEN H, et al. Dietary fiber type reflects physiological functionality: comparison of grain fiber,inulin, and polydextrose[J]. Nutrition Reviews, 2011, 69(1):9-21. DOI: 10.1111/j.1753-4887.2010.00358.x.
[5] MUMFORD S L, SCHISTERMAN E F, MARIA S R A, et al.Effect of dietary fiber intake on lipoprotein cholesterol levels independent of estradiol in healthy premenopausal women[J].American Journal of Epidemiology, 2011, 173(2): 145-156. DOI:10.1093/aje/kwq388.
[6] SIDDIQ M, HARTE J B, DOLAN K D, et al. Use of low-temperature extrusion for reducing phytohemagglutinin activity (PHA) and oligosaccharides in beans (Phaseolus vulgaris L.) cv. Navy and Pinto[J]. Food Chemistry 2012, 4(133):1636-1639. DOI: 10.1016/j.foodchem.2012.02.044.
[7] KERR B J, SHURSON G C. Strategies to improve fiber utilization in swine[J]. Journal of Animal Science &Biotechnology, 2013, 4: 11-11. DOI: 10.1186/2049-1891-4-11.
[8] SHARMA S K, BANSAL S, MANGAL M, et al. Utilization of food processing by-products as dietary, functional and novel fibre: a review[J]. Critical Reviews in Food Science and Nutrition, 2015, 56(10). DOI: 10.1080/10408398.2013.794327.
[9] MÄLKKI Y. Physical properties of dietary fiber as keys to physiological functions[J]. Cereal Foods World, 2001, 46(5):196-199. DOI: 10.1094/CCHEM.2001.78.3.368.
[10] OTHMAN R, MOGHADASIAN M, PJH J. Cholesterollowering effects of oat B-glucan: Mini review[J]. Nutrition Reviews, 2011, 69(6): 299-309. DOI: 10.1111/j.1753-4887.2011.00401. x.
[11] WEICKERT M O, PFEIFFER A F H. Metabolic effects of dietary fiber consumption and prevention of diabetes1[J]. Journal of Nutrition, 2008, 3(138): 439-442. DOI: 10.1093/jn/138.3.439.
[12] DIKEMAN C L, MURPHY M R, FAHEY G C. Dietary fibers affect viscosity of solutions and simulated human gastric and small intestinal digesta[J]. Journal of Nutrition, 2018, 136(4):913-919. DOI: 10.1111/j.1365-277X.2006.00684.x.
[13] 仇菊, 朱宏, 吴伟菁. 苦荞中可溶及不可溶膳食纤维调控糖脂代谢的功效[J]. 食品科学, 2020. DOI: 10.7506/spkx1002-6630-20200507-062.QIU J, ZHU H, WU W J. Effect of soluble and insoluble dietary fiber in Tartary buckwheat on glucose and lipid metabolism[J].Food Science, 2020. DOI: 10.7506/spkx1002-6630-20200507-062.
[14] ZHU R G, SUN Y D, LI T P et al. Comparative effects of hawthorn (Crataegus pinnatifida Bunge) pectin and pectin hydrolyzates on the cholesterol homeostasis of hamsters fed high-cholesterol diets[J]. Chemico-Biological Interactions, 2015,5(238): 42247. DOI: 10.1016/j.cbi.2015.06.006.
[15] ZHU R G, HOU Y, SUN Y, et al. Pectin penta-oligogalacturonide suppresses intestinal bile acids absorption and downregulates the FXR-FGF15 axis in high-cholesterol fed mice[J]. Lipids, 2017,52(6): 489-498. DOI: 10.1007/s11745-017-4258-x.
[16] HAN K H, TSUCHIHIRA H, NAKAMURA Y, et al. Inulin-type fructans with different degrees of polymerization improve lipid metabolism but not glucose metabolism in rats fed a high-fat diet under energy restriction[J]. Digestive Diseases and Sciences,2013, 58(8): 2177-2186. DOI: 10.1007/s10620-013-2631-z.
[17] LARRAUFIE P, MARTIN-GALLAUSIAUX C, LAPAQUE N,et al. SCFAs strongly stimulate PYY production in human enteroendocrine cells[J]. Scientific Reports, 2018, 8(74): 1-9.DOI: 10.1038/s41598-017-18259-0.
[18] HOWARTH N C, SALTZMAN E, ROBERTS S B. Dietary fiber and weight regulation[J]. Nutrition Reviews, 2001, 59(5): 129-139. DOI: 10.1111/j.1753-4887.2001.tb07001.x.
[19] CHANG H C, HUANG C N, YEH D M, et al. Oat prevents obesity and abdominal fat distribution, and improves liver function in humans[J]. Plant Foods Hum Nutr, 2013, 68(1):18-23. DOI: 10.1007/s11130-013-0336-2.
[20] WILLIS H J, ELDRIDGE A L, BEISEIGEL J, et al. Greater satiety response with resistant starch and corn bran in human subject[J]. Nutrition Research, 2009. DOI: 10.1016/j.nutres.2009.01.004.
[21] FALCINELLI S, PICCHIETTI S, RODILES A, et al.Lactobacillus rhamnosus lowers zebrafish lipid content by changing gut microbiota and host transcription of genes involved in lipid metabolism[J]. Scientific Reports, 2015, 5: 9336-9347.DOI: 10.1038/srep09336.
[22] 高伟华. 乳酸菌对高糖高脂2 型糖尿病小鼠糖脂代谢及肠道菌群的影响[D]. 临汾: 山西师范大学, 2018.GAO W J. Effects of lactobacillus on glucolipids metabolism and intestinal flora in type 2 diabetic mice fed with high-glucose and high-fat diet Master dissertation[D]. Linfen: Shanxi normal university, 2018.
[23] BAGAROLLI R A, TOBAR N, OLIVEIRA A G, et al. Probiotics modulate gut microbiota and improve insulin sensitivity in DIO mice[J]. The Journal of Nutritional Biochemistry, 2017, 50 (1):16-25. DOI: 10.1016/j.jnutbio.2017.08.006.
[24] SILVIA F, ANA R, AZADEH H, et al. Influence of probiotics administration on gut microbiota core: a review on the effects on appetite control, glucose, and lipid metabolism[J]. Journal of Clinical Gastroenterology, 2018, 52(Suppl 1): S50-S56. DOI:10.1097/MCG.0000000000001064.
[25] ZOU J, CHASSAING B, SINGH V, et al. Fiber-mediated nourishment of gut microbiota protects against diet-induced obesity by restoring il-22-mediated colonic health[J]. Cell Host Microbe, 2018, 23(1): 41-53. e4. DOI: 10.1016/j.chom.2017.11.003.
[26] CHRISTENSEN E G, LICHT T R, KRISTENSEN M, et al.Bifidogenic effect of whole-grain wheat during a 12-week energy-restricted dietary intervention in postmenopausal women[J]. European Journal of Clinical Nutrition, 2013, 67(12):1316-1321. DOI: 10.1038/ejcn.2013.207.
[27] CARVALHO-WELLS A L, HELMOLZ K, NODET C, et al.Determination of the in vivo prebiotic potential of a maize-based whole grain breakfast cereal: a human feeding study[J]. British Journal of Nutrition, 2010, 104(09): 1353-1356. DOI: 10.1017/S0007114510002084.
[28] GEURTS L, NEYRINCK A M, DELZENNE N M, et al. Gut microbiota controls adipose tissue expansion, gut barrier and glucose metabolism: novel insights into molecular targets and interventions using prebiotics[J]. Beneficial microbes, 2014,5(1): 3-17. DOI: 10.3920/BM2012.0065.
[29] DAVID L A, MAURICE C F, CARMODY R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J].Nature, 2014, 505(7484): 559-563. DOI: 10.1038/nature12820.
[30] LOZUPONE C A, STOMBAUGH J I, GORDON J I, et al.Diversity, stability and resilience of the human gut microbiota[J].Nature, 2012, 489(7415): 220-230. DOI: 10.1038/nature11550.
[31] LE CHATELIER E, NIELSEN T, QIN J, et al. Richness of human gut microbiome correlates with metabolic markers[J].Nature, 2013, 500(7464): 541-546. DOI: 10.1038/nature12506.
[32] VELIKONJA A, LIPOGLAVŠEK L, ZOREC M, et al.Alterations in gut microbiota composition and metabolic parameters after dietary intervention with barley beta glucans in patients with high risk for metabolic syndrome development[J].Anaerobe, 2019, 55: 67-77. DOI: 10.1016/j.anaerobe.2018.11.002.
[33] DE FILIPPO C, CAVALIERI D, DI PAOLA M, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J]. Proceedings of the National Academy of Sciences, 2010, 107(33): 14691-14696.DOI: 10.1073/pnas.1005963107.
[34] SANCHEZ J, MARZORATI M, GROOTAERT C, et al.Arabinoxylan-oligosaccharides (AXOS) affect the protein/carbohydrate fermentation balance and microbial population dynamics of the simulator of human intestinal microbial ecosystem[J]. Microbial Biotechnology, 2009, 2(1): 101-113.DOI: 10.1111/j.1751-7915.2008.00064.x.
[35] 付南燕, 吴正平, 周林华, 等. 谷物膳食纤维对高胆固醇饮食小鼠脂质代谢及肠道菌群的影响[J]. 动物营养学报2021,33(2): 1137-1144. DOI: 10. 3969/j.issn.1006-267x.2021.02.054.FU N Y, WU Z P, ZHOU L H, et al. Effects of grain dietary fiber on lipid metabolism and intestinal microflora in mice with high cholesterol diet[J]. Chinese Journal of Animal Nutrition, 2021,33(2): 1137-1144. DOI: 10.3969/j.issn.1006-267x.2021.02.054.
[36] EVERARD A, CANI P D. Gut microbiota and GLP-1[J].Reviews in Endocrine and Metabolic Disorders, 2014, 15(3):189-196. DOI: 10. 1007/s11154-014-9288-6.
[37] CHAMBERS E S, VIARDOT A, PSICHAS A, et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults[J]. Gut, 2015, 64(11): 1744-1754. DOI: 10.1136/gutjnl-2014-307913.
[38] TOTH I, GOSZLETH G, FRENYÓ L. The major regulators of feed-intake: ghrelin, leptin and their interactions[J]. Literature Review. Magyar Állatorvosok Lapja, 2012, 134(8): 504-512.
[39] CHANG P V, HAO L, OFFERMANNS S, et al. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition[J]. Proceedings of the National Academy of Sciences, 2014, 111(6): 2247-2252. DOI: 10.1073/pnas.1322269111.
[40] LI Z, ZHU Y, LI C, et al. Liraglutide ameliorates palmitateinduced insulin resistance through inhibiting the IRS-1 serine phosphorylation in mouse skeletal muscle cells[J]. Journal of Endocrinological Investigation, 2018, 41(9): 1097-1102. DOI:10. 1007/s40618-018-0836-x.
[41] WU J, ZHOU Z, HU Y, et al. Butyrate-induced GPR41 activation inhibits histone acetylation and cell growth[J]. Journal of Genetics and Genomics, 2012, 39(8): 375-384. DOI:10.1016/j.jgg.2012.05.008.
[42] MAURY E, BRICHARD S. Adipokine dysregulation, adipose tissue inflammation and metabolic syndrome[J]. Molecular and Cellular Endocrinology, 2010, 314(1): 1-16. DOI: 10. 1016/j.mce. 2009. 07. 031.
[43] RODRIGUEZ C M, GALVEZ J, CAMUESCO D, et al.Intestinal anti-inflammatory activity of dietary fiber (plantago ovata seeds) in HLA-B27 transgenic rats[J]. Clinical Nutrition,2003, 22(5): 463-471. DOI: 10.1016/S0261-5614(03)00045-1.
[44] KIM M S, HWANG S S, PARK E J, et al. Strict vegetarian diet improves the risk factors associated with metabolic diseases by modulating gut microbiota and reducing intestinal inflammation[J]. Environmental Microbiology Reports, 2013,5(5): 765-775. DOI: 10.1111/1758-2229.12079.
[45] FANG W, ZHANG L, MENG Q, et al. Effects of dietary pectin on the profile and transport of intestinal bile acids in young pigs[J]. Journal of Animal Science, 2018, 96(11): 4743-4754.DOI: 10.1093/jas/sky327.
[46] TRABELSI M S, LESTAVEL S, STAELS B, et al. Intestinal bile acid receptors are key regulators of glucose homeostasis[J].Proceedings of the Nutrition Society, 2017, 76(3): 192-202. DOI:10.1017/S0029665116002834.
[47] WATANABE M, HOUTEN S M, WANG L, et al. Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c [J]. The Journal of clinical investigation, 2004, 113(10): 1408-1418. DOI: 10.1172/JCI21025.
[48] HU X, XIONG Q, XU Y, et al. Association of serum fibroblast growth factor 19 levels with visceral fat accumulation is independent of glucose tolerance status[J]. Nutrition,Metabolism and Cardiovascular Diseases, 2018, 28(2): 119-125.DOI: 10.1016/j.numecd.2017.10.009.
[49] WAHLSTRÖM A, SAYIN S I, MARSCHALL H-U, et al.Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism[J]. Cell Metabolism, 2016, 24(1):41-50. DOI: 10.1016/j.cmet.2016.05.005.
[50] GINOS B N, NAVARRO S L, SCHWARZ Y, et al. Circulating bile acids in healthy adults respond differently to a dietary pattern characterized by whole grains, legumes and fruits and vegetables compared to a diet high in refined grains and added sugars: a randomized, controlled, crossover feeding study[J].Metabolism, 2018, 83: 197-204. DOI: 10.1016/j.metabol.2018.02.006.