我国是大豆的发源地,从古至今,豆制品的种类多种多样,而豆腐是最受欢迎的一种豆制品。在豆腐挤压成型过程中所产生的、组织状态为棕黄色胶体混合物的废水,即为大豆黄浆水。随着我国豆腐产业的快速发展,大豆黄浆水产量也逐渐增加。研究表明,大豆中的生理活性物质会在豆腐生产过程中随着黄浆水而流失,大豆黄浆水中蛋白质、碳水化合物、脂类、色素以及盐类物质含量丰富[1-4],但其化学需氧量和生物需氧量均较高,直接排放到环境中不仅浪费资源,而且会造成环境的污染[5]。大豆黄浆水中含有大量的微生物生长所需的营养基质[6],黄莉等[7]利用木醋杆菌对黄浆水进行发酵,生产细菌纤维素。刘平[8]利用大豆黄浆水发酵生产维生素 B12。伊静等[9]以黄浆水和山楂为主要原料,经调配和乳酸菌发酵技术制备功能性饮品。因而将黄浆水作为微生物发酵基质,以甘蔗糖蜜作为碳源,既降低发酵成本,又有效解决大豆黄浆水污染问题,实现资源的再利用。
本实验利用乳酸菌和酵母菌对黄浆水进行发酵,以甘蔗糖蜜为碳源,考察糖蜜添加量和初始pH以及不同培养条件对发酵后大豆黄浆水中乳酸菌及酵母菌活菌数的影响,并为后续开发动物微生态制剂打下基础,为制备动物微生态制剂提供廉价的原料以及生产工艺,为大豆黄浆水的综合利用提供新的途径和理论依据。
1 材料与方法
1.1 实验材料
大豆黄浆水:锦州市气象台豆腐厂生产;干酪乳杆菌、发酵乳杆菌、酿酒酵母:由实验室保存;乳酸细菌培养基(MRS培养基)、孟加拉红培养基:天津市科密欧化学试剂;其他试剂均为国产分析纯。
1.2 仪器与设备
DHP-9082型恒温培养箱:金坛市鑫鑫实验仪器厂;SW-CJ-1C超净工作台:苏州净化;M4-AL204电子分析天平:兰州中西仪器;YXQ-LS型立式压力蒸汽灭菌器:上海博讯实业有限公司;DHG-9245A型高低温恒温振荡培养箱:上海一恒科技有限公司。
1.3 方法
1.3.1 菌种种子液制备
黄浆水中加入5%的糖蜜微热混合均匀,121 ℃灭菌15 min,冷却至室温后,从斜面接一环乳酸菌到黄浆水培养基,37 ℃培养24 h;将酵母菌接入上述黄浆水培养基中,28 ℃培养72 h,进行活化培养。
1.3.2 发酵液的制备方法
在添加5%糖蜜、初始pH菌种为6.0的黄浆水培养基中,按接种量为 5%,接种菌种比例为V(发酵乳杆菌):V(干酪乳杆菌)∶V(酿酒酵母)= 1∶1∶1,转速为120 r/min[10],37 ℃振摇培养 72 h。
1.3.3 单因素实验
1.3.3.1 糖蜜添加量对活菌数的影响 在黄浆水培养基中调整添加1%、3%、5%、7%、9%糖蜜,培养条件同 1.3.2,考察糖蜜添加量对活菌数的影响。
1.3.3.2 初始 pH对活菌数的影响 依据 1.3.3.1的研究结果,确定糖蜜的最佳添加量后,调整初始pH为5.2、5.6、6.0、6.4、6.8,其它培养条件同1.3.2,考察初始pH对活菌数的影响。
1.3.3.3 接种量对活菌数的影响 依据1.3.3.2的研究结果,调整接种量为1%、3%、5%、7%、9%,其它培养条件同 1.3.2,考察接种量对活菌数的影响。
1.3.3.4 接种比例对活菌数的影响 依据 1.3.3.3的研究结果,调整接种比例为1∶1∶2、1∶2∶1、1∶1∶1、2∶1∶1、2∶2∶1,转速为 120 r/min,37 ℃振摇培养72 h,考察接种比例对活菌数的影响。
1.3.3.5 转速对活菌数的影响 依据1.3.3.4的研究结果,调整转速为 80、100、120、140、160 r/min,37 ℃振摇培养72 h,考察培养转速对活菌数的影响。
1.3.3.6 培养温度对活菌数的影响 依据 1.3.3.5的研究结果,调整培养温度为31、33、35、37、39 ℃,振摇培养72 h,考察培养温度对活菌数的影响。
1.3.3.7 培养时间对活菌数的影响 依据 1.3.3.6的研究结果,调整培养时间为24、48、72、96、120 h,考察培养时间对活菌数的影响。
1.3.4 乳酸菌总数的测定
采用 GB4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验的方法》测定乳酸菌总数。
1.3.5 酵母菌总数的测定
采用 GB4789.15—2016《食品安全国家标准食品微生物学检验霉菌酵母计数检验的方法》测定酵母菌总数。
1.3.6 响应面实验
在单因素实验的基础上,以乳酸菌活菌数(Y)为指标,以糖蜜添加量(A)、发酵温度(B)、初始pH(C)为自变量,根据Box-Behnken实验设计原理,采用软件Design-Expert V8.0.6.1设计三因素三水平的响应面分析实验,实验因素与水平设计表1所示。
表1 响应面优化实验因素与水平
Table 1 Factors and levels of response surface optimization test

水平因素–1 0 1 A糖蜜添加量/% 4.0 5.0 6.0 B初始pH 6.6 6.8 7.0 C发酵温度/℃ 30 31 32
1.3.7 数据处理
实验数据用Microsoft Excel 2010进行初步整理,每组实验重复3次,实验结果以平均值±标准偏差的形式表示;采用SPSS 22.0软件对单因素数据进行方差分析,并采用LSD法进行多重比较,P>0.05为差异不显著,P<0.05为差异显著。
2 结果与分析
2.1 单因素实验
2.1.1 糖蜜添加量对活菌数影响
甘蔗糖蜜呈深棕色、黏稠状和半流动的液态,含多种活性物质,可作为微生物的碳源或基料[11]。由图1可知酵母菌菌数随着糖蜜添加量的增加呈先降低后升高的趋势,在糖蜜添加量为3%时,菌数达到最低值。随着糖蜜添加量的增加乳酸菌菌数先升高后降低,在糖蜜添加量为 5%时菌数最高,达到 1.72×109 CFU/mL,显著高于其他糖蜜添加量(P<0.05),所以综合考虑本实验以糖蜜添加量5%为宜。

图1 糖蜜添加量对活菌数的影响
Fig.1 The effect of molasses addition on the number of viable bacteria
2.1.2 初始pH对活菌数影响
由图2可知,酵母菌菌数在初始pH为5.6时最高为3.61×107 CFU/mL,初始pH为6.4时菌数次之。随着初始 pH的逐渐升高,乳酸菌菌数先降低后升高,在初始pH为6.8时最高,活菌数为2.03×109 CFU/mL,显著高于其他pH(P<0.05),该因素影响到细菌的分裂程度,可能与细胞分裂诱导机制有关[12],综合分析确定本实验初始 pH为6.8。

图2 初始pH对活菌数的影响
Fig.2 The effect of initial pH on the number of viable bacteria
2.1.3 接种量对活菌数的影响
由图3可知,在接种量为6%时,乳酸菌菌数最高为 2.16×109 CFU/mL,显著高于其他接种量(P<0.05),接种量为 7%时菌数下降。这可能因为随着接种量增多,乳酸菌因群体感应可以更快的适应环境,并快速生长,但当接种量超过一定限度,乳酸菌间会因为竞争营养和生存空间导致乳酸菌的活菌数反而下降[13]。酵母菌菌数在接种量为7%时最高为5.5×107 CFU/mL,但是接种量为6%与7%差异不显著(P>0.05),因此确定最佳接种量为6%。

图3 接种量对活菌数的影响
Fig.3 The influence of inoculation amount on the number of viable bacteria
2.1.4 接种比例对活菌数的影响
由图4可知,当接种比例为1∶1∶1时,乳酸菌和酵母菌的活菌数都达到最高,乳酸菌菌数2.34×109 CFU/mL,酵母菌菌数为5.7×107 CFU/mL,二者菌数均显著高于其他接种比例(P<0.05)。这可能是因为在接种比例为1∶1∶1时,共生促进生长作用大于起始菌数的影响[14],所以确定此接种比例对于混合发酵较为合适。

图4 接种比例对活菌数的影响
Fig.4 The effect of inoculation ratio on the number of viable bacteria
2.1.5 培养转速对活菌数的影响
由图5可知,随着转速的增大,乳酸菌和酵母菌活菌数均呈先增高后降低的趋势。当转速为120 r/min时,乳酸菌活菌数为2.35×109 CFU/mL,显著高于其他培养转速(P<0.05),酵母菌活菌数为6.1×107 CFU/mL。这可能因为转速适当时,将新增的菌体均匀的分散,与培养基充分接触,更加有利于菌体的生长。然而当转速超过一定限度时,菌体数量反而降低,这可能是因为当转速过高时,剪切力过大,使菌体受到损伤,影响其正常生长[15],所以确定培养转速为120 r/min。

图5 培养转速对活菌数的影响
Fig.5 The influence of culture speed on the number of viable bacteria
2.1.6 培养温度对活菌数的影响
由图 6可知,当培养温度为 31 ℃,乳酸菌和酵母菌活菌数均显著高于其他温度(P<0.05),酵母菌菌数为3.5×108 CFU/mL,随着温度升高,超过适合酵母菌生存的温度,活菌数逐渐下降,当温度为 39 ℃时,没有酵母菌存活。而乳酸菌在31 ℃时菌数最高达到3.0×109 CFU/mL,这可能因为乳酸菌为厌氧菌、酵母菌为兼性好氧菌,二者都具有耐酸性,且酵母菌主要在早期生长并产生大量的菌体及代谢产物,而乳酸菌在该温度可以存活,并且能够利用酵母菌的代谢产物进行生长[16],因此最佳培养温度为31 ℃。

图6 培养温度对活菌数的影响
Fig.6 The influence of culture temperature on the number of viable bacteria
2.1.7 培养时间对活菌数的影响
从图7可知,酵母菌在培养时间为72 h时活菌数最高,这是因为酵母的生长周期长于乳酸菌,乳酸菌在培养时间为 48 h时,活菌数最高为3.18×109 CFU/mL,显著高于其他培养时间(P<0.05),培养72 h菌数显著下降,乳酸菌单独培养到24 h大致进入衰亡期,但乳酸菌48 h时菌数最高,可能是由于添加了酵母菌混合发酵,乳酸菌的衰亡期推后[17],综合考虑培养时间以 48 h为宜。

图7 培养时间对活菌数的影响
Fig.7 The influence of culture time on the number of viable bacteria
2.2 响应面法优化培养条件
2.2.1 响应面优化实验结果与分析
依据单因素实验结果,固定接种量为6%、接种比例为1∶1∶1、转速为120 r/min、培养时间为 48 h,选择糖蜜添加量(A)、初始 pH(B)、培养温度(C)3个因素为自变量,因乳酸菌对多种肠道疾病有潜在的抑制作用,是制备微生态制剂的主要菌种,所以将大豆黄浆水发酵液中乳酸菌的活菌数(Y)作为响应值,根据 BoxBehnken设计原理进行响应面实验,实验共17个实验点,其中14个为析因点,5个为中心点,实验设计方案和结果如表2所示。
2.2.2 模型的建立与显著性分析
利用Design-Expert V8.0.6.1软件对表2中的数据进行二次多元回归拟合分析,得到综合评分Y对响应面因素的二次多项回归方程:
表2 响应面分析实验设计及结果
Table 2 Test design and results of response surface analysis

编号 A B C 乳酸菌活菌数/(109 CFU/mL)1 1 0 –1 1.94 2 0 1 1 1.62 3 1 –1 0 1.95 4 0 0 0 3.21 5 0 0 0 3.14 6 1 0 1 1.98 7 0 0 0 3.17 8 –1 0 1 1.57 9 0 –1 1 1.78 10 0 0 0 3.22 11 1 1 0 2.03 12 –1 –1 0 1.66 13 –1 0 –1 1.69 14 0 0 0 3.16 15 –1 1 0 1.72 16 0 –1 –1 1.80 17 0 1 –1 1.89
Y=+3.18+0.16A+8.750E–003B–0.046C+5.000E–003AB+0.040AC–0.062BC–0.66A2–0.68B2–0.73C2。在该二次多元回归方程中,各项系数的绝对值大小反映了其所对应因子对乳酸菌活菌数的影响程度[18],对该回归方程进行分析可知,3个因子对乳酸菌活菌数的影响程度为:糖蜜添加量>培养温度>初始pH。
由表3可知,回归模型的P值<0.000 1,说明模型高度显著;决定系数R2为0.997 7,校正系数Radj2为0.994 7,决定系数R2高于0.90,说明回归模型的拟合程度高,实验误差较小。失拟项P>0.05为不显著,进一步说明回归模型与实际情况拟合程度较高[19],可用该模型来分析和预测大豆黄浆水发酵的工艺参数。
从表 3回归方程系数显著性检验可知,一次项糖蜜添加量(A),二次项糖蜜添加量(A2)、初始pH值(B2)、培养温度(C2)对乳酸菌活菌数影响极显著(P<0.01),一次项培养温度(C)、初始pH和培养温度的交互项(BC)对乳酸菌活菌数影响显著(P<0.05),其他项影响不显著。
表3 方差分析结果
Table 3 ANOVA results
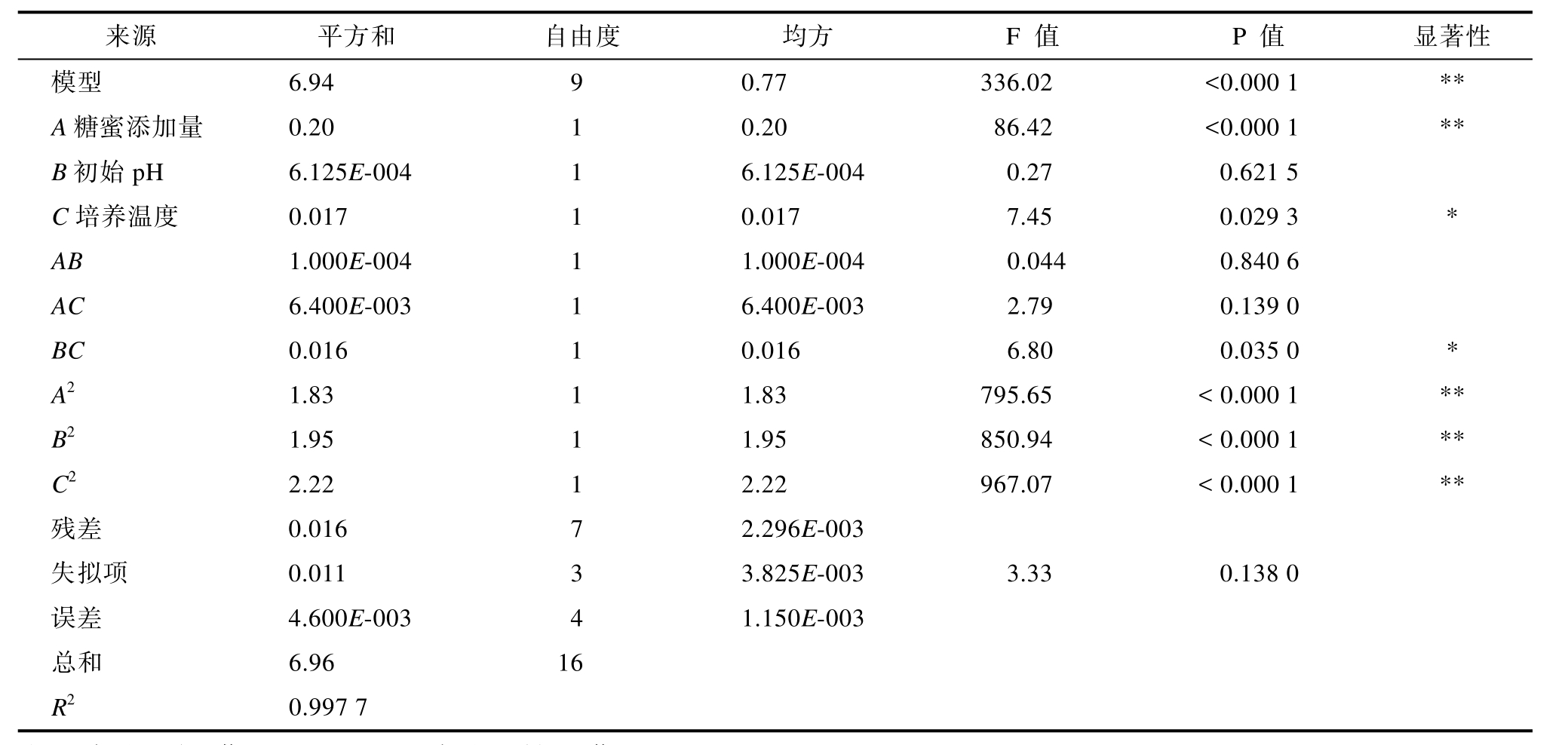
注:*表示差异显著,即P<0.05;**表示差异极显著,即P<0.01。
来源 平方和 自由度 均方 F 值 P 值 显著性模型 6.94 9 0.77 336.02 <0.000 1 **A糖蜜添加量 0.20 1 0.20 86.42 <0.000 1 **B初始pH 6.125E-004 1 6.125E-004 0.27 0.621 5 C培养温度 0.017 1 0.017 7.45 0.029 3 *AB 1.000E-004 1 1.000E-004 0.044 0.840 6 AC 6.400E-003 1 6.400E-003 2.79 0.139 0 BC 0.016 1 0.016 6.80 0.035 0 *A2 1.83 1 1.83 795.65 < 0.000 1 **B2 1.95 1 1.95 850.94 < 0.000 1 **C2 2.22 1 2.22 967.07 < 0.000 1 **残差 0.016 7 2.296E-003失拟项 0.011 3 3.825E-003 3.33 0.138 0误差 4.600E-003 4 1.150E-003总和 6.96 16 R2 0.997 7
2.2.3 响应面交互作用分析
图 8~10是依据回归方程所绘制出各因素交互作用的响应面图及等高线图,等高线图的形状即反映交互作用的强弱,圆形表示两因素交互作用不显著,而椭圆形表示两因素交互作用显著[20-21]。由8至10响应面图可以看出,乳酸菌活菌数随着糖蜜添加量、初始pH、培养温度的变化出现先升高后降低的趋势。由图8和图9等高线图可知,等高线图趋近于圆形,表示糖蜜添加量和初始pH、培养温度对乳酸菌活菌数的交互作用不显著。而图 10等高线图呈椭圆形,表示初始pH与培养温度对乳酸菌活菌数的交互作用显著。

图8 糖蜜添加量(A)与初始pH(B)对乳酸菌活菌数的曲面图和等高线图
Fig.8 Curved surface and contour plots of molasses addition (A) and initial pH (B) on the number of viable lactic acid bacteria

图9 糖蜜添加量(A)培养温度(C)对乳酸菌活菌数的曲面图和等高线图
Fig.9 Curved surface and contour plot of molasses addition amount (A) culture temperature(C) on the number of viable lactic acid bacteria

图10 初始pH(B)与培养温度(C)对乳酸菌活菌数的曲面图和等高线图
Fig.10 Curved surface plot and contour plot of initial pH (B) and culture temperature(C) on the number of viable lactic acid bacteria
经统计分析优化得到最佳培养条件为:糖蜜添加量5.12%,初始pH6.80,培养温度30.97 ℃,此时发酵液中乳酸菌的活菌数的理论值达到3.19×109 CFU/mL。
2.2.4 最佳培养条件验证
按照实验得出的培养条件校正为:糖蜜添加量5%,初始pH 6.80,培养温度31 ℃进行3次重复实验得到实际的发酵液中乳酸菌的活菌数为(3.18±0.05)× 109 CFU/mL,与预测值接近,酵母菌菌数为(4.1±0.10)× 108 CFU/mL。由此可见响应面分析法优化的大豆黄浆水发酵工艺条件可行,参数较为可靠,具有一定的实用价值。
3 结论
本研究在单因素实验的基础上,利用响应面法优化乳酸菌和酵母菌混合发酵大豆黄浆水的工艺参数,结果表明最佳的工艺参数为:接种量6%、接种比例1∶1∶1、培养转速120 r/min、培养时间48 h、糖蜜添加量5%、初始pH 6.80,培养温度31 ℃,在此条件下大豆黄浆水发酵液中乳酸菌活菌数为 3.18×109 CFU/mL,酵母菌菌数为 4.1×108 CFU/mL,乳酸菌和酵母菌的活菌数相比优化前显著提高,降低了微生态制剂的制作成本,为进一步利用大豆黄浆水提供技术参考。
[1]唐思颉,涂传海,胡文秀,等.红茶菌发酵黄浆水的体外抗氧化活性[J].食品科学,2019,40(17):1-6.TANG S J,TU C H,HU W X,et al.In vitro antioxidant activity of kombucha fermented yellow syrup[J].Food Science,2019,40(17):1-6.
[2]CHENG J J,XIE S Y,WANG S,et al.Optimization of protein removal from soybean whey wastewater using chitosan ultrafiltration[J].Journal of food process engineering,2017,40(2):12370.1-12370.1.
[3]严玲.豆腐黄浆水制备大豆低聚糖的工艺研究[D].湖北工业大学,2015.YAN L.Study on the process of preparing soybean oligosaccharides from tofu yellow water[D].Hubei University of Technology,2015.
[4]李云捷,周哲,刘志,等.大豆黄浆水综合利用研究进展[J].科技与创新,2016(5):9-10.LI Y J,ZHOU Z,LIU Z,et al.Research progress on comprehensive utilization of soybean yellow jelly[J].Science Technology and Innovation,2016(5):9-10.
[5]吕博.发酵黄浆水有机酸凝固剂的制备及应用研究[D].哈尔滨商业大学,2014.LU B.Preparation and application of organic acid coagulant for fermented yellow pulp water[D].Harbin University of Commerce,2014.
[6]郑玉玺.大豆黄浆水回收利用研究进展[J].广州城市职业学院学报,2015,9(2):58-61.ZHENG Y X.Research progress of soybean yellow pulp water recycling[J].Journal of Guangzhou City Vocational College,2015,9(2):58-61.
[7]黄莉,费楠,孙常秀,等.豆腐黄浆水制备细菌纤维素条件初探[J].食品工业科技,2014,35(24):164-166+171.HUANG L,FEI N,SUN C X,et al.Preliminary study on the preparation of bacterial cellulose from tofu Yellow Jelly[J].Food Industry Science and Technology,2014,35(24):164-166+171.
[8]刘平,李晓峰,谭新敏.利用大豆黄浆水发酵生产维生素 B12的工艺探索[J].陕西科技大学学报,2003(4):83-85.LIU P,LI X F,TAN X M.Exploration on the process of producing vitamin B12 by fermenting soybean yellow syrup[J].Journal of Shaanxi University of Science and Technology,2003(4):83-85.
[9]伊静,李婷,袁冬,等.地瓜黄浆水与山楂复合发酵饮料的研制[J].食品工业科技,2019,40(21):130-135.YI J,LI T,YUAN D,et al.Development of a compound fermented beverage of sweet potato yellow jelly and hawthorn[J].Science and Technology of Food Industry,2019,40(21):130-135.
[10]任雅丽.开菲尔乳酸菌的高密度培养及其微生态制剂的研究[D].北京:中国农业大学,2007.REN Y L.High-density cultivation of Kefir lactic acid bacteria and research on its microecological preparation[D].Beijing:China Agricultural University,2007.
[11]杨云东,王倩,张佳婵,等.糖蜜及其发酵制品的应用研究进展[J].食品工业,2020,41(3):232-236.YANG Y D,WANG Q,ZHANG J Q,et al.Application research progress of molasses and its fermented products[J].Food Industry,2020,41(3):232-236.
[12]贾朋辉.发酵饲料用乳酸菌培养条件及保藏工艺的研究[D].江苏:江南大学,2009.JIA P H.Study on the culture conditions and preservation technology of lactic acid bacteria for fermented feed[D].Jiangsu:Jiangnan University,2009.
[13]王小标,武运,王璐.酸马乳发酵过程中乳酸菌与酵母菌生长的相互影响[J].食品科学,2015,36(11):125-129.WANG X B,WU X,WANG L.The interaction between the growth of lactic acid bacteria and yeast during the fermentation of kefir[J].Food Science,2015,36(11):125-129.
[14]李晏蝶,李珊,高云云,等.副干酪乳杆菌和马克斯克鲁维酵母混合发酵条件优化[J].中国乳品工业,2020,48(10):8-12.LI Y D,LI S,GAO Y Y,et al.Optimization of mixed fermentation conditions of Lactobacillus paracasei and Kluyveromyces marxianus[J].China Dairy Industry,2020,48(10):8-12.
[15]侯旭彤.乳酸菌发酵马铃薯及其高密度的研究[D].天津:天津科技大学,2018.HOU X T.Study on lactic acid bacteria fermented potato and its high density[D].Tianjin:Tianjin University of Science and Technology,2018.
[16]贺月林,郭照辉,谭周进,等.酵母菌与乳酸菌混合培养中试研究[J].现代农业科技,2010,(2):29-31.HE Y L,GUO Z H,TANG J Z,et al.Pilot study on mixed culture of yeast and lactic acid bacteria[J].Modern Agricultural Science and Technology,2010,(2):29-31.
[17]李先胜,姜铁民,陈历俊.发酵乳中酵母菌和乳酸菌生长的相互影响[J].食品工业科技,2012,33(17):139-141.LI X S,JIANG T M,CHEN L J.The interaction between the growth of yeast and lactic acid bacteria in fermented milk[J].Science and Technology of Food Industry,2012,33(17):139-141.
[18]王珊珊,孙晓琦,马玉洁,等.响应面法优化黄浆水发酵液制备工艺及其抗氧化活性研究[J].食品研究与开发,2020,41(4):45-51.WANG S S,SUN X Q,MA Y J,et al.Response surface methodology to optimize the preparation process of yellow syrup fermentation broth and its antioxidant activity[J].Food Research and Development,2020,41(4):45-51.
[19]蒲立柠,陈光静,阚建全.响应面实验优化青稞麸皮薏仁红曲霉发酵工艺[J].食品科学,2017,38(2):264-270.PU L N,CHEN G J,KAN J Q.Optimization of the fermentation process of highland barley bran and barley monascus by response surface experiment[J].Food Science,2017,38(2):264-270.
[20]宋思圆,苏平,王丽娟,等.响应面实验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J].食品科学,2017,38(2):283-289.SONG S Y,SU P,WANG L J,et al.Optimization of ultrasonic extraction technology of okra flower pectin polysaccharide and its in vitro antioxidant activity[J].Food Science,2017,38(2):283-289.
[21]崔玮,张勇,高海宁,等.响应面实验优化果胶酶辅助提取锁阳原花青素工艺[J].食品科学,2016,37(14):18-23.CUI W,ZHANG Y,GAO H N,et al.Optimization of pectinaseassisted extraction of proanthocyanidins from Cynomorium by response surface experiment[J].Food Science,2016,37(14):18-23.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。