玉米赤霉烯酮(Zearalenone,ZEN)是世界上分布最广泛的一种镰刀霉菌素,在亚洲、欧洲和美洲等地的谷物及农副产品中均有发生[1]。ZEN主要发生在富含淀粉的谷物类种子上,通过饲料、食品加工原料形式进入食物链,在人或动物体内造成蓄积[2]。它在机体内产生雌激素效应综合症状,引起动物体雌激素过多,具有致癌性,对动物体肾脏、肝脏均能产生毒害作用[3]。ZEN化学名为 6-(10-羟基-6-氧基-反式-1-十一碳烯基)-β-二羟基苯酸内酯(结构式见图1),分子式为C18H22O5,分子量为318.369 0,是一种取代的2,4-二羟基苯甲酸内酯,具有雌激素活性,在碱性条件下可以将内酯打开,碱性下降可以将键恢复[4]。ZEN的纯品为白色晶体,不溶于水、四氯化碳和二硫化碳,溶于碱性水溶液和甲醇、乙醇、乙腈、二氯甲烷、乙酸乙酯等有机溶剂[5]。ZEN性质比较稳定,在110 °C下加热处理1 h后才会被完全破坏,其酮环结构在碱性条件下会发生水解反应[5-6]。

图1 玉米赤霉烯酮结构式
Fig.1 Structure of Zearalenone
近年来,通过物理[7-8]、化学[9-14]、生物[15-17]的方法进行ZEN脱毒处理已经成为研究热点,吸引了科学家们广泛的兴趣。但由于 ZEN价格昂贵,又有很强的毒性,为了降低实验风险和成本,人们提出合成一种与ZEN结构、性质、功能相似且毒性较小的化合物来替代ZEN进行研究。这种化合物由 2,4-二羟基苯甲酸和环十二醇通过内酯化反应合成,命名为 2,4-二羟基苯甲酸环十二烷酯(CDHB)[18],分子式为 C19H28O4,分子量320.429 0从其结构(见图2)可看出有两个酚羟基,且酚羟基的位置与ZEN的相同,表现出疏水性,可通过化学反应大量制备,制备成本低。但目前相关研究较少,已有报道中提到的方法存在成本高,不易操作,产率较低,纯度不高等缺陷,尤其是纯化过程受环境、试剂等非人为因素影响较大,较难控制。
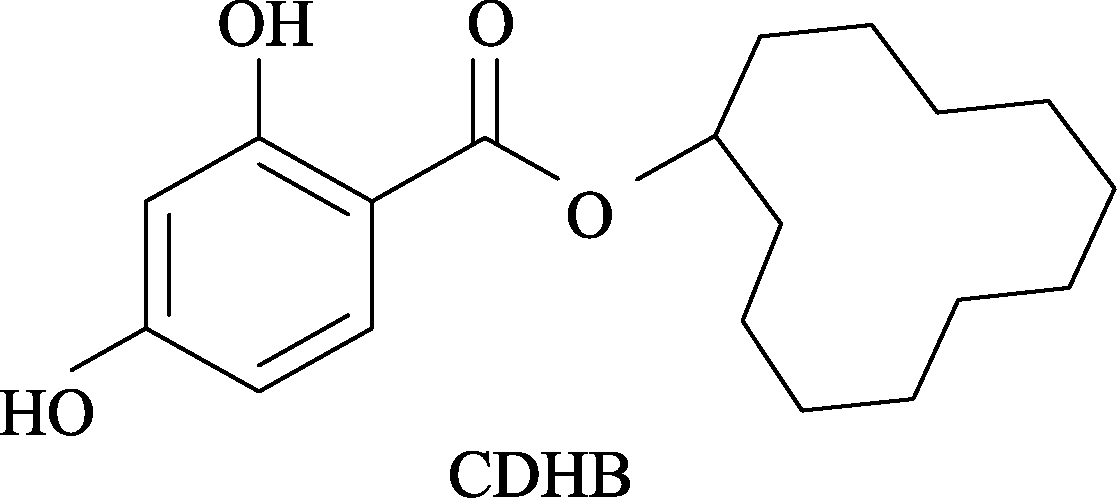
图2 CDHB结构式
Fig.2 Structure of CDHB
2,4-二羟基苯甲酸和环十二醇的酯化反应需要在酸或碱条件下并加热才能进行,且易发生逆反应,因此需要引入一种活化剂来促进反应。多篇研究[19-22]发现,N,N′-羰基二咪唑(CDI)极易与有羧酸官能团的化合物反应,生成具有一定反应活性的酰胺类中间体和咪唑、CO2副产物,其中CO2还可进一步促进反应。Baidya等[23]研究发现,1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)在反应中即可作为催化剂和碱质子化,又同时作为亲核试剂参与反应,而且碱性强于其他有机碱。Larrivee-Aboussafy等[24]也提出DBU可以有效催化CDI的酰胺化中间产物与有氨基官能团的有机物发生的亲核取代反应。Bi[25]对反应溶剂进行筛选,发现同一反应中,只有催化剂为 DBU,溶剂为 N,N-二甲基甲酰胺(DMF)时,反应时间最短且产率最高。因此,在CDHB的合成反应中,选择DMF为反应溶剂,先将CDI与2,4-二羟基苯甲酸反应生成具有活性的中间产物,考虑到环十二醇有羟基基团,也可作为亲核试剂,尝试引入 DBU作为催化剂促进中间产物和环十二醇的亲核取代反应。反应过程如图 3所示,此反应条件温和,极易发生,且反应不可逆,产物得率也将得到提高。

图3 CDHB合成反应示意图
Fig.3 Schematic representation of CDHB synthesis
由于CDHB有疏水性且极性小,纯化过程一般采用柱层析法,洗脱剂选用乙酸乙酯石油醚或者乙酸乙酯正己烷体系,收集过程用薄层色谱法(TLC)实时监控[26-27]。但这种监控比较粗放,一些与 CDHB极性特别相近的副产物容易被忽略,因此本文用HPLC法辅助监控,有效提高了CDHB的纯度,之后又利用制备液相色谱和高速逆流色谱(HSCCC)分别制备CDHB,并比较了3种方法的优劣。得到干燥产物后,分别用高效液相色谱(HPLC)、高效液相色谱-四级杆飞行时间串联质谱(HPLC-QTOF)、紫外-可见光谱(UV-vis)、傅里叶变换红外光谱(FTIR)和核磁共振谱仪(NMR)对产物进行定性定量分析。
目前关于CDHB应用的研究中,多将其用于制备 ZEN的分子印迹材料(MIP)。分子印迹聚合物是模板分子与功能单体通过分子间作用力结合,然后在交联剂作用下聚合,利用溶剂将模板分子洗脱后形成具有特定空穴的聚合物[18]。该聚合物可特异性对模板分子进行吸附,对于ZEN的分子印迹聚合物,为避免模板泄漏和节约成本,通常用CDHB充当ZEN的模板分子。Urraca,J.L.等[27-31]多篇报道提到用CDHB制备分子印迹聚合物,Fang等[26]用 CDHB制备分子印迹光量子材料,并在实验中用CDHB替代ZEN进行吸附实验。本文在这些应用的基础上,在分子印迹过程中引入石墨烯,得到石墨烯表面分子印迹聚合物(RGO-MIP),与MIP相比提高了对ZEN的吸附性能,为之后的应用研究提供了方法和思路。
1 材料和方法
1.1 实验材料
N,N′-羰基二咪唑(CDI,≥90%)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU,≥99%)、1-烯丙基哌嗪(1-ALPP,96%):sigma;三羟甲基丙烷三丙烯酸酯(TRIM,试剂级,75%)、2,4-二羟基苯甲酸(>98%)和环十二醇(>98%):TCI;N-乙烯基咔唑(98%)和偶氮二异丁腈(AIBN,99%):百灵威。
1.2 仪器制备
Thermo Nanodrop 2000c紫外-可见分光光度计:美国热电公司;600 M核磁共振谱仪(氘代乙腈为溶剂,TMS为内标):日本电子株式会社;Bruker VERTEX 70傅里叶变换红外光谱仪(KBr压片):德国布鲁克公司;Agilent高效液相色谱-四级杆飞行时间串联质谱(1290-6510 Q-TOF,ESI源)、Agilent 1260高效液相色谱仪:安捷伦科技有限公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;BUCHI R-215旋转蒸发仪:瑞士步琪公司;DZF-6050真空干燥箱:上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 CDHB的制备
称取一定量的CDI和2,4-二羟基苯甲酸置于圆底烧瓶中,加入无水DMF将其溶解后,在40 °C水浴锅中磁力搅拌1 h。之后将环十二醇和DBU加入到上述溶液中,继续搅拌22 h,上述原料物质的量比为1∶1∶1∶1。反应完成后加入相同体积的水和二氯甲烷与溶液充分混合,静置分层后取下层有机相,再依次用盐酸、水和饱和碳酸氢钠溶液分别重复多次洗涤有机相,在得到的油相产物中加入无水硫酸钠干燥过夜。离心后旋蒸除去二氯甲烷等溶剂,得到淡黄色固体状态的粗产物。
1.3.2 CDHB的纯化
1.3.2.1 硅胶柱层析法 展开剂为石油醚∶乙酸乙酯=16~32∶1(v/v),洗脱剂为石油醚∶乙酸乙酯=16~32∶1(v/v)
1.3.2.2 HSCCC分离纯化 选用V(正己烷)∶V(乙酸乙酯)∶V(甲醇)∶V(水)=1∶0.2~0.8∶1∶0.2~0.8为溶剂体系,上相为HSCCC流动相,下相为固定相,流动相速度为2 mL/min,转速为800 r/min,检测波长254 nm。以20 mL/min的流速向分离管中注入上相,以2 mL/min的流速注入下相,根据色谱图上的目标峰接收目标物。
1.3.2.3 制备液相纯化 Agela Technologies反相色谱柱(21.2 mm×250 mm,5 μm),流动相A为水,流动相B为乙腈,梯度洗脱(0~30 min,60%~90%B; 30~40 min,90%~100%B)流速 20 mL/min,检测波长254 nm。纯化后收集含目标物溶液,旋蒸除去溶剂得到白色固体,真空干燥后得到产物。
1.3.3 石墨烯表面分子印迹聚合物的制备
先将20.0 mg RGO超声分散到20 mL DMF中,混合均匀后再加入CDHB、1-ALPP和10 mL乙腈,将此混合溶液保持15 min后,加入TRIM和 AIBN,混合均匀后向体系中通氮,将密封的反应容器置于紫外光(λ=254 nm)下照射,得到灰黑色硬状分子印迹聚合物,其中反应物物质的量比为CDHB∶1-ALPP∶TRIM=1∶4∶20。将聚合物在研钵中研磨均匀后,以 V(甲醇)∶V(乙酸)=96∶4的混合溶液为洗脱液,多次回流除去CDHB后,再用 V(甲醇)∶V(水)=80∶20多次洗涤,最后在烘箱中 40 ℃干燥过夜,得到RGO-MIP。作为对照,同样的方法制备不加CDHB的非印迹聚合物(NIP)和不加RGO溶液的MIP作为对照组。
1.3.4 性能测试
准确称取10 mg RGO-MIP、MIP和NIP,加入100 mL 10 mg/LZEN溶液,超声0.5 h使吸附剂分散均匀,再磁力搅拌5 h,每间隔1 h取样,过0.22 μm尼龙膜,用HPLC检测吸附结果。聚合物对 ZEN的吸附能力用 qe表示。qe根据以下公式计算:
qe=(C0–Ct)V/m
其中C0和Ct分别代表ZEN的起始浓度和某一时刻吸附平衡的浓度(mg/L),V代表溶液体积(L),m代表吸附剂的质量(g)[32]。
1.4 数据分析
利用OriginPro 8.0软件处理和分析实验数据。
2 结果与分析
2.1 CDHB的制备研究
2.1.1 柱层析条件优化
选择石油醚/乙酸乙酯作为展开剂,考察不同比例展开剂对目标物纯化的影响,并结合 HPLC手段来验证。结果显示,当展开剂为石油醚∶乙酸乙酯=16∶1(v/v)时,可有效分离纯化CDHB。HPLC检测CDHB粗产物-甲醇溶液得到的色谱图与薄层层析结果一致:色谱图上最后一个峰的峰面积最大,硅胶板中最上面的点显色后颜色最深,且目标物极性小,所以初步判断色谱图中最后一个峰和硅胶板上最上面的点即为 CDHB。再通过HPLC收集最后一个峰,浓缩后用 HPLC-QTOF检测,负离子模式下m/z=319.196 7,CDHB分子量为320.429 0,进一步确认了硅胶板最前端的点和色谱图上最后一个峰即为目标物。因此,过柱纯化CDHB时收集最先被洗脱出来的条带。
收集目标产物洗脱液时,为了保证产物的纯度,每收集5 mL左右点板监测,每收集100 mL用HPLC-FLD监测,监测过程如图4所示,每次可得到 360 mL左右含有纯目标物的洗脱液,这些洗脱液合并旋蒸溶剂并干燥后得到的产物有1.2 g左右,计算得产率>70%。

图4 CDHB纯化过程液相色谱图
Fig.4 HPLC chromatograms of CDHB purification process
2.1.2 HSCCC条件优化
高速逆流色谱的溶剂体系是根据目标化合物在两相溶液中的分配系数(KD)选择的,合适的KD范围是0.5~2.0。实验测定了目标化合物在不同比例的正己烷/乙酸乙酯/甲醇/水体系中的 KD值。结果表明,目标物可以在正己烷∶乙酸乙酯∶甲醇∶水(1∶0.2∶1∶0.2,v/v/v/v)体系中达到与杂质的有效分离。
2.1.3 纯化方法的对比研究
比较柱层析法、HSCCC和制备液相法:制备液相法得到的产品纯度高(≥98%),但样品上载量比较小,费溶剂,且CDHB粗产物粘性比较大,容易滞留在柱子上影响目标物的收集;因为目标物极性较小,也可用硅胶柱层析,柱层析法溶剂用量少,操作方便,但分离效果受环境温度和湿度影响较大,纯化过程中需要控制好温度和湿度;高速逆流色谱法分离效果稳定,得到的产品纯度可达到90%左右,与柱层析法均能实现目标物较大产量的制备。总之,3种方式均可用于 CDHB的分离纯化过程,在实际生产中,可根据目标物纯度、成本等需求选用合适的制备方式。
2.2 CDHB表征
2.2.1 高效液相色谱
参照文献[27]中的检测条件,用HPLC-FLD检测了纯化前后的产物和ZEN,从色谱图(图5(a))中看出产物呈单一狭窄对称峰,说明该产物纯度高,再与同样条件下ZEN色谱图(图5(b))对照,发现二者的保留时间几乎一致,说明 CDHB与ZEN的极性相似,可作为ZEN的替代物被研究。

图5 CDHB色谱图(a)和ZEN色谱图(b)对比
Fig.5 Comparison of chromatograms between CDHB (a) and ZEN (b)
以甲醇作为有机相,水为水相优化流动相比例,分别设置有机相比例为50%、52%、60%、65%,根据保留时间与分离效果选择65%的有机相,在有机相中加入15%的乙腈和15 mmol/L的乙酸铵出峰会更好。当选用紫外检测器时,色谱图上会出很多杂质峰,影响判断,因此最终选用荧光检测器。
2.2.2 质谱
文献报道[18]中CDHB的结构含有酚羟基,在电喷雾电离下容易失去一个质子而带有负电荷,因此在负电离模式下对CDHB进行表征。质谱图如图 6所示,m/z=319.196 7 ([M-H]–1),CDHB 分子量的理论值为320.429 0,在失去一个质子后,分子量减去一个氢离子的质量,其质量数与质谱图中的荷质比一致,由此可初步判断合成了CDHB。
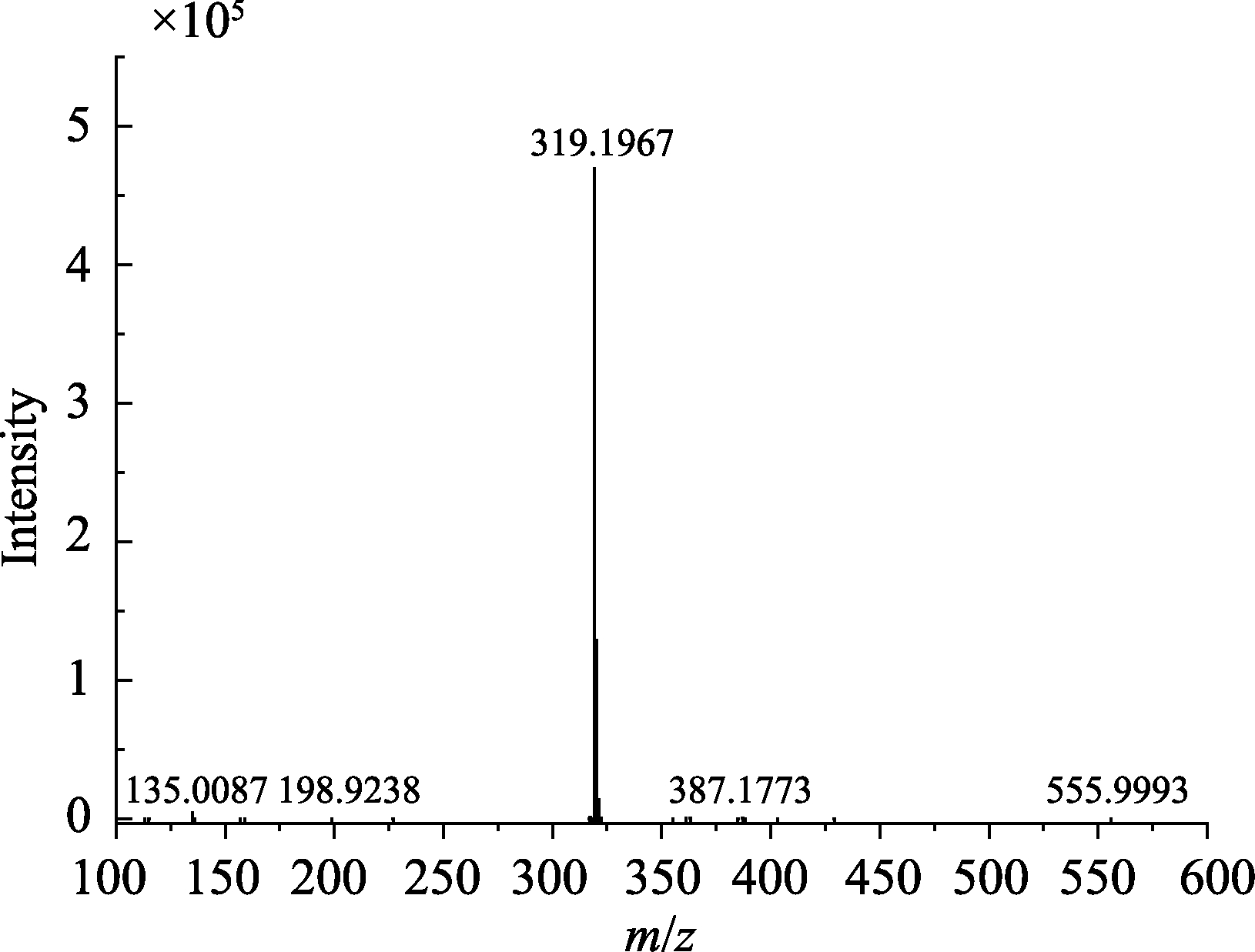
图6 CDHB质谱图
Fig.6 Mass spectra of CDHB
2.2.3 紫外可见光谱
由CDHB的紫外可见光谱图(图7)可知,其在258 nm波长处的吸收强度较大,在295 nm波长处的吸收强度中等,可判断至少有3~5个共轭生色团和助色团,由于CDHB结构中有苯环,是大共轭体系,可产生π→π*跃迁,苯环上有羟基,含有n电子,与苯环相连时能使吸收波长向长波方向移动,吸收强度增强,此外苯环上连有C=O,含有不饱和键,也能吸收紫外-可见光产生 π→π*跃迁,并且C=O与苯环共轭,使吸收强度增加,且向长波方向移动。
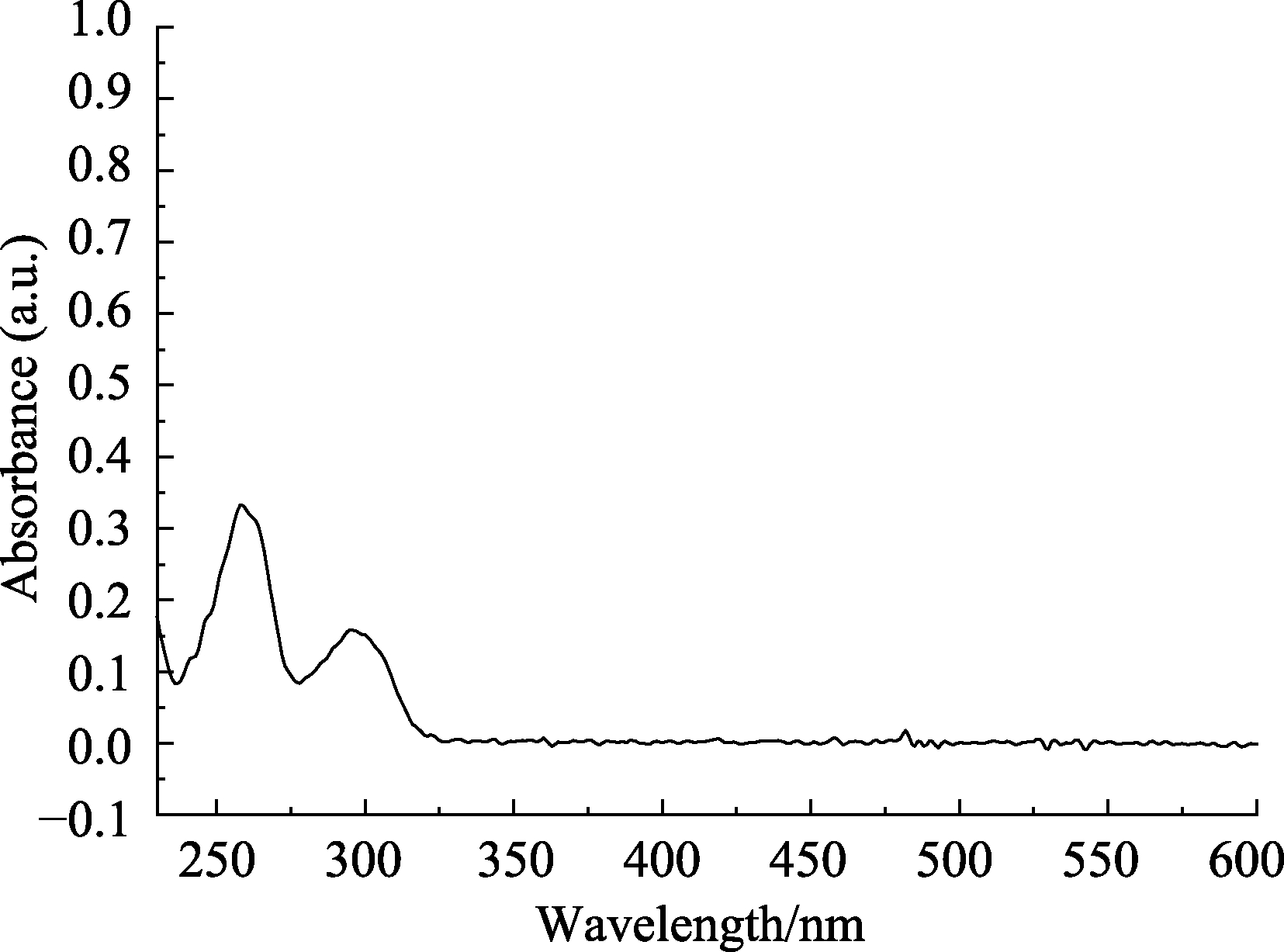
图7 CDHB的紫外-可见光谱图
Fig.7 UV-vis spectra of CDHB
2.2.4 红外光谱
CDHB分子式为 C19H28O4,不饱和度为 6。由CDHB的红外光谱图(图8)可知,2 945 cm–1处的峰可归属为烷基上C-H的伸缩振动吸收峰,1 643 cm–1、1 518 cm–1、1 469 cm–1处的峰可归属为苯环上C==C的骨架振动吸收峰,850 cm–1、775 cm–1处的峰可归属为苯环上 C-H的面外弯曲振动吸收峰,且取代基位置为苯环上的1,2,4位。1 359 cm–1处的峰可归属为苯环上 O-H的面内弯曲振动吸收峰,在1 253 cm–1处的峰可归属为C—O—C的不对称伸缩振动吸收峰,初步确定产物结构中的官能团有苯环、酚羟基、C—O—C,结合不饱和度估计产物结构还可能存在饱和环结构和酯基。

图8 CDHB傅里叶红外光谱图
Fig.8 FTIR spectra of CDHB
2.2.5 核磁
CDHB核磁共振氢谱的峰值模式:d(doublet,双峰),dd(double of doublets,双重双峰),m(multiplet,多重峰),bs(broad singlet,宽峰)。
根据CDHB的核磁共振氢谱图(图9 (a))和文献[26-27, 33]解析可知:在6.29(1H,d,J=2.4 Hz)、6.35(1H,dd,J=2.4 Hz; 8.8 Hz)、7.65(1H,d,J=8.8 Hz)处的3个峰分别为苯环上的3个取代H的化学位移,在 1.32(18H,bs)、1.59(2H,bs)、1.78(2H,bs)、5.18(1H,m)处的4个峰分别为十二元环上CH2-和CH的化学位移。参考文献[34]可知,1.92处为氘代乙腈的溶剂峰。与文献相比,苯环上 1和3位置上 OH-的活泼氢信号缺失,可能是溶剂、水等因素的影响[35]。
由CDHB的核磁共振碳谱图(图9 (b))和文献解析可得[26-27, 33]:在 20.64、20.96、22.98、23.18、23.23、23.32、23.68、23.92、24.10、28.85、32.14、73.09处的峰为十二元环上12个C的化学位移,在 102.47、105.22、107.98、131.69、163.60、163.82处的峰为苯环上6个C的化学位移,在169.74处的峰为与苯环相连的—C==O—的化学位移。综上所述,可推测化合物的结构与CDHB结构相同。

图9 CDHB的核磁共振谱图
Fig.9 NMR spectrum of CDHB
注:(a)为氢谱,(b)为碳谱。
Note:(a) is 1H NMR spectrum,(b) is 13C NMR spectrum.
2.3 RGO-MIP吸附性能
ZEN的吸附动力学实验结果显示,吸附 5 h后,RGO-MIP、MIP和NIP对ZEN的吸附率分别为72.36%、67.15%和59.90%。图10为不同吸附时间下,3种聚合物对ZEN吸附性能的比较。
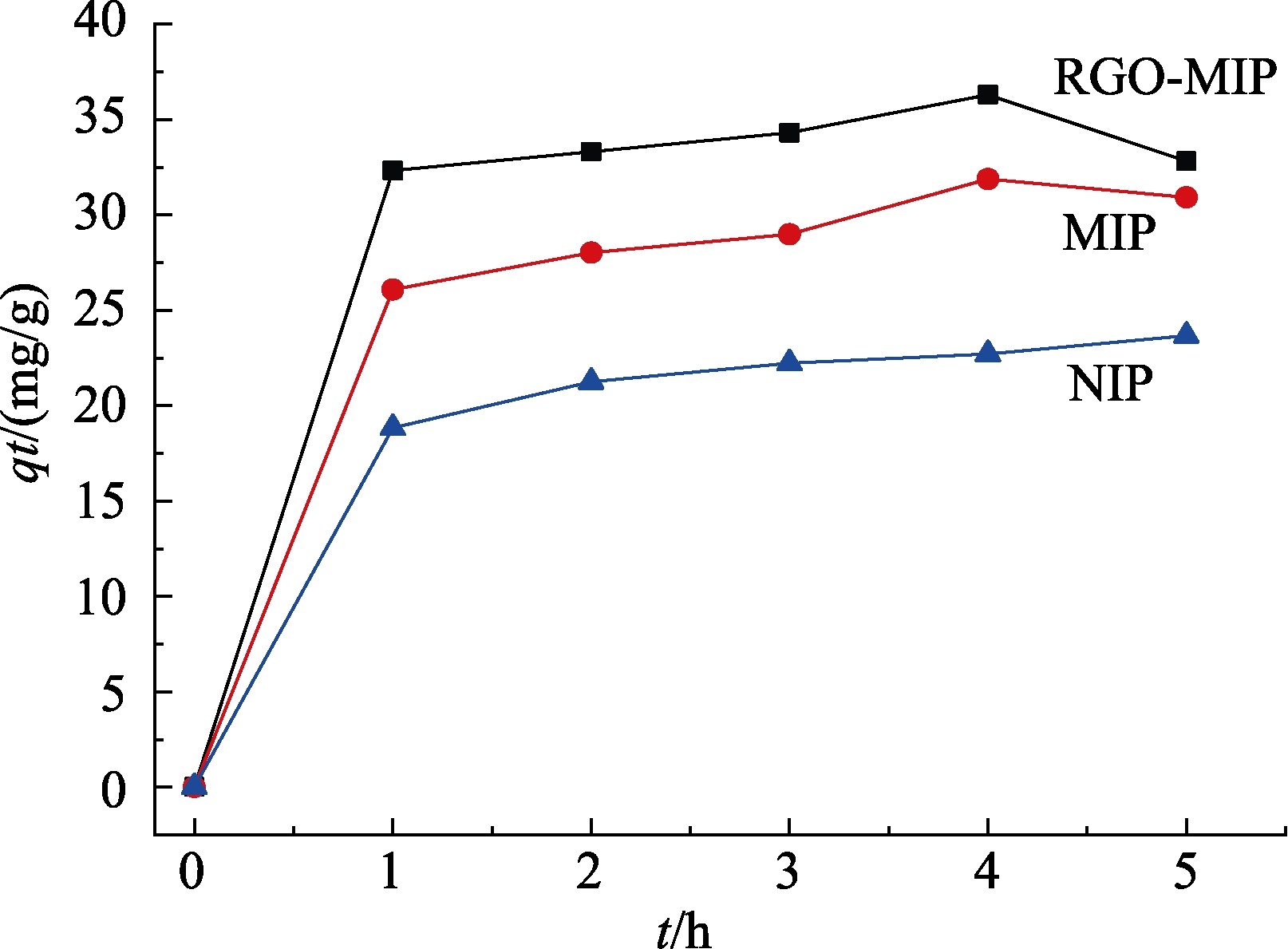
图10 3种聚合物对ZEN吸附性能的比较
Fig.10 Comparison of adsorption of ZEN by three polymers
从结果看,RGO-MIP和 MIP的吸附性能均优于 NIP,根据分子印迹聚合物的形成原理,可推断加入CDHB后,CDHB与功能单体在氢键作用下结合,再在交联剂和引发剂的作用下,借助紫外光形成聚合物,当CDHB在溶液中被洗脱出聚合物时,聚合物表面就形成与ZEN结构相似的空穴位点,使 ZEN能有效与聚合物表面空穴结合;而 RGO-MIP的吸附性能优于 MIP,说明引入的石墨烯发挥了作用,根据石墨烯自身的网状结构[36],当CDHB和石墨烯溶液混合时,CDHB被引入到石墨烯基底上,同时氢键作用与功能单体结合,进一步在石墨烯表面形成聚合物,这种结构使聚合物更多地铺展在载体表面,洗脱模板后,更多的空穴位点也暴露出来,使得同等条件下,RGO-MIP能吸附更多的ZEN分子。而且根据Bai等[37]的研究,石墨烯本身对ZEN也有一定的吸附作用,因此RGO-MIP对ZEN的吸附效果大大提高。如图11所示,RGO-MIP的吸附符合伪二级动力学模型。
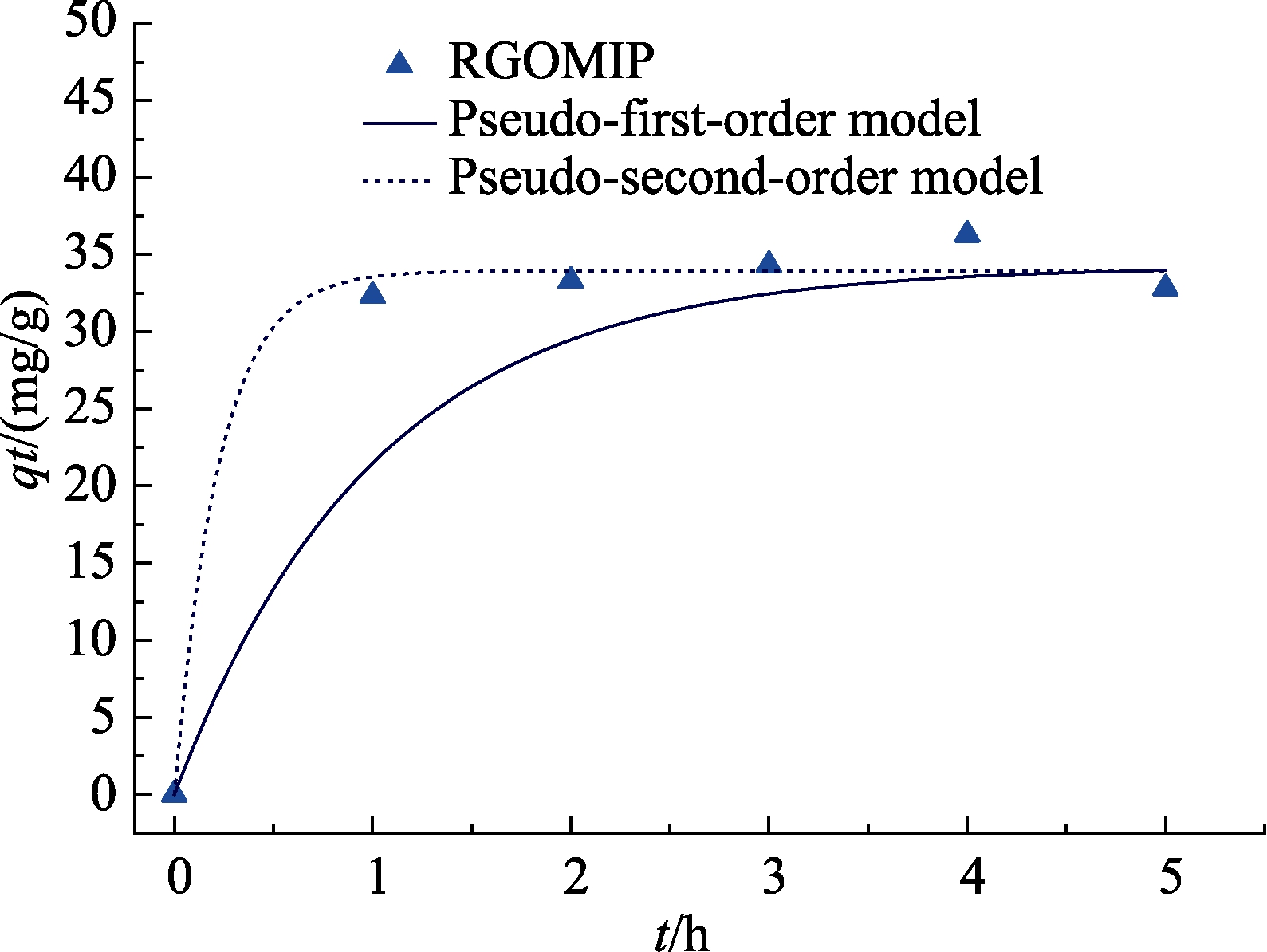
图11 RGO-MIP的吸附动力学模型
Fig.11 Dynamic adsorption model of RGO-MIP
对于CDHB来说,作为与ZEN结构性质相似的化合物,充当ZEN模板分子的作用已被充分验证,利用其制备的各种分子印迹聚合物,通过不同手段的调控提高分子印迹聚合物的吸附率和选择性将会被越来越多的人所研究,再结合固相萃取、电化学检测等手段,制备固相萃取柱和电化学传感器可将其应用到谷物及其农副产品的毒素检测和脱毒上。
3 结论
本文将有机合成和多种纯化手段联用制备出一种与ZEN结构、大小、极性、性能相近的化合物CDHB,对CDHB的制备条件进行了优化,通过各种表征手段确定了该物质的结构。这种方法过程简单、安全、稳定、可重复,一定程度上提高了产物的产率和纯度。
应用方面,以MIP为例,CDHB作为模板分子可避免模板泄漏问题。本文将CDHB引入到石墨烯载体上,制备的石墨烯表面分子印迹聚合物,不仅在特异选择性上优于活性炭、硅铝酸盐、蒙脱石、膨润土等这类吸附剂,而且对比 MIP,吸附性能也得到明显的提高,是MIP的1.2倍,从侧面验证了CDHB的纯度。除此之外,CDHB以其高产、低毒、易制备等优势还可用作ZEN的替代物,降低ZEN的研究成本。该化合物的制备也为其他ZEN类似物的合成提供了研究基础。
[1]ZINEDINE A,SORIANO J M,MOLTÓ J C,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food & Chemical Toxicology,2007,45(1):1-18.
[2]PLASENCIA J,MIROCHA C J.Isolation and characterization of zearalenone sulfate produced by Fusarium spp[J].Applied & Environmental Microbiology,1991,57(1):146.
[3]MARIN M L,MURTHA J,PESTKA W D & J J.Effects of mycotoxins on cytokine production and proliferation in el-4 thymoma cells[J].Journal of Toxicology and Environmental Health,1996,48(4):379-396.
[4]路子显,伍松陵,孙长坡.玉米赤霉烯酮生物合成和降解的研究进展[J].中国生物工程杂志,2011,31(2):116-123.LU Z X,WU S L,SUN C P.Research advancement on biosynthesis and degradation of zearalenone[J].China Biotechnology,2011,31(2):116-123.
[5]姜淑贞,杨维仁,杨在宾.玉米赤霉烯酮的污染和残留及其作用机制[J].中国饲料,2011,2:41-44.JIANG S Z,YANG W R,YANG Z B.The contamination,residue and mechanism of zearalenone[J].China Feed,2011,2:41-44.
[6]邓友田,袁慧.玉米赤霉烯酮毒性机理研究进展[J].动物医学进展,2007,28(2):89-92.DENG Y T,YUAN H.The development of zearalenone toxicity mechanism[J].Progress T.in Veterinary Medicine,2007,28(2):89-92.
[7]NUMANOGLU E,YENER S,GOEKMEN V,et al.Modelling thermal degradation of zearalenone in maize bread during baking[J].Food Additives & Contaminants,2013,30(3):528-533.
[8]YENER S,KÖKSEL,H.Effects of washing and drying applications on deoxynivalenol and zearalenone levels in wheat[J].World Mycotoxin Journal,2013,6(3):335-341.
[9]KALAGATUR N K,KARTHICK K,ALLEN J A,et al.Application of activated carbon derived from seed shells of Jatropha curcas for decontamination of zearalenone mycotoxin[J].Frontiers in Pharmacology,2017,8(24):760.
[10]MARKOVIĆ M,DAKOVIĆ A,ROTTINGHAUS G E,et al.Ochratoxin A and zearalenone adsorption by the natural zeolite treated with benzalkonium chloride[J].Colloids and Surfaces A Physicochemical and Engineering Aspects,2017,529:7-17.
[11]方圣琼,翁洪平,李晓,等.羟基铁柱撑蒙脱石吸附玉米赤霉烯酮机理研究[J].功能材料,2016,47(8):143-148.FANG S Q,WENG H P,LI X,et al.Study on adsorption of zearalenone by hydroxy-Fe intercalated montmorillonite[J].Journal of Functional Materials,2016,47(8):143-148.
[12]骆翼,陈峰.季铵盐处理蒙脱石的结构及其对玉米赤霉烯酮的吸附[J].饲料工业,2014,114-117.LUO Y,CHEN F.The microstructure and zearalenone adsorption of montmorillonite modified by quaternary ammonium salts[J].Feed Industry,2014,114-117.
[13]WONGTANGTINTAN S,SILARATANA N,TENGJAROENKUL U,et al.In vitro adsorption study of zearalenone by Thai bentonite and mineral clays[J].Livestock Research for Rural Development,2015,27(9).
[14]PIMPUKDEE K,TENGJAROENKUL B,CHAVEERACH P,et al.The characterization of clays and cetylpyridinium-exchanged clays for their ability to adsorb zearalenone[J].Thai J.Vet.Med.,2004,34(4):23-31.
[15]TIAN Y,TAN Y,YAN Z,et al.Antagonistic and detoxification potentials of trichoderma isolates for control of Zearalenone(ZEN) producing fusarium graminearum[J].Frontiers in Microbiology,2017,8:2710.
[16]CHEN S W,HSU J T,CHOU Y A,et al.The application of digestive tract lactic acid bacteria with high esterase activity for zearalenone detoxification[J].Journal of the Science of Food and Agriculture,2018,98(10):3870-3879.
[17]KAKEYA H,TAKAHASHI-ANDO N,KIMURA M,et al.Biotransformation of the mycotoxin,zearalenone,to a non-estrogenic compound by a fungal strain of Clonostachys sp.[J].Bioscience Biotechnology & Biochemistry,2002,66(12):2723-2726.
[18]樊超.荧光分子印迹聚合物检测玉米赤霉烯酮的研究[D].天津,天津科技大学,2014.FAN C.A novel molecularly imprinted polymer on CdSe/ZnS quantum dots for highly selective optosensing of mycotoxin zearalenone in cereal samples[D].Tianjin University of Science and Technology,Tianjin,2014.
[19]PAUL R,ANDERSON G W.N,N'-Carbonyldiimidazole,a new peptide forming reagent1[J].Journal of the American Chemical Society,1960,82(17):4596-4600.
[20]许小聪,刘美华,卢彦兵,等.N,N'-羰基二咪唑作为活化剂在高分子合成中的研究进展[J].高分子通报,2007,2:74-80.XU X C,LIU M H,LU Y B,et al.Research progress of N,N'-carbonyl diimidazole as activator in polymer synthesis[J].Polymer Bulletin,2007,2:74-80.
[21]DUBÉ P,NATHEL N F F,VETELINO M,et al.Carbonyldiimidazole-mediated Lossen rearrangement[J].Organic Letters,2009,11(24):5622-5625.
[22]CHEN H Z,GUO Z K,JIA L L.Preparation and surface modification of highly dispersed nano-ZnO with stearic acid activated by N,N’-carbonyldiimidazole[J].Materials Letters,2012,82:167-170.
[23]BAIDYA M,MAYR H.Nucleophilicities and carbon basicities of DBU and DBN[J].Chemical Communications,2008,15(15):1792-1794.
[24]LARRIVEE-ABOUSSAFY C,JONES B P,PRICE K E,et al.DBU catalysis of N,N'-carbonyldiimidazole-mediated amidations[J].Organic Letters,2010,12(2):324-327.
[25]BI X,DONG D,LIU Q,et al.[5+1]Annulation:A Synthetic Strategy for Highly Substituted Phenols and Cyclohexenones[J].Journal of the American Chemical Society,2005,127(13):4578-4579.
[26]FANG G Z,FAN C,LIU H L,et al.A novel molecularly imprinted polymer on CdSe/ZnS quantum dots for highly selective optosensing of mycotoxin zearalenone in cereal samples[J].RSC Advances,2014,4:2764-2771.
[27]URRACA J L,MARAZUELA M D,MERINO E R,et al.Molecularly imprinted polymers with a streamlined mimic for zearalenone analysis[J].Journal of Chromatography A,2006,1116(1-2):127-134.
[28]URRACA J L,MARAZUELA M D,MORENO-BONDI M C.Molecularly imprinted polymers applied to the clean-up of zearalenone and α-zearalenol from cereal and swine feed sample extracts[J].Analytical & Bioanalytical Chemistry,2006,385(7):1155-1161.
[29]NAVARRO-VILLOSLADA F,URRACA J L,MORENOBONDI M C,et al.Zearalenone sensing with molecularly imprinted polymers and tailored fluorescent probes[J].Sensors & Actuators B Chemical,2007,121(1):67-73.
[30]URRACA J L,CARBAJO M C,TORRALVO M J,et al.Effect of the template and functional monomer on the textural properties of molecularly imprinted polymers[J].Biosensors & Bioelectronics,2008,24(1):155-161.
[31]TORRES J J,MONTEJANO H A,CHESTA C A.Characterization of imprinted microbeads synthesized via minisuspension polymerization[J].Macromolecular Materials and Engineering,2012,297(4):342-352.
[32]XU J,WANG L,ZHU Y.Decontamination of bisphenol a from aqueous solution by graphene adsorption[J].Langmuir,2012,28(22):8418-8425.
[33]GADZALA-KOPCIUCH R,CENDROWSKI K,CESARZ A,et al.Determination of zearalenone and its metabolites in endometrial cancer by coupled separation techniques[J].Analytical and Bioanalytical Chemistry,2011,401(7):2069-2078.
[34]史艺文.核磁共振简易谱在药学中的应用探讨[D].河南开封,河南大学,2014.SHI Y W.Studies of the applications of facile NMR in pharmacy[D].Henan University,Kaifeng,Henan,2014.
[35]TAKAMUKU T,NOGUCHI Y,YOSHIKAWA E,et al.Alkali chlorides-induced phase separation of acetonitrile–water mixtures studied by small-angle neutron scattering[J].Journal of Molecular Liquids,2007,131-132:131-138.
[36]RAO C N R,SOOD A K,SUBRAHMANYAM K S,et al.Graphene:the new two-dimensional nanomaterial[J].Angewandte Chemie International Edition,2010,48(42):7752-7777.
[37]BAI X,SUN C,XU J,et al.Detoxification of Zearalenone from corn oil by adsorption of functionalized GO systems[J].Applied Surface Science,2018,430:198-207.