高脂血症(HLP)是指血浆中的脂蛋白谱异常,一般特指总胆固醇(TC)、甘油三酯(TG)升高,伴或不伴高密度脂蛋白(HDL-C)降低和(或)低密度脂蛋白(LDL-C)升高[1],是脑卒中、心脏猝死、高血压、糖尿病、脂肪肝及肥胖的重要因素。研究表明核桃粕提取物对谷氨酸钠诱导的肥胖小鼠和 3T3-L1脂肪细胞具有较强的降脂作用[2],能显著调节肝脏和血清中脂质水平以及下调参与胆固醇吸收的蛋白质(ABCG5/8和NPC1L1)表达[3]。
核桃又名胡桃、弟桃,系胡桃科胡桃属植物,位居“四大干果”之首,是一种药食兼备的优良经济作物[4]。不仅味道鲜美,而且营养价值丰富,古书记载其有补肾、温肺、润肠之功,又有强身健脑、驻颜延年之用故又有“万岁子、长寿果”、“益智果”、“美容果”的美誉[5]。核桃经榨油后得到的副产物——核桃粕,呈片状或粉末状[6]。由于核桃粕成分复杂多样,本研究通过网络药理学方法分析核桃粕降脂的作用成分及其靶点和机理,为核桃粕用于高脂血症提供更多的科学依据。
1 材料和方法
1.1 核桃粕活性成分及潜在靶点的筛选
通过 TCMSP(Traditional Chinese Medicine Systems pharmacology)(http://tcmspw.com/tcmsp.php)数据库[7]和相关文献获得核桃粕的化学成分及相应潜在靶点。口服生物利用度(OB)反映药物口服进入体循环的比例[8],类药性(DL)是根据混合物的结构和性质表征成药特性,用于药物发现早期的初筛[9]。通常以OB≥15%和DL≥0.18作为筛选标准。
1.2 HLP靶点搜集
使用 GeneCards(https://www.genecards.org/)和OMIM(https://omim.org/)两个数据库[10],以“ hyperlipidemia”、“ hypercholesterolemia”、“hypertriglyceridemia”为关键词搜索 HLP相关靶点,将两个数据库的靶点进行归并得到HLP的靶点,以评分≥3为筛选条件,搜集HLP相关靶点。
1.3 药物–活性成分–疾病–靶点
将核桃粕的潜在靶点与HLP相关的靶蛋白使用Draw Venn Diagram(http://bioinformatics.psb.ugent.be/webtools/Venn/)取交集,即为核桃粕作用于HLP的潜在靶标。
1.4 网络构建
将交集靶点信息整理成 Excel格式导入网络可视化软件Cytoscape3.7.2(http://cytoscape.org/,v3.7.2)构建核桃粕“活性成分–药物–疾病–靶点”网络图,并运用Meta-analysis和Network Analyzer插件分析网络拓扑参数:选取节点度(Degree)前三位的活性成分为主要活性成分[11],进一步了解核桃粕活性成分与HLP相关靶点的相互作用关系。目前STRING (search tool for recurring instances of neighbouring genes)是蛋白质相互作用覆盖种类最多的数据库[12],将交集靶点导入STRING(https://string-db.org/)在线分析平台以获得蛋白质–蛋白质相互作用网络(protein protein interaction network,PPI)。蛋白质–蛋白质相互作用评分的置信度设置为0.900,并隐藏无相互作用的蛋白。将获得的PPI数据导出为 TSV文件格式并导入到 Cystoscape 3.7.2软件绘制网络图,利用Network Analyzer插件分析网络拓扑参数,Degree值越大代表了该点在网络图中越重要,进行关键靶点筛选。
1.5 GO功能富集和KEGG信号通路分析
使用DAVID(https://david.ncifcrf.gov/)数据库进行GO功能富集和KEGG信号通路分析。主要进行细胞、分子和生物三方面功能富集分析,以统计学超几何分布定量(P值)评估相关性,设置P<0.01。
2 结果与分析
2.1 核桃粕活性成分筛选结果
综合数据库搜索和文献报道,以OB≥15%,DL≥0.18为筛选标准,从TCMSP数据库获得核桃粕活性成分 14种(见表 1)[13-21]。其中有 12个成分口服生物利用度 OB≥30%,如芥子酸(Sinapic acid,64.15)、咖啡酸(Caffeic acid,54.97)、儿茶素(Catechin,54.83)、褪黑素(Melatonin,52.96)、丁香酸(Syringic acid,47.78)、槲皮素(Quercetin,46.43)、香豆酸(Coumaric acid,43.29)、鞣花酸(Ellagic acid,43.06)、Glansreginin B(41.37)、阿魏酸(Ferulic acid,39.56)、Glansreginin A(35.16)、没食子酸(Gallic acid,31.69),但绿原酸(Chlorogenic acid,13.61)和芦丁(Rutin,3.2)较低。而类药性DL满足筛选要求的则依次为芦丁(0.68)、Glansreginin A(0.64)、Glansreginin B(0.63)、鞣花酸(0.43)、绿原酸(0.31)、儿茶素(0.24)、槲皮素(0.28)共7个。但从临床来看无论是口服生物利用度较低的绿原酸(Chlorogenic acid,13.61)、芦丁(Rutin,3.2)或类药性较低的褪黑素等有口服制剂的报道。
表1 核桃粕潜在活性成分
Table 1 Potential active ingredients of walnut cold-press meal
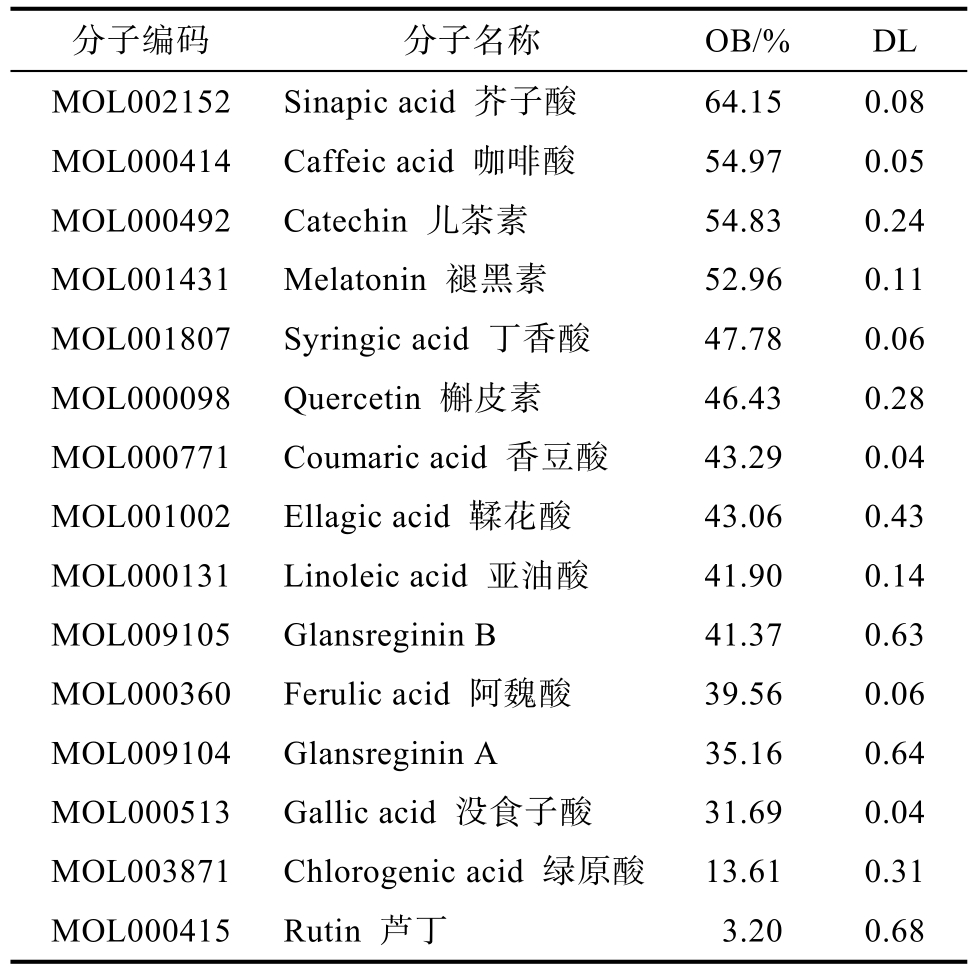
分子编码 分子名称 OB/% DL MOL002152 Sinapic acid 芥子酸 64.15 0.08 MOL000414 Caffeic acid 咖啡酸 54.97 0.05 MOL000492 Catechin 儿茶素 54.83 0.24 MOL001431 Melatonin 褪黑素 52.96 0.11 MOL001807 Syringic acid 丁香酸 47.78 0.06 MOL000098 Quercetin 槲皮素 46.43 0.28 MOL000771 Coumaric acid 香豆酸 43.29 0.04 MOL001002 Ellagic acid 鞣花酸 43.06 0.43 MOL000131 Linoleic acid 亚油酸 41.90 0.14 MOL009105 Glansreginin B 41.37 0.63 MOL000360 Ferulic acid 阿魏酸 39.56 0.06 MOL009104 Glansreginin A 35.16 0.64 MOL000513 Gallic acid 没食子酸 31.69 0.04 MOL003871 Chlorogenic acid 绿原酸 13.61 0.31 MOL000415 Rutin 芦丁 3.20 0.68
2.2 核桃粕作用于HLP的潜在靶点
基于所获得的14种化合物进行搜索,仅芥子酸;咖啡酸;儿茶素;褪黑素;丁香酸;槲皮素;香豆酸;鞣花酸;阿魏酸;没食子酸;绿原酸;芦丁共 12种化合物具有 256个潜在靶点。从GeneCards和OMIM数据库获得1 236个HLP的潜在靶点(评分≥25)。通过Draw Venn Diagram将HLP相关基因和核桃粕的潜在靶点相交,结果显示只有7个成分的59个潜在靶标与HLP相关(见表2和图1)。
表2 核桃粕成分中与HLP相关的潜在靶点
Table 2 Potential targets related to HLP in walnut cold-press meal
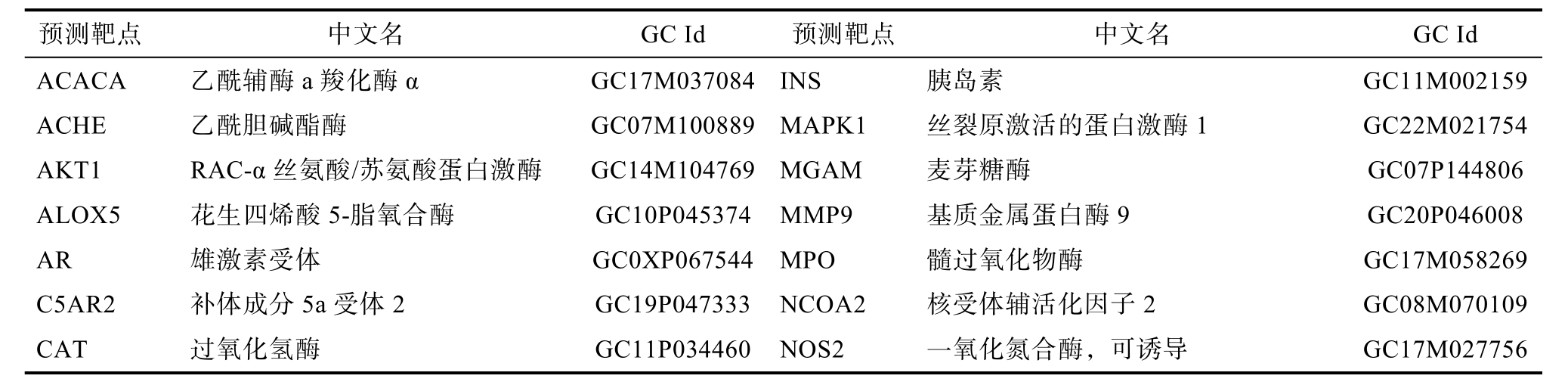
预测靶点 中文名 GC Id 预测靶点 中文名 GC Id ACACA 乙酰辅酶a羧化酶α GC17M037084INS 胰岛素 GC11M002159 ACHE 乙酰胆碱酯酶 GC07M100889MAPK1 丝裂原激活的蛋白激酶1 GC22M021754 AKT1 RAC-α丝氨酸/苏氨酸蛋白激酶 GC14M104769MGAM 麦芽糖酶 GC07P144806 ALOX5 花生四烯酸5-脂氧合酶 GC10P045374 MMP9 基质金属蛋白酶9 GC20P046008 AR 雄激素受体 GC0XP067544 MPO 髓过氧化物酶 GC17M058269 C5AR2 补体成分5a受体2 GC19P047333 NCOA2 核受体辅活化因子2 GC08M070109 CAT 过氧化氢酶 GC11P034460 NOS2 一氧化氮合酶,可诱导 GC17M027756
续表

预测靶点 中文名 GC Id 预测靶点 中文名 GC Id CAV1 小窝蛋白1 GC07P116524 NOS3 一氧化氮合酶,内皮 GC07P150990 CCL2 C-C基序趋化因子2 GC17P034255 NR1I2 核受体亚家族1第一类成员2 GC03P119780 CD40LG CD40配体 GC0XP136649 PLAT 组织型纤溶酶原激活剂 GC08M042174 CRP C反应蛋白 GC01M159715 PON1 血清对氧磷酶/芳基酯酶1 GC07M095297 CXCL10 C-X-C基序趋化因子10 GC04M076021 POR NHLPPH——细胞色素P450还原酶 GC07P075899 CXCL8 白介素8 GC04P073740 PPARA 过氧化物酶体增殖物激活受体α GC22P046150 CYP3A4 细胞色素P450 3A4 GC07M099759 PPARD 过氧化物酶体增殖物激活受体δ GC06P046031 EGF 前表皮生长因子 GC04P109912 PPARG 过氧化物酶体增殖物激活受体γ GC03P012287 EGFR 表皮生长因子受体 GC07P055019 PRSS1 胰蛋白酶1 GC07P144706 ESR1 雌激素受体 GC06P151656 PTGS2 前列腺素合成酶2 GC01M186640 F3 组织因子 GC01M094530 PTPN1 蛋白酪氨酸磷酸酶非受体1型 GC20P050510 F7 凝血因子VII GC13P113105 SELE E选择素 GC01M169722 FASN 脂肪酸合酶 GC17M082078 SERPINE1 纤溶酶原激活物抑制剂1 GC07P101127 FOS 原癌基因c-Fos GC14P075278 SLC2A4 溶质载体家族2,促葡糖转运蛋白4 GC17P007282 HAS2 透明质酸合酶2 GC08M121594 SOD1 超氧化物脱氧酶1 GC21P031659 HLPRB2 β-2肾上腺素受体 GC05P148825 SPP1 骨桥蛋白 GC04P087975 HMGCR 3-羟-3-甲戊二酰辅酶A还原酶 GC05P075336 THBD 血栓调节蛋白 GC20M023026 HMOX1 血红素加氧酶1 GC22P035380 TNF 肿瘤坏死因子 GC06P033397 ICAM1 细胞间粘附分子1 GC19P010270 TOP1 DNA拓扑异构酶1 GC20P041028 IGF2 胰岛素样生长因子II GC11M002130 TP53 肿瘤蛋白P53 GC17M007661 IGFBP3 胰岛素样生长因子结合蛋白3 GC07M045912 VEGFA 血管内皮生长因子A GC06P043770 IL10 白介素10 GC01M206767 XDH 黄嘌呤脱氢酶/氧化酶 GC02M031294 IL6 白介素6 GC07P022765
2.3 网络构建
通过Cytoscape3.7.2软件构建核桃粕“活性成分–药物–疾病–靶点”网络图(见图 1)。网络图包含68个节点,核桃粕活性成分7个,作用靶点59个,144条相互作用的边。作用靶点最多的成分为槲皮素、芦丁、儿茶素、芥子酸和鞣花酸;受最多化合物作用的靶点为透明质酸合酶 2(HAS2)、核受体辅活化因子2(NCOA2)、雌激素受体(ESR1)、过氧化氢酶(CAT)、雄激素受体(AR)、血管内皮生长因子 A(VEGFA)和NHLPPH——细胞色素P450还原酶(POR)。

图1 核桃粕活性成分-靶点网络图
Fig.1 Active ingredient of walnut cold-press meal-target network diagram
将 59个靶基因输入 STRING数据库进行分析,获得靶点蛋白相互作用关系网络图(见图 2左)。关键蛋白为白介素-6(IL6)、胰岛素(INS)、RAC-α丝氨酸/苏氨酸蛋白激酶(AKT1)、肿瘤坏死因子(TNF)、血管内皮生长因子A(VEGFA)、肿瘤蛋白P53(TP53)等(见图2右)。这些蛋白可能在核桃粕降脂中起关键作用。
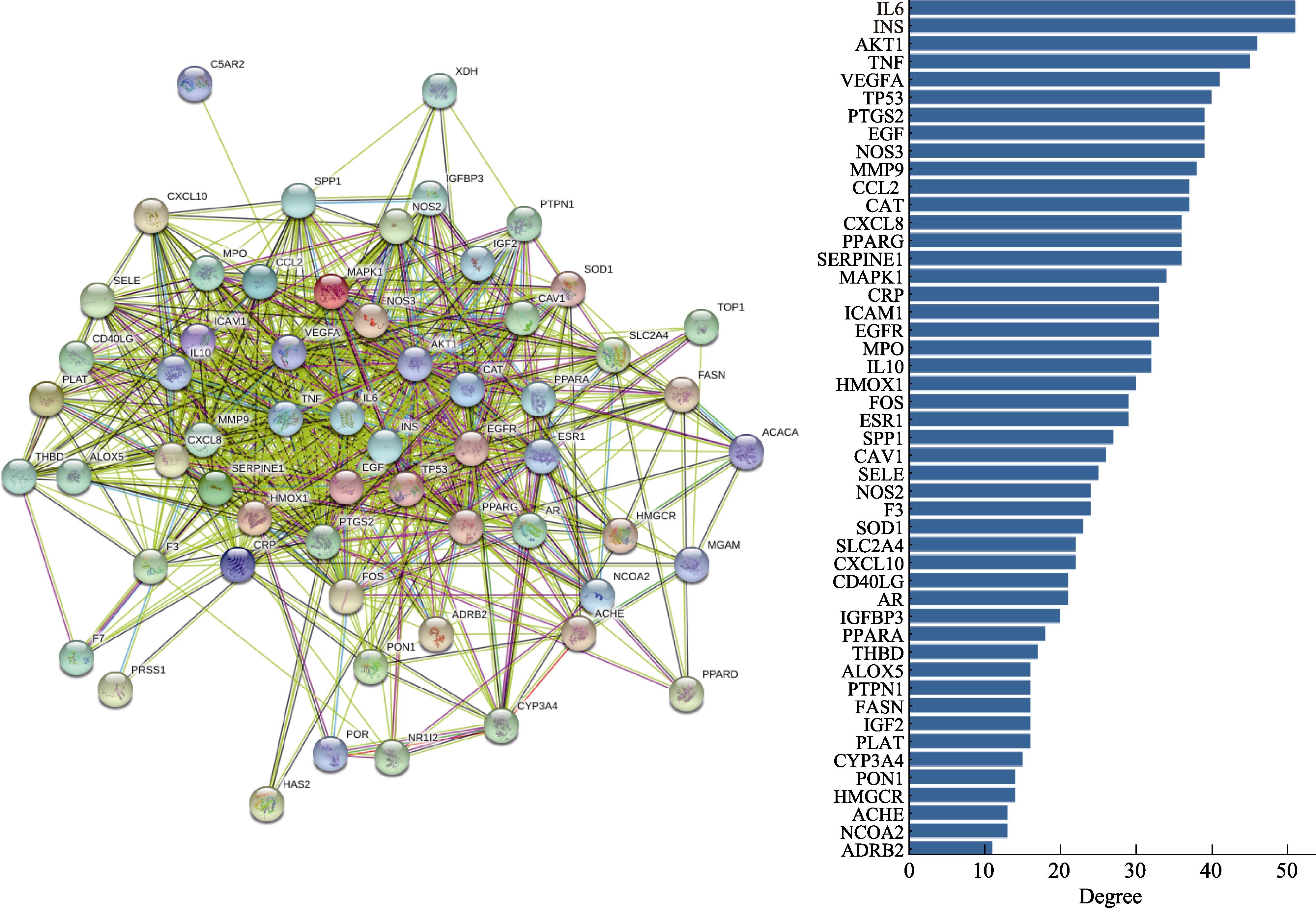
图2 蛋白质-蛋白质相互作用(PPI)网络图(左)和关键蛋白排序(右)
Fig.2 Protein-protein interaction (PPI) network diagram (left) and key protein sequencing (right)
2.4 GO功能富集分析
采用DAVID数据库,对核桃粕的59个HLP相关靶点进行细胞、分子和生物三方面功能富集分析(P<0.01)(见图 3)。其中生物过程主要包括对一氧化氮生物合成过程的正调控(positive regulation of nitric oxide biosynthetic,P=1.18E-10)、细胞对脂多糖的反应(cellular response to lipopolysaccharide,P=1.66E-10)、炎症反应(inflammatory response,P=4.05E-10)、细胞对缺氧的反应(cellular response to hypoxia,P=3.79E-08)和血管舒张的积极调节(positive regulation of vasodilation,P=4.59E-08)等;细胞成分主要涉及细胞外空间(extracellular space,P=3.02E-19)、细胞外区域(extracellular region,P=5.19E-08)、小窝(caveola,P=1.95E-06)、细胞质核周区(perinuclear region of cytoplasm,P=1.40E-04)和细胞表面(cell surface,P=3.01E-04)等;分子功能主要涉及酶结合(enzyme binding,P=1.13E-09)、RNA聚合酶II转录因子活性,配体激活序列特异性 DNA 结合(RNA polymerase II transcription factor activity,ligand-activated sequence-specific DNA binding,P=1.40E-07)、蛋白质结合(protein binding,P=2.13E-07)、类固醇激素受体活性(steroid hormone receptor activity,P=1.34E-06)和转录因子结合(transcription factor binding,P=5.38E-06)等。表明相关靶点通过调控不同生物学功能作用于HLP。

图3 GO功能富集图(左:前10个生物进程;中:前10个细胞成分;右:前10个分子功能)
Fig.3 GO functional enrichment diagram (left:top 10 biological processes; middle:top 10 cell components;right:top 10 molecular functions)
2.5 KEGG通路分析
对核桃粕的59个HLP相关靶点进行KEGG通路富集分析得到86条通路,筛选(P<0.01)得到46条相关通路,前20条重要通路(见图4)。其中,HIF-1信号通路(HIF-1 signaling pathway,P=1.39E-09),TNF信号通路(TNF signaling pathway,P=4.07E-09),南美锥虫病(美洲锥虫病)(Chagas disease (American trypanosomiasis),P=5.22E-08),疟疾(Malaria,P=5.45E-08)可能为核桃粕不同成分作用于HLP的关键通路。

图4 KEGG通路分析图
Fig.4 KEGG pathway analysis diagram
3 讨论
中医理论认为高脂血症的发生与脏腑功能失调有密切的联系,外多为嗜食肥甘厚味,内与脾肾运化失职,肝胆疏泄失调相关,二者终致气机阻滞,痰瘀内聚,膏脂不归正化[22]。核桃粕为核桃取油后的副产物,课题组的前期研究表明核桃粕乙醇提取物具有显著降脂作用[13],可改善II型糖尿病模型大鼠肝脏脂肪变性,改善肝脏脂质积累并提高肝脏抗氧化能力,可极显著地降低大鼠血清和肝脏中TG、TC蓄积,改善肝脏和胰腺的病理损伤,对高脂高糖高胆固醇诱导的II型糖尿病大鼠有良好的预防作用[13]。除此之后其他文献中也阐明了核桃粕有降脂作用[23]。网络药理学以系统生物学为基础,系统阐述药物成分与机体相互作用的原理与规律,可用来预测中药单体[24]或复方[25]的各有效成分及其作用靶点和参与的相关通路,探索药物与疾病间的关联性,解释中药治疗疾病的作用机理。本研究应用网络药理学方法筛选得到核桃粕12种活性成分具有HLP相关的潜在靶点59个,主要为酚类、黄酮类化合物。槲皮素、芦丁、儿茶素、芥子酸和鞣花酸等显示出较强的靶向作用,均可调节脂质代谢,降血脂。黄酮类化合物和多酚类化合物被认为是脂肪组织和肝脏中脂质稳态的调节因子。黄酮类化合物能抑制磷酸二酯酶[26],化合物中的多酚降脂归因于它们的抗氧化作用,从而抑制LDL氧化,改变肝脏胆固醇吸收、三酰基甘油组装和分泌[27]。肥胖是一种慢性低度炎症状态,在肥胖状态下,肥大、增生的脂肪细胞会分泌大量的促炎症因子如白细胞介素6(IL-6)、单核细胞趋化蛋白-1(Mcp-1)、肿瘤坏死因子-α(TNF-α)等,进而诱发各种疾病,槲皮素能够有效改善高脂引起的炎症因子的表达异常,所涉及的靶点均为本研究中发现的HLP相关重要靶点[28-29]。IL-6、TNF在炎症和B细胞成熟中起作用,并具有多种生物学功能,如参与淋巴细胞和单核细胞分化,对肝细胞发挥作用,且上述蛋白已成为高血压高脂血症发展的重要指标[30-31]。鞣花酸物具有清除自由基的能力,对低密度脂蛋白胆固醇体外氧化改性的敏感性具有保护作用[2]。本研究获得的透明质酸合酶 2(HAS2)、核受体辅活化因子2(NCOA2)、雌激素受体(ESR1)、过氧化氢酶(CAT)、雄激素受体(AR)、血管内皮生长因子 A(VEGFA)和 NHLPPH-细胞色素P450还原酶(POR),可能是HLP的关键靶点。研究发现,VEGFA具有调节细胞增殖,促进细胞迁移,抑制细胞并并调节血管通透性的作用[32]。高脂血症在诱发动脉粥样硬化的过程中,炎症细胞因子,如VEGF和TNF-α会诱发血管血栓的形成,同时导致大量正常的细胞凋亡,加剧病情的发展[33]。核桃粕可以通过提高机体主要的过氧化氢酶(CAT)活性,调节体内抗氧化酶活性降低脂质过氧化程度,从而促进降脂效果。
KEGG通路分析获得的一条重要通路为HIF-1信号通路,高脂血症的发生,发展以及并发症常伴有炎症[34]和内皮功能障碍[35],炎症组织的特征在于低氧状况和免疫细胞浸润,TNF信号通路和HIF-1信号通路主要涉及炎症反应和缺氧[36]。Mylonis等[37]研究发现,在缺氧条件下,HIF对维持细胞代谢平衡起重要作用,因为HIF可以上调糖酵解通路以及降低线粒体功能,同时缺氧也可以增强脂肪生成,主要是因为涉及脂肪酸(FA)摄取,合成和储存的基因由HIF依赖性诱导,所以 HIF参与糖代谢与脂质代谢的调节。HIF-1信号通路中的低氧诱导因子 1(HIF-1),是一种转录因子,调节细胞在低氧环境下的反应,在过氧化物酶体脂质代谢的调节中起着关键作用[38],HIF-1通过激活肝组织中脂素lipin 1的表达,从而导致活性氧的减少和防止肝脂质沉积[39]。胰岛素信号通路主要调节脂肪细胞中葡萄糖转运和脂肪分解,与胰岛素抵抗密切相关[40]。核桃粕在脂肪细胞的分化和减少三酰基甘油的积累中起重要作用。因此,核桃粕能够减少或抑制脂肪的形成,使其成为预防和治疗肥胖的潜在治疗剂[29]。
综上所述,核桃粕中的多个有效成分能同时作用于2个以上的靶点,并对应多条信号通路,在抗炎、抗氧化、诱导细胞凋亡等方面发挥作用,表明核桃粕通过多途径多靶点干预高脂血症的分子机制,主要作用为改善肝脏脂质积累、抗氧化、调节细胞代谢、调节脂质代谢、调节糖代谢等多个方面,同时对糖尿病、胰岛素抵抗等内分泌系统疾病起着多重协同效应。尽管目前HLP的发病机理尚不明确,核桃粕的降脂功能也有待开发,但借助网络药理学研究显示核桃粕可从多成分、多靶点、多途径协同干预HLP的发生和发展,为核桃粕防治HLP的功能成分和靶点机理提供数据和理论支持。
[1]EL-TANTAWY W H,TEMRAZ A.Natural products for controlling hyperlipidemia:Review[J].Arch Physiol Biochem,2019,125(2):128-135.
[2]LIANG X,CHEN D,CAO L,et al.Effects of pressed degreased walnut meal extracts on lipid metabolism in postnatally monosodium glutamate-induced mice and 3T3-L1 preadipocytes[J].J Funct Foods,2017,31:89-96.
[3]REN S,YAN X,MA J,et al.Defatted walnut powder extract reduces cholesterol gallstones formation in C57BL/6 mice by downregulating the levels of ABCG5/8 in the liver and NPC1L1 in the intestine[J].J Funct Foods,2018,48:85-91.
[4]刘玲,韩本勇,陈朝银.核桃蛋白研究进展[J].食品与发酵工业,2009,35(9):116-118.LIU L,HAN B Y,CHEN C Y.Research progress of walnut protein[J].Food and Fermentation Industries,2009,35(9):116-118.
[5]陈勤,李磊珂,吴耀核.桃仁的成分与药理研究进展[J].安徽大学学报:自然科学版,2005,29(1):86-89.CHEN Q,LI L K,WU Y H.Research progress on components and pharmacology of peach kernel[J].Anhui University:Natural Science Edition,2005,29(1):86-89.
[6]武万兴,陈朝银,赵声兰,等.固态发酵核桃粕制备活性肽及其抗氧化活性的研究[J].食品工业科技,2013,34(16):266-271.WU W X,CHEN C Y,ZHAO S L,et al.Preparation of active peptides from walnut cold-press meal by solid state fermentation and their antioxidant activity[J].Food Industry Science and Technology,2013,34(16):266-271.
[7]RU J,LI P,WANG J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Chem inform,2014,6(1):13.
[8]WANG J,HOU T.Advances in computationally modeling human oral bioavailability[J].Adv Drug Deliv Rev,2015,86:11-16.
[9]HU Q,FENG M,LAI L,et al.Prediction of drug-Likeness using deep autoencoder neural networks[J].Front Gene,2018,9:585.
[10]WANG Y,ZHANG S,LI F,et al.Therapeutic target database 2020:enriched resource for facilitating research and early development of targeted therapeutics[J].Nucl Acids Res,2020,48(D1):D1031-41.
[11]张晶,李冰冰,黄敏仪,等.基于网络药理学的参芪降糖颗粒治疗2型糖尿病机制探讨[J].中草药,2020,51(19):4873-4883.ZHANG J,LI B B,HUANG M Y,et al.Study on the mechanism of Shenqi Jiangtang granules in the treatment of type 2 diabetes based on network pharmacology[J].Chinese Journal of Chinese Herbal Medicine,2020,51(19):4873-4883.
[12]ZINSMAIER K E.Cysteine-string protein's neuroprotective role[J].J Neurogenet,2010,24(3):120-132.
[13]王祖坤,马雅鸽,杨婧娟,等.核桃粕乙醇提取物降脂活性的谱效关系[J].现代食品科技,2020,36(7):105-112.WANG Z K,MA Y G,YANG J J,et al.Relationship between spectral effect and lipid-lowering activity of ethanol extract from walnut cold-press meal[J].Modern Food Technology,2020,36(7):105-112.
[14]SALEHI A,RABIEI Z,SETORKI M.Effect of gallic acid on chronic restraint stress-induced anxiety and memory loss in male BALB/c mice[J].Iran J Basic Med Sci,2018,21(12):1232-1237.
[15]OGUT E,SEKERCI R,AKCAY G,et al.Protective effects of syringic acid on neurobehavioral deficits and hippocampal tissue damages induced by sub-chronic deltamethrin exposure[J].Neurotoxi terat,2019,76:106839.
[16]MHILLAJ E,CATINO S,MICELI F M,et al.Ferulic acid improves cognitive skills through the activation of the heme oxygenase system in the rat[J].Mol Neurobio,2018,55(2):905-916.
[17]SHAHMOHAMHLPY P,EIDI A,MORTAZAVI P,et al.Effect of sinapic acid on memory deficits and neuronal degeneration induced by intracerebroventricular administration of streptozotocin in rats[J].Pol J Pathol,2018,69(3):266-277.
[18]ZHONG L,LIU H,ZHANG W,et al.Ellagic acid ameliorates learning and memory impairment in APP/PS1 transgenic mice via inhibition of β-amyloid production and tau hyperphosphorylation[J].Experi Therap Med,2018,16(6):4951-4958.
[19]HERMAWATI E,ARFIAN N,MUSTOFA M,et al.Chlorogenic acid ameliorates memory loss and hippocampal cell death after transient global ischemia[J].Eur J Neurosci,2020,51(2):651-669.
[20]RAMALINGAYYA G V,CHERUKU S P,NAYAK P G,et al.Rutin protects against neuronal damage in vitro and ameliorates doxorubicin-induced memory deficits in vivo in Wistar rats[J].Drug Des Devel Ther,2017,11:1011-1026.
[21]KE F,LI H R,CHEN X X,et al.Quercetin alleviates LPS-induced depression-like behavior in rats via regulating BDNF-related imbalance of copine 6 and TREM1/2 in the hippocampus and PFC[J].Front Pharmacol,2020,10:1544.
[22]邵明义,施斌,魏明.中医药治疗高脂血症临床研究概况[J].中医杂志,2005,4(46):311-312.SHAO M Y,SHI B,WEI M.Clinical study on the treatment of hyperlipidemia with traditional Chinese medicine[J].Journal of traditional Chinese medicine,2005,4(46):311-312.
[23]GU M,CHEN H,ZHAO M,et al.Identification of antioxidant peptides released from defatted walnut (Juglans sigillata Dode)meal proteins with pancreatin[J].LWT-Food Sci Tech,2015,60(1):213-220.
[24]YANG S,ZHANG J,YAN Y,et al.Network pharmacologybased strategy to investigate the pharmacologic mechanisms of Atractylodes macrocephala Koidz.for the treatment of chronic gastritis[J].Front Pharmacol,2020,10:1629.
[25]HE D,HUANG J H,ZHANG Z Y,et al.A Network pharmacology-based strategy for predicting active ingredients and potential targets of LiuWei DiHuang Pill in treating type 2 diabetes mellitus[J].Drug Des Devel Ther,2019,13:3989-4005.
[26]LI L,TSAO R,YANG R,et al.Polyphenolic profiles and antioxidant activities of heartnut (Juglans ailanthifolia Var.cordiformis) and Persian walnut (Juglans regia L.)[J].J Agri Food Chem,2006,54(21):8033-8040.
[27]RIVERA L,MORÓN R,SÁNCHEZ M,et al.Quercetin ameliorates metabolic syndrome and improves the inflammatory status in obese Zucker rats[J].Obesity,2012,16(9):2081-2087.
[28]DANDONA P,ALJADA A,BANDYOPADHYAY A.Inflammation:The link between insulin resistance,obesity and diabetes[J].Trends in Immunology,2004,25(1):4-7.
[29]SUN S,JI Y,KERSTEN S,et al.Mechanisms of inflammatory responses in obese adipose tissue[J].Annual Review of Nutrition,2012,32(1):261-286.
[30]ZHOU J,XU G,YAN J,et al.Rehmannia glutinosa (Gaertn)DC.polysaccharide ameliorates hyperglycemia,hyperlipemia and vascular inflammation in streptozotocin-induced diabetic mice[J].Journal of Ethnopharmacol,2015,164(10):229-238.
[31]黄帅,成鹏,杨宇,等.基于网络药理学探究蒲参胶囊治疗高脂血症的作用机制[J].南京中医药大学学报,2019,35(3):290-296.HUANG S,CHENG P,YANG Y,et al.To explore the mechanism of action of Pushen Capsule in treating hyperlipidemia based on network pharmacology[J].Journal of Nanjing University of ChineseMedicine,2019,35(3):290-296.
[32]ABBASALIZAD FARHANGI M,VAJDI M,NIKNIAZ L,et al.Interaction between vascular endothelial growth factor-a(rs2010963) gene polymorphisms and dietary diversity score on cardiovascular risk factors in patients with metabolic syndrome[J].Lifestyle Genom,2020,13(1):1-10.
[33]AN H J,KIM J Y,GWON M G,et al.Beneficial effects of SREBP decoy oligodeoxynucleotide in an animal model of hyperlipidemia[J].Int J Mol Sci,2020,21(2):552.
[34]PAPAPANAGIOTOU A,SIASOS G,KASSI E,et al.Novel inflammatory markers in hyperlipidemia:clinical implications[J].Current Med Chem,2015,22(23):2727-2743.
[35]AGATA S,ANNA G,URSZULA F,et al.Cellular and molecular mechanisms of inflammation-induced angiogenesis[J].IUBMB life,2015,67(3):145-159.
[36]IAN W,RABKIN S W.Hypoxia-inducible factor 1-alpha(HIF-1α) as a factor mediating the relationship between obesity and heart failure with preserved ejection fraction[J].Obes Rev,2019,20(5):701-712.
[37]ILIAS M,GEORGE S,EFROSYNI P.Hypoxia-inducible factors and the regulation of lipid metabolism[J].Cells,2019,214(8):1-16.
[38]SHI X J,SUNG S H P,LEE M M S,et al.A lipophilic AIE gen for lipid droplet imaging and evaluation of the efficacy of HIF-1 targeting drugs[J].J Mater Chem B,2020,8(7):1516-1523.
[39]TAKATOMO A,MASAKO T,NOBUHITO G.HIF-1-dependent lipin1 induction prevents excessive lipid accumulation in choline-deficient diet-induced fatty liver[J].Sci Rep,2018,8(1):14230.
[40]CHAN H,BHIDE K P,VAIDYAM A,et al.Proteomic analysis of 3T3-L1 adipocytes treated with insulin and TNF-α[J].Proteomes,2019,7(4):35.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。