淀粉是植物体内通过光合作用产生的一类可生物降解的高分子碳水化合物,在自然界中产量大、来源广、种类多,广泛应用于食品、医药和化妆品等领域。然而,天然淀粉颗粒粒径较大(>10 μm),且亲水性强,难以吸附于油水界面形成稳定的 Pickering乳液[1],将淀粉改性减小其粒径并增加疏水性,可使其成为一种良好的新型固体颗粒乳化剂。
目前,淀粉颗粒在制备Pickering乳化剂方面已有大量研究,主要分为三类:天然淀粉、物理改性淀粉和化学改性淀粉。Li等[2]采用不同粒径的米淀粉、小麦淀粉、蜡质玉米淀粉和马铃薯淀粉作为乳化剂,制备水包油型Pickering乳液,结果表明米淀粉颗粒的粒径较小,所制备的乳液具有较好的稳定性。Bortmowska等[3]采用预糊化后的蜡质玉米淀粉制备Pickering乳液,发现其对低油相体积分数的乳液有较好的乳化效果。除天然淀粉和物理改性淀粉外,辛烯基琥珀酸改性淀粉稳定 Pickering乳液是近些年的研究热点。Song等[4]探究不同直链淀粉含量的辛烯基琥珀酸改性淀粉的乳化性能,结果显示随着辛烯基琥珀酸取代度的升高,乳液呈现出明显的稳定效果。
淀粉脂质复合物是由链淀粉包裹线性的脂肪酸分子构成,在疏水性、抗消化性及热特性等与天然淀粉有很大不同。目前,淀粉脂质复合物的应用主要有:抗性食品原料(第五类抗性淀粉)、活性成分的包埋壁材和油脂的抗氧化稳定,而关于其作为乳化剂用于稳定Pickering乳液的研究鲜有报道。Lu等[5]采用湿热法制备颗粒态淀粉脂质复合物,发现复合物相对原淀粉的疏水性显著提高,乳化性能显著提升。
淀粉纳米粒子包括淀粉纳米晶和淀粉纳米球,淀粉纳米晶可通过酶解或酸解后再经过重结晶得到,淀粉纳米球可通过纳米沉淀法制备,淀粉纳米粒子可稳定吸附在油水界面,用于稳定Pickering乳液[6]。Ge等[7]以玉米淀粉、木薯淀粉和甘薯淀粉为原料制备淀粉纳米粒子,发现三种淀粉纳米粒子稳定的乳液均呈现良好的稳定性。然而,目前采用纳米沉淀法结合脂肪酸复合法制备聚集态淀粉脂质复合物纳米粒子(SFACNs)及其乳化性能的研究尚处于空白。本研究采用干法和湿法制备 SFACNs,对其脂质复合率、微观形态、粒径分布、结晶结构和乳化性等进行研究,为新型淀粉基Pickering乳化剂的制备提供思路。
1 材料和方法
1.1 实验材料
普通玉米淀粉:吉林天成玉米开发有限公司;月桂酸:上海凌峰化学试剂有限公司;碘:上海银典化工有限公司;碘化钾:广东光华科技股份有限公司;大豆油:南海油脂工业(赤湾)有限公司。
1.2 仪器与设备
MR Silver恒温磁力搅拌器、SilentCrusherM高速剪切搅拌器:德国 Heidolph公司;MS2000粒度仪:英国Malvern仪器有限公司;EVO 18扫描电子显微镜:德国 Carl Zeiss公司;UV-1100紫外可见光分光光度计:上海美析仪器有限公司;OCA40Micro全自动视频微观接触角:德国Dataphysics公司;D8ADVANCE X-射线散射仪:德国Bruker公司;TPS.SP5激光共聚焦显微镜:德国LEICA公司。
1.3 实验方法
1.3.1 SFACNs制备
参考 Chang等[8]的方法稍作修改,通过湿法和干法制备SFACNs,具体方法如下:
湿法:取3.0 g普通玉米淀粉(干基),加入适量蒸馏水配成3%(w/w)的淀粉乳,置于沸水浴中磁力搅拌1 h,将得到的淀粉糊冷却至60 ℃并保持不断搅拌,然后逐滴加入熔融的月桂酸(添加量为淀粉干基的10%,w/w)反应30 min,待混合两者均匀后,冷却至室温,向混合物中逐滴滴加 2倍体积分数的无水乙醇,将所得产物在4 000 r/min下离心15 min后取出沉淀用无水乙醇洗涤 2次,在 40 ℃烘箱中干燥 12 h,得到SFACNs。
干法:取3.0 g普通玉米淀粉(干基),加入蒸馏水配成3%(w/w)淀粉乳,置于沸水浴中磁力搅拌1 h,冷却至室温后,向淀粉糊中逐滴滴加2倍体积分数的无水乙醇,将所得产物在4 000 r/min下离心15 min后取出沉淀,在40 ℃烘箱中干燥12 h,然后粉碎过200目筛备用。将月桂酸(添加量为淀粉干基的10%,w/w)在60 ℃下进行熔融处理,与上述淀粉在烘箱内反复捏合,直至淀粉呈现明显的颗粒感,颗粒之间无黏连,即混合均匀,最后在40 ℃烘箱中干燥48 h,得到SFACNs。
1.3.2 复合率测定
参考Chen[9]等方法,并进行适当修改。取0.1 g干基SFACNs分散于5 mL蒸馏水中,置于沸水浴20 min后冷却至室温,然后在3 000 r/min下离心15 min,取上清液50 μL与4 mL碘–碘化钾溶液混合,置于试管中涡旋1 min,在690 nm处测定吸光度,原普通玉米淀粉作为对照,复合率(CI)的计算公式如下:
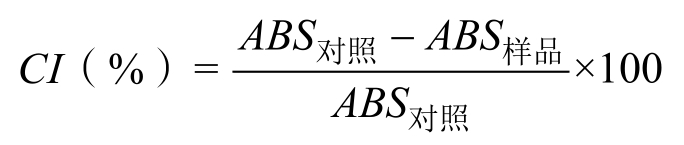
式中,ABS对照,普通玉米淀粉的吸光度;ABS样品,SFACNs样品的吸光度。
1.3.3 溶解度测定
参考 Wang等[10]方法,并进行适当修改。取0.1 g干基SFACNs加入蒸馏水配成1%(w/w)淀粉乳,在4 000 r/min下离心15 min,将离心后的上清液在120 ℃下干燥12 h,称重并记为m上清液,溶解度(S)的计算公式如下:
1.3.4 扫描电子显微镜(SEM)观察
采用扫描电子显微镜对SFACNs进行颗粒形貌的观察[9]。用导电双面胶将处理好的样品固定在样品台上,置于离子溅射仪中喷金,在扫描电镜下放大一定倍数观察样品,扫描电压为10 kV。
1.3.5 粒径分布
采用Mastersizer 2000激光粒度仪对SFACNs进行分析,分散溶剂为蒸馏水,参考 LIN等[11]的方法并进行适当调整。测试期间,将淀粉样品缓慢分散于蒸馏水中,开启超声波振荡3 min,使淀粉样品均匀分散,待遮光背景强度达到12%时进行测试。淀粉颗粒和蒸馏水的折光系数分别为1.54和1.33。
1.3.6 接触角测试
取0.2 g干基SFACNs,放入标准模具(厚度:2 mm和直径:13 mm),通过自动压片机在10 MPa下制成片剂。将片剂浸没在OCA40Micro装置载物台上的棕榈油浴装置中,并使用高精度注射器将2 μL的去离子水轻轻滴在片剂的表面上,同时通过高速相机以 10帧/秒的采集速度,记录水滴在片剂表面的球形变化趋势。
1.3.7 X-射线衍射(XRD)测试
在进行 XRD测试前,测试样品需放置在100%相对湿度的容器中在25 ℃下平衡水分24 h。XRD的测试参数分别为:40 kV、40 mA和Cu-Kα射线(λ=0.154 nm)。将样品密封包装在矩形样品台中,以2 (°)/min在2θ为4~35°区间进行扫描。
1.3.8 SFACNs在Pickering乳液中的应用
1.3.8.1 Pickering乳液表观形态观察 分别以干法和湿法制备的SFACNs为乳化剂,大豆油为油相,去离子水为水相,制备Pickering乳液,乳化剂添加量为 4%(w/w),油相体积分数为 50%,用高速剪切搅拌机剪切2 min,间隔30 s,转速为20 000 r/min,制备 Pickering乳液[11],并拍照记录乳液情况。
1.3.8.2 Pickering乳液激光共聚焦显微观察(CLSM) 取制备的新鲜乳液1 mL,加入100 μL 1%尼罗红和尼罗蓝混合试剂(1∶1,v/v),盖上铝箔纸,在1 000 r/min下涡旋震荡30 min,避光保存,在盖玻片边缘上涂上油封边,用CLSM观察乳滴的形态,其中尼罗蓝的激发波长设置为633 nm,照片分辨率为1 024×1 024。
1.3.8.3 不同乳化剂浓度制备Pickering乳液表观形态观察 根据上述实验结果,以干法制备的SFACNs为乳化剂,充分水化后,加入大豆油,乳化剂添加量分别为0.5%、1%、2%、3%、4%、5%(w/w,占油水总质量),油相体积分数为50%(v/v,占油水总体积),用高速剪切搅拌机剪切2 min,间隔 30 s,转速为 20 000 r/min,制备Pickering乳液。
1.4 数据处理
各组实验数据均重复3次,用SPSS 18.0进行统计分析,用ORIGIN 8.0进行图表制作。
2 结果与讨论
2.1 脂质复合率
不同方法制备的 SFACNs脂质复合率如表 1所示。表中显示,采用干法制备SFACNs的脂质复合率显著高于湿法,这与脂肪酸的加入方式有关。湿法制备过程中,月桂酸与糊化淀粉复合后进行醇沉处理,乙醇的加入可将未完全复合的月桂酸洗脱,无法形成淀粉脂质复合物。此外,月桂酸可能在与直链淀粉形成复合物后包裹在淀粉外部,阻碍了月桂酸与淀粉复合,导致复合率较低[12]。Chang[8]等认为当糊化淀粉体系水分含量高于50%时,淀粉脂质复合物的焓值开始减小,这是由于大量的糊化淀粉形成粘性体系,抑制了复合物的形成。
表1 SFACNs的脂质复合率和溶解度
Table 1 The fatty acid complex index and solubility of SFACNs %

制备方法 脂质复合率 溶解度湿法 69.46 ± 0.45 6.2 ± 0.15干法 93.69 ± 0.76 1.1 ± 0.05
干法制备过程中,月桂酸与制备得到的V型结晶淀粉直接复合,与糊化淀粉相比,其内部排列紧密的单螺旋结构更加有利于对月桂酸的截留。Dries等[13]研究表明,这种单螺旋结构内部具有较强的疏水性,通过疏水相互作用与脂肪酸形成直链淀粉复合物。此外,对于V型结晶淀粉,除了其内部的单螺旋结构可容纳脂肪酸分子外,单螺旋结构之间的间隙也可对脂肪酸截留,从而提高复合率[14]。然而,位于单螺旋之间的脂肪酸与淀粉分子之间结合力较弱,容易被有机溶剂洗脱[15]。本研究中采用干法制备的SFACNs未经有机溶剂洗涤,因此复合率较高。
2.2 溶解度
不同方法制备的SFACNs溶解度如表1所示。表中显示,采用湿法制备的SFACNs溶解度显著高于干法,这与脂肪酸的复合率有关。淀粉与脂肪酸复合后,疏水性增强,导致其溶解度降低,并且脂质复合率越高,疏水性越强[16]。Wang等[17]认为淀粉与脂肪酸复合后,可减少直链淀粉溶出并延迟水分进入淀粉颗粒内部,导致淀粉与水结合的位点减少,从而使复合物的溶解度降低。此外,干法制备过程中,月桂酸未经过乙醇洗涤,部分月桂酸位于淀粉颗粒表面,大大降低了复合物的溶解度。
2.3 微观形态分析
不同方法制备SFACNs的SEM如图1所示。图中可以看出,湿法和干法制备的SFACNs均出现聚集态纳米颗粒(图中箭头所示),并且呈现粗糙和不规则的形状。这种现象与淀粉纳米粒子的制备过程有关,经过醇沉后的淀粉纳米颗粒较小,表面的范德华力和静电引力较大,干燥时易团聚;此外,直链淀粉在醇沉时易交叉,导致纳米颗粒出现堆积[18]。Kiatponglarp等[19]通过酶解蜡质米淀粉和米淀粉,在重结晶后均可得到聚集态淀粉纳米颗粒,米淀粉制备的纳米颗粒表面粗糙,而蜡质米淀粉制备的纳米颗粒表面光滑,这可能是由于制备过程中未结晶的分子链之间的斥力导致结晶片层不规则堆积。Rajesh等[20]采用直链淀粉–棕榈酸复合物制备淀粉纳米粒子,同样发现纳米颗粒之间出现粘连。Cai等[21]认为这种聚集态结构是颗粒内部晶体的部分有序性聚集导致,即短直链淀粉链缔合成双螺旋并形成簇,然后簇状的结晶单元重排成纳米颗粒,最后颗粒生长成大聚集体。

图1 湿法(左)和干法(右)制备的SFACNs的扫描电镜图
Fig.1 SEM of SFACNs prepared with wet (left) and dry method (right)
2.4 粒径分布分析
不同方法制备的 SFACNs的粒径分布如图 2所示。图中可以看出,湿法和干法制备的SFACNs均呈现单峰粒径分布,表明粒径分布均匀。此外,两种方法制备的SFACNs平均粒径分别为208.7 nm和325.0 nm,与干法较高的脂质复合率有关。脂质复合率越高,颗粒间的疏水间相互作用力越强,从而加剧了颗粒之间的“团聚”,导致平均粒径增大,这与SEM结果一致。Lesmes等[22]认为淀粉纳米粒子的粒径大小可能与复合物的制备方法有关,湿法制备过程中,由于月桂酸与直链淀粉形成复合物包裹在淀粉表面,在醇沉、干燥时可能阻碍直链淀粉重新进入颗粒内部,导致湿法制备的颗粒粒径小于干法。Duyen等[23]采用纳米沉淀法和微乳液法制备淀粉纳米颗粒,发现微乳液法制备的淀粉纳米颗粒聚集度较高,同样呈现出较大的颗粒粒径。
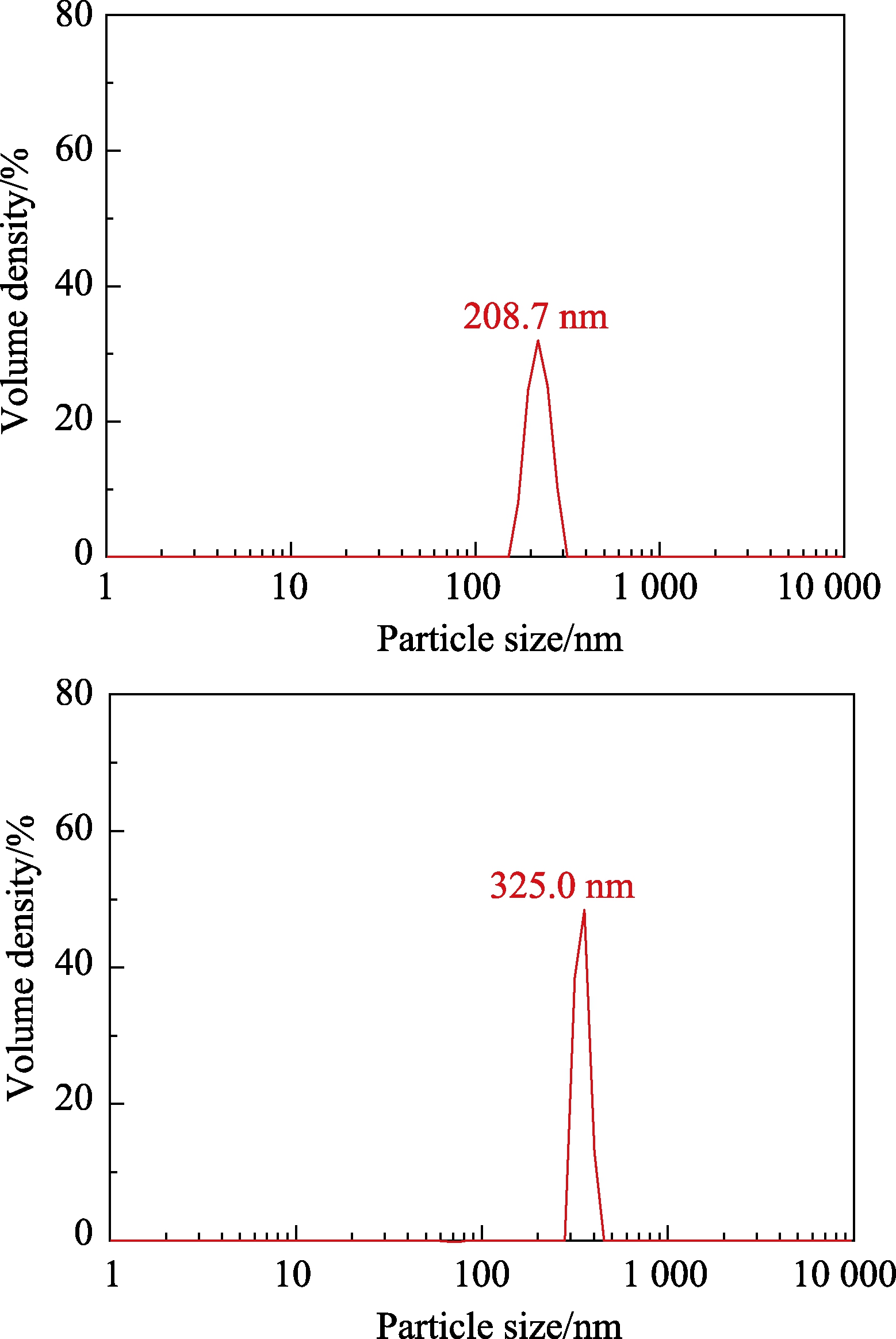
图2 湿法(左)和干法(右)制备的SFACNs的粒径分布图
Fig.2 Particle size distribution of SFACNs prepared with wet (left) and dry (right) methods
2.5 接触角分析
不同方法制备的 SFACNs三相接触角如图 3所示。图中可以看出,湿法制备的SFACNs接触角为81.2°,干法制备的SFACNs接触角为94.6°,表明干法制备的粒子两亲性较高。三相接触角 θ可以直观地反映出颗粒的亲疏水性,接触角越接近 90°,越能促进其在油水界面的有效吸附和排列,形成稳定的物理界面屏障,有利于形成稳定的 Pickering乳液[24]。本研究中的这种差异与SFACNs的脂质复合率有关,淀粉颗粒本身是一种亲水性颗粒,与脂质复合后疏水性提高,并且脂质的复合率越高,接触角越接近 90°。此外,颗粒的尺寸与接触角也有关系,Ge等[7]采用纳米沉淀法制备淀粉纳米颗粒,发现通过减小淀粉颗粒粒径来增加其比表面积,可能会减少淀粉的亲水性区域的暴露,有助于增强颗粒的疏水性和乳化性能。然而,本实验中采用湿法制备的SFACNs粒径较小,其接触角也较小,呈现出与之前不同的研究结果,这可能是由于Ge等[7]研究中并未将淀粉纳米颗粒与脂质复合,仅通过降低颗粒粒径来提高疏水性。以上结果表明,SFACNs的脂质复合率对其乳化性起主导作用。

图3 湿法(左)和干法(右)制备的SFACNs三相接触角
Fig.3 Three-phase contact angle of SFACNs prepared with wet and dry methods
2.6 晶型结构分析
不同方法制备的SFACNs晶型结构如图4所示。图中可以看出,原玉米淀粉呈现出典型的 A型结晶结构。两种方法制备的SFACNs均在2θ 13°和20°附近出现尖锐峰,表明SFACNs为V型结晶结构。SFACNs的制备过程中,淀粉糊在乙醇的诱导下形成大量的单螺旋结构,这些单螺旋结构可容纳月桂酸分子形成淀粉脂质复合物。此外,干法制备的SFACNs衍射峰强度明显高于湿法,暗示干法制备的SFACNs单螺旋结构排列更加紧密[25],这与干法的脂质复合率较高有关。Wang等[26]研究发现普通小麦淀粉的V型峰强度归因于V型络合物的形成,直链淀粉–脂质复合物越多,V型峰强度越高。有趣的是,干法制备的SFACNs在2θ 21.15°和23.9°出现了月桂酸的特征衍射峰,说明干法制备的 SFACNs中存在游离月桂酸,这与 Wang等[26]研究结果一致。然而,湿法制备 SFACNs过程中,由于乙醇的洗涤作用,未复合的游离月桂酸被洗脱,因此未出现月桂酸衍射峰。

图4 玉米淀粉、月桂酸及湿法和干法制备的SFACNs的XRD图谱
Fig.4 XRD patterns of corn starch,lauric acid,and SFACNs prepared with wet and dry methods
2.7 乳液表观
不同方法制备的SFACNs稳定的乳液表观如图 5所示。图中可以看出,两种方法制备的SFACNs稳定的Pickering乳液均无乳析或油析的现象,表明SFACNs可作为一种良好的Pickering乳化剂。将其在室温下放置24 h后,乳液为乳白色粘稠状,未出现乳析和油析现象,然后对乳液进行倒置,发现乳液不流动,表明Pickering乳液凝胶形成。Pickering乳液凝胶体系可以将液态的乳液转化成固态的乳液凝胶,因而呈现出倒置不流动的现象[27]。基于以上结果,SFACNs乳液凝胶的形成机理可能为:SFACNs被吸附在油水界面上后,颗粒表面向外延伸的直链淀粉分子和淀粉脂质复合物互相“桥联”形成稳定的网状结构,加强液滴之间的相互作用,从而形成乳液凝胶[28]。

图5 湿法和干法制备的SFACNs稳定的乳液表观图
Fig.5 Emulsion appearance stabilized by SFACNs prepared with wet and dry methods
2.8 激光共聚焦观察
不同方法制备的SFACNs稳定的乳液CLSM如图 6所示。SFACNs通过尼罗蓝(亲水性荧光染料)进行荧光染色,在图谱中被标记为蓝色。图中可以看出,湿法制备的SFACNs稳定的乳液粒径分布不均匀且乳滴较大,表明该乳液稳定性较差。干法制备的SFACNs稳定的乳液,颗粒在界面的分布较均匀(蓝色深)且乳滴更小,表明乳液的稳定性较好,与接触角结果一致。干法制备的 SFACNs表面的直链淀粉分子及淀粉–月桂酸复合物被大量吸附到油水界面并向油滴延伸,由于较高的脂质复合率,使油滴之间相互连接更加紧密,形成更为稳定的凝胶网络结构,呈现出较均匀的乳液粒径分布。Timgren等[29]发现,疏水改性的藜麦淀粉会自发通过疏水长链吸附到油滴的油水界面上,并均匀的覆盖在油滴上,疏水改性程度与乳滴粒径分布的均匀性成正相关,与本实验结果一致。上述实验结果表明,干法制备的SFACNs乳化性较好,因此采用干法制备的乳化剂制备Pickering乳液。

图6 湿法(左)和干法(右)制备的SFACNs稳定的乳液CLSM图
Fig.6 CLSM of emulsion stabilized by SFACNs prepared with wet and dry methods
2.9 乳化剂浓度对Pickering乳液乳化效果影响
不同浓度的SFACNs制备的Pickering乳液表观如图7所示。图中可以看出,不同浓度的乳化剂制备的新鲜乳液均呈白色液体状,且当乳化剂浓度为0.5%时出现乳析现象。随着乳化剂浓度提高,乳析现象消失,表明乳化剂浓度为1%~5%时乳化效果较好。贮藏7天后,乳化剂浓度为0.5%

图7 不同浓度的SFACNs稳定的乳液表观图
Fig.7 Emulsion appearance stabilized by different concentrations of SFACNs
和1%的乳液均出现乳析现象,这是由于乳化剂浓度较低,不足以覆盖在水油界面,导致乳液不稳定[30]。此外,当乳化剂浓度为3%~5%时,乳液呈现倒置不流动现象,表明形成了乳液凝胶[27],这是由于淀粉脂质复合物纳米粒子之间的接触较紧密,粒子表面的直链淀粉分子或淀粉脂质复合物之间的“桥联”较多,形成了凝胶网络结构。考虑到实际生产成本,该乳化剂添加量为3%时即可制备稳定的Pickering乳液。
3 结论
本文采用湿法和干法分别制备 SFACNs,研究其微观结构、脂质与淀粉的复合方式及其界面润湿性,并将其用于稳定Pickering乳液,考察其乳化能力。研究发现两种方法制备的SFACNs均呈现聚集态分布及V型结晶结构。其中,干法制备的SFACNs的脂质复合率较高,增加了粒子的润湿性,形成的乳液粒径更小,分布更均匀,并发现干法制备的乳化剂浓度为3%~5%时,在贮藏7天仍表现出较好的乳液稳定性,形成乳液凝胶。本研究将纳米沉淀法结合脂质复合制备新型淀粉基Pickering乳化剂,具有工艺成本低和乳液稳定性高等优势,为开发淀粉基Pickering乳化剂提供一条更为简单和绿色的制备途径。
[1]XIAO J,LI Y,HUANG Q.Recent advances on food-grade particles stabilized Pickering emulsions:Fabrication,characterization and research trends[J].Trends in Food Science & Technology,2016,55:48-60.
[2]LI C,LI Y,SUN P,et al.Pickering emulsions stabilized by native starch granules[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,431:142-149.
[3]BORTNOWSKA G,BALEJKO J,TOKARCZYK G,et al.Effects of pregelatinized waxy maize starch on the physicochemical properties and stability of model low-fat oil-inwater food emulsions[J].Food Hydrocolloids,2014,36:229-237.
[4]SONG X,PEI Y,ZHU W,et al.Particle-stabilizers modified from indica rice starches differing in amylose content[J].Food Chemistry,2014,153:74-80.
[5]LU X,LIU H,HUANG Q.Fabrication and characterization of resistant starch stabilized Pickering emulsions[J].Food Hydrocolloids,2020,103:105703.
[6]CAMPELO P H,SANTANA A S,CLERICI M T P S.Starch nanoparticles:production methods,structure,and properties for food applications[J].Current Opinion in Food Science,2020,33:136-140.
[7]GE S,XIONG L,LI M,et al.Characterizations of Pickering emulsions stabilized by starch nanoparticles:Influence of starch variety and particle size[J].Food Chemistry,2017,234:339-347.
[8]CHANG F,HE X,FU X,et al.Effects of heat treatment and moisture contents on interactions between lauric acid and starch granules[J].Journal of Agricultural and Food Chemistry,2014,62(31):7862-7868.
[9]CHAO C,YU J,WANG S,et al.Mechanisms underlying the formation of complexes between maize starch and lipids[J].Journal of Agricultural and Food Chemistry,2018,66(1):272-278.
[10]WANG S,COPELAND L.New insights into loss of swelling power and pasting profiles of acid hydrolyzed starch granules[J].Starch - Stärke,2012,64(7):538-544.
[11]LIN Q,LIANG R,ZHONG F,et al.Effect of degree of octenyl succinic anhydride (OSA) substitution on the digestion of emulsions and the bioaccessibility of β-carotene in OSA-modified-starch-stabilized-emulsions[J].Food Hydrocolloids,2018,84:303-312.
[12]RAPHAELIDES S N,GEORGIADIS N.Effect of fatty acids on the rheological behaviour of maize starch dispersions during heating[J].Carbohydrate Polymers,2006,65(1):81-92.
[13]DRIES D M,GOMAND S V,PYCARELLE S C,et al.Development of an infusion method for encapsulating ascorbyl palmitate in V-type granular cold-water swelling starch[J].Carbohydrate Polymers,2017,165:229-237.
[14]PUTSEYS J A,LAMBERTS L,DELCOUR J A.Amyloseinclusion complexes:Formation,identity and physico-chemical properties[J].Journal of Cereal Science,2010,51(3):238-247.
[15]SNAPE C E,MORRISON W R,MAROTO-VALER M M,et al.Solid state13C NMR investigation of lipid ligands in V-amylose inclusion complexes[J].Carbohydrate Polymers,1998,36(2):225-237.
[16]GARCIA M C,FRANCO C M L.Effect of glycerol monostearate on the gelatinization behavior of maize starches with different amylose contents[J].Starch-Stärke,2015,67(1-2):107-116.
[17]WANG L,WANG W,WANG Y,et al.Effects of fatty acid chain length on properties of potato starch-fatty acid complexes under partially gelatinization[J].International Journal of Food Properties,2018,21(1):2121-2134.
[18]SINGH J,LELANE C,STEWART R B,et al.Formation of starch spherulites:Role of amylose content and thermal events[J].Food Chemistry,2010,121(4):980-989.
[19]KIATPONGLARP W,RUGMAI S,ROLLAND-SABATÉ A,et al.Spherulitic self-assembly of debranched starch from aqueous solution and its effect on enzyme digestibility[J].Food Hydrocolloids,2016,55:235-243.
[20]BHOSALE R G,ZIEGLER G R.Preparation of spherulites from amylose-palmitic acid complexes[J].Carbohydrate Polymers,2010,80(1):53-64.
[21]CAI L,SHI Y C.Structure and digestibility of crystalline shortchain amylose from debranched waxy wheat,waxy maize,and waxy potato starches[J].Carbohydrate Polymers,2010,79(4):1117-1123.
[22]LESMES U,COHEN S H,SHENER Y,et al.Effects of long chain fatty acid unsaturation on the structure and controlled release properties of amylose complexes[J].Food Hydrocolloids,2009,23(3):667-675.
[23]DUYEN T T M,HUNG P V.Morphology,crystalline structure and digestibility of debranched starch nanoparticles varying in average degree of polymerization and fabrication methods[J].Carbohydrate Polymers,2021,256:117424.
[24]LI S,HUANG L,ZHANG B,et al.Fabrication and characterization of starch/zein nanocomposites with pH-responsive emulsion behavior[J].Food Hydrocolloids,2021,112:106341.
[25]CHANVRIER H,UTHAYAKUMARAN S,APPELQVIST I A M,et al.Influence of storage conditions on the structure,thermal behavior,and formation of enzyme-resistant starch in extruded starches[J].Journal of Agricultural and Food Chemistry,2007,55(24):9883-9890.
[26]WANG S,WANG J,YU J,et al.Effect of fatty acids on functional properties of normal wheat and waxy wheat starches:A structural basis[J].Food Chemistry,2016,190:285-292.
[27]DICKINSON E.Stabilising emulsion-based colloidal structures with mixed food ingredients[J].Journal of the Science of Food and Agriculture,2013,93(4):710-721.
[28]LI C,YUNXING L,SUN P,et al.Starch nanocrystals as particle stabilisers of oil-in-water emulsions[J].Journal of the Science of Food and Agriculture,2014,94:136-140.
[29]TIMGREN A,RAYNER M,DEJMEK P,et al.Emulsion stabilizing capacity of intact starch granules modified by heat treatment or octenyl succinic anhydride[J].Food Science & Nutrition,2013,1:157-71.
[30]LEAL-CASTAÑEDA E J,GARCÍA-TEJEDA Y,HERNÁNDEZSÁNCHEZ H,et al.Pickering emulsions stabilized with native and lauroylated amaranth starch[J].Food Hydrocolloids,2018,80:177-185.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。