玉米是全世界的主要粮食作物之一,我国播种面积3亿亩左右,年产量两亿多吨[1-2]。玉米蛋白粉是玉米淀粉加工生产过程的主要副产物,产量巨大。但由于玉米蛋白粉的水溶性差及直接利用的生物学价值低等原因,严重限制了其在食品工业中的应用,大多仅被当作饲料或废弃物[1-2]。因此开发玉米蛋白粉高效加工利用技术具有重要应用价值。玉米肽是玉米蛋白的水解产物,其具有易消化吸收、抗氧化等优良特性[3-5]。目前利用玉米蛋白制备玉米肽的方法主要包括化学法、酶解法和微生物发酵法[2-3],微生物发酵法产玉米肽,较之其他产肽方法(酶法和化学法),能修饰重组苦味基团,减少苦味,同时使玉米肽的抗氧化性、解酒、抗疲劳、降血压、抗炎、抗癌、抗糖尿病等功能得到更充分的发挥和应用[2,5-7],是一项具有广阔应用发展前景的玉米蛋白粉加工技术。我国在生物活性肽尤其在玉米肽研究上起步晚于欧美,但是近些年越来越受到关注和重视[2,5-6]。但微生物发酵玉米蛋白粉产功能肽的研究相比酶法等还处于早期研究阶段[2,6,8],面临适宜发酵微生物资源及其蛋白酶认识和开发不足、微生物种类较单一以及相应发酵工艺建立等亟待解决的问题。其中,筛选获得降解玉米蛋白粉能力强和具高效蛋白酶活性的菌株成为微生物发酵生产应用的基础和关键所在。
鉴于此,本研究从多种来源样品中,利用玉米蛋白粉固体筛培法和福林酚法等技术,分离筛选高蛋白酶活性的菌株;进行菌株鉴定及生长特性的研究,评价这些菌株的蛋白分解能力和可利用性能,为解决和提高微生物发酵玉米蛋白粉的高效微生物资源缺乏及发展应用技术奠定了基础。
1 材料方法
1.1 材料
玉米蛋白粉及分离所用传统发酵食品(酸奶、益生菌饮料、发酵面团等):市购;菌株基因组提取试剂盒(TIANamp Bacteria DNA Kit):北京天根生化科技有限公司;酪蛋白、福林酚:北京索莱宝科技有限公司;配制培养基的各种样品、试剂,均为国产分析纯:国药集团。
测定蛋白酶活的试剂:无水碳酸钠溶液、三氯乙酸溶液、磷酸缓冲液(pH分别为 4.5、7.2、9.3)。
菌株分离纯化采用 LB培养基:酵母提取物5.0 g、胰蛋白胨 10.0 g、NaCl 10.0 g、琼脂粉20.0 g、蒸馏水1.0 L、pH 7.0~7.5。
菌株筛选采用玉米蛋白粉培养基:玉米蛋白粉30 g、KH2PO4 3.0 g、K2HPO4 2.0 g、NH4Cl 0.1 g、MgSO4·7H2O 0.2 g、NaCl 5.0 g、蛋白胨 1.5 g、牛肉膏 0.6 g、琼脂 20.0 g、蒸馏水 1.0 L、pH 7.0~7.5。
玉米蛋白粉粉碎过 100目筛。以上培养基调节pH值后,灭菌条件为121℃,20 min。
1.2 实验仪器
pH计,FE20K:瑞士梅特勒–托利多(METTLER TOLEDO)公司;超净工作台,DL-CJ-1N:河南兄弟仪器设备有限公司;振荡培养箱,SHK-99-II:北京北方同正生物技术发展有限公司;微型旋涡仪,V2S02S:德国艾卡(IKA)公司;恒温水浴锅,SM-8D:南京舜玛仪器设备有限公司;酶标仪,SynergvHT,美国伯腾(BIOTEK)公司;台式高速冷冻离心机,EPPENDORF 5810R,德国艾本德 (EPPENDORF)公司;PCR仪,C1000 Touch:美国伯乐(BIORAD)。
1.3 实验方法
1.3.1 菌株分离纯化
分离采用传统平板涂布法。将样品悬液适当的稀释,取一定量的稀释液放在无菌的 LB琼脂平板上,然后用无菌刮刀把稀释液均匀地涂布在培养基表面上,30 ℃恒温培养,观察挑取单个菌落。
纯化采用平板划线法。利用无菌接种环取菌株培养物少许在平板上进行划线。经培养后,划线上的单个细胞形成纯的单菌落。
1.3.2 菌株初筛
菌株纯化菌液10~20 μL接种到玉米蛋白粉平板筛选培养基的无菌滤纸片上或空孔中(直径均为0.5 cm),放入30 ℃恒温培养箱中培养72 h,每隔 12 h观察测定菌落周围透明圈的大小。
1.3.3 菌株蛋白酶活性测定复筛
初筛后出现水解透明圈的菌株进行复筛。接种待测菌株于 LB液体培养基中,在 37 ℃,150 r/min条件下振荡培养后,接种于玉米蛋白粉基础发酵液培养基中,在37 ℃,150 r/min条件下发酵培养48 h后,离心(4 000 r/min,10 min),取上清液为待测样品,测定蛋白酶活性。按照福林酚试剂法测定发酵液中上清液的蛋白酶活性(GB/T 28715—2012饲料添加剂酸性、中性蛋白酶活力的测定,SB/T 10317—1999蛋白酶活力测定法)。
1.3.4 序列分析和菌种鉴定
将分离纯化后的细菌菌株接种到 LB液体培养基中,在37 ℃,170 r/min的条件下振荡培养48 h,再利用细菌基因组试剂盒提取基因组DNA。采取试剂盒抽提得到细菌DNA后,通过PCR扩增16S rDNA,配置50 μL的反应体系,细菌16S rDNA引物为27F和1492R。PCR循环程序为:95 ℃预变性 5 min,95 ℃ 30 s,52 ℃ 30 s,72 ℃90 s,30个循环;72 ℃延伸10 min。扩增得到的细菌PCR产物送至上海生工生物科技有限公司测序,测序的长度在1 400 bp左右。采用DNAMAN软件序列图谱对测序结果进行人工校对拼接,拼接后的序列在 NCBI核酸序列数据库中进行同源序列搜索比对。根据同源序列搜索结果,选取测试菌株关系较近的模式菌株的16S rDNA序列区序列,Bioedit比对后用 MEGA X 软件采取 ML法构建系统发育树,可靠性检验bootstrap法,初始值1 000次。系统发育树中本研究测得的序列号为MW090728-MW090784,Genbank中下载用于比对分析做系统发育树的序列有 MH997645、MK993455、KY129662、MN227492、MT539148、MT039450、MK629812、MN209912、MN733170、NR_104873、KM234223、FJ613555、MN865799、MK990073、MT457707、NR_042254、MH734924、MN204064。
1.3.5 菌株生长特性研究
生长曲线。采用LB培养基,30 ℃测定菌株生长曲线。YTSS培养基,每隔 4 h取样一次测OD600值。
生长温度。配置LB培养基,2%接种量,在温度梯度 4~70 ℃培养,测定菌株生长的温度范围及最适生长温度。
生长pH。配置LB培养基,2%接种量,调配培养基pH 2~12,测定菌株生长的pH范围及最适生长pH。
2 结果与讨论
2.1 样品菌株分离纯化、菌株初筛及菌种鉴定
从各种传统发酵食品(酸奶、益生菌饮料、发酵面团等样品中共分离菌株405株,其中通过玉米蛋白粉平板筛选培养基初筛出现透明水解圈菌株58株,透明水解圈一般经过48 h培养后根据不同菌株情况陆续出现,部分菌株透明水解圈图片见图1,菌株透明圈(H/C)值最大可达4.2,多数在1.5~2.5之间。提取能够产生透明水解圈菌株的基因组DNA,PCR扩增16s rDNA序列,并测序获得高质量序列信息,通过NCBI BLAST比对确定菌株分类地位。结果显示筛选获得的细菌归属于4科,5属,17种,2个亚种。丰度最高为芽孢杆菌属Bacillus,具体见分类表1。菌株之间的系统发育进化树见图2。
表1 分离菌株筛选鉴定结果
Table 1 NCBI blast identification of isolated strains

分离菌号 分离物鉴定 相似性/%CGM1(3) Bacillus tequilensis 99 CGM4(2) Bacillus albus 100 CGM6(12) Bacillus amyloliquefaciens 99.8 CGM18(5) Bacillus cereuss 99 CGM23 Bacillus halotolerans 100 CGM24(5) Bacillus licheniformis 99 CGM29 Bacillus mojavensis 99 CGM30 Bacillus proteolyticus 100 CGM31(10) Bacillus subtilis 99.9 CGM41 Bacillus subtilis subsp.inaquosorum 99 CGM42(2) Bacillus subtilis subsp.qingdao 100 CGM44 Bacillus thuringiensis 100 CGM45 Bacillus tropicus 99.8 CGM46(7) Bacillus velezensis 99 CGM53 Enterococcus faecalis 98 CGM54(2) Enterococcus faecium 99.8 CGM56 Paenibacillus glucanolyticus 99.3 CGM57 Lactobacillus plantarum 99 CGM58 Planomicrobium chinense 99
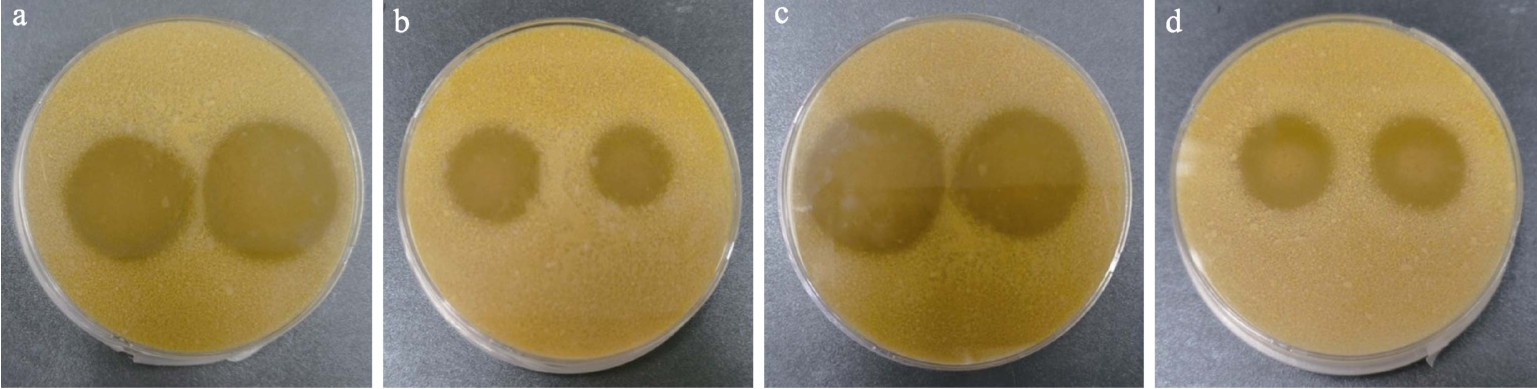
图1 玉米蛋白粉固体筛选培养基菌株水解透明圈图
Fig.1 Hydrolytic transparent circles of microbial strains of corn gluten meal screening medium
注:a.左为菌株CGM1,右为菌株CGM40;b.左为菌株CGM8,右为菌株CGM4;c.左为菌株CGM32,右为菌株CGM48;d.左为菌株CGM6,右为菌株CGM46.
a.left: CGM1, right: CGM40; b.left: CGM8, right: CGM4; c.left: CGM32, right: CGM48; d.left: CGM6, right: CGM46.
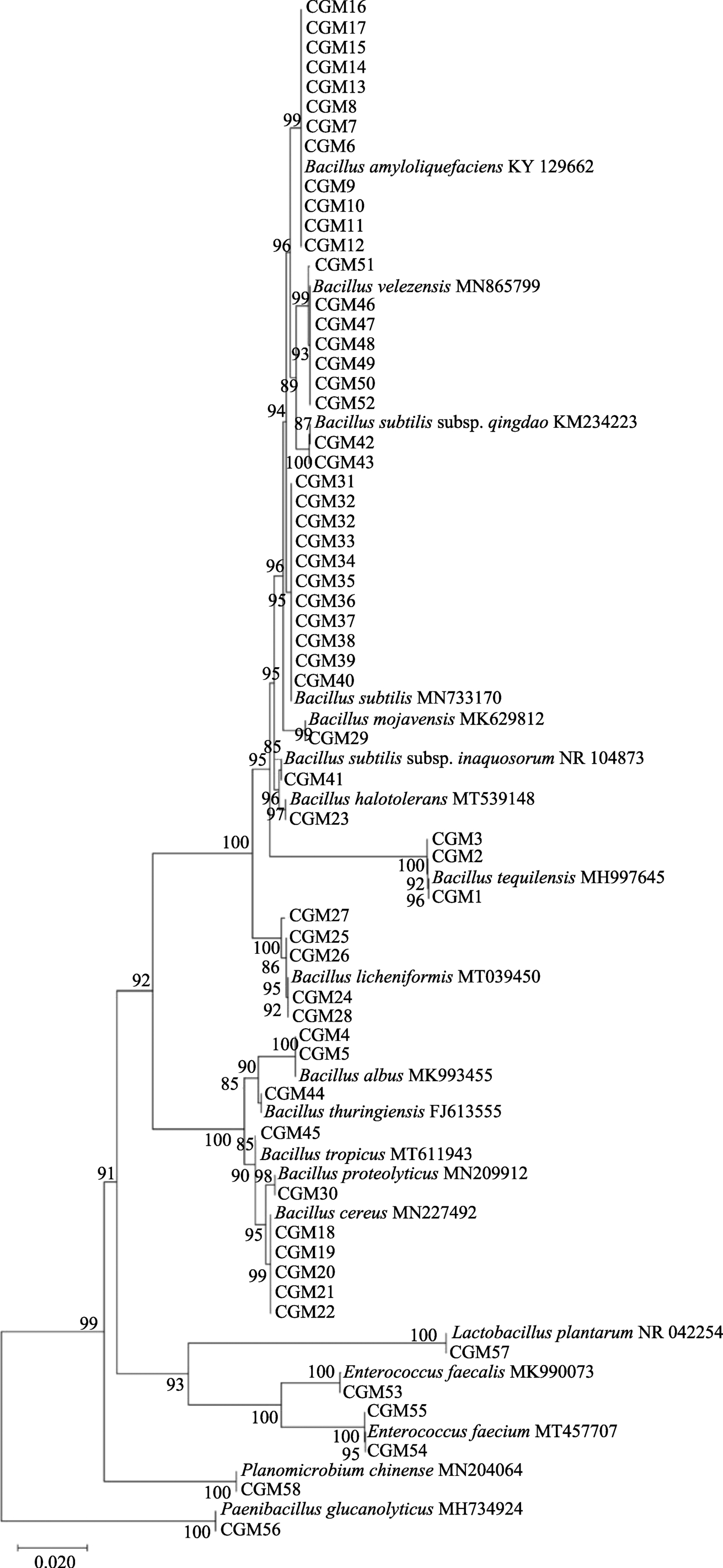
图2 菌株16S rDNA序列构建的系统发育树
Fig.2 Phylogenetic tree based on 16S rDNA sequence of microbial strains
目前,常见的产蛋白酶微生物包括枯草芽孢杆菌、米曲霉、黑曲霉等[1,7,9]。微生物发酵菌种的选择标准一般有菌种繁殖速度快而稳定、分泌酶能力强、耐受性强等[1,2,5,7]。本研究中分离菌株数目最多的为芽孢杆菌。芽孢杆菌既可以产生中性蛋白酶,又可以产碱性蛋白酶[1],并且被收录在我国食品目录上,是比较安全可靠的菌种。枯草芽孢杆菌(Bacillus subtilis),是常见的一种芽孢杆菌,分布广泛,能够帮助动物免疫器官发育,提升抗体和免疫球蛋白的水平,增强免疫力,还能够合成多种维生素类,并能合成脂肪酶、纤维素酶、α-淀粉酶、蛋白酶等酶类[1,5,7,10]。
研究中还发现了地衣芽孢杆菌(Bacillus licheniformis),该菌亦属于芽孢杆菌属。应用价值广泛,能够净化水质、降解毒害物质,调整肠道菌群及肠道功能,也能够提高生物体免疫力,拮抗病原菌等,并具有较强的蛋白酶、脂肪酶、纤维酶活性[11-12]。贝莱斯芽孢杆菌(Bacillus velezensis)在农业上有促进植物生长和抵御病原微生物作用,具有广谱抗菌活性,并且用于开发生物药剂潜力巨大[13]。乳酸菌广泛用于乳制品、肉制品、水产品和果蔬产品等发酵,还可产生抑菌活性的代谢产物,作为生物保护菌[14],本研究也有分离到。
值得注意的是中华游动微菌(Planomicrobium chinense)最早分离自我国海岸沉积物[15],本研究分离自发酵海产品,而建立该属的模式种韩国游动微菌(Planomicrobium koreense),也是分离自韩国传统发酵海产品[16],也有该属种分离自章鱼肠道并报道具有蛋白酶活性[17]。
2.2 菌株蛋白酶活性测定复筛
筛选得到的58株菌株的碱性、中性、酸性蛋白酶活性测定结果见表 2。从研究结果可看出筛选获得的菌株中性蛋白酶活性和碱性蛋白酶活性普遍高于酸性蛋白酶活性,并且碱性蛋白酶活性普遍较高,一般大于60 U/mL,大于90 U/mL的有8株,分离到的芽孢杆菌、乳酸菌、游动微菌等都表现出较高的蛋白酶活性,显示出巨大的碱性蛋白酶资源潜力。
表2 菌株蛋白酶活性测定表
Table 2 Protease activity of microbial strains U/mL
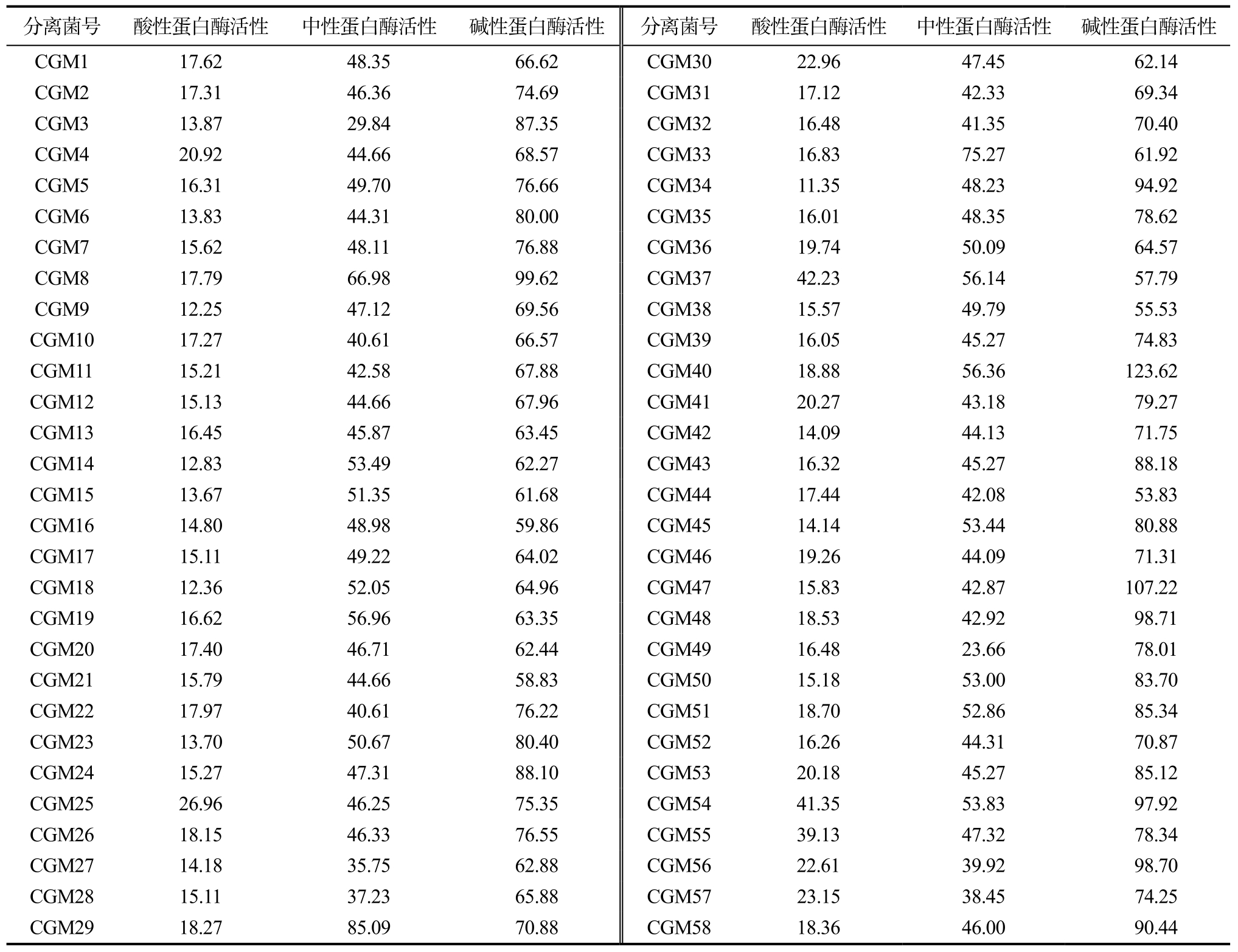
分离菌号 酸性蛋白酶活性 中性蛋白酶活性 碱性蛋白酶活性 分离菌号 酸性蛋白酶活性 中性蛋白酶活性 碱性蛋白酶活性CGM1 17.62 48.35 66.62 CGM30 22.96 47.45 62.14 CGM2 17.31 46.36 74.69 CGM31 17.12 42.33 69.34 CGM3 13.87 29.84 87.35 CGM32 16.48 41.35 70.40 CGM4 20.92 44.66 68.57 CGM33 16.83 75.27 61.92 CGM5 16.31 49.70 76.66 CGM34 11.35 48.23 94.92 CGM6 13.83 44.31 80.00 CGM35 16.01 48.35 78.62 CGM7 15.62 48.11 76.88 CGM36 19.74 50.09 64.57 CGM8 17.79 66.98 99.62 CGM37 42.23 56.14 57.79 CGM9 12.25 47.12 69.56 CGM38 15.57 49.79 55.53 CGM10 17.27 40.61 66.57 CGM39 16.05 45.27 74.83 CGM11 15.21 42.58 67.88 CGM40 18.88 56.36 123.62 CGM12 15.13 44.66 67.96 CGM41 20.27 43.18 79.27 CGM13 16.45 45.87 63.45 CGM42 14.09 44.13 71.75 CGM14 12.83 53.49 62.27 CGM43 16.32 45.27 88.18 CGM15 13.67 51.35 61.68 CGM44 17.44 42.08 53.83 CGM16 14.80 48.98 59.86 CGM45 14.14 53.44 80.88 CGM17 15.11 49.22 64.02 CGM46 19.26 44.09 71.31 CGM18 12.36 52.05 64.96 CGM47 15.83 42.87 107.22 CGM19 16.62 56.96 63.35 CGM48 18.53 42.92 98.71 CGM20 17.40 46.71 62.44 CGM49 16.48 23.66 78.01 CGM21 15.79 44.66 58.83 CGM50 15.18 53.00 83.70 CGM22 17.97 40.61 76.22 CGM51 18.70 52.86 85.34 CGM23 13.70 50.67 80.40 CGM52 16.26 44.31 70.87 CGM24 15.27 47.31 88.10 CGM53 20.18 45.27 85.12 CGM25 26.96 46.25 75.35 CGM54 41.35 53.83 97.92 CGM26 18.15 46.33 76.55 CGM55 39.13 47.32 78.34 CGM27 14.18 35.75 62.88 CGM56 22.61 39.92 98.70 CGM28 15.11 37.23 65.88 CGM57 23.15 38.45 74.25 CGM29 18.27 85.09 70.88 CGM58 18.36 46.00 90.44
2.3 菌株生长特性研究
通过前面的菌株分离纯化、初筛和蛋白酶活测定复筛,综合透明圈大小、酶活高低、菌株种类等因素,选出8株菌株进行了生长特性研究。8株菌的生长曲线见图3,生长温度曲线见图4,生长 pH曲线见图 5。生长曲线中(图 3),菌株的生长可分为两大类,一类菌株CGM54、CGM40、CGM47、CGM48、CGM8在生长48 h左右达到峰值,另一类菌株CGM58、CGM56、CGM34在生长80 h左右达到峰值。生长最适温度一般在30~40 ℃(图 4)。生长最适 pH 一般在 7~9(图 5)。

图3 菌株生长曲线图
Fig.3 Growth curves of microbial strains
注:a.CGM58; b.CGM54; c.CGM40; d.CGM48; e.CGM47; f.CGM56; g.CGM8; h.CGM34.

图4 菌株生长温度图
Fig.4 Growth temperature curves of microbial strains
注:a.CGM58; b.CGM54; c.CGM40; d.CGM48; e.CGM47; f.CGM56; g.CGM8; h.CGM34.
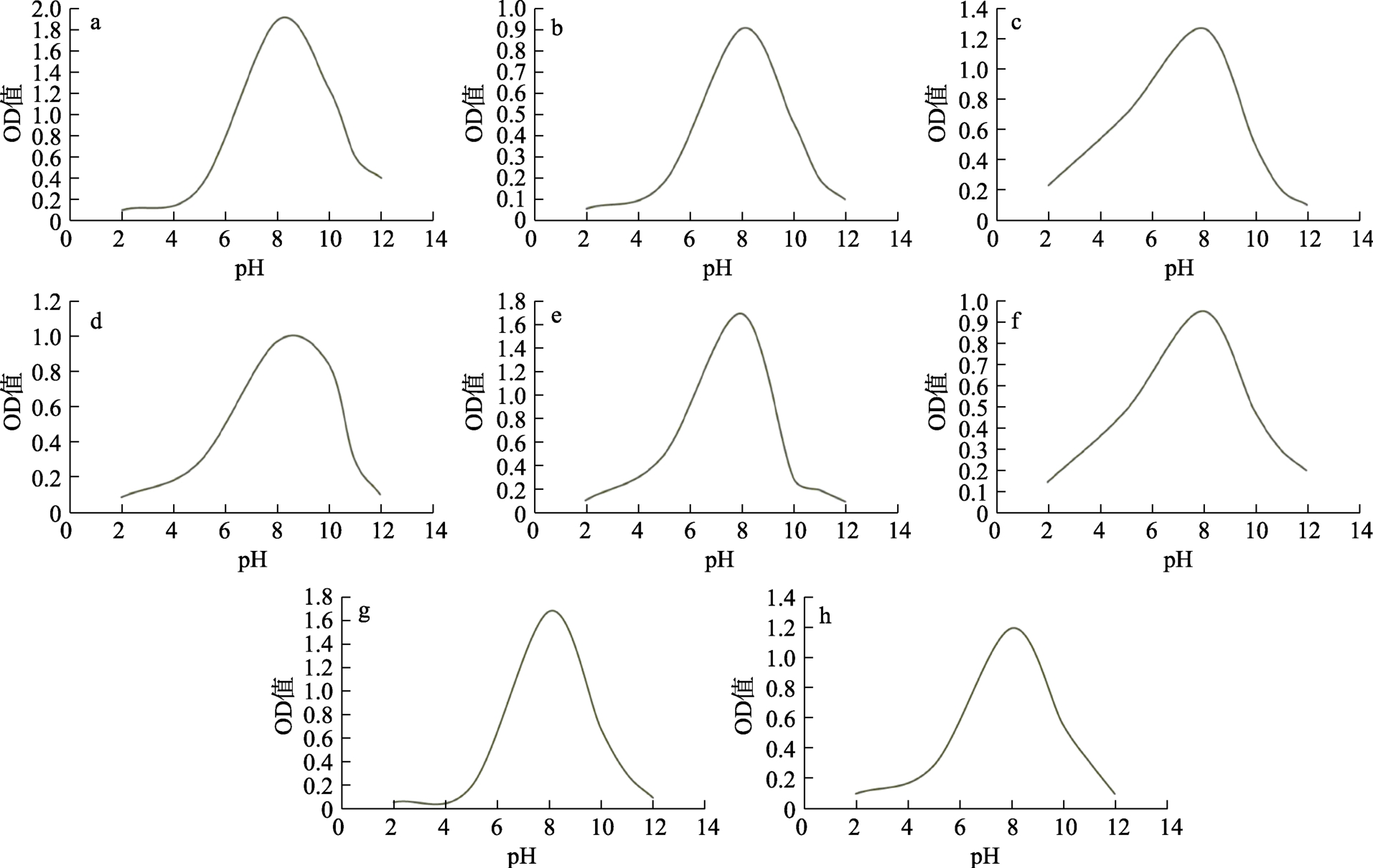
图5 菌株生长pH图
Fig.5 Growth pH curves of microbial strains
注:a.CGM58; b.CGM54; c.CGM40; d.CGM48; e.CGM47; f.CGM56; g.CGM8; h.CGM34.
本研究中生长特性也表现出菌株特异性,不同菌株间存在显著差异。细菌的生长繁殖一般包括四个阶段,迟缓期、对数期、稳定期和衰亡期。大部分筛选菌株在接种后几个小时内可进入快速的指数生长期,少数菌株则有缓慢适应生长阶段后,再进入指数生长期;培养菌株的指数生长期的持续时间也存在不同。例如CGM34和CGM40,16S rDNA序列比对都鉴定为枯草芽孢杆菌(Bacillus subtilis),但其生长曲线存在较大差异。生长温度、生长最适温度、生长pH及生长最适pH等和已报道的同类别菌株基本一致[1,13,15,16],如中华游动微菌(Planomicrobium chinense)被报道在10~45 ℃生长,最适生长温度为30~35 ℃,生长pH 5~10,生长最适pH 6~7[15]。菌株的生长特性研究十分重要,生长特性条件将为后续微生物发酵工艺的优化和生产利用等提供参考和基础。
3 结论
筛选高效降解玉米蛋白粉的微生物菌株,是目前的重要研究领域。本研究分离筛选了高产蛋白酶菌株,从各种样品中共分离菌株405株,其中通过玉米蛋白粉平板筛选培养基初筛出现透明水解圈菌株58株,确定了菌株的系统分类地位;并结合菌株分离纯化、初筛和蛋白酶活测定复筛,综合透明圈大小、酶活高低、菌株种类等因素,选出8株菌株进行了生长特性研究,菌株一般生长最适温度一般在30~40 ℃,生长最适pH一般在7~9。蛋白酶活及生长特性等具有菌株特异性。本研究扩展丰富了后续微生物发酵玉米蛋白粉得到玉米肽的微生物菌株资源及微生物蛋白酶源,增加了微生物种类。后续将利用筛选菌株进行玉米蛋白粉微生物发酵产玉米肽的研究和优化发酵工艺的探索,为玉米蛋白粉的增值和综合利用提供理论和技术基础。
[1] 王雨婷, 缪礼鸿, 周风鸣, 等.一株高效降解玉米蛋白粉枯草芽孢杆菌的筛选及其发酵特性研究[J].饲料工业, 2017,38(21): 49-56.WANG Y T, MIAO L H, ZHOU F M, et al.An efficient degradation of corn gluten meal Bacillus subtilis screening and fermentation characteristics research[J].Feed Industry, 2017,38(21): 49-56.
[2] 李艳娟, 李书国.玉米生物活性肽的制备及功能和食品的研究进展[J].粮食与饲料工业, 2014, 12(6): 41-44.LI Y J, LI S G.Research progress on preparation and biological activity of bioactive peptides derived from corn gluten and its functional foods[J].Cereal & Feed Industry, 2014, 12(6): 41-44.
[3] 曹慧英, 柴媛, 肖志刚, 等.玉米活性肽的研究进展[J].食品安全质量检测学报, 2019, 10(19): 6587-6591.CAO H Y, CHAI Y, XIAO Z G, et al.Research progress of corn active peptide[J].Journal of Food Safety & Quality, 2019,10(19): 6587-6591.
[4] 徐艳阳, 朱志红, 李晴, 等.纳豆菌发酵玉米蛋白粉制备玉米肽工艺优化[J].食品研究与开发, 2014, (19): 75-79.XU Y Y, ZHU Z H, LI Q, et al.Optimization of fermentation process for polypeptide from corn protein powder via Bacillus Natto[J].Food Research and Development, 2014, (19): 75-79.
[5] ZHU B, HE H, HOU T.A comprehensive review of corn protein-derived bioactive peptides: production, characterization,bioactivities, and transport pathways[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18: 329-345.
[6] SHINSUKE M, HIROMI l.TOSHIYUID K.Structures and activity of angiotensin converting enzyme iuhittor in an zein hydrolysate[J].Agricultural and Biological Chemistry, 1991,55(3): 1313-1318.
[7] LI G, LIU W, WANG Y, et al.Functions and applications of bioactive peptides from corn gluten meal[M].Advances in food and nutrition research.Academic Press, 2019, 87: 1-41.
[8] 李艳娟, 李书国.玉米生物活性肽制备、功能及其保健食品研究[J].粮食与油脂, 2014, 27(6): 13-16.LI Y J, LI S G.Research progress on preparation and biological activity of bioactive peptides derived from corn gluten and its health foods.Cereals & Oils, 2014, 27(6): 13-16.
[9] JIANG X, CUI Z C, WANG L H, et al.Production of bioactive peptides from corn gluten meal by solid-state fermentation with Bacillus subtilis MTCC5480 and evaluation of its antioxidant capacity in vivo[J].LWT-Food science and technology, 2020,doi: 10.1016/j.lwt.2020.109767
[10] 程洪斌, 刘晓桥, 陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J].上海农业学报, 2006, 22(1): 109-112.CHENG H B, LIU X Q, CHEN H M.Research advance in controlling plant fungous diseases by Bacillus subtilis[J].Acta Agriculturae Shanghai, 2006, 22(1): 109-112.
[11] 余祖华, 丁轲, 孙侯奎, 等.产纤维素酶地衣芽孢杆菌的诱变选育及其产酶条件优化[J].中国畜牧兽医, 2016, 43(4):1006-1011.YU Z H, DING K, SUN H K, et al.Mutation breeding and optimization of enzyme-producing condition of Bacillus lichenniformis producing cellulase[J].China Animal Husbandry& Veterinary Medicine, 2016, 43(4): 1006-1011.
[12] 顾真荣, 马承铸, 韩长安.产几丁质酶芽孢杆菌对病原真菌的抑菌作用[J].上海农业学报, 200l, 17(4): 88-92.GU Z R, MA C Z, HAN C A.Inhibitory action of chitinase producing Bacillus spp.to pathogenic fungi[J].Acta Agriculturae Shanghai, 200l, 17(4): 88-92.
[13] 蔡高磊, 张凡, 欧阳友香, 等.贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J].北方园艺, 2018, 12: 162-167.CAI G L, ZHANG F, OUYANG Y X, et al.Research Progress on Bacillus velezensis[J].Northern Horticulture, 2018, 12: 162-167.
[14] 吕懿超, 李香澳, 王凯博, 等.乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J].食品科学, 2020, doi:10.7506/spkx1002-6630-20200620-279.LV Y C, LI X A, WANG K B, et al.Antimicrobial mechanism of lactic acid bacteria as bioprotective bacteria and their application in Food Industry: A Review[J].Food Science, 2020, doi:10.7506/spkx1002-6630-20200620-279.
[15] DAI X, WANG Y N, WANG B J, et al.Planomicrobium chinense sp.nov., isolated from coastal sediment, and transfer of Planococcus psychrophilus and Planococcus alkanoclasticus to Planomicrobium as Planomicrobium psychrophilum comb.nov.and Planomicrobium alkanoclasticum comb.nov[J].International Journal of Systematic and Evolutionary Microbiology, 2005, 55:699-702.
[16] YOON J H, KANG S S, LEE K C, et al.Planomicrobium koreense gen.nov., sp.nov., a bacterium isolated from the Korean traditional fermented seafood jeotgal, and transfer of Planococcus oke anokoites (Nakagawa et al.1996) and Planococcus mcmeekinii (Junge et al.1998) to the genus Planomicrobium[J].International Journal of Systematic and Evolutionary Microbiology, 2001, 51: 1511-1520.
[17] 金玉兰, 王玉荣.产蛋白酶菌Planomicrobium sp.L-2发酵条件的优化[J].化学与生物工程, 2014, 31(11): 34-39.JIN Y L, WANG Y R.Optimization of fermentation conditions of a protease-producing strain Planomicrobium sp.l-2[J].Chemistry & Bioengineering, 2014, 31(11): 34-39.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/index.axpx)、中国知网、万方、维普、超星等数据库下载获取。