燕麦(Avena sativa L.)是我国传统粮食之一,也称莜麦。与其他谷物相比,燕麦中的膳食纤维、脂肪酸、多酚等营养成分的含量更高[1]。麸皮是燕麦加工中的主要副产物。由于燕麦质地柔软且脂质含量相对较高,胚乳不易分离干净,导致燕麦麸皮中含大量的淀粉和蛋白质[1]。燕麦中的蛋白质、β-葡聚糖、矿物质等营养成分多集中在麸皮部分,因此与燕麦相比,燕麦麸皮可富集除淀粉外的其他营养素[2-3],其中 β-葡聚糖的含量更高。β-葡聚糖可降低血清胆固醇水平,因为 β-葡聚糖可增加肠内物质的粘度,延缓胃排空速率并抑制食物、消化酶以及胆汁盐的混合和运输,同时可干扰胆汁盐的肠肝循环,促进肝脏将胆固醇转化为胆汁酸[4-5]。
发酵工艺历史悠久,具有改善食品营养价值、增加风味以及延长保质期的作用[6]。丝状真菌通常具有安全性好,在发酵过程中可以产生纤维素酶、蛋白酶、淀粉酶以及β-葡萄糖苷酶,促进发酵底物中营养成分的溶解和提取[7-8]。红曲米(又称:红曲)是我国常用的一种食品着色剂,由稻米经红曲霉(Monascus purpureus Went.)发酵而成。莫纳可林K(Monacolin K)是红曲霉发酵过程中产生的主要次级代谢产物。其中莫纳可林K,又称洛伐他汀(Lovastation),可抑制 HMG-CoA还原酶活性,从而阻止生物体内胆固醇的合成,是一种广泛使用的处方药物[9-10]。红曲色素属于氮杂菲酮类化合物,以呈现黄色、橙色、红色的色素为主[11-12],动物实验结果表明安卡红曲黄素(Ankaflavin)可降低血清中总甘油三酯水平,具有一定的降脂作用[13]。
高胆固醇血症是发展为心血管疾病(CVD)的重要因素之一,但是服用他汀类药物具有多种副作用[14],利用饮食疗法应对危险因素(如血清胆固醇水平升高)已成为预防CVD的关键方法。
本研究将红曲米粉与燕麦麸皮粉混合后进行半固体发酵,以莫纳可林 K、β-葡聚糖、红曲色素为评价指标。比较不同发酵条件下燕麦麸红曲发酵产物中降脂成分含量的差异,明确发酵条件与降脂成分含量的关系,优化红曲米粉混合发酵燕麦麸皮的条件。
1 材料与方法
1.1 实验材料
燕麦麸皮:山西众一农业发展有限公司提供;功能性红曲粉:西安金硕果业有限公司。
1.2 实验试剂
β-葡聚糖试剂盒:爱尔兰 Megazyme公司;莫纳可林K:Sigma-Aldrich公司;甲醇、乙腈:Fisher试剂有限公司;磷酸:上海麦克林Macklin公司;实验所用水均为去离子水;其他试剂均为国产分析纯。
1.3 实验设备
HZQ-100型恒温震荡培养箱:太仓市实验设备厂;YXQ-SG46-280A型(立式)高压蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;CJ-1D型超净工作台:天津市泰斯特仪器有限公司;WFZUV-2100型紫外可见分光光度计:尤尼克上海仪器有限公司;ODS-C18柱(250 mm×4.6 mm×5 μm)和1260 Infinity II型高效液相色谱仪:安捷伦科技有限公司。
1.4 实验方法
1.4.1 混合发酵产物的制备
称取90 g水、10 g燕麦麸皮于锥形瓶中,混合均匀,121 ℃、0.12 MPa灭菌20 min,冷却至室温后加入红曲粉,于 160 r/min、30 ℃的条件下发酵,冻干后得燕麦红曲混合发酵产物。
1.4.2 混合发酵的单因素确定
通过单因素实验确定不同发酵条件对混合发酵产物的影响,每组实验重复三次。发酵时间对发酵的影响:在红曲粉添加量为10 g、未调节水的pH值(pH = 6.7)的条件下,分别发酵24、48、72 和96 h;发酵用水的pH值对发酵的影响:在红曲粉添加量为10 g,发酵72 h的条件下,通过1 mol/L HCl调节水的pH值分别为4.0、5.0、6.0以及6.7(未调节pH值);红曲粉添加量对发酵的影响:在未调节水的pH值(pH = 6.7)的条件下,红曲粉添加量分别为5、10、15和20 g,发酵72 h。
1.4.3 水分的测定
根据GB 5009.3—2016《食品中水分的测定》对样品的水分进行测定[15]。
1.4.4 β-葡聚糖的测定
发酵前后燕麦麸红曲混合物中 β-葡聚糖的含量采用 Megazyme β-葡聚糖含量检测试剂盒进行测定,设置试剂空白组、葡萄糖对照组以及样品组,具体方法参考试剂盒的使用说明书。
1.4.5 莫纳可林K的测定
根据汪静[16]等的方法并略作修改,利用高效液相色谱法(HPLC)对样品中两种结构的莫纳可林K进行测定。
标准品对照液的配制:先配制 0.200 mg/mL的标准品储备液于4 ℃储存,实验时加入甲醇将内酯型、酸型储备液分别稀释成 40.0 μg/mL、20.0 μg/mL的标准品对照液,过滤后备用。
样品溶液的配制:称取0.2 g过筛(60目)后的样品于10 mL容量瓶中,加7 mL甲醇摇匀,超声40 min,冷却后加甲醇定容,再超声20 min使样品充分溶解后定容。3 500 r/min,20 ℃条件下离心10 min。用0.22 μm 微孔滤膜过滤,待测。
按照汪静[16]等的HPLC条件进行测定,其中样品进样量为10 μL,两种构型的莫纳可林K标准品对照液进样量依次为10、20、30和40 μL。
1.4.6 红曲色素的测定
参考Pattanagul等[17]的方法测定发酵产物中色素的含量,利用95%乙醇(v/v)提取样品中色素后,通过分光光度计分别在400、470和500 nm处测量黄色、橙色以及红色可溶性色素提取物水平。
1.4.7 桔霉素的测定
根据GB 5009.222—2016《食品中桔青霉素的测定》对样品中的桔霉素进行测定[18]。
1.5 数据分析
所用实验数据以均值 ± 标准差(Mean ± SD)表示,通过SPSS 21.0进行数据处理,利用单因素方差分析(ANOVA)进行不同组别间的比较,Duncan分析进行事后比较。其中P < 0.05时认为具有显著性差异。
2 结果与分析
2.1 发酵时间对发酵产物有效降脂成分的影响
混合发酵是红曲霉利用燕麦麸皮提供的碳源生长并产生次级代谢产物的过程,因此发酵时间对发酵产物中有效降脂成分有重要影响。莫纳可林K可竞争性抑制HMG-CoA还原酶活性,包括内酯型(闭环结构)和酸型(开环结构)两种同分异构体[19]。由表1可知,发酵时间对混合发酵产物中酸型莫纳可林K几乎没有影响,但对于内酯型莫纳可林K具有显著影响(P < 0.05),在96 h后可由1.77 mg/g增加至3.11 mg/g,总莫纳可林K最高可提升至发酵前的1.6倍。利用提取液在不同波长时的吸光度值可表示不同颜色红曲色素含量。经不同时间发酵后,混合物中三种色素含量由大到小排序均为:黄色色素>红色色素>橙色色素(见表2),这与Pattanagul等[17]在研究不同红曲霉菌种对发酵后产生红曲色素影响时的结果一致。三种色素的含量在48 h后与发酵前相比均具有显著性(P < 0.05)且在96 h后具有最大值。微生物对不同碳源的利用具有一定选择性,可分为速效碳源和迟效碳源[20]。由图1可知,在前 48 h内 β-葡聚糖的含量无显著性变化,而在72 h后 β-葡聚糖含量显著降低(P < 0.05),96 h后降幅更达约77%。这是因为发酵过程中葡聚糖被酶解,时间越长,酶解越充分。根据发酵产物中三种有效降脂成分含量的分析,选定 72 h为最佳发酵时间。这一条件下,莫纳可林K高于报道的数值[21]。
表1 不同发酵时间对莫纳可林K含量的影响
Table 1 The influence of different fermentation time on monacolin K content
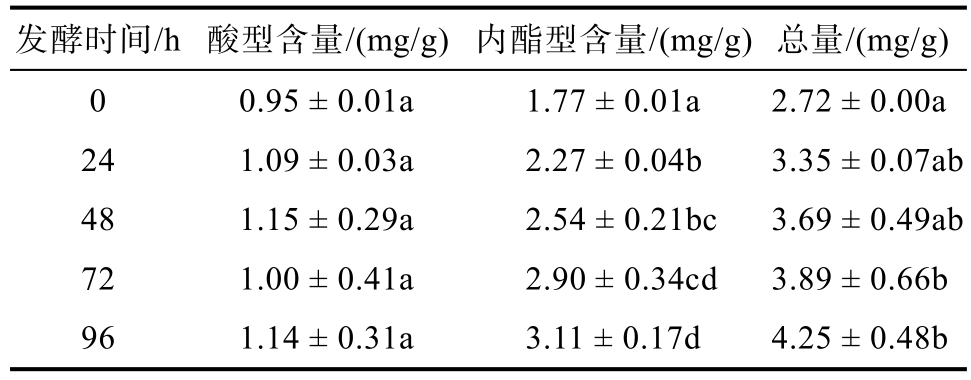
注:酸型含量、内酯型含量、总量依次表示酸型莫纳可林K含量、内酯型莫纳可林K含量、总莫纳可林K含量。同一列中英文字母不同者具有显著性差异(P < 0.05)。
发酵时间/h酸型含量/(mg/g)内酯型含量/(mg/g) 总量/(mg/g)0 0.95 ± 0.01a 1.77 ± 0.01a 2.72 ± 0.00a 24 1.09 ± 0.03a 2.27 ± 0.04b 3.35 ± 0.07ab 48 1.15 ± 0.29a 2.54 ± 0.21bc 3.69 ± 0.49ab 72 1.00 ± 0.41a 2.90 ± 0.34cd 3.89 ± 0.66b 96 1.14 ± 0.31a 3.11 ± 0.17d 4.25 ± 0.48b
表2 不同发酵时间对红曲色素含量(吸光度值)的影响
Table 2 The influence of different fermentation time on Monascus pigment content (absorbance value)

注:400、470和500 nm分别对应红曲黄色色素、橙色色素和红色色素在400、470和500 nm处的吸光度;总量表示三种不同颜色红曲色素吸光度之和。同一列中英文字母不同者具有显著性差异(P < 0.05)。
发酵时间/h 400 nm 470 nm 500 nm 总量0 9.52 ± 0.03a 5.77 ± 0.20a 7.13 ± 0.27a 22.42 ± 0.45a 24 10.25 ± 0.09ab 5.68 ± 0.06a 7.10 ± 0.09a 23.03 ± 0.19a 48 11.41 ± 0.65bc 6.46 ± 0.27b 7.82 ± 0.27b 25.69 ± 0.82b 72 12.13 ± 1.21c 6.98 ± 0.36c 8.46 ± 0.39c 27.58 ± 1.81b 96 13.68 ± 0.20d 7.29 ± 0.08c 8.84 ± 0.22c 29.81 ± 0.26c
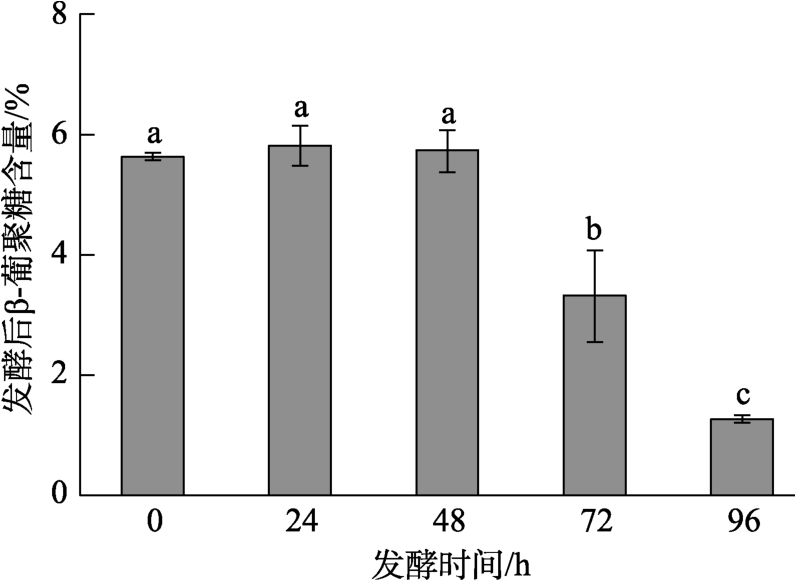
图1 不同发酵时间对β-葡聚糖含量的影响
Fig.1 The influence of different fermentation time on β-glucan content
注:英文字母不同者具有显著性差异(P < 0.05)。
2.2 发酵用水的pH值对发酵产物中有效降脂成分的影响
调整发酵用水的 pH值可改变微生物的膜结构以及细胞质膜的通透性,进而影响物质的吸收和释放,最终导致微生物代谢发生改变[22]。由于燕麦麸中含有大量的膳食纤维,加水后膳食纤维吸水导致粘度明显增加,另行调整物料的 pH值变得非常困难。所以在混匀燕麦麸皮时加入不同pH的发酵用水,以研究不同发酵用水pH对发酵产物的影响。实验表明,改变发酵用水的 pH值对酸型、内酯型以及总莫纳可林K含量没有显著影响,pH = 6.7时总莫纳可林K的含量最高(见表 3)。由表 4,发酵用水的 pH值仅对红曲橙色色素影响较大,pH = 6.7(即未调节pH值)时橙色色素含量有明显增加(P < 0.05),且此时色素总量最高。由图 2可知,在未调节发酵用水 pH值时,β-葡聚糖的含量最低(P < 0.05)。调节发酵用水的pH值对红色素和莫纳可林的影响不大,而对燕麦麸皮中葡聚糖影响较大。添加pH5的水时葡聚糖含量最高(葡聚糖基本未降解,与原料麸皮中的葡聚糖差异不显著),而发酵用水的 pH增加到6或者降低为4时,虽然与pH5没有显著性差异,但在数值上有所下降。而 pH进一步增加到7时,葡聚糖明显下降,这与卢颖的结论一致。可能是因为燕麦在一定的酸性条件下,葡聚糖水解酶被抑制,具有一定的缓冲作用[23]。因此,选择在发酵时不调整发酵用水的pH值。
表3 不同发酵用水pH对莫纳可林K含量的影响
Table 3 The influence of different pH of fermentation water on monacolin K content (mg/g)
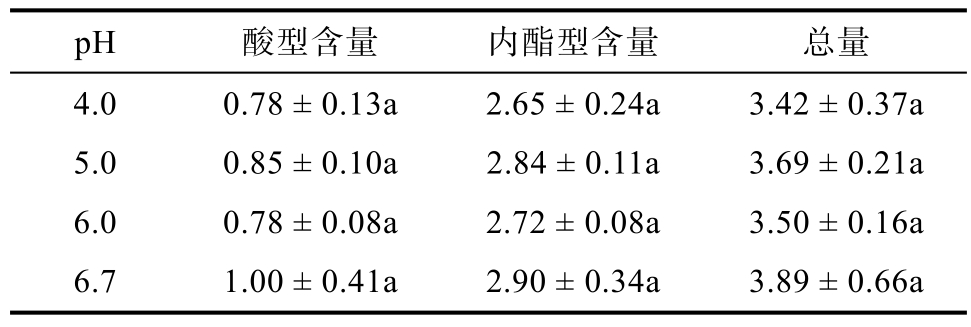
注:酸型含量、内酯型含量、总量依次表示酸型莫纳可林K含量、内酯型莫纳可林K含量、总莫纳可林K含量。同一列字母不同者具有显著性差异(P < 0.05)。
pH 酸型含量 内酯型含量 总量4.0 0.78 ± 0.13a 2.65 ± 0.24a 3.42 ± 0.37a 5.0 0.85 ± 0.10a 2.84 ± 0.11a 3.69 ± 0.21a 6.0 0.78 ± 0.08a 2.72 ± 0.08a 3.50 ± 0.16a 6.7 1.00 ± 0.41a 2.90 ± 0.34a 3.89 ± 0.66a
表4 不同发酵用水pH对红曲色素含量(吸光度值)的影响
Table 4 The influence of different pH of fermentation water on Monascus pigment content (absorbance value)
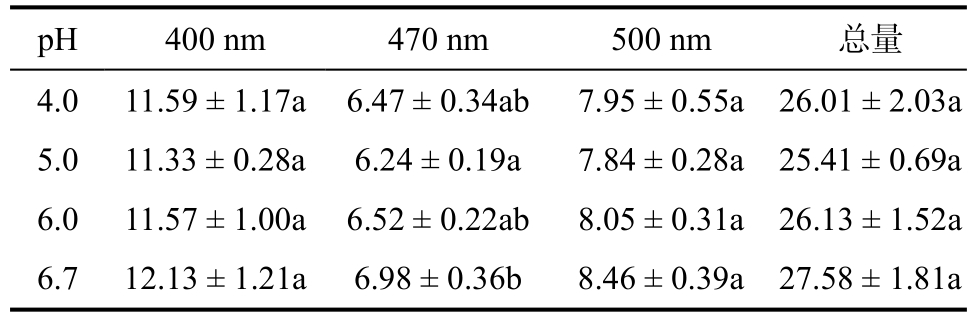
注:400、470和500 nm分别对应红曲黄色色素、橙色色素和红色色素在400、470和500 nm处的吸光度;总量表示三种不同颜色红曲色素吸光度之和。同一列中英文字母不同者具有显著性(P < 0.05)。
pH 400 nm 470 nm 500 nm 总量4.0 11.59 ± 1.17a 6.47 ± 0.34ab 7.95 ± 0.55a 26.01 ± 2.03a 5.0 11.33 ± 0.28a 6.24 ± 0.19a 7.84 ± 0.28a 25.41 ± 0.69a 6.0 11.57 ± 1.00a 6.52 ± 0.22ab 8.05 ± 0.31a 26.13 ± 1.52a 6.7 12.13 ± 1.21a 6.98 ± 0.36b 8.46 ± 0.39a 27.58 ± 1.81a

图2 不同发酵用水pH对β-葡聚糖含量的影响
Fig.2 The influence of different pH of fermentation water on β-glucan content
注:英文字母不同者具有显著性差异 (P < 0.05)。
2.3 红曲粉添加量对发酵产物中有效降脂成分的影响
红曲粉添加量决定发酵过程中红曲霉的接种量。接种量过少时,发酵周期长;接种量过高时不利于次级代谢产物的累积,而且造成资源的浪费。根据发酵前混合物中莫纳可林K的含量可计算发酵后混合物莫纳可林K的相对增加量。由表5可知,随红曲粉添加量增加,发酵产物中总莫纳可林K含量上升,但相对增加量下降。添加量大于10 g时,总莫纳可林K含量显著上升(P <0.05)。红曲色素的总量与相对添加量的变化趋势与莫纳可林K一致,说明在低添加量时发酵进程的效率较高(表6)。当红曲粉添加量为5 g时,培养基中的燕麦麸皮被充分利用,β-葡聚糖的含量仅为0.25%(图3);当添加量的范围为10 ~ 20 g时,β-葡聚糖的含量均为3%左右,与谭友莉[24]对市售青稞红曲中β-葡聚糖含量(2.64% ~ 3.35%)检测的结果相接近。利用免疫亲和柱法对此条件下的样品中桔霉素的含量进行测定,未检出说明安全性有一定保证。
表5 不同红曲粉添加量对莫纳可林K含量的影响
Table 5 The influence of different additive amount of Monascus powder on monacolin K content
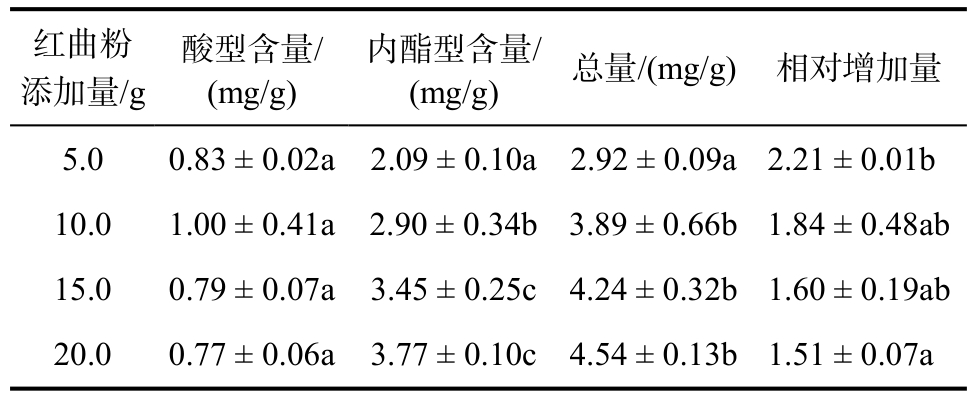
注:酸型含量、内酯型含量、总量依次表示酸型莫纳可林K含量、内酯型莫纳可林K含量、总莫纳可林K含量;相对增加量=(发酵后混合物中总莫纳可林K含量–发酵前混合物中总莫纳可林K含量)/发酵前混合物中总莫纳可林K含量。同一列中英文字母不同者具有显著性差异(P < 0.05)。
红曲粉添加量/g酸型含量/(mg/g)内酯型含量/(mg/g) 总量/(mg/g) 相对增加量5.0 0.83 ± 0.02a 2.09 ± 0.10a 2.92 ± 0.09a 2.21 ± 0.01b 10.0 1.00 ± 0.41a 2.90 ± 0.34b 3.89 ± 0.66b 1.84 ± 0.48ab 15.0 0.79 ± 0.07a 3.45 ± 0.25c 4.24 ± 0.32b 1.60 ± 0.19ab 20.0 0.77 ± 0.06a 3.77 ± 0.10c 4.54 ± 0.13b 1.51 ± 0.07a
表6 不同红曲粉添加量对红曲色素含量(吸光度值)的影响
Table 6 The influence of different additive amount of Monascus powder on Monascus pigment content (absorbance value)
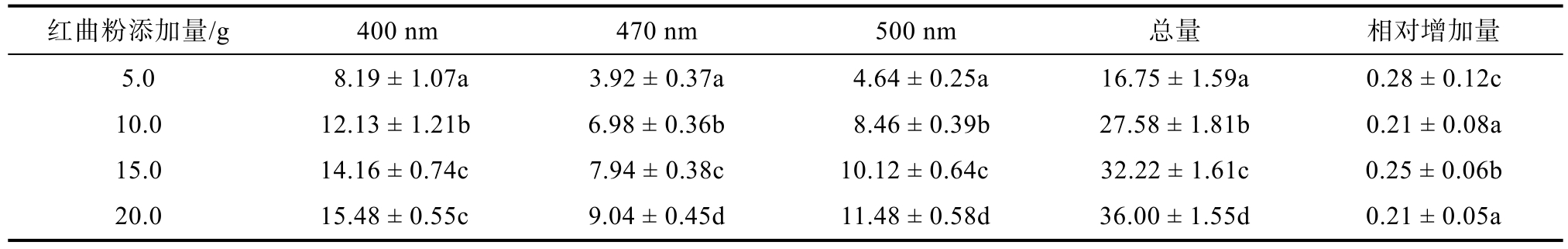
注:400、470和500 nm分别对应红曲黄色色素、橙色色素和红色色素在400、470和500 nm处的吸光度;总量表示三种不同颜色红曲色素吸光度之和。同一列中英文字母不同者具有显著性差异(P < 0.05)。相对增加量=(发酵后混合物中总红曲色素含量–发酵前混合物中总红曲色素含量)/发酵前混合物中总红曲色素含量。同一列中英文字母不同者具有显著性差异(P < 0.05)。
红曲粉添加量/g 400 nm 470 nm 500 nm 总量 相对增加量5.0 8.19 ± 1.07a 3.92 ± 0.37a 4.64 ± 0.25a 16.75 ± 1.59a 0.28 ± 0.12c 10.0 12.13 ± 1.21b 6.98 ± 0.36b 8.46 ± 0.39b 27.58 ± 1.81b 0.21 ± 0.08a 15.0 14.16 ± 0.74c 7.94 ± 0.38c 10.12 ± 0.64c 32.22 ± 1.61c 0.25 ± 0.06b 20.0 15.48 ± 0.55c 9.04 ± 0.45d 11.48 ± 0.58d 36.00 ± 1.55d 0.21 ± 0.05a
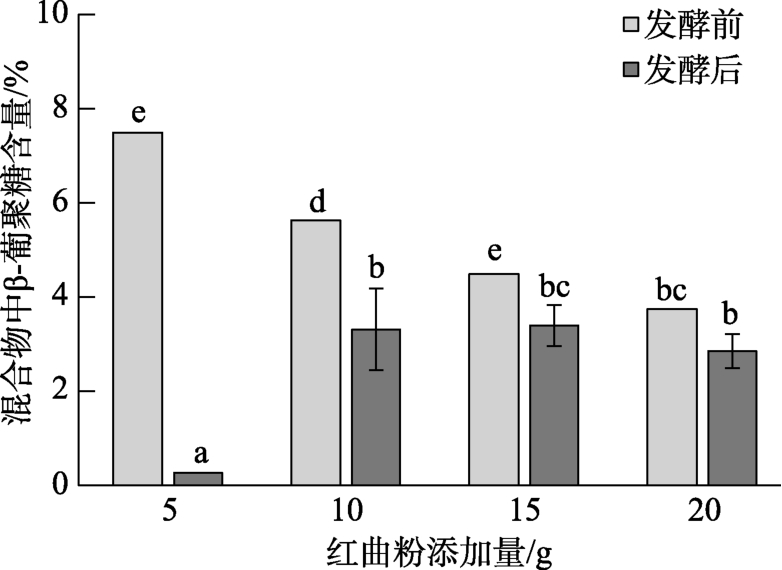
图3 不同红曲粉添加量对β-葡聚糖含量的影响
Fig.3 The influence of different additive amount of Monascus powder on β-glucan content
注:英文字母不同者具有显著性差异(P < 0.05)。
3 讨论与结论
莫纳可林 K是美国食品药品监督管理局(USFDA)批准的一类降脂处方药物,是红曲发酵产物中的重要降脂成分。且进一步研究表明,当发酵产物中莫纳可林K含量相近时,高红曲色素含量的产物降脂效果更好[13]。同时,燕麦麸皮富含葡聚糖,也是应用较广泛的降脂成分。不过,红曲发酵过程通常在提高莫纳可林含量的同时伴随着葡聚糖含量因水解而降低。本研究以提升莫纳可林含量的同时尽可能控制葡聚糖水解为目标,通过调节发酵时间、发酵用水pH、红曲粉添加量的单因素实验,确定了燕麦麸皮与红曲粉混合发酵的优化条件。结果表明,在不调节发酵用水的pH值时,加入10 g红曲粉发酵72 h可得到同时具有较高含量的莫纳可林,葡聚糖和红色素的发酵产物。在此条件下,发酵产物中既含有高含量的β-葡聚糖(3.31%),同时莫纳可林K、红曲色素分别提升至3.76 mg/g、27.58,且此条件下的燕麦麸与红曲粉发酵产物中的桔霉素含量低于国家标准。莫纳可林,葡聚糖和红色素的降脂机理与效率都有不同,包含了这三种成分的红曲燕麦麸皮的降脂效果还有待于进一步验证,并以降脂效果为主要指标进行发酵条件的进一步优化,是我们今后的研究目标。
[1] GRUNDY M M, FARDET A, TOSH S M, et al.Processing of oat: the impact on oat's cholesterol lowering effect[J].Food &Function, 2018, 9(3): 1328-1343.
[2] SCHAR M Y, CORONA G, SOYCAN G, et al.Excretion of avenanthramides, phenolic acids and their major metabolites following intake of oat bran[J].Molecular Nutrition & Food Research, 2017, 62(2): 1700499.
[3] IZYDORCZYK M S, MCMILLAN T, BAZIN S, et al.Milling of Canadian oats and barley for functional food ingredients: Oat bran and barley fibre-rich fractions[J].Canadian Journal of Plant Science, 2014, 94(3): 573-586.
[4] GUNNESS P, GIDLEY M J.Mechanisms underlying the cholesterol-lowering properties of soluble dietary fibre polysaccharides[J].Food & Function, 2010, (1): 149-155.
[5] PURNIMA G, JORIS M, LYNN V, et al.Reduction in circulating bile acid and restricted diffusion across the intestinal epithelium are associated with a decrease in blood cholesterol in the presence of oat-glucan[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2016, 30(12): 4227-4238.
[6] CHAVES L, CLEMENCIA, SERIO A, et al.Traditional fermented foods and beverages from a microbiological and nutritional perspective: The Colombian heritage[J].Comprehensive Reviews in Food Science & Food Safety, 2014, 13(5): 1031-1048.
[7] BENOIT-GELBER I, GRUNTJES T, VINCK A, et al.Mixed colonies of Aspergillus niger and Aspergillus oryzae cooperatively degrading wheat bran[J].Fungal Genetics & Biology, 2017, 102:31-37.
[8] LONDOŇO-HERNÁNDEZ L, RAMÍREZ-TORO C, RUIZ H A, et al.Rhizopus oryzae- Ancient microbial resource with importance in modern food industry[J].International Journal of Food Microbiology, 2017, 257: 110-127.
[9] SURAIYAS, KIM J H, TAK J Y, et al.Mevinolin, citrinin and pigments of adlay angkak fermented by Monascus sp.[J].LWT -Food Science and Technology, 2018, 92: 1-9.
[10] DIKSHIT R, TALLAPRAGADA P.Statistical optimization of lovastatin and confirmation of nonexistence of citrinin under solid-state fermentation by Monascus sanguineus[J].Journal of Food and Drug Analysis, 2016, 24: 433-440.
[11] ZHANG L, LI Z, DAI B, et al.Effect of submerged and solid-state fermentation on pigment and citrinin production by Monascus purpureus[J].Acta Biologica Hungarica, 2013, 64(3):385-394.
[12] LIAN X, LIU L, DONG S, et al.Two new Monascus red pigments produced by Shandong Zhonghui Food Company in China[J].European Food Research & Technology, 2015, 240: 719-724.
[13] LEE C L, KUNG Y H, WU C L, et al.Monascin and Ankaflavin act as novel hypolipidemic and high-density lipoprotein cholesterol-raising agents in red mold dioscorea[J].Journal of Agricultural and Food Chemistry, 2010, 58(16): 9013-9019.
[14] HIGASHIKAWA F, NODA M, AWAYA T, et al.Reduction of serum lipids by the intake of the extract of garlic fermented with Monascus pilosus: A randomized, double-blind, placebo-controlled clinical trial[J].Clinical Nutrition, 2012, 31(2): 261-266.
[15] 食品中水分的测定: GB 5009.3—2016[S].北京:中华人民共和国国家卫生和计划生育委员会, 2016.Determination of moisture in food: GB 5009.3—2016[S].Beijing: National Health and Family Planning Commission of the People's Republic of China, 2016.
[16] 汪静.HPLC法同时测定红曲中两种构型洛伐他汀的含量[J].浙江中西医结合杂志, 2014(3): 273-274.WANG J.Simultaneous determination of lovastatin in two configurations of red yeast by HPLC[J].Zhejiang Journal of Integrated Chinese and Western Medicine, 2014, (3): 273-274.
[17] PATTANAGUL P, PINTHONG R, PHIANMONGKHOL A, et al.Mevinolin, citrinin and pigments of adlay angkak fermented by Monascus sp.[J].International Journal of Food Microbiology,2008, 126(1-2): 20-23.
[18] 食品中桔青霉素的测定: GB 5009.222—2016[S].北京: 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局, 2016.Determination of penicillin in food: GB 5009.222—2016[S].Beijing: National Health and Family Planning Commission of the People's Republic of China, State Food and Drug Administration,2016.
[19] 高红.不同稻米基质对红曲重要代谢产物影响的研究[D].天津科技大学, 2015.GAO H.Effects of different substrates on the important metabolites of red yeast rice[D].Tianjin University of Science and Technology, 2015.
[20] 龚光禄, 桂阳, 卢颖颖, 等.红托竹荪培养基及培养条件优化[J].贵州农业科学, 2015, 43(11): 74-82.GONG G L, GUI Y, LU Y Y, et al.Optimization of medium and cultural conditions of Dictyophora rubr ovolvata[J].Guizhou Agricultural Science, 2015, 43(11): 74-82.
[21] PYO Y H, SEO S Y.Simultaneous production of natural statins and coenzyme Q10 by Monascus pilosus fermentation using different solid substrates[J].Food Science & Biotechnology,2010, 19(6): 1635-1641.
[22] 张云开, 符唐科, 梁树华.一株产纤溶酶的耐盐微生物的筛选及发酵条件研究[J].轻工科技, 2014, 6: 24-26.ZHANG Y K, FU T K, LIANG S H.Screening and fermentation conditions of a salt-tolerant microbe producing fibrinolytic enzyme[J].Journal of Light Industry, 2014, 6: 24-26.
[23] 卢颖.红曲霉固态发酵燕麦功能成分的生物转化[D].华南理工大学, 2016.LU Y.Biotransformation of functional components in oats by solid-state fermentation of Monascus spp[D].South China University of Technology, 2016.
[24] 谭友莉.青稞红曲化学成分与质量标准的初步研究[D].成都中医药大学, 2015.TAN Y L.Preliminary Study on chemical composition and quality standard of highland barley Monascus[D].Chengdu University of Traditional Chinese Medicine, 2015.