目前,在食品安全风险监测任务中,存在样品种类多,检测项目多样化而标准适用范围单一的问题,标准不适用于规定检测任务的现象,可能会存在含有违禁成分或是添加剂超出 GB2760—2014《食品安全国家标准 食品添加剂使用标准》规定的最大使用限量标准要求而检不出的隐患。现行有效的合成着色剂测定标准有 4个:GB5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》、SN/T4457—2016《出口饮料、冰淇淋等食品中 11种合成着色剂的检测 液相色谱法》、DBS52/023—2017《食品安全地方标准 食品中13种水溶性合成着色剂的测定》、GB/T21916—2008《水果罐头中合成着色剂的测定 高效液相色谱法》。GB5009.35—2016标准范围适用于饮料、配制酒、硬糖、蜜饯、淀粉软糖、巧克力豆及着色糖衣制品中合成着色剂的测定,由于谷类食品中淀粉吸附色素的特性,该标准不适用于玉米渣、玉米片、黑米、挂面等制品中合成着色剂的测定。SN/T4457—2016适用于果汁、碳酸饮料、冰淇淋中 11种合成着色剂的测定,DBS52/023—2017规定了馒头、面条中13种合成着色剂的测定,GB/T21916—2008规定了水果罐头中8种合成着色剂的测定。这四个标准范围均不包含风险监测任务中的样品种类,并且按照标准中的提取方法提取的样品在净化环节会有损失,导致测定结果偏低,加标回收率低不满足 GB/T27404—2008《实验室质量控制规范 食品理化检测》质控要求。
食用小苏打,有效成分为碳酸氢钠,主要用于食品、饮料汽水和冷饮中二氧化碳的发生剂,还用作洗涤剂,由于碳酸氢钠有较高的解吸能力,可用作溶出剂[1]。碳酸氢钠在食品工业中的研究也有报道,例如,用植物汁液和碳酸氢钠腌渍可以提高乳山羊肉的烧烤品质[2];同时,碳酸氢钠还可以应用于天然色素的提取工艺中,有研究表明,茶叶在30 ℃条件下浸提30 min,碳酸氢钠用量为10 g/L条件下,可以有效提取茶叶中的茶色素[3]。
日落黄、苋菜红、胭脂红、诱惑红和亮蓝,均为水溶性偶氮类着色剂,易溶于水,溶于甘油及丙二醇,不溶于油脂,都具有耐酸性[4]。目前国内外研究色素的样品种类多,既有天然色素提取与测定的研究,也有合成着色剂的测定研究。如不同葡萄品种中花青素和酚类化合物的提取[5],酸奶中合成着色剂的提取[6],火锅调味品中胭脂红、苋菜红、诱惑红、日落黄等水溶性色素和其他脂溶性色素的测定[7],软饮料、糕点和方便面中栀子黄的测定[8],鱼制品中日落黄、苋菜红和诱惑红等着色剂的测定[9]。色素的测定方法主要有液相色谱法[10]、液相–电喷雾质谱法[11]、RamTracer-200-HS拉曼光谱仪分析法[12]、紫外可见分光光度测定法[13]。有关合成着色剂的提取试剂主要为氨化甲醇溶液[14]、乙醇–乙腈–氨水[15-16]、氨化乙醇溶液[17],这些提取试剂的共同点都是碱性条件,不足之处是氨水溶液味道刺激,有机试剂用量大。
为了简化食品中合成着色剂提取工艺,提高加标回收率,本研究以大米粉、小米、玉米粉、发糕、玉米窝头、荞麦挂面、玉米片、玉米糁子为实验样品,采用碱性溶液体系提取离心后,阴离子交换柱进行净化,25%氨水甲醇洗脱,制成水溶液,注入高效液相色谱质谱仪进行定量分析,完善谷类食物中合成着色剂检测体系。
1 材料与方法
1.1 试验材料
小米、发糕、玉米窝头、荞麦挂面、玉米片、玉米糁子、食用小苏打:宁夏银川超市或市场;分析检测用质控样品:广州谱恩科学仪器有限公司;甲醇、乙腈(色谱级):Fisher Scientific 公司;异丙醇、甲酸(色谱级)、氨水(分析纯)、乙酸铵(优级纯):天津市光复精细化工研究所;吐温20(化学纯)、丙三醇、1,2-丙二醇(分析纯):成都市科龙化工试剂厂;乙醇(分析纯):安徽安特食品股份有限公司;Strata X-AW SPE:美国Phenomenex公司;标准品日落黄、苋菜红、胭脂红、诱惑红和亮蓝(0.50 mg/mL):中国计量科学研究院。
1.2 仪器设备
Agilent 1290 Infinity II液相色谱-6470三重四极杆质谱联用仪,配有 ESI离子源:美国Agilent公司;HU401K-超声波清洗器:天津恒奥;HMG-D24氮吹仪:北京华安麦科生物技术有限公司;GL-20G-C高速冷冻离心机:上海安亭科学仪器厂;RV 10 Control旋转蒸发仪:德国IKA公司;QL-901旋涡混合器:海门市其林贝尔仪器制造有限公司;Perten 3100实验磨:瑞典波通仪器公司。
1.3 试验方法
1.3.1 样品中色素的提取
采用锤式旋风磨将干燥后的样品粉碎至细度为100目的粉末状样品。称取样品5.00 g于离心管中,添加1.00 g食用小苏打作为辅助提取剂,加入 30 mL 40%的甲醇水溶液,涡旋混合提取5 min,提取完毕后在 4 000 r/min条件下离心5 min,收集上清液,重复提取3次,将收集的上清液合并混匀。
1.3.1.1 提取试剂优化 取六份玉米粉各5.0 g,按1:6的比例加入提取液,添加1.0 g小苏打作为辅助提取试剂,分别以V(甘油)/V(乙醇)=5∶95、V(1,2丙二醇)/V(无水乙醇)=10∶90、V(25%氨水)/V(甲醇)=5∶95、V(甲醇)/V(氨水)/V(水)=80∶2∶18、V(氨水)/V(乙醇)=1∶99和V(甲醇)/V(氨水)=40∶60为提取试剂,提取后测定加标回收率。
1.3.1.2 小苏打的添加量 取六份玉米粉各5.0 g,按 1∶6的比例加入提取液,分别添加小苏打量为:0、0.2、0.4、0.6、0.8、1.0、2.0、5.0 g,提取后测定加标回收率。
1.3.1.3 pH值对净化工艺的影响 A组:中性环境(pH值=7),即净化柱活化后用水平衡,保持中性环境;B组:碱性环境(pH值=12),即净化柱活化后用 2%氨水平衡;C组:酸性环境(pH值=2.6),即净化柱活化后用 2%甲酸水平衡,保持酸性环境。
1.3.2 提取液的固相萃取柱净化
先后加1 mL甲醇、1 mL水活化固相萃取柱Strata X-AW SPE,在加1 mL 2%甲酸水溶液平衡净化柱,滤液均弃去;取1 mL样品提取液加入净化柱,弃去滤液;加入1 mL 2%甲酸水溶液淋洗固相萃取柱,弃去滤液,将小柱抽干。加1 mL 25%氨水甲醇溶液洗脱固相萃取柱,控制流速,确保洗脱液逐滴下落,收集洗脱液;将收集的洗脱液采用氮吹方式吹干;用1 mL的去离子水复溶,涡旋混合1 min,待样品充分溶解,将样品溶液过0.22 μm亲水性针式过滤器,待上机分析。
1.3.3 HPLC-MS/MS分析条件
采用Agilent SB-C18色谱柱(2.1 mm×100 mm,1.8 μm),柱温为 30 ℃,以乙腈(A)、0.01 mol/L乙酸铵水溶液(B)为流动相,梯度洗脱(0~2 min,95%B→80%B;2~3min,80%B→50%B;3~6 min,50%B→60%B,6~6.1 min,60%B→95%B,保持4 min),流速 0.3 mL/min,进样量为 5 μL。采用电喷雾(electrospray ionization,ESI)负离子模式,扫描方式为多反应检测(multiple reaction monitoring,MRM),毛细管电压3.5 kV,干燥器温度350 ℃,干燥器流速8 L/min,鞘气温度250 ℃,鞘气流速10 L/min,喷嘴电压为1 500 V。测定5种合成着色剂的质谱参数见表1。
表1 5种合成着色剂的质谱参数
Table 1 Mass spectrometry parameters of five dyes

着色剂 tR/min 相对分子质量/Mz母离子/(m/z)子离子/(m/z)碰撞电压/V 509.2 13 429.1 24胭脂红 1.097 562.49 537.1 302.4 26 456.9 31 317.1 34苋菜红 1.208 604.47 537.4 302.1 39 327.2 29日落黄 2.414 452.38 407.2 207.2 34 371.5 25诱惑红 2.868 496.43 451.4 207.1 36 667.0 41亮蓝 3.508 792.86 747.6 561.0 46
1.3.4 标准曲线的制作
配制10 μg/mL的单一标准储备液,4 ℃冰箱保存。日落黄、苋菜红、胭脂红、诱惑红和亮蓝分别取 10、20、40、60、80、100、120、140 μL于 2 mL样品瓶,用去离子水定容配制成混标溶液,配制浓度分别为 0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 μg/mL的系列梯度溶液,经 0.22 μm微孔滤膜过滤后进行色谱分析。
1.3.5 方法精密度
将600 ng/mL的5种合成着色剂标准混合溶液用方法1.3.3连续进样6次,根据测定量计算其相对标准偏差(RSD)。
1.3.6 加标回收率
为了评价方法的准确度,进行了添加回收率实验。选择小米、玉米糁子、发糕、玉米窝头、荞麦挂面五种不同基质的食物样品,加入日落黄、苋菜红、胭脂红、诱惑红和亮蓝5种待研究的合成着色剂,加标水平分别为1、2和10 μg/g,每个加标水平分别进行6个平行试验。
1.4 数据处理方法
数据和图表处理采用Excel软件处理。
2 结果与分析
2.1 提取试剂的优化
针对谷类物质易吸附色素的特点,提取过程中,既要观察所采用的试剂对色素的提取程度,又要考虑提取液的清澈程度。如图1所示,采用V(甲醇)/V(氨水)=40∶60溶液连续提取合成着色剂,加标回收率在 80%~120%范围,符合GB/T27404—2008《实验室质量控制规范食品理化检测》标准对加标回收率的规定。因此,小苏打添加在 V(甲醇)/V(氨水)=40∶60的提取试剂中可以充分提取合成着色剂。

图1 采用不同的提取试剂对5种合成着色剂加标回收率的影响
Fig.1 Effects of different extraction reagents on the recoveries of 5 synthetic colorants
2.2 小苏打的添加量对提取率的影响
目标物在水相中的溶解度通常随离子强度的增加而降低。有研究表明:NaCl、NaNO3、KCl和Na2CO3对可提高色素的萃取率,强度顺序为:KCl>NaCl>NaNO3>Na2CO3[13]。另一方面,随着介质离子强度的增加,水溶液的粘度和密度也增加,导致传质效率降低[18]。Rawikan Kachangoon[19]研究了 NaCl、Na2SO4、Na2CO3和 CH3COONa对水、土壤和尿液样本中烟碱类杀虫剂的萃取率影响,结果表明在峰面积上,加入Na2SO4可以提高萃取效率。为了研究离子强度对萃取方法的影响,优化小苏打的添加量。结果表明:当小苏打添加量增至2 g时,小苏打会吸附亮蓝。当小苏打添加量增至5 g时,小苏打会吸附一些红色素。测试结果如图2所示,当小苏打的添加量为0 g时,5种合成着色剂的加标回收率均低于 60%,随着小苏打的添加量增大,加标回收率升高,而当小苏打添加量为2.0 g和5.0 g时,部分色素加标回收率降低。考虑经济效益及检测结果的准确性,选取最优小苏打添加量为1.0 g。因此,在合成着色剂的提取过程中加入食用小苏打有助于合成着色剂分布于提取溶液中,但是加入过多的小苏打导致样品溶液粘度增加,使合成着色剂分子更难扩散到提取试剂溶液中。

图2 小苏打的添加量对5种合成着色剂回收率的影响
Fig.2 Effect of the adding amount of sodium bicarbonate on recovery of 5 synthetic colorants
2.3 pH值对净化工艺中样品富集率的影响
Andrade等[20]采用Sep-pack C18分离纯化软饮料中的苋菜红,也有聚酰胺、凝胶渗透色谱(GPC)、PWAX及Strata X-AW SPE等固相萃取柱的研究报道[21]。净化工艺也会影响加标回收率,Strata X-AW是弱阴离子交换官能团化聚合物吸附剂,可完整保留pKa小于5的酸性化合物,本研究采用Strata X-AW固相萃取柱纯化样品,如图3显示,样品提取液通过SPE后,A组液体含有颜色,固相萃取柱表面有淡淡的颜色;B组液体颜色明显,固相萃取柱表面无颜色变化;C组液体无颜色,固相萃取柱表面明显有颜色富集。测试结果如图 3所示:在酸性环境中使用 Strata X-AW SPE净化样品,加标回收率高,与现有研究结果一致[15,17]。
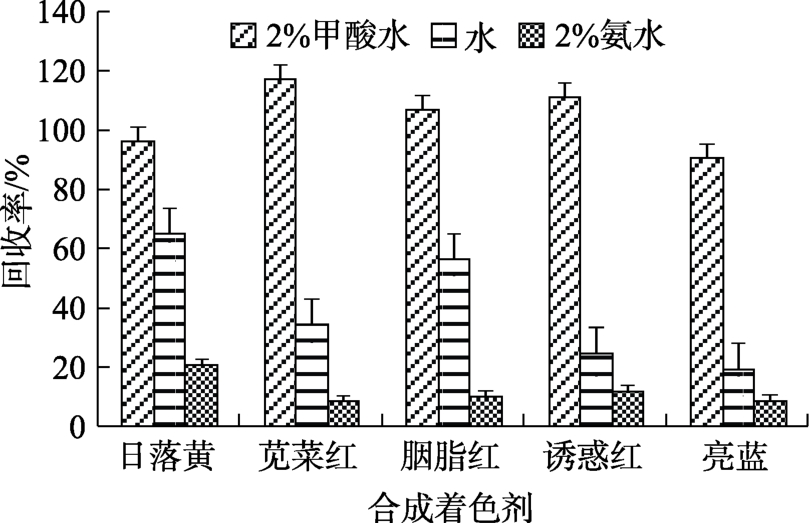
图3 pH对样品合成着色剂回收率的影响
Fig.3 Effect of pH on recovery of 5 synthetic colorants
2.4 小苏打对合成着色剂的富集作用
采用添加有小苏打的40%甲醇水溶液提取谷类食品中的着色剂,在酸性条件下通过固相萃取柱净化,固相萃取柱表面有显著的颜色富集,并且弃去的滤液无色。而未添加小苏打的40%甲醇水溶液提取液通过固相萃取柱净化时,弃去的滤液有明显的颜色,根据加标回收率测试试验结果显示,在酸性环境中,含有小苏打的合成色素提取液更容易被固相萃取柱中的吸附剂吸附。因此,小苏打可使合成着色剂高效富集在固相萃取柱表面。
2.5 方法验证
2.5.1 线性试验结果
五种合成着色剂的线性范围、相关系数、检出限和回归方程的研究结果见表2,5种合成着色剂在0.1~1.4 μg/mL质量浓度范围线性关系良好,相关系数(R2)均高于0.990 0。检出限在0.07~0.50 μg/g之间。
表2 合成着色剂的线性范围、相关系数、检出限和回归方程
Table 2 Linear range, coefficients of determination (R2), limits of detection and calibration equations of synthetic colorants

合成着色剂 线性范围/(μg/mL)相关系数(R2)LOD/(μg/g) 回归方程苋菜红 0.1~1.4 0.993 8 0.12 y=0.73*x–136.46胭脂红 0.1~1.4 0.995 9 0.50 y=0.75*x–56.37日落黄 0.1~1.4 0.994 9 0.09 y=4.35*x+326.85诱惑红 0.1~1.4 0.990 9 0.13 y=4.35*x+453.47亮蓝 0.1~1.4 0.996 5 0.07 y=5.81*x+197.88
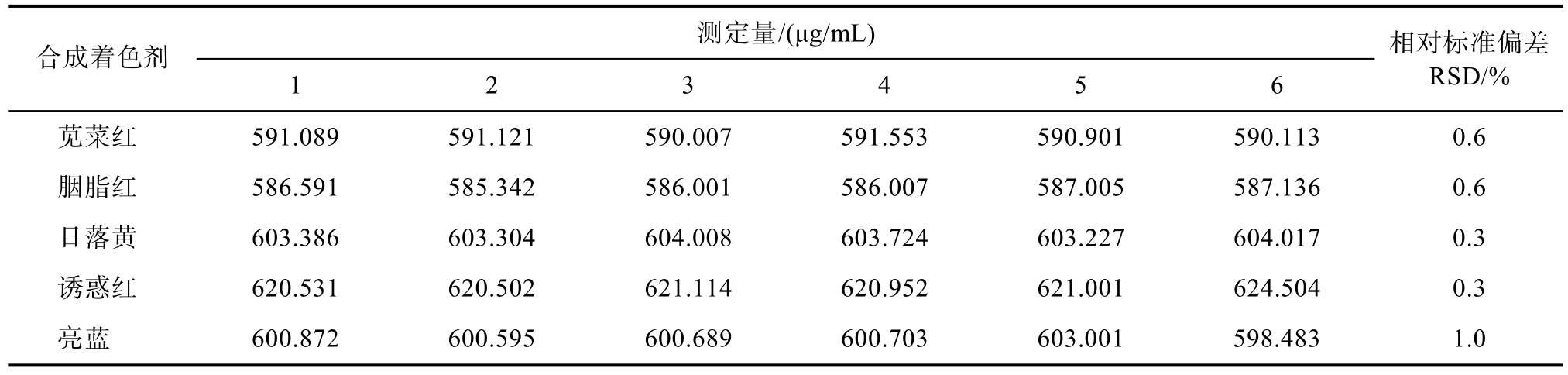
2.5.2 方法精密度
五种合成着色剂的 HPLC-MS检测精密度试验结果见表 3,相对标准偏差范围在 0.3%~1.0%之间,表明本试验建立的高效液相色谱质谱检测方法精密度良好,重现性高,可应用于样品检测。
表3 HPLC-MS检测精密度试验结果
Table 3 The precision result of HPLC-MS test
?
2.5.3 加标回收率
本研究测定小米、玉米糁子、发糕、玉米窝头、荞麦挂面五种不同的食物样品,对合成着色剂测定结果为0的样品加入日落黄、苋菜红、胭脂红、诱惑红和亮蓝5种合成着色剂,加标回收试验结果见表4,加标回收率在81.5%~109.4%之间,说明采用方法1.3.1和1.3.2对样品进行处理可有效减少合成着色剂的损失,能较好地提取和纯化样品中的合成着色剂。
表4 谷类食品中不同加标水平的平均加标回收率和相对标准偏差(n = 6)
Table 4 Mean recoveries and R.S.D.s (n = 6) of three colorants from spiked food matrices at various fortification levels

苋菜红 95.8 5.0 95.7 4.3 100.7 1.3胭脂红 81.1 1.0 80.0 0.9 81.5 0.8日落黄 83.4 1.1 83.5 1.0 92.6 0.7玉米窝头 0诱惑红 93.8 1.5 82.1 0.9 99.9 0.9荞麦挂面 0 亮蓝 88.0 2.9 84.3 1.7 94.4 1.0苋菜红 90.3 3.8 98.2 2.5 103.0 1.2胭脂红 92.6 3.0 91.4 1.0 106.1 1.0日落黄 85.2 2.3 89.8 0.9 90.6 1.8诱惑红 91.0 5.1 98.4 2.6 109.4 2.2玉米糁子 0亮蓝 88.0 5.0 84.3 3.5 98.0 4.6小米 0 日落黄 92.3 2.0 92.5 2.5 100.2 1.3发糕 0 日落黄 98.0 2.7 97.7 2.1 107.5 1.1
2.6 实际样品分析
将本文所开发的验证方法应用于样品中合成着色剂的测定。本研究中分析了来自宁夏市场和超市的 500多个小米、玉米粉、发糕、玉米窝头、荞麦挂面、玉米片、玉米糁子样本。在测试样本中,紫色发糕中检出苋菜红,样品测试结果质谱图如图4所示。结果表明,该方法是一种比较合适的验证方法。

图4 紫色发糕中苋菜红检测质谱图:4-1苋菜红的选择离子监测色谱图;4-2苋菜红的定量离子对和定性离子对色谱图的重叠图;4-3苋菜红的二级质谱图。
Fig.4 MRM chromatograms of amaranth in purple steamed sponge cake: 4-1 the selective ion monitoring chromatogram of amaranth; 4-2 the overlapping diagram of quantitative and qualitative ion pairs of amaranth; 4-3the secondary mass spectra of amaranth
3 结论
本研究发现了小苏打(碳酸氢钠)的新用途,即在40%的甲醇水溶液里添加食用小苏打,可以有效提取谷物加工品中的合成着色剂,解决了淀粉含量高而合成着色剂不易检出的技术难题。与GB5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》采用的聚酰胺法提取相比,本文开发的提取工艺测定结果具有较高的加标回收率,适用于液相色谱仪和液相色谱质谱仪同时淀粉含量高的谷物食品中合成着色剂的测定,为合成色素检测时的前处理过程提供了一种参考方法。
[1] SONG M, LI M.Adsorption and regeneration characteristics of phosphorus from sludge dewatering filtrate by magnetic anion exchange resin[J].Environ.Sci.Pollut.Res.Int., 2019, 37:123–144.
[2] PENSIRI K, CHAIYAWAN W, SAOWAKON W.Improving the quality of barbecued culled-dairy-goat meat by marination with plant juices and sodium bicarbonate[J].Journal of Food Science and Technology, 2020 : 1-10.
[3] 唐孝明.茶色素提取工艺的初步研究.山东化工,2009, 38:1008-1021.TANG X M.The research of the extraction technology of tea pigment.Shandong Chemical Industry, 2009, 38: 1008-1021.
[4] 郝利平,聂乾忠,周爱梅,等.食品添加剂[M].北京:中国农业大学出版社,2016: 82-89.HAO L P, NIE Q Z, ZHOU A M, et al.Food additives[M].Beijing: China Agricultural University Press, 2016: 82-89.
[5] BELENGORDILL O, GREGORY T S, FEI L, et al.Assessment of the color modulation and stability of naturally copigmented anthocyanin-grape colorants with different levels of purification[J].Food Research International, 2018, 106: 791-799.
[6] WALESKA DE A B, BRUNO P L, ANA P S P.Simultaneous determination of synthetic colorants in yogurt by HPLC[J].Food Chemistry, 2015, 183: 154-160.
[7] BOBIN T, CUNXIAN X, YUN Z, et al.Simultaneous determination of 16 synthetic colorants in hotpot condiment by high performance liquid chromatography[J].Journal of Chromatography B, 2014, 960: 87-91.
[8] ZHOU W E, ZHANG Y, LI Y, et al.Determination of gardenia yellow colorants in soft drink, pastry, instant noodles with ultrasound-assisted extraction by high performance liquid chromatography-electrospray ionization tandem mass spectrum[J].Journal of Chromatography A, 2016, 1446: 59-69.
[9] KARANIKOLOPOULOS G, GERAKIS A, PAPADOPOULOU K, et al.Determination of synthetic food colorants in fish products by an HPLC-DAD method[J].Food Chemistry, 2015, 177: 197-203.
[10] SHUQIANG Z, JIA Z, HONGFANG J, et al.Liquid–liquid microextraction of synthetic pigments in beverages using a hydrophobic deep eutectic solvent[J].Food Chemistry, 2018,243: 351-356.
[11] CHAO Y Y CHEN Y L, CHEN W C, et al.Rapid detection of illegal colorants on traditional Chinese pastries through mass spectrometry with an interchangeable thermal desorption electrospray ionization source[J].Food Chemistry, 2018, 252:189-197.
[12] YUNFEI X, TING C, YAHUN G, et al.Rapid SERS detection of acid orange II and brilliant blue in food by usingFe3O4@Au core–shell substrate[J].Food Chemistry, 2019, 270: 173-180.
[13] ELHAM H, REZA T.Simultaneous spectrophotometric determination of synthetic dyes in food samples after cloud point extraction using multiple response optimizations[J].Talanta 2016, 148: 237-246.
[14] 常洪.PWAX柱固相萃取-HPLC法检测食品中多种合成着色剂的应用研究[J].安徽预防医学杂志, 2018, 24(6): 416-421.CHANG H.Determination of synthetic colorants in foods by PWAX solid-phase extraction[J].Anhui J Prev Med, 2018, 24(6):416-421.
[15] 薛昆鹏, 金雪锋, 屠炳芳, 等.改进固相萃取-高效液相色谱法同时测定食品中 7种合成着色剂[J].食品安全质量检测学报, 2018, 9(23): 6229-6236.XUE K P, JIN X F, TU B F, et al.Simultaneous determination of 7 kinds of synthetic colorants in food by improved solid-phase extraction and high performance liquid chromatography[J].Journal of Food Safety and Quality, 2018, 9(23): 6229-6236.
[16] 高洁, 宁尚勇, 许志强.固相萃取-高效液相色谱法检测食品中的非食用色素[J].分析试验室, 2008, 27(8): 33-35.GAO J, NING S Y, XU Z Q.Solid phase extraction-liquid chromatography for simultaneous of inedible pigment in food[J].Chin J Anal Lab, 2008, 27(8): 33-35.
[17] 佟芳荻, 张婷, 何婷, 等.高效液相色谱法测定食品中 11种合成着色剂[J].食品安全质量检测学报, 2019, 10(2): 533-538.TONG F D, ZHANG T, HE T, et al.Determination of 11 kinds of synthetic colorants in foods by high performance liquid chromatography[J].Journal of Food Safety and Quality, 2019,10(2): 533-538.
[18] NAING N N, LEE H K.Determination of glyoxal and methylglyoxal in atmospheric fine particulate matter by vortex-assisted micro-solid phase extraction and liquid chromatography-diode array detection[J].J.Chromatogr.A, 2018, 1573: 42-47
[19] RAWIKAN K, JITLADA V, YANAWATH S, et al.Cloud-point extraction coupled to in-situ metathesis reaction of deep eutectic solvents for preconcentration and liquid chromatographic analysis of neonicotinoid insecticide residues in water, soil and urine samples[J].Microchemical Journal, 2020, 152.
[20] FRANCISCA IVANI DE A, MARIA I F G, ÍCARO P V, et al.Determination of synthetic food dyes in commercial soft drinks by TLC and ion-pair HPLC[J].Food Chemistry, 2014, 157: 193-198.
[21] KOEUN R, PILLAI P P, SHAFIQUZZAMAN S, et al.Methods for the analysis of Sunset Yellow FCF (E110) in food and beverage products- a review[J].Trends in Analytical Chemistry,2016, 85: 47-56.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/index.axpx)、中国知网、万方、维普、超星等数据库下载获取。