玉米油富含多种脂肪酸,不饱和脂肪酸含量高达85%左右,其中亚油酸约占55%左右[1-2]。亚油酸作为一种人体自身不能合成的必需脂肪酸,具有降胆固醇、增强心血管机能、软化血管、预防和改善动脉硬化等功效[3]。经压榨离心制得的玉米胚芽油中磷脂含量较高,是毛油中主要的胶溶性杂质,这些杂质的存在不仅会降低油脂的流动性、使用价值和贮藏稳定性,而且在油脂精炼加工中还会导致成品油的质量下降。因此,在油脂精炼过程中需进一步去除磷脂组分[4]。
目前,植物油脂脱胶多采用传统脱胶方法,如水化脱胶和酸法脱胶等[5-6]。传统的脱胶方法可以有效地去除水化磷脂,但非水化磷脂很难去除[7]。酶法脱胶是通过添加磷脂酶将毛油中的非水化磷脂转变为水化磷脂,便于利用水化的方法除去[8]。常用于植物油脱胶的酶有磷脂酶 A1(PLA1)、磷脂酶 A2(PLA2)和磷脂酶 C(PLC)。PLA2由于脱胶效果不突出且价格昂贵应用较少,工业应用中多选择PLA1或PLC进行植物油脂脱胶[9-11]。其中PLC具有很多独特的优点,根据侧链基团的不同,磷脂酶C可以分为磷脂酰胆碱特异性磷脂酶 C(PC-PLC)、磷脂酰肌醇特异性磷脂酶C(PI-PLC)和非特异性磷脂酶C(NPC)。其中,PC-PLC可以特异性水解磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE),但对前者的底物特异性更好;PI-PLC只能特异性水解磷脂酰肌醇(PI),不能水解 PC;NPC则以普通磷脂为底物,可以水解PC、PE、磷脂酰丝氨酸(PS)、磷脂酰甘油(PG)和磷脂酸(PA)[11]。PLC脱胶水解产物为有机磷酸酯(磷酸胆碱、磷酸乙醇胺或磷酸肌醇等)及甘油二酯,脱胶过程不产生其它副产物,安全性更高,且脱胶过程中仅需1%~2%的水分,极大减少了废水的产生,对环境污染相对较小,因此更受青睐[12]。目前,已有许多天然或重组PLC应用于不同毛油脱胶,如玉米胚芽油[13]、大豆毛油[14]、菜籽毛油[15]、米糠毛油[16]、山茶毛油[17]和蔬菜毛油[18]等。叶展等[19]利用PLC处理菜籽油,菜籽毛油磷含量由693 mg/kg降低至7.85 mg/kg。Cerminati等[20]将球形芽孢杆菌 PI-PLC和商业PC-PLC复配对大豆毛油进行脱胶,除去了约91%的磷脂。Jiang等[21]使用蜡状芽孢杆菌PLC对山茶毛油脱胶,磷含量降至6.84 mg/kg,脱磷率达到98.2%。同时,部分商业PLC(PLC Purifine®和PLC Lecitase Ultra)也被应用于毛油脱胶,包括大豆毛油和米糠毛油等[22-24],但是关于玉米胚芽油酶法脱胶的报道相对较少[12,23]。
本课题组前期从太瑞斯梭孢壳霉(Thielavia terrestris)中克隆表达得到一种新型磷脂酶C。该酶应用于大豆毛油脱胶,能完全除去PC和 PI,仅有极少部分的 PE残留[11]。玉米胚芽油磷脂成分包括PC、PI、PA、PE等,主要为PC和PE,含量分别占20%以上。因此,使用对PC和PE底物特异性强的磷脂酶C利于脱胶完全[23]。本研究进一步探究该酶在玉米胚芽油脱胶工艺中的应用效果,优化玉米胚芽油毛油酶法脱胶工艺的主要参数,以期为该酶的后续工业化应用奠定理论基础。
1 材料与方法
1.1 实验材料
玉米胚芽油(磷含量 102.7 mg/kg):中粮东海粮油工业张家港有限公司;太瑞斯梭孢壳霉磷脂酶C(TtPLC):中国农业大学酶工程实验室自制;重水 D2O、钼酸钠二水合物、氧化锌、硫酸联氨、脱氧胆酸钠等试剂均为分析纯:上海麦克林生化科技有限公司。
高速台式离心机(TGL 12GB):上海安亭科学仪器厂公司;全温振荡培养箱(HZQ-F160):江苏省太仓市实验设备厂公司;慧泰智能马弗炉(16-12TP):上海慧泰仪器制造有限公司;封闭电炉(TDWYL-12):沧州泰鼎恒业试验仪器有限公司;核磁共振波谱仪(Agilent 500 MHz DD2):美国Agilent公司;水浴恒温振荡器(THZ-82A)、磁力加热搅拌器:江苏金坛市荣华仪器制造有限公司;紫外可见分光光度计(TU 1800 PC):北京普析通用仪器设备有限责任公司。
1.2 实验方法
1.2.1 磷脂酶C的制备
参照Xiang等[11]方法制备太瑞斯梭孢壳霉磷脂酶 C。从本课题组筛选保藏的嗜热真菌太瑞斯梭孢壳霉Thielavia terrestris CAU709克隆得到磷脂酶C基因,将其在毕赤酵母中进行异源表达。依照Pichia Fermentation Process Guidelines(Version B,053002,Invitrogen)操作方法,在5 L发酵罐中进行高密度发酵制备磷脂酶 C,制备得到的磷脂酶C酶活力为98 970 U/mL。
1.2.2 磷脂酶C活力测定
采用对硝基苯磷脂酰胆碱(p-NPPC)法测定磷脂酶C酶活力:将20 μL适当稀释的酶液加入到96孔板中,再加入180 μL含10 mM p-NPPC的50 mM HEPES pH 6.5缓冲溶液于55 ℃培养箱静置。反应30 min后,使用酶标仪测定410 nm下吸光度值。磷脂酶 C酶活力单位(U)定义为在上述条件下每分钟反应产生1 μmol对硝基苯酚所需的酶量。
1.2.3 玉米胚芽油的酶法脱胶
磷脂酶C应用于玉米胚芽油的脱胶工艺参照Jiang等[25]的方法进行。称取300 g玉米胚芽油于1 L烧杯中,水浴加热至70 ℃,加入0.3 mL的柠檬酸溶液(45 %,w/w),在200 rpm条件下预热处理 20 min。然后冷却至预设温度(25~50 ℃),加入一定量的4% NaOH溶液(w/v,0.3~2.4 mL)调节pH,再加入3 mL蒸馏水和一定量的磷脂酶C纯酶液(0~10 000 U/kg),混合均匀后,在200 rpm摇床中反应(0~4 h)。反应结束后,将油样置于沸水浴中处理10 min终止酶反应,10 000 rpm离心10 min,取上层油样测定磷含量。以加入灭活的酶液处理组作为对照组。
1.2.4 磷含量测定
参照国标GB/T 5537—2008的方法测定磷含量。用坩埚称取3 g油样,加入0.5 g氧化锌在电炉上加热至碳化后,置于马弗炉中575 ℃灼烧2 h至完全灰化。取出坩埚冷却至室温,用10 mL盐酸溶液(50%,v/v)溶解灰分并加热至微沸,5 min后停止加热,待溶解液温度降至室温后过滤注入100 mL容量瓶中,用5 mL热水冲洗坩埚和滤纸3~4次,待滤液冷却至室温后用KOH溶液(50%,w/w)中和至出现混浊,缓慢滴加盐酸溶液(50%,v/v)使氧化锌沉淀全部溶解。最后用水稀释定容。吸取10 mL被测液到50 mL比色管中,加入8 mL硫酸联氨溶液(0.015%,w/v),2 mL 2.5%钼酸钠稀硫酸溶液(V(浓硫酸)∶V(水)=7∶25),加塞振摇3~4次,沸水浴处理10 min,冷却至室温后用水稀释至刻度并充分摇匀,静置10 min。最后用分光光度计测定溶液650 nm下吸光度值。
1.3 数据处理
采用Excel对实验数据进行分析,Origin 2018作图。
2 结果与分析
2.1 反应时间对脱胶效果的影响
在初始条件酶添加量为5 000 U/kg,NaOH和柠檬酸体积比为4,温度为35 ℃时,分别在反应时间为0.5、1、2、3和4 h下进行脱胶实验,以磷含量为指标,考察反应时间对玉米胚芽油脱胶效果的影响。实验结果见表 1,整体来看,随着反应时间的延长,磷含量逐渐下降,其中在0~1 h内油脂磷含量下降显著,反应1~4 h期间,磷含量变化趋于平缓。综合考虑脱胶率和脱胶时间,确定最佳反应时间为1 h。
表1 反应时间对玉米胚芽油脱胶效果的影响
Table 1 Effect of reaction time on the degumming efficiency of crude corn oil
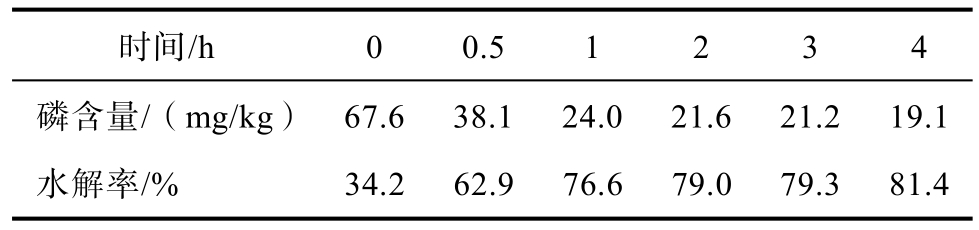
时间/h 0 0.5 1 2 3 4磷含量/(mg/kg) 67.6 38.1 24.0 21.6 21.2 19.1水解率/% 34.2 62.9 76.6 79.0 79.3 81.4
反应时间对磷脂酶 C脱胶效果影响较大。Sampaio等[23]利用商业PLC Purifine®处理玉米胚芽油的最佳反应时间为2 h。Xiang等[11]进行大豆毛油磷脂脱胶时最佳的酶解时间与本研究结果一致。这是由于脱胶过程中磷脂发生凝聚,反应时间过短,磷脂凝聚不完全,脱胶率较低,随着反应时间的延长,脱胶效果提高,反应时间继续增加,脱胶效果不再提升,这是由于反应时间过长容易发生油脂乳化,不利于磷脂的分离[15]。此外,酶活性也会随着反应时间的延长而降低[8]。因此,适宜的反应时间能够提高酶法脱胶的效果。
2.2 NaOH和柠檬酸的体积比对脱胶效果的影响
在初始条件酶添加量为5 000 U/kg,温度为35 ℃,反应时间为 1 h,柠檬酸添加量为 0.1%(v/w)时,通过添加适量体积的NaOH来调节反应体系的pH,分别在NaOH和柠檬酸的体积比为1、2、4、6和8的条件下进行脱胶实验,以磷含量为指标,考察 pH对玉米胚芽油脱胶效果的影响。实验结果见图 1,随着 NaOH和柠檬酸体积比的增加,磷含量呈现先降低后升高的趋势,当NaOH和柠檬酸的体积比为4时,磷含量达到最低点。因此,确定NaOH和柠檬酸的最佳体积比为4。

图1 NaOH和柠檬酸的体积比对玉米胚芽油脱胶效果的影响
Fig.1 Effect of volume ratio of NaOH to citric acid on the degumming efficiency of crude corn oil
不同的酸碱比对玉米胚芽油脱胶效果有很大的影响。Xiang等[11]应用磷脂酶C进行大豆毛油磷脂脱胶最佳酸碱体积比为1 : 2。毛程鑫等[26]用磷脂酶对菜籽油进行脱胶,最佳酸碱体积比为1 : 4.5。这可能是由于pH显著影响酶的活性及酶促反应速度,酶在其最适 pH条件下才能达到最高酶促反应水平,当酶在过低或过高pH条件下,酶结构会受到破坏,酶的活性随之降低甚至失去活性[8,20]。因此,采用适宜的酸碱比能有效提高酶法脱胶的效果。
2.3 温度对脱胶效果的影响
在初始条件酶添加量为5 000 U/kg,NaOH和柠檬酸的体积比为4,酶解时间为1 h时,分别在25、30、35、40、45和 50 ℃下进行脱胶实验,以磷含量为指标,考察温度对玉米胚芽油脱胶效果的影响。实验结果见图 2,随着反应温度的升高,磷含量呈现先降低后升高的趋势,当温度为35 ℃时,磷含量达到最低点。因此,确定最佳反应温度为35 ℃。
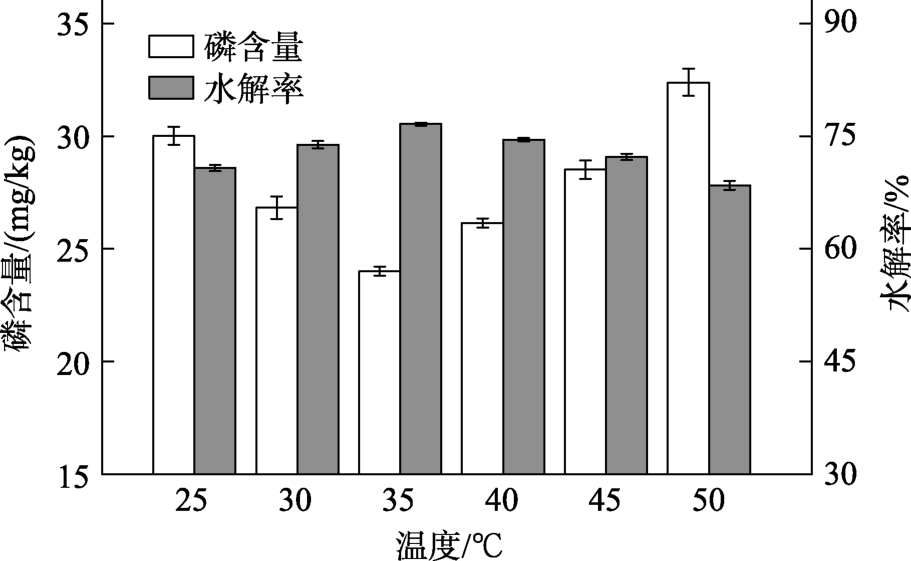
图2 温度对玉米胚芽油脱胶效果的影响
Fig.2 Effect of temperature on the degumming efficiency of crude corn oil
温度也是影响酶法脱胶效果的重要因素之一。Qu等[9]进行大豆毛油酶法脱胶时的最佳反应温度为55 ℃。Jiang等[21]进行茶花籽油酶法脱胶的最适反应温度为 53 ℃。温度过低,油脂流动性降低,反应物分子间结合不充分,酶促反应较慢,随着温度的升高,油脂的流动性越好,反应物分子间结合越充分,酶促反应速度越快,但是温度过高会导致酶变性,使酶的活性降低甚至完全不可逆的丧失活性[16,21]。因此,适宜的温度范围能显著提高酶法脱胶效果。
2.4 酶添加量对脱胶效果的影响
在初始条件 NaOH和柠檬酸的体积比为 4,温度为35 ℃,水解时间为1 h时,分别在酶添加量为 0、1 000、2 500、5 000、7 500和 10 000 U/kg的条件下进行脱胶实验,以磷含量为指标,考察酶添加量对玉米胚芽油脱胶效果的影响。实验结果见图3,随着加酶量的增加,磷含量逐渐降低,当加酶量为5 000 U/kg时,磷含量达到最低点。综合考虑,确定PLC脱胶最适加酶量为5 000 U/kg。
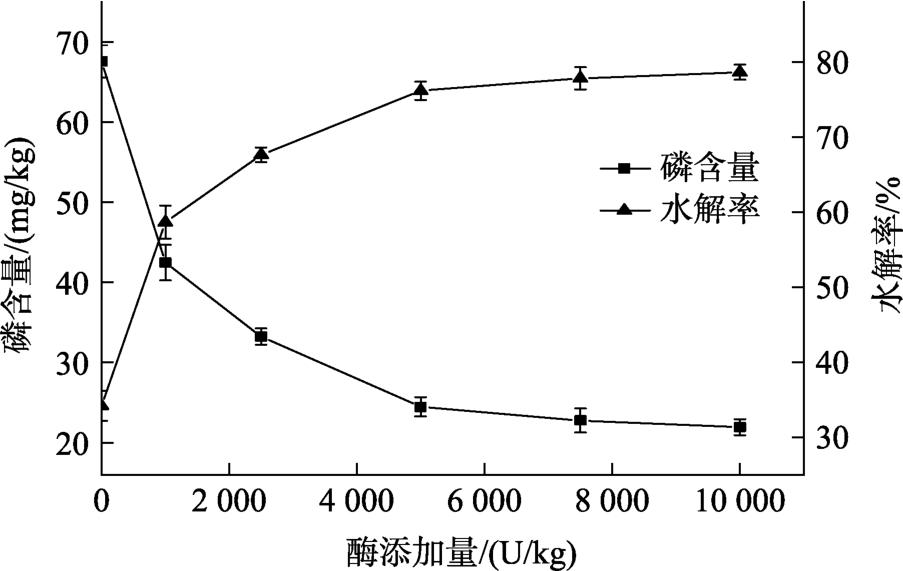
图3 酶添加量对玉米胚芽油脱胶效果的影响
Fig.3 Effect of enzyme dosage on the degumming efficiency of crude corn oil
本研究加酶量同Xiang等[11]大豆毛油磷脂脱胶结果一致,但是低于商业PLC Purifine®用于沙棘果油脱胶的酶添加量(12 000 U/kg)。这是由于在底物充足的情况下,酶促反应速度与酶浓度大小成正比。酶浓度越高,酶促反应速度越快,但是反应速度并不会一直随着酶添加量的上升而加快,因此,当酶的浓度达到一定值时,催化速率曲线逐渐趋于平缓,之后再继续增加酶的使用量时,反应速率不再明显变化[8]。
综上所述,采用磷脂酶C对玉米胚芽油进行磷脂脱胶的最佳条件为:酸碱比为 4、反应温度为35 ℃、反应时间为1 h、加酶量为5 000 U/kg。在该最优条件下,玉米胚芽油中磷的含量降低到24.0 mg/kg,水解率为76.6%。该酶的脱胶效果优于帝斯曼公司的 DSM磷脂酶 C(商业酶,64.70 mg/kg)[23]和商业 PLC Purifine®(27 mg/kg)[26],稍差于其它几种磷脂酶(表2)。但是从柠檬酸的使用量来看,本研究中的使用量仅为其它脱胶工艺的50%左右(表2)。因此,综合考虑本研究的酶活力、脱胶效果和柠檬酸的用量,重组磷脂酶C(TtPLC)在玉米胚芽油脱胶工业中具有较大的应用潜力。
表2 部分磷脂酶酶法脱胶效率比较
Table 2 Comparison of enzymatic degumming efficiencies of partial phospholipases
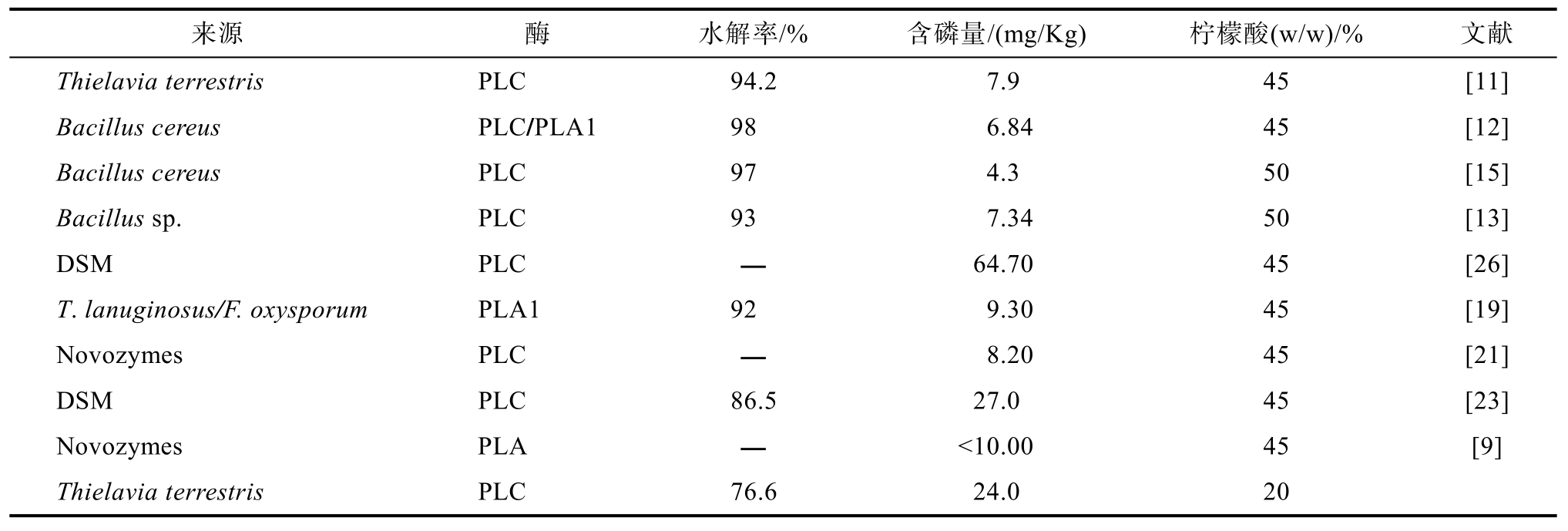
来源 酶 水解率/% 含磷量/(mg/Kg) 柠檬酸(w/w)/% 文献Thielavia terrestris PLC 94.2 7.9 45 [11]Bacillus cereus PLC/PLA1 98 6.84 45 [12]Bacillus cereus PLC 97 4.3 50 [15]Bacillus sp.PLC 93 7.34 50 [13]DSM PLC — 64.70 45 [26]T.lanuginosus/F.oxysporum PLA1 92 9.30 45 [19]Novozymes PLC — 8.20 45 [21]DSM PLC 86.5 27.0 45 [23]Novozymes PLA — <10.00 45 [9]Thielavia terrestris PLC 76.6 24.0 20
3 结论
采用自制的太瑞斯梭孢壳霉磷脂酶 C,优化了玉米胚芽油酶法脱胶工艺。得到最佳工艺参数为:NaOH和柠檬酸的体积比为 4、温度为35 ℃、加酶量为5 000 U/kg和水解时间1 h。在最佳条件下,玉米胚芽油脱胶效果显著,磷含量由 102.7 mg/kg降低至 24.0 mg/kg,水解率为76.6%。PLC脱胶不仅安全性高,水解产物为有机磷酸酯及甘油二酯,不产生其它副产品,而且环境友好,脱胶过程用水量少(仅需1%~2%的水分),可显著减少废水排放量。因此太瑞斯梭孢壳霉磷脂酶C在玉米胚芽油酶法脱胶工业中具有潜在的应用价值。
[1] 杨小倩, 郅慧, 张辉, 等.玉米不同部位化学成分、药理作用、利用现状研究进展[J].吉林中医药, 2019, 39(6): 837-840.YANG X Q, ZHI H, ZHANG H, et al.Research progress on chemical constituents, pharmacological effects and utilization status of different parts of corn[J].Jilin Journal of Traditional Chinese Medicine, 2019, 39(6): 837-840.
[2] THAÍS K D L, MUSSO M, MENEZES D B.Using Raman spectroscopy and an exponential equation approach to detect adulteration of olive oil with rapeseed and corn oil[J].Food Chemistry, 2020, 333.
[3] 李灵杰.共轭亚油酸改善肥胖糖尿病小鼠脂代谢的作用及其分子机制研究[D].南方医科大学, 2018.LI L J.The effect of conjugated linoleic acid on improving lipid metabolism in obese diabetic mice and its molecular mechanism[D].Southern Medical University, 2018.
[4] 陈昀昀, 王进英, 王兴瑞, 等.胡麻籽油脱胶工艺优化及理化指标分析[J].食品与机械: 1-10.CHEN Y Y, WANG J Y, WANG X R, et al.Process optimization and physical and chemical index analysis of flax seed oil degumming[J].Food and Machinery: 1-10.
[5] 王月华, 房涛, 程芳园, 等.玉米油水化脱胶无皂精炼工艺探讨[J].粮食与食品工业, 2016, 23(4): 27-31.WANG Y H, FANG T, CHENG F Y, et al.Discussion on soapfree refining process of corn oil hydration and degumming[J].Cereal and Food Industry, 2016, 23(4): 27-31.
[6] CHIARA A, ANDREA B, PAOLA D A, et al.Valorization of corn seed oil acid degumming waste for phospholipids preparation by phospholipase D-mediated processes[J].Catalysts, 2020, 10(7).
[7] LU P W, ZU W L, QIANG Z, et al.Effect of degumming methods on the degradation behavior of silk fibroin biomaterials[J].Fibers and Polymers, 2019, 20(1).
[8] 徐赢华, 王国敬, 李春, 等.酶法脱胶在植物油脂精炼中的应用进展[J].农业工程学报, 2015, 31(23): 269-276.XU Y H, WANG G J, LI C, et al.Application progress of enzymatic degumming in vegetable oil refining[J].Transactions of the Chinese Society of Agricultural Engineering, 2015,31(23): 269-276.
[9] QU Y F, SUN L X, LI X X, et al.Enzymatic degumming of soybean oil with magnetic immobilized phospholipase A2[J].LWT - Food Science and Technology, 2016, 73.
[10] 俞乐, 黄健花, 王兴国, 等.大豆毛油磷脂组成对磷脂酶 A1深度脱胶的影响[J].中国油脂, 2018, 43(12): 18-21.YU L, HUANG J H, WANG X G, et al.Effect of soybean wool oil phospholipid composition on deep degumming of phospholipase A1[J].China Oils & Fats, 2018, 43(12): 18-21.
[11] XIANG M, WANG L, YAN Q J, et al.High-level expression and characterization of a novel phospholipase C from Thielavia terrestris suitable for oil degumming[J].International journal of biological macromolecules, 2020, 156.
[12] 胡旭东, 蔡永国, 周勇, 等.磷脂酶A_1和磷脂酶C对沙棘果油脱胶的影响[J].新疆农业大学学报, 2019, 42(6): 431-437.HU X D, CAI Y G, ZHOU Y, et al.Effects of phospholipase A1 and phospholipase C on degumming of hippohae rhamnoides fruit oil[J].Journal of Xinjiang Agricultural University, 2019,42(6): 431-437.
[13] 邹权, 陈圣, 严明.磷脂酰胆碱特异性和磷脂酰肌醇特异性磷脂酶C酶学性质及其在油脂脱胶中的应用[J].生物加工过程, 2019, 17(2): 144-151.ZOU Q, CHEN S, YAN M.Enzymatic properties of phosphatidylcholine-specific and phosphatidylinositol-specific phospholipase C and their application in oil degumming[J].Bioprocessing, 2019, 17(2): 144-151.
[14] YU D Y, YU C, JIANG Y, et al.Magnetic immobilisation of phospholipase C and its hydrolysis of phospholipids in crude soybean oil[J].Quality Assurance and Safety of Crops & Foods,2019, 11(4).
[15] 刘露, 田华, 段愿, 等.磷脂酶C的制备及其脱菜籽油胶体的研究[J].农业机械, 2013(11): 42-46.LIU L, TIAN H, DUAN Y, et al.Preparation of phospholipase C and research on de-rapeseed oil colloid[J].Agricultural Machinery, 2013(11): 42-46.
[16] YE Z, QIAO X, LUO Z, et al.Optimization and comparison of water degumming and phospholipase C degumming for rapeseed oil[J].CyTA - Journal of Food, 2016, 14(4).
[17] JAHANI M, ALIZADEH M, PIROZIFARD M, et al.Optimization of enzymatic degumming process for rice bran oil using response surface methodology[J].LWT-Food Science and Technology,2007, 41(10).
[18] 穆文侠.真菌脂肪酶的液态发酵、固定化及其应用[D].安徽农业大学, 2007.MU W X.Liquid fermentation, immobilization and application of fungal lipase[D].Anhui Agricultural University, 2007.
[19] 叶展, 冉玉兵, 胡传荣, 等.菜籽油磷脂酶C脱胶工艺优化及效果分析[J].食品与发酵工业, 2015, 41(11): 87-92.YE Z, RAN Y B, HU C R, et al.Process optimization and effect analysis of rapeseed oil phospholipase C degumming[J].Food and Fermentation Industries, 2015, 41(11): 87-92.
[20] SEBASTIÁN C, FLORENCIA E, CLAUDIA E E, et al.Development of a highly efficient oil degumming process using a novel phosphatidylinositol-specific phospholipase C enzyme[J].Applied Microbiology and Biotechnology, 2017, 101(11).
[21] XIAO F J, MING C, QING Z J, et al.Optimization of the degumming process for camellia oil by the use of phospholipase C in pilot-scale system[J].Journal of Food Science and Technology, 2015, 52(6).
[22] 徐振山, 郑有涛, 刘宝珍.磷脂酶C在大豆油脱胶中的应用实践[J].中国油脂, 2017, 42(11): 152-153.XU Z S, ZHENG Y T, LIU B Z.Application practice of phospholipase C in soybean oil degumming[J].China Oils and Fats, 2017, 42(11): 152-153.
[23] SAMPAIO K A, ZYAYKINA N, UITTERHAEGEN E, et al.Enzymatic degumming of corn oil using phospholipase C from a selected strain of Pichia pastoris[J].LWT - Food Science and Technology, 2019, 107.
[24] XIAO F J, MING C, QING Z J, et al.Application of phospholipase A 1 and phospholipase C in the degumming process of different kinds of crude oils[J].Process Biochemistry,2015, 50(3).
[25] 毛程鑫, 李桂华, 薛武军, 等.菜籽油酶法脱胶的研究[J].中国粮油学报, 2016, 31(8): 75-79.MAO C X, LI G H, XUE W J, et al.Research on enzymatic degumming of rapeseed oil[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(8): 75-79.
[26] JIANG Y, DU J, TANG H L, et al.Synthesis and application of nanomagnetic immobilized phospholipase C[J].Journal of Chemistry, 2019.