多糖是由 10个或以上单糖通过缩合而形成的链状结构物质,在动植物和微生物中广泛分布,对维持正常生命活动至关重要[1-2]。而多糖中单糖组成分析是研究多糖的结构性质及对其进行质量控制的重要内容。
目前常用的多糖水解方法是加热酸水解法,加热方式常采用烘箱加热,该方法耗时长、能耗大,且受热不均匀,导致水解样品重复性很差,远远不能满足研究的需求。而微波水解是将样品、酸置于微波电磁场中,微波频率使极性分子取向快速变换,分子在来回转动过程中与周围分子高速碰撞摩擦,增加总能量,产生高热[3]。微波水解方法能使样品受热均匀,加快水解速度,降低能耗,降低检测成本[4]。
对水解后的多糖进行单糖组成分析,常用的方法有气相色谱法[5]、高效液相色谱法[6]等。由于单糖的挥发性低,难气化,气相色谱法测单糖时必须对其进行硅烷化或酯化等衍生化处理,操作繁琐。采用高效液相色谱法检测单糖时最常用的是示差折光检测器,但这种检测器的灵敏度低、基线易受温度影响产生大的波动、不能进行梯度洗脱[7],而采用灵敏度较高的紫外检测器检测时,则需对单糖进行衍生化反应,操作繁琐[8]。近年来,高效阴离子交换色谱被广泛用于糖的检测,这是由于糖类分子具有高的电化学活泼性,且在强碱溶液中全部或部分电离成阴离子形式[9],可以在阴离子交换柱上被保留并得到分离[10]。由于糖在金电极上易发生氧化还原反应产生信号,离子色谱法检测糖主要使用金电极的脉冲安培检测器[11]。该检测器检测糖非常灵敏,操作简便,检测限可以达到pmol/L,而且不需衍生反应和复杂的样品处理。
本文将微波水解和离子色谱分析相结合,建立一种快速、高效、准确的多糖组成的分析方法。并采用这种方法构建香菇多糖组成的离子色谱指纹图谱,通过多糖的单糖组成的分析对香菇多糖的生产进行质量监控,弥补现行质量监控上的不足。
1 材料与方法
1.1 材料与试剂
氢氧化钠(NaOH)溶液(50%,w/w):瑞士Fluka公司;三氟乙酸(TFA)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、无水乙醇均为分析纯:国药集团化学试剂有限公司;乙腈,色谱纯:美国TEDIA公司;岩藻糖(Fuc)、鼠李糖(Rham)、氨基葡萄糖(GlcN)、半乳糖(Gal)、葡萄糖(Glc)、甘露糖(Man)、木糖(Xyl),果糖(Fru)、核糖(Rib)标准品:美国 sigma-aldrich公司。
1.2 仪器与设备
ICS-5000+离子色谱仪,配有双泵(DP)模块、检测器/色谱(DC)模块、自动进样器(AS)模块、Chromeleon 7.0色谱工作站:美国Thermo Fisher公司;Waters 2695高效液相色谱仪,配有Waters2489紫外检测器、Empower色谱工作站:美国Waters公司;CEM Mars6高通量密闭微波消解仪,配有消解罐:美国 CEM 公司;Milli-Q Advantage A10超纯水机:美国Millipore公司;5424离心机:德国Eppendrof公司;LE204E分析天平:梅特勒-托利多国际贸易(上海)有限公司。
1.3 实验方法
1.3.1 香菇多糖样品的制备
取10 mL浓缩香菇多糖产品放入50 mL离心管中,加入30 mL无水乙醇,充分摇匀后,在4 000 r/min下离心10 min,除去上清,沉淀用80%乙醇(30 mL)溶解,充分混匀后,在4 000 r/min下离心10 min,除去上清,在60 ℃下烘干,备用。
1.3.2 微波水解香菇多糖条件优化
以三氟乙酸浓度、微波温度、微波时间、物料比为单因素,进行优化实验。准确称取20 mg烘干后的香菇多糖样品放入微波消解罐中,每次实验仅改变一个条件,其他条件固定不变。分别将三氟乙酸浓度设置 1.0、1.5、2.0、2.5、3.0、3.5 mol/L五个水平;微波温度设置100、110、120、130、140 ℃五个水平;微波时间设置10、20、25、30、35、40 min五个水平;物料比设置5.0、6.0、7.0、8.0、9.0 mL的三氟乙酸(3.0 mol/L)。设定微波功率1 600 W,微波水解后水解液稀释1 000倍,进行离子色谱分析。
1.3.3 标准溶液配制
分别准确称取10 mg的半乳糖、岩藻糖、鼠李糖、氨基葡萄糖、果糖、葡萄糖、甘露糖、木糖、核糖标准品,用水定容于10 mL容量瓶中,配成1.000 g/L储备液,于冰箱中保存,使用时将储备液稀释至系列混合标准溶液。
1.3.4 离子色谱条件
色谱柱:Thermo CarboPac PA20 (150 mm×3 mm i.d.) 阴离子交换柱,配有保护柱 (30 mm×3 mm);柱温:30 ℃;进样体积:20 µL。以0.25 mol/L NaOH和水为流动相进行梯度洗脱,流速:0.5 mL/min,淋洗条件见表1。脉冲安培检测器采用糖标准四电位波形。
表1 梯度洗脱表
Table 1 Gradient elution conditions

时间/min 水/% 0.25 mol/L NaOH/%0 98.5 1.5 20 98.5 1.5 21 20.0 80.0 35 20.0 80.0
1.3.5 离子色谱方法学研究
1.3.5.1 标准曲线、检出限 精密称取各单糖标样适量,用水配置成系列标准溶液,采用以上离子色谱条件分析。以各标液质量浓度为横坐标,相应峰面积为纵坐标,绘制标准曲线,得到各标样的回归方程、相关系数和线性范围。
1.3.5.2 重复性、稳定性研究 平行制备水解多糖样品溶液6份,采用离子色谱条件分别分析,计算6个样品中各单糖峰面积的平均值及相对标准偏差(RSD)。
取稀释至合适浓度的水解多糖样品,在0、2、4、6、8、12、24 h采用离子色谱分析,计算样品中各单糖峰面积的平均值及RSD。
1.3.5.3 准确性研究 取已知单糖组成含量的多糖样品9份,分别加入高、中、低3个浓度的混合单糖标液,微波水解,离子色谱分析,测定其回收率及RSD。
1.4 数据处理
实验数据均以平均值±标准偏差表示,每个实验至少重复三次。数据统计使用SPSS 19.0软件进行One-Way ANOVA分析,以及Tukey’s多重检验,P<0.05被认为数据差异显著。采用Origin软件绘制图形。
2 结果与讨论
2.1 微波水解香菇多糖条件优化
2.1.1 三氟乙酸浓度对香菇多糖水解的影响
改变三氟乙酸的浓度,保持其他条件不变。由图 1A我们能够发现:当三氟乙酸的浓度小于3.0 mol/L时,水解液中单糖总量与三氟乙酸的浓度呈正相关;当三氟乙酸的浓度为3.0 mol/L时,单糖总量达到最大值;再增加三氟乙酸的浓度,水解液中单糖总量的下降,因此,最佳三氟乙酸反应浓度为3.0 mol/L。
2.1.2 微波温度对香菇多糖水解的影响
改变微波温度,保持其他条件不变。由图1B我们能够发现:随着温度的提高,水解液中单糖总量先增加;当温度提高到130 ℃以上,单糖总量逐渐下降。同时考虑到过高的温度造成爬升温度时时间的延长及成本的提高,选择微波温度为130 ℃。
2.1.3 微波时间对香菇多糖水解的影响
改变微波水解时间,保持其他条件不变。由图 1C我们发现:随着时间的延长,水解液中单糖总量先增加;当时间达到30 min以上时,单糖总量下降并逐渐趋于平缓,因此,选择的最佳微波水解时间为30 min。
2.1.4 物料比对香菇多糖水解的影响
考虑到CEM Mars6高通量密闭微波消解仪的使用情况,我们设置了 5、6、7、8、9 mL共 5个三氟乙酸的体积,其他条件均不变,改变物料比。由图 1D我们能够发现:随着三氟乙酸体积的增加,水解液中单糖总量增加;当三氟乙酸的体积高于 7 mL时,单糖总量逐渐下降。因此,最佳三氟乙酸的体积为7 mL。
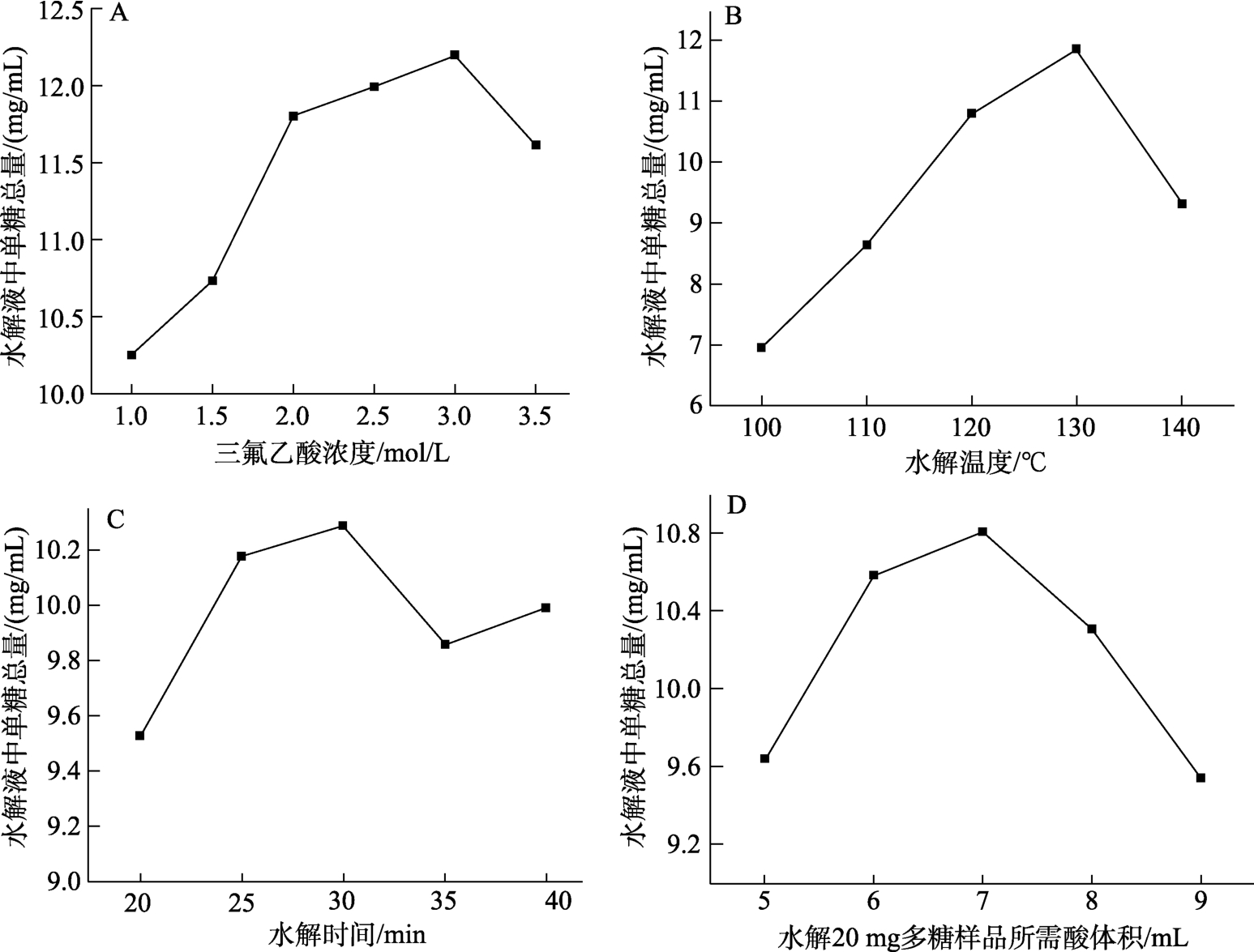
图1 三氟乙酸浓度(A)、微波温度(B)、微波时间(C)和物料比(D)对香菇多糖水解的影响
Fig.1 Effects of trifluoroacetic acid concentration (A), microwave temperature (B),microwave time (C) and material ratio (D) on lentinan hydrolysis
经过单因素实验分析,得到微波水解的最佳使用条件为:三氟乙酸的浓度:3.0 mol/L;微波温度:130 ℃;微波水解时间:30 min;物料比:20 mg样品:7 mL三氟乙酸。
2.2 离子色谱条件优化
2.2.1 色谱柱的选择
目前用于分离单糖和小分子低聚糖的阴离子交换色谱柱主要有CarboPac PAl、CarboPac PA10和CarboPac PA20三种。通过实验比较了这3种色谱柱对样品中可能存在的 7种糖类的分离效果。实验发现,在色谱柱CarboPac PA1和CarboPac PA10上,甘露糖和木糖不能较好分离,而在CarboPac PA20上可以达到基线分离。这是由于CarboPac PA20色谱柱树脂基核及覆盖在树脂表面的键合季胺基团的乳胶比CarboPac PA10小,分析速度快,柱效高,有更大优势[9]。故本实验选择CarboPac PA20柱进行相关测定。
2.2.2 流动相NaOH的浓度对离子效果的影响
在强碱条件下能够使糖以阴离子的形式存在,高 pH阻碍了糖分子间氢键的行程,使糖分子可与固定相相互作用,故改变NaOH浓度,会影响糖分子与固定相之间的作用程度,从而影响保留时间和响应值[12]。保证其他条件不变的情况下,分别考察3.75、5.00和6.25 mmol/L NaOH淋洗液对9种糖的分离效果,结果如图2。甘露糖和木糖在NaOH浓度为5.00 mmol/L和6.25 mmol/L时不能分离。而各种糖只有在浓度为3.75 mmol/L的NaOH溶液下才能在 20 min的分析时间内达到较好的分离效果。随后升高 NaOH浓度为200 mmol/L,冲洗掉样品中在色谱柱上强保留的组份,达到再生色谱柱的目的,保证离子色谱检测的稳定性。
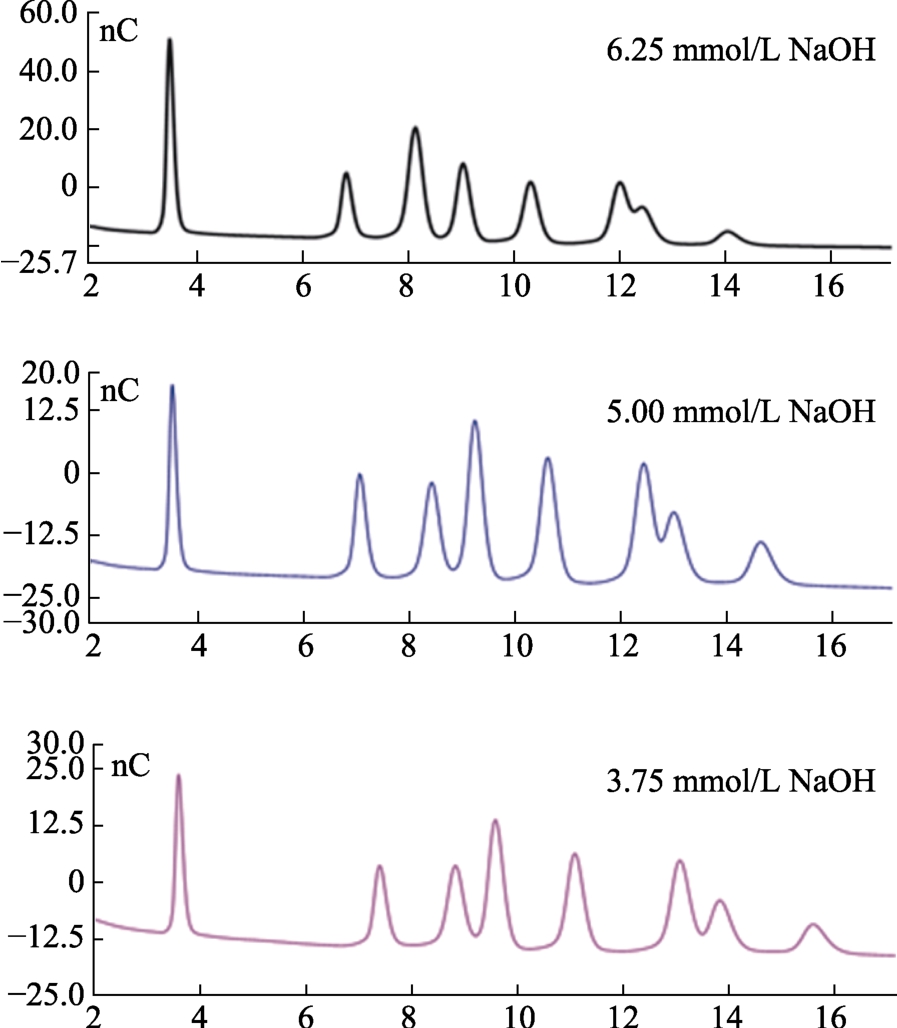
图2 不同洗脱条件下各种糖的离子色谱图
Fig.2 Ion chromatograms of various sugars under different elution conditions
2.2.3 柱温对离子效果的影响
柱温是极易影响离子色谱分析法分离的一个重要参数,改变柱温能够改变液液传质速率,导致分离柱的理论塔板高度的变化,从而对样品的保留时间产生影响,直接影响到分析物质中各组分在色谱柱上保留时间及分离程度[13-14]。本实验比较不同柱温(25、30和 35 ℃)下,各种糖的保留程度,特别是难分离物质氨基葡萄糖和半乳糖以及甘露糖和木糖的保留和分离的影响。由图3可知,在柱温为25 ℃时,糖的保留时间均延长,其中氨基葡萄糖和半乳糖不能分离。在柱温为35 ℃时,糖的保留时间均缩短,但甘露糖和木糖又不能分离。在柱温为30 ℃时,各种糖组份都能够达到基线分离。因此,选定色谱柱温度为30 ℃。
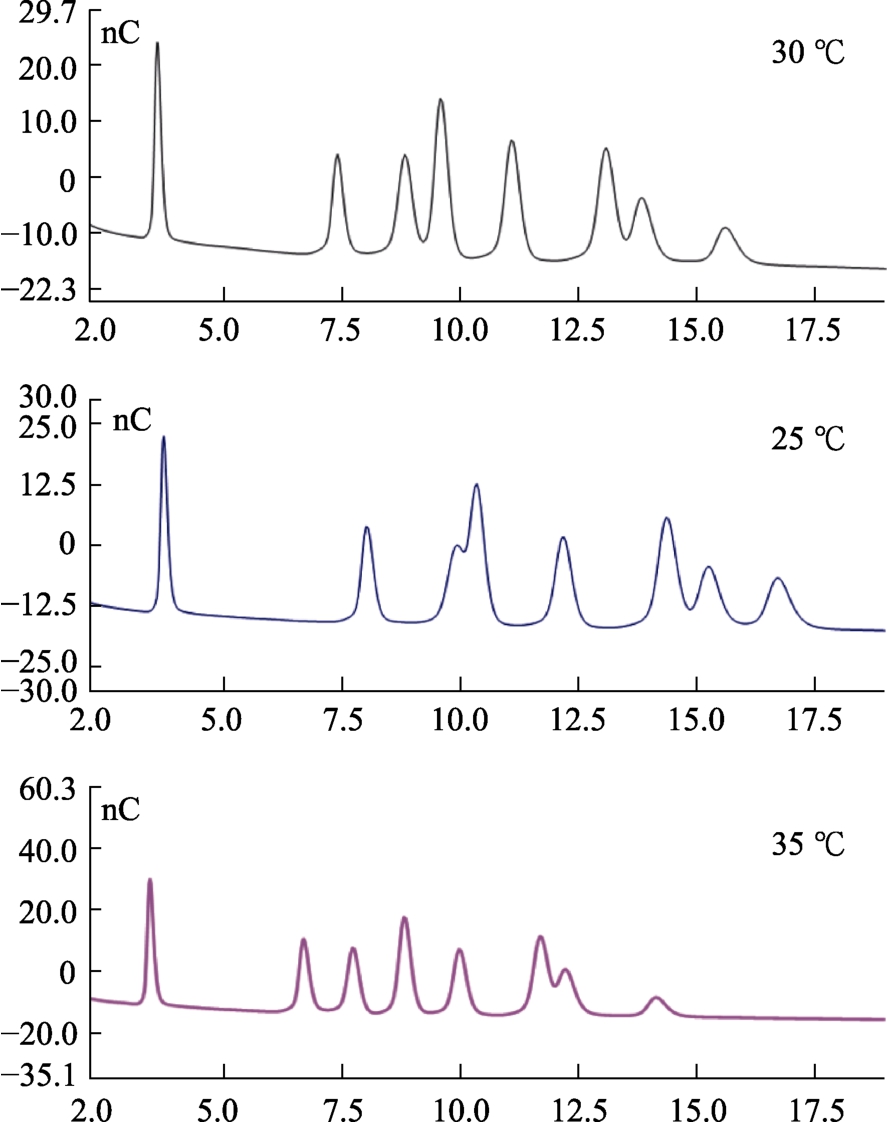
图3 不同温度下各种糖的离子色谱图
Fig.3 Ion chromatograms of various sugars at different temperatures
2.3 微波水解–离子色谱法与常规水解–PMP衍生化–液相色谱法比较
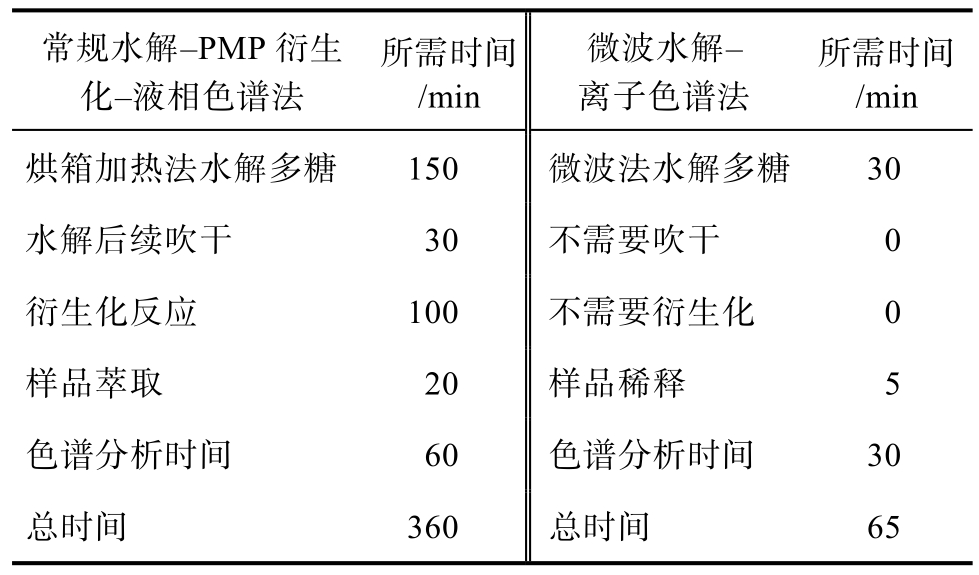
常规水解–PMP衍生化–液相色谱法是目前多糖单糖组成常见的检测方法,我们将建立的微波水解–离子色谱法与其在分析时间和分析结果方面进行了比较。结果表明,利用微波辐射的“内加热”作用,能加快水解的作用,且不需要对水解样品进行衍生化反应,整个样品的分析时间从360 min缩短至65 min,大大提高了分析效率。分析结果比较表明,微波水解–离子色谱法的回收率略高于常规水解–PMP衍生化–液相色谱法,微波水解–离子色谱法含量分析结果比常规水解–PMP衍生化–液相色谱法多8.54%,差别并不显著。说明微波水解多糖与常规烘箱加热法相比,主要是能提高水解效率,而对水解产物无显著影响。
表2 微波水解–离子色谱和常规水解–PMP衍生化–液相色谱法分析时间比较
Table 2 Comparison of analysis time by the microwave hydrolyzation–ion chromatography and the conventional hydrolyzation–PMP derivatization-liquid chromatography
?
表3 微波水解–离子色谱和常规水解–PMP衍生化–液相色谱法分析结果比较
Table 3 Comparison of analysis results by the microwave hydrolyzation–ion chromatography and the conventional hydrolyzation–PMP derivatization-liquid chromatography

?
2.4 离子色谱方法学研究
2.4.1 标准曲线、检出限
9种单糖的质量浓度 x (mg/L)与其峰面积 y(nC· min)在0.05~80 mg/L范围内具有很好的线性关系,线性系数 R2均大于 0.998 5(如表 4)。9种糖的检出限(20 μL 进样,S/N = 3)在 2.0~9.0 μg /L范围内。证明该方法检测线性很好,线性范围较宽,检测灵敏度很高。
表4 9种单糖的检出限及线性关系
Table 4 Detection limit and linear relationship of 9 monosaccharides sample
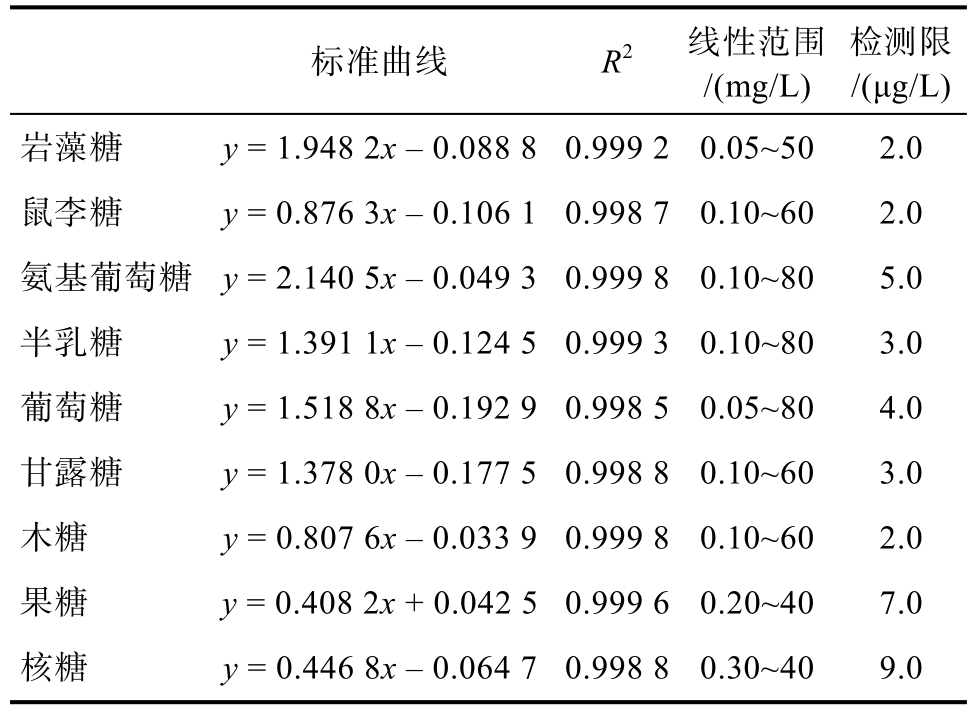
标准曲线 R2 线性范围/(mg/L)检测限/(μg/L)岩藻糖 y = 1.948 2x – 0.088 8 0.999 2 0.05~50 2.0鼠李糖 y = 0.876 3x – 0.106 1 0.998 7 0.10~60 2.0氨基葡萄糖 y = 2.140 5x – 0.049 3 0.999 8 0.10~80 5.0半乳糖 y = 1.391 1x – 0.124 5 0.999 3 0.10~80 3.0葡萄糖 y = 1.518 8x – 0.192 9 0.998 5 0.05~80 4.0甘露糖 y = 1.378 0x – 0.177 5 0.998 8 0.10~60 3.0木糖 y = 0.807 6x – 0.033 9 0.999 8 0.10~60 2.0果糖 y = 0.408 2x + 0.042 5 0.999 6 0.20~40 7.0核糖 y = 0.446 8x – 0.064 7 0.998 8 0.30~40 9.0
2.4.2 方法精密度、稳定性及重复性
标准溶液连续进样5次测定色谱峰峰面积,计算9种单糖的峰面积的RSD为1.32%~4.58%;取合适浓度的水解多糖样品,分别在0、2、4、6、8、12、24 h进行测定,计算各峰面积得RSD为1.45%~4.99%;平行制备水解多糖样品溶液6份,经水解、稀释后进行测定,RSD为1.31%~5.07%。以上结果表明,该方法精密度高、稳定性高、重现性好,可应用于多糖水解样品中9种单糖的分析。
2.4.3 准确度实验
分别加高、中、低 3个浓度的混合氨基酸对照品溶液各3份于已知含量的供试品溶液中,测其回收率,实验结果表明各单糖于各浓度下的回收率均在80.4%~95.0%之间,RSD为2.36%~4.57%,说明本方法测定多糖水解液中各单糖含量回收率良好,准确度高。
2.5 香菇多糖离子色谱标准指纹图谱的构建
2.5.1 香菇多糖离子色谱标准指纹图谱
将 106个香菇多糖样品的离子色谱图谱数据转换成CDF格式,导入指纹图谱专用软件“中药色谱指纹图谱相似度评价系统”,见图4。经多点校正、色谱峰匹配等软件处理方法生成香菇多糖离子色谱标准指纹图谱,见图5。

图4 香菇多糖的离子色谱图谱
Fig.4 Ion chromatogram of lentinan
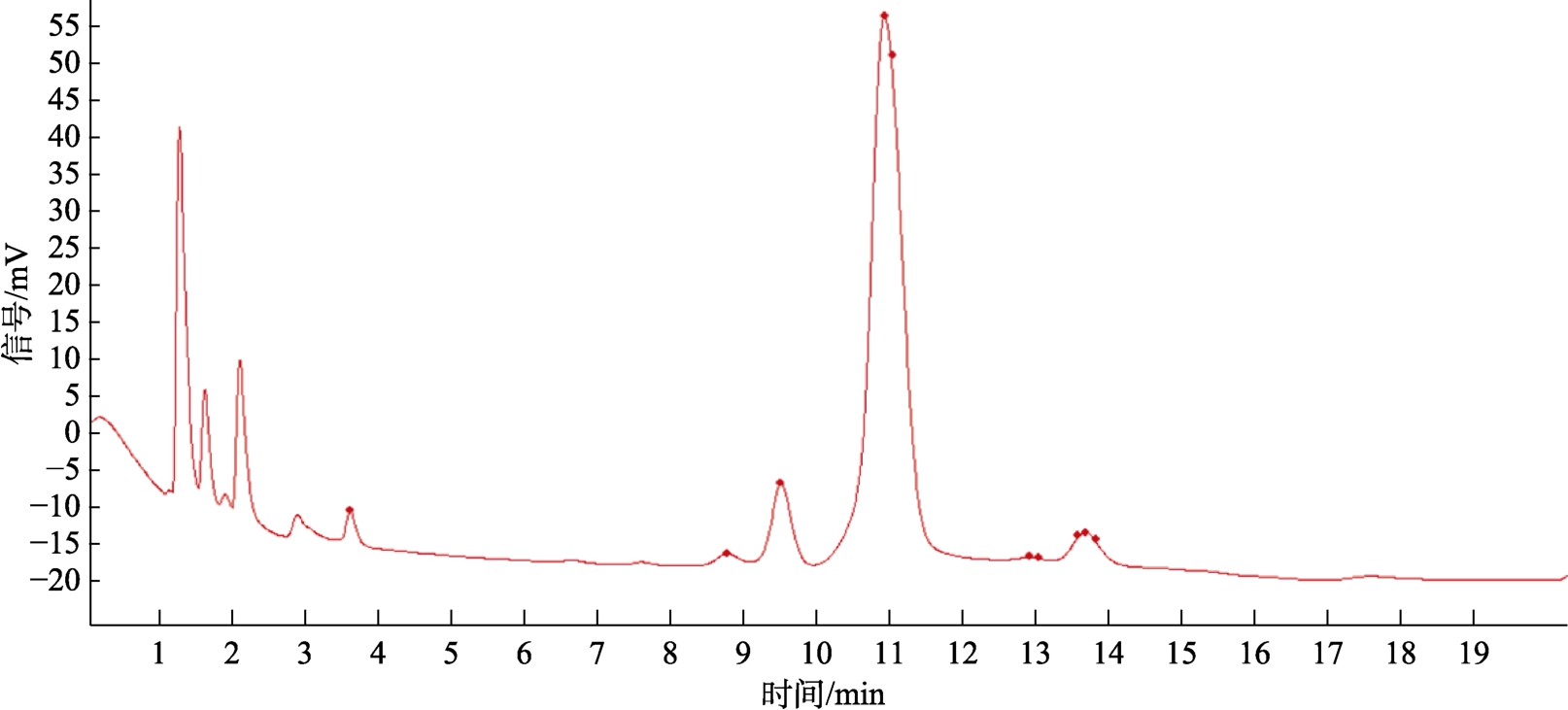
图5 香菇多糖的离子色谱标准指纹图谱
Fig.5 Standard fingerprint of ion chromatograms of lentinan
2.5.2 单糖标准品对照定性共有峰中的单糖峰
对照上述在同样离子色谱条件下分析得到的9个单糖混合标样的色谱图见图6A,比较图中各峰的相对保留时间,可以确定香菇多糖指纹共有特征峰中有6个是单糖峰,依次为岩藻糖、氨基葡萄糖、半乳糖、葡萄糖、甘露糖、木糖。
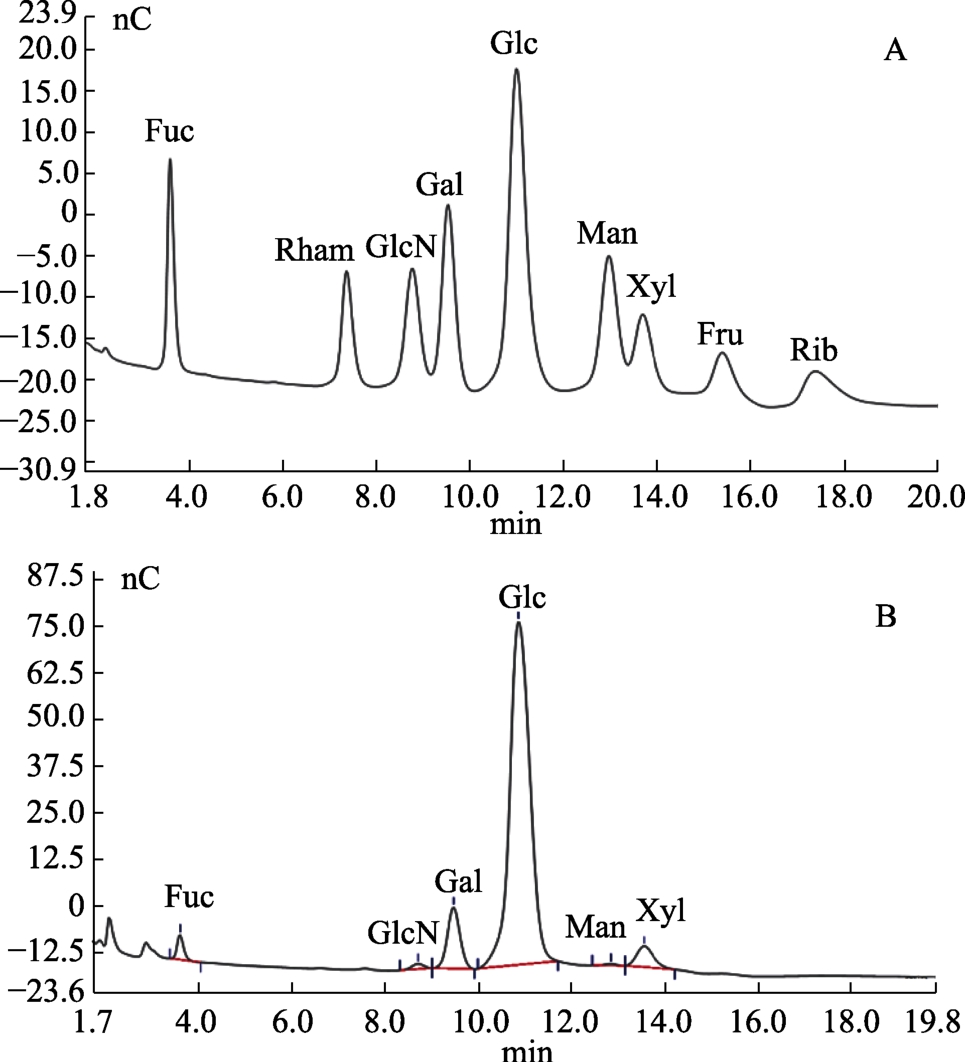
图6 9种单糖标样(A)和香菇多糖样品(B)的离子色谱图
Fig.6 A: Ion chromatograms of 9 monosaccharides standard sample; B: Ion chromatograms of lentinan sample
对 106批次香菇多糖样品进行相似度评价,均在0.95以上,说明各批次间相似度良好,离子色谱指纹图谱可作为香菇多糖质量控制和评价指标的重要参考依据之一。
3 结论
采用微波辅助酸水解法对香菇多糖样品进行前处理,离子色谱检测,优化了微波水解多糖条件和离子色谱条件,与常规水解–PMP衍生化–液相色谱法相比,该方法每个样品的分析时间由原来的365 min缩短到65 min。方法学研究表明该方法准确性高,重现性、稳定性好,可应用于香菇多糖样品的单糖组成分析。采用该方法对多批次香菇多糖样品进行分析,构建基于多糖单糖组成信息的离子色谱指纹图谱,为香菇多糖的质量控制提供更全面的参考。
[1] CHAKRABORTY I, SEN I K, MONDAL S, et al.Bioactive polysaccharides from natural sources: A review on the antitumor and immunomodulating activities[J].Biocatalysis and Agricultural Biotechnology, 2019, 22: 101425.
[2] ZHANG J, WEN C T, ZHANG H H, et al.Review of isolation,structural properties, chain conformation, and bioactivities of psyllium polysaccharides[J].International Journal of Biological Macromolecules, 2019, 139: 409-420.
[3] LEE J H, CHOUNG M G.Determination of optimal acid hydrolysis time of soybean isoflavones using drying oven and microwave assisted methods[J].Food Chemistry, 2011, 129:577-582.
[4] 任晓宇, 裴晓静, 张少云, 等.微波水解衍生高效液相色谱法测定饲料中的氨基酸[J].分析测试学报, 2017, 10: 1255-1259.REN X Y, PEI X J, ZHANG S Y, et al.Determination of amino acids in feed by high performance liquid chromatography with microwave hydrolysis derivatization[J].Journal of Instrumental Analysis, 2017, 10: 1255-1259.
[5] 庄伟, 屈咪, 赵迪, 等.黑木耳多糖的结构组成及其免疫活性研究[J].食品科技, 2020, 2: 205-210.ZHUANG W, QU M, ZHAO D, et al.Structual composition and immunomodulatory activities of polysaccharides from Auricularia Auricula[J].Food Science and Technology, 2020, 2: 205-210.
[6] GU J Y, ZHANG H H, YAO H, et al.Comparison of characterization, antioxidant and immunological activities of three polysaccharides from Sagittaria sagittifolia L.[J].Carbohydrate Polymers, 2020, 235: 115939.
[7] 张忠华, 高维平.植物多糖分析检测研究进展[J].吉林化工学院学报.2014, 31: 33-37.ZHANG Z H, GAO W P.A dvances in detection analysis of plant polysaccharides[J].Journal of Jilin Institute of Chemical Technology, 2014, 31: 33-37.
[8] LIU J, SHANG F N, YANG Z M, et al.Structural analysis of a homogeneous polysaccharide from Achatina fulica[J].International Journal of Biological Macromolecules, 2017, 98: 786-792.
[9] LODI G, PELLEGRINI L A, ALIVERTI A, et al.Recovery of monosaccharides from lignocellulosic hydrolysates by ion exclusion chromatography[J].Journal of Chromatography A, 2017, 1496:25-32.
[10] 李仁勇, 梁立娜, 牟世芬, 等.离子色谱-脉冲安培检测白醋和豆腐水中单糖和大豆低聚糖[J].分析化学, 2009, 5(37): 725-728.LI R Y, LIANG L N, MOU S F, et al.Determination of monosaccharides and soybean oligosaccharides in white vinegar and tofu water by ion chromatography and pulsed amperometric detection[J].Chinese Journal of Analytical Chemistry, 2009,5(37): 725-728.
[11] 朱松, 戴军, 陈尚卫, 等.高效阴离子交换色谱法检测酱油中的单糖及双糖[J].分析测试学报, 2012, 3111: 1411-1415.ZHU S, DAI J, CHEN S W, et al.Determination of monosaccharide and disaccharide in soy sauce by ion chromatography[J].Journal of Instrumental Analysis, 2012, 3111: 1411-1415.
[12] 张水锋, 盛华栋, 姜侃, 等.梯度洗脱优化-离子色谱-脉冲安培法分析婴幼儿配方乳粉中的糖和糖醇[J].色谱, 2016, 10:946-950.ZHANG S F, SHENG H D, JIANG K, et al.Determination of carbohydrates and sugar alcohol in infant formula by ion chromatography with pulsed amperometric detection and an optimized gradient elution[J].Chinese Journal of Chromatography,2016, 10: 946-950.
[13] 牟世芬, 李宗利.阴离子交换分离一脉冲安培检测分析糖类化合物的进展[J].色谱, 1995, 13: 320-324.MOU S F, LI Z L.The progress of carbohydrates determination by anion exchange separation with pulsed amperometric detection.[J].Chinese Journal of Chromatography, 1995, 13: 320-324.
[14] ALYASSIN M, CAMPBELL G M, O'NEILL H M, et al.Simultaneous determination of cereal monosaccharides, xyloand arabinoxylo-oligosaccharides and uronic acids using HPAEC-PAD[J].Food Chemistry, 2020, 315: 126221.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/index.axpx)、中国知网、万方、维普、超星等数据库下载获取。