多糖(polysaccharide)是一类具有一定的重复单元和聚合度、相对分子量大小不一且呈一定分布宽度的生物大分子。其重复单元由相同或不相同的中性、酸性或碱性单糖以一定的摩尔比、糖苷键和分支度等连接而成,它们的极性一般较强,结构相近,均呈多分散性,故不可能像小分子那样可以高分辨、高选择性地直接进行色谱分析[1]。为了改善其分离选择性和提高检测灵敏度,常将多糖水解后采用柱前或柱后衍生化色谱法进行分离检测,其中 l-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化高效液相色谱法,因其具有温和的反应条件和较高的灵敏度而被广泛应用[2-5]。本研究将香菇多糖经过微波辅助酸水解为单糖,研究 PMP衍生化-液相色谱法分析测定香菇多糖的单糖组成并进行方法学考察,并构建香菇多糖的单糖组成PMP-HPLC指纹图谱。
多糖具有多种生物活性,包括免疫调节、抗癌、抗氧化、降血脂、降血糖等,尤其是增强免疫力这一功能被广泛关注[6-10]。多糖的生物活性与其结构密切相关[11],而多糖的水解产物可以侧面表征多糖的一级结构。因此,本研究拟采用香菇多糖的单糖组成PMP-HPLC标准指纹图谱,并通过偏最小二乘回归分析(PLS)建立多糖指纹图谱及其免疫活性的谱效关系。进行多糖免疫活性与其单糖组成指纹图谱的相关性研究,可以快速高效地表征多糖的免疫活性,并以指纹图谱对活性的正相关峰指导实际生产从而获得高活性多糖产品。
1 材料与方法
1.1 材料与试剂
香菇多糖样品(81批次):无限极(中国)有限公司;三氟乙酸(TFA)、Na2HPO4、NaH2PO4、无水乙醇均为分析纯:国药集团化学试剂有限公司;乙腈为色谱纯:美国 TEDIA公司;12种单糖标准品为岩藻糖(Fuc)、鼠李糖(Rham)、氨基葡萄糖(GlcN)、半乳糖(Gal)、葡萄糖(Glc)、甘露糖(Man)、木糖(Xyl),氨基半乳糖(GalN)、核糖(Rib)、阿拉伯糖(Ara)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA):美国Sigma-Aldrich公司。
小鼠单核巨噬细胞白血病细胞(RAW264.7细胞):上海生命科学研究院生物化学与细胞生物学研究所;DMEM培养基:北京索莱宝科技有限公司 Solarbio;二甲基亚砜(DMSO):北京百灵威科技有限公司;新生牛血清(FBS):美国Gibco-Invitrogen公司;青霉素–链霉素双抗溶液:美国Gibco公司;四甲基偶氮唑蓝(MTT):美国Sigma-Aldrich公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪,配有Waters2489紫外检测器、Empower色谱工作站:美国Waters公司;LE204E分析天平,感量0.000 1 g:梅特勒–托利多国际贸易(上海)有限公司;流动相真空抽滤脱气装置(津腾抽滤装置1 L):广州奈姆塔贸易有限公司;SW-CJ-2D超净工作台:苏州净化设备有限公司;二氧化碳培养箱、Multiskan GO型酶标仪、超低温冰箱:美国 Thermo公司。
1.3 实验方法
1.3.1 香菇多糖样品的制备
分别取10 mL香菇多糖样品(81个批次),加入30 mL无水乙醇,充分摇匀后,4 000 r/min离心10 min,除去上清,沉淀用30 mL 80%乙醇溶解,充分混匀后再一次离心除上清,沉淀在60 ℃下烘干,备用。
1.3.2 香菇多糖样品的微波水解
取20 mg香菇多糖放入微波消解管中,加入7 mL 3.0 mol/L的三氟乙酸溶液,130 ℃下微波水解30 min,得到香菇多糖水解液。
1.3.3 PMP衍生化
1.3.3.1 混合单糖标样的衍生化 分别取100 µL的混合单糖标准液(各单糖质量浓度均为0.36 g/L左右)与100 µL的0.6 mol/L NaOH溶液混合均匀;取50 µL的混合液与50 µL 0.5 mol/L的PMP甲醇溶液漩涡混匀;70 ℃反应100 min后冷却至室温;加50 µL 0.3 mol/L的HCl溶液进行中和;补水至1 mL,再加1 mL的氯仿,振摇混匀后静置分层,弃去下层氯仿相,重复上述萃取步骤 3次以上,用0.45 µm微孔滤膜过滤后进行液相色谱分析。
1.3.3.2 香菇多糖水解样品的衍生化 香菇多糖水解样品的衍生化参考 Sun等的方法并稍作修改[12],具体如下:取水解后的香菇多糖水解液200 µL于试管中,氮吹仪吹干,加1 mL水漩涡振荡溶解。取100 µL上述溶液,与100 µL 0.6 mol/L的NaOH溶液混匀。加入0.5 mol/L的PMP甲醇溶液200 µL混匀。于70 ℃反应100 min后,冷却至室温。加250 µL 0.3 mol/L的HCl中和,然后加水(补 350 µL的水)至1 mL,混匀,再加 1 mL的氯仿,振摇混匀后静置分层,弃去下层氯仿相,重复上述萃取步骤至少3次以上,用0.45 µm微孔滤膜过滤后进行液相色谱分析。
1.3.4 色谱条件
色谱柱为 ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 µm);流动相为磷酸盐缓冲液(0.1 mol/L,pH 6.7)–乙睛(体积比为 80∶20);柱温:30 ℃;检测器:紫外检测器;检测波长:245 nm;流速:0.8 mL/min;进样体积:10 µL。
1.3.5 PMP-HPLC方法学研究
1.3.5.1 系统适用性 将12种单糖混合标准品衍生化后,采用液相色谱条件分析,连续进样5针,记录色谱图,计算各峰面积RSD(%)。
1.3.5.2 标准曲线、检出限 精密称取各单糖标样适量,用水配置成系列标准溶液,采用液相色谱条件分析,以峰面积为纵坐标,对照品浓度为横坐标,绘制标准曲线,得到回归方程、相关系数和线性范围。
1.3.5.3 重复性、稳定性 平行制备水解多糖样品溶液6份,采用液相色谱条件分别分析,计算6个样品中各单糖峰面积的平均值及RSD(%)。取水解多糖样品,分别在 0、2、4、6、8、12、24 h,采用液相色谱条件分析,计算样品中各单糖峰面积的平均值及RSD(%)。
1.3.5.4 准确性 取已知单糖组成含量的多糖样品,分别加入高、中、低3个浓度的混合单糖对照品溶液,微波水解法水解,采用液相色谱条件分析,测定其回收率及RSD(%)。
1.3.6 不同多糖溶液配制
准确称取10 mg香菇多糖样品,用含有1%双抗的DMEM培养基溶解后配成1 mg/mL的母液,在无菌条件下过0.22 μm微孔滤膜除菌,将滤液等梯度稀释成500、250、100、50和25 μg/mL 5个剂量组。
1.3.7 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测定RAW264.7细胞活力
MTT法测定RAW264.7细胞活力参考张勇的方法并稍作修改[13],将处于对数生长期的RAW264.7小鼠巨噬细胞消化传代并收集后接种于96孔板中,细胞密度为2×104个/mL,每孔接种量为 100 μL,同时在 96孔板的边缘孔加入100 μL的PBS。将接种后的细胞摇匀后置于二氧化碳培养箱中培养12 h,每孔加入100 μg/mL的香菇多糖,继续培养24 h,同时设置空白对照,之后向每孔加入10 μLMTT试剂(5 mg/mL),继续培养4 h。培养结束后,吸出上清液,并向每孔中加入150 μL DMSO溶液混合均匀后继续培养15 min,在490 nm处用酶标仪测定吸光度值。细胞存活率计算公式为:
1.4 数据处理
实验数据均以平均值±标准偏差表示,每个实验至少重复三次。数据统计使用SPSS 19.0软件进行One-Way ANOVA分析,以及Tukey’s多重检验,P<0.05被认为数据差异显著。采用Origin软件绘制图形。
2 结果与讨论
2.1 PMP-HPLC方法学研究
2.1.1 系统适用性
由表 1可知,适用性实验 RSD数据均满足GB/T27417—2017《化学分析方法确认和验证指南》附录B要求,说明系统对不同单糖具有良好的适用性。在该色谱条件下,除木糖和阿拉伯糖外,其余10种单糖均能达到基线分离,理论板数以葡萄糖计不低于8 000,色谱图见图1。
表1 12种单糖对液相色谱的适用性
Table 1 Applicability of 12 monosaccharides to liquid chromatography
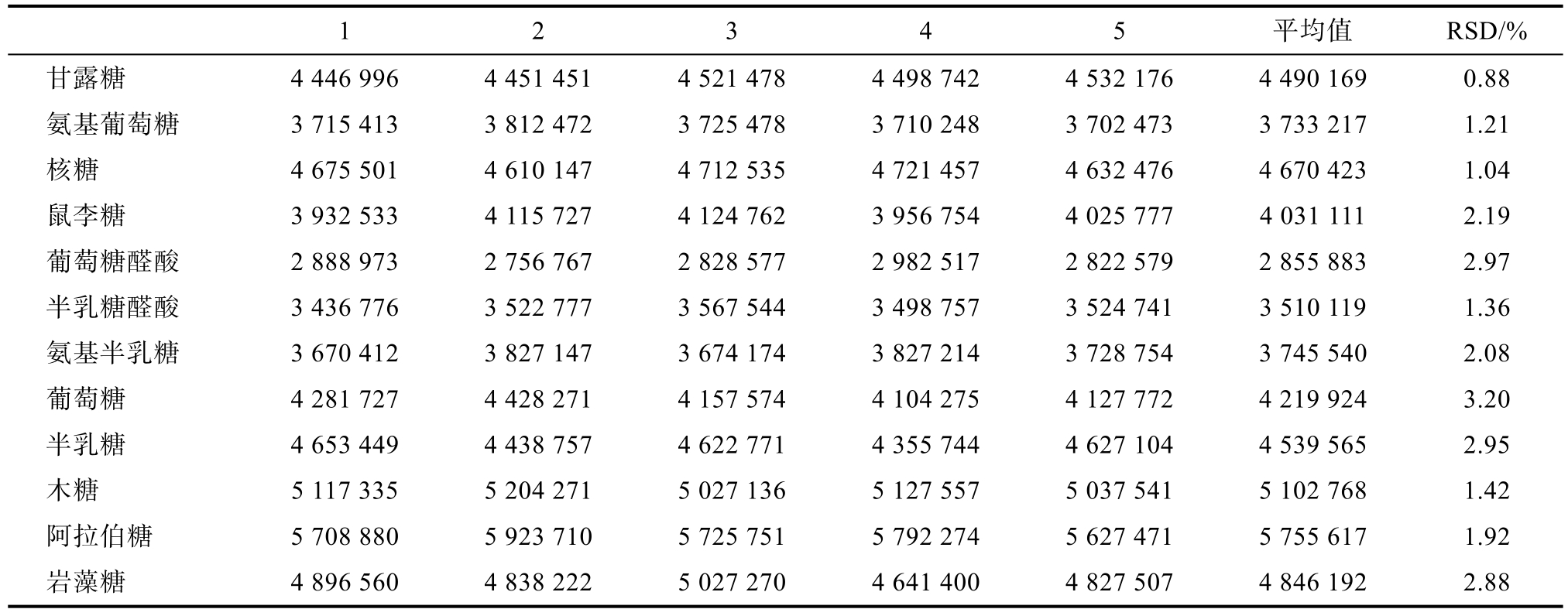
1 2 3 4 5 平均值 RSD/%甘露糖 4 446 996 4 451 451 4 521 478 4 498 742 4 532 176 4 490 169 0.88氨基葡萄糖 3 715 413 3 812 472 3 725 478 3 710 248 3 702 473 3 733 217 1.21核糖 4 675 501 4 610 147 4 712 535 4 721 457 4 632 476 4 670 423 1.04鼠李糖 3 932 533 4 115 727 4 124 762 3 956 754 4 025 777 4 031 111 2.19葡萄糖醛酸 2 888 973 2 756 767 2 828 577 2 982 517 2 822 579 2 855 883 2.97半乳糖醛酸 3 436 776 3 522 777 3 567 544 3 498 757 3 524 741 3 510 119 1.36氨基半乳糖 3 670 412 3 827 147 3 674 174 3 827 214 3 728 754 3 745 540 2.08葡萄糖 4 281 727 4 428 271 4 157 574 4 104 275 4 127 772 4 219 924 3.20半乳糖 4 653 449 4 438 757 4 622 771 4 355 744 4 627 104 4 539 565 2.95木糖 5 117 335 5 204 271 5 027 136 5 127 557 5 037 541 5 102 768 1.42阿拉伯糖 5 708 880 5 923 710 5 725 751 5 792 274 5 627 471 5 755 617 1.92岩藻糖 4 896 560 4 838 222 5 027 270 4 641 400 4 827 507 4 846 192 2.88

图1 衍生化处理的混合标样(A)和香菇多糖(B)的高效液相色谱图
Fig.1 High performance liquid chromatography (HPLC) of the derivatized mixed standard sample (A) and lentinan hydrolyzed samples (B)
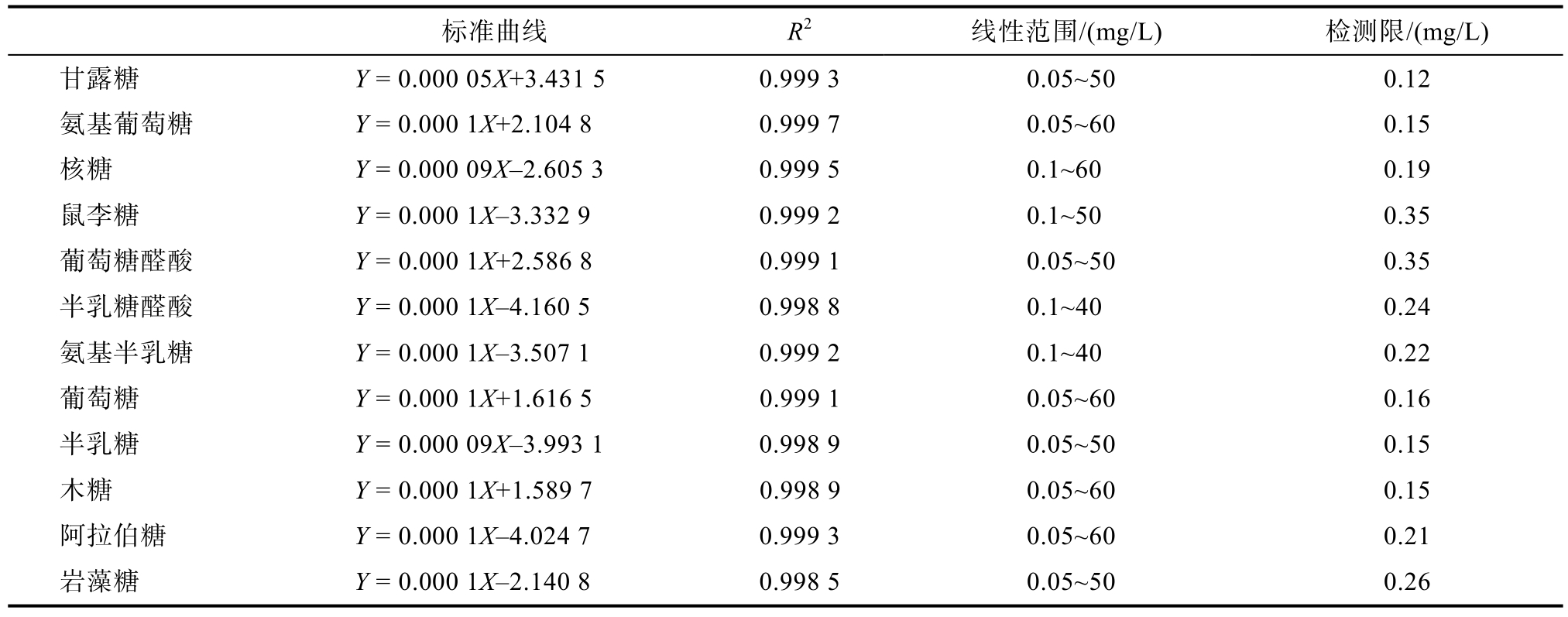
2.1.2 标准曲线、检出限
12种单糖的峰面积Y与其质量浓度X (mg/L)在0.05~60 mg/L范围内具有很好的线性关系,线性系数均大于0.998 5,见表2。12种糖的检出限(20 μL进样,S/N=3)为0.12~0.35 mg/L。结果表明,该方法检测线性很好,线性范围较宽,检测灵敏度很高。
表2 9种单糖的检出限及线性关系
Table 2 Detection limits and linear relationship of 9 monosaccharides
?
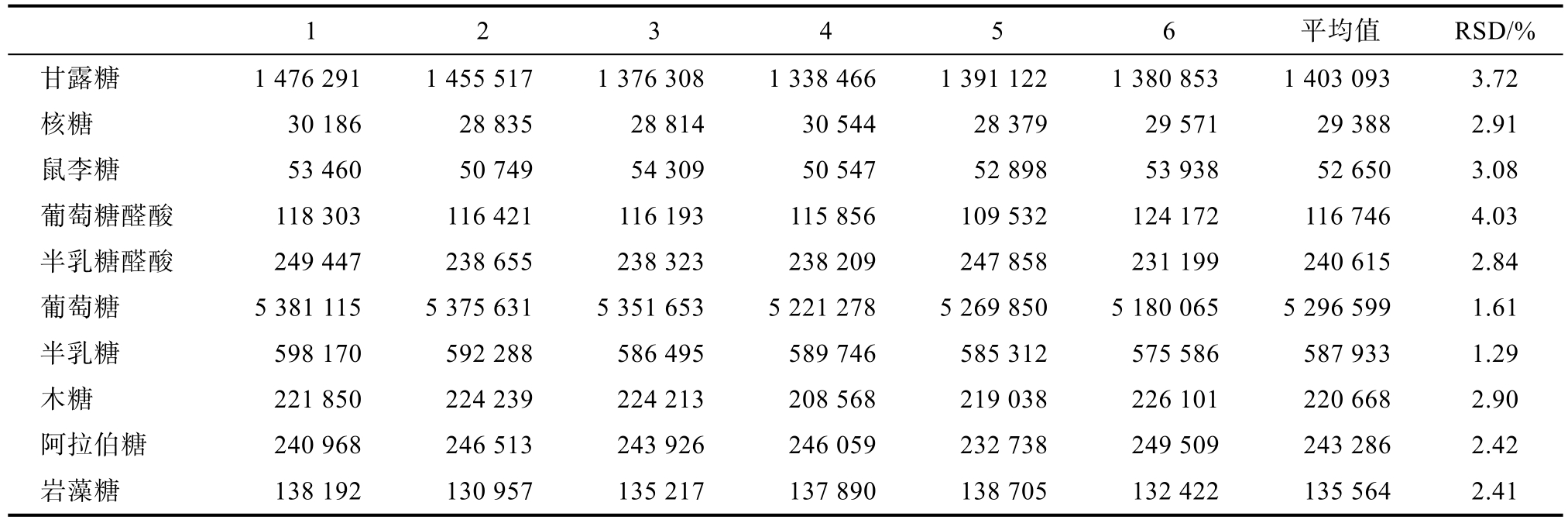
2.1.3 重复性、稳定性
由表 3可知,重复性实验 RSD数据均满足GB/T27417—2017《化学分析方法确认和验证指南》附录B要求,说明该方法重复性好,可应用于香菇多糖水解样品中10种单糖的分析。
表3 香菇多糖水解样品的重复性实验结果
Table 3 Repetitive results of lentinan hydrolyzed samples
?
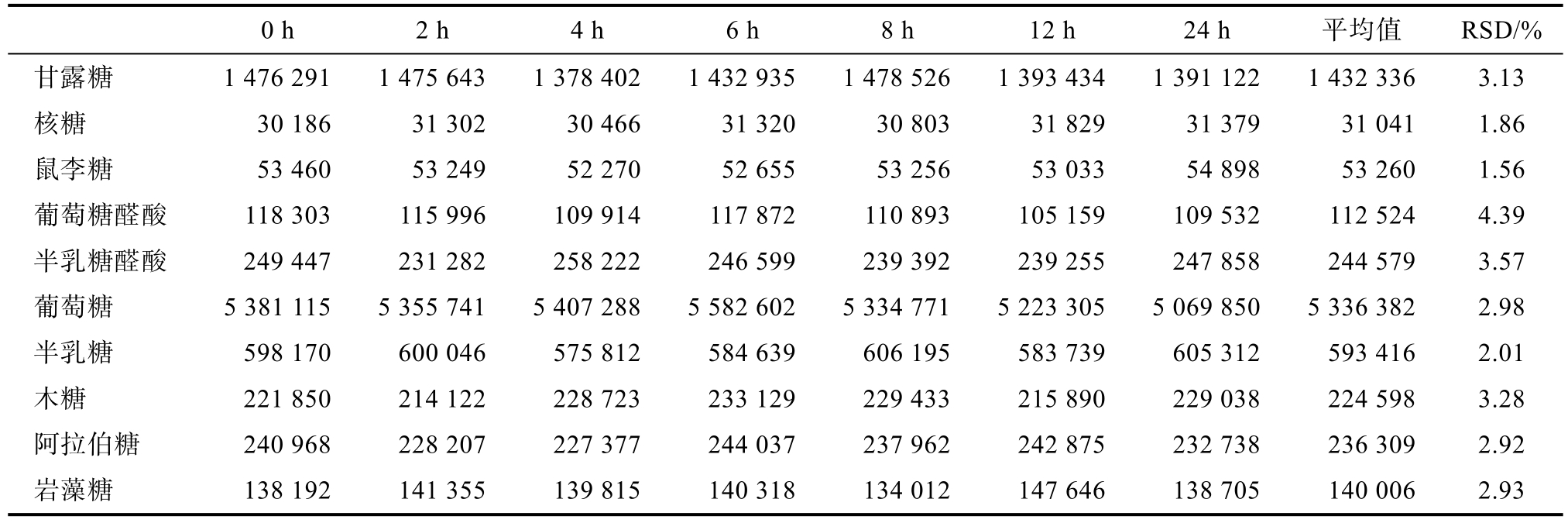
由表 4可知,稳定性实验 RSD数据均满足GB/T27417—2017《化学分析方法确认和验证指南》附录B要求,说明样品溶液在24 h内稳定。
表4 香菇多糖水解样品的稳定性实验结果
Table 4 Stability results of lentinan hydrolyzed samples
?
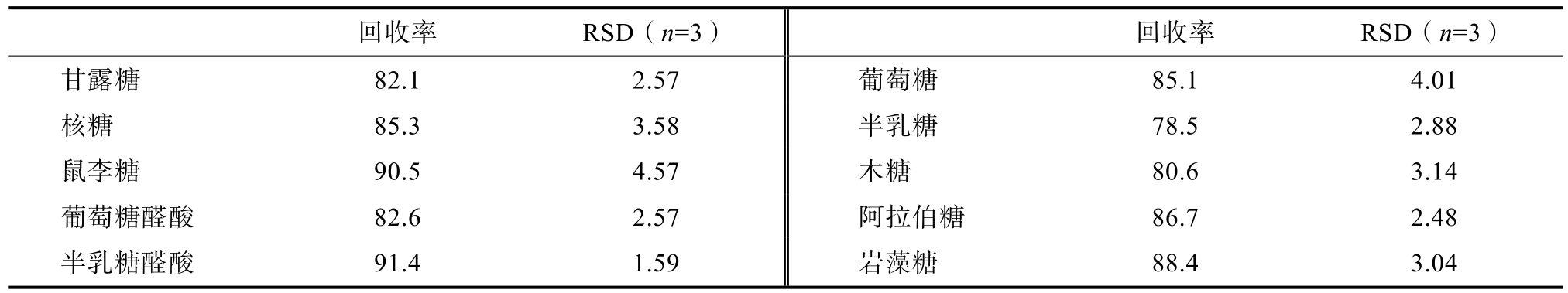
2.1.4 准确性
各单糖在不同浓度下的回收率均在 78%~91%之间,RSD%均小于5.0%(表5),说明本方
法测定单糖含量回收率良好,准确度高。
表5 加标回收率和相对标准偏差
Table 5 Recovery rate of standard addition and relative standard deviation %
回收率 RSD(n=3) 回收率 RSD(n=3)82.1 2.57 葡萄糖 85.1 4.01
2.2 香菇多糖PMP-HPLC标准指纹图谱的构建
2.2.1 香菇多糖PMP-HPLC标准指纹图谱
将81个批次香菇多糖样品的PMP-HPLC标准指纹图谱数据转换成CDF格式,导入指纹图谱专用软件“中药色谱指纹图谱相似度评价系统”,见图 2。经多点校正、峰匹配等软件处理生成香菇多糖PMP-HPLC标准指纹图谱,见图3。
图2 香菇多糖的PMP-HPLC图谱
Fig.2 PMP-HPLC chromatogram of lentinan

图3 香菇多糖的PMP-HPLC标准指纹图谱
Fig.3 Standard fingerprint of lentinan chromatogram
2.2.2 单糖标准品对照定性共有峰中的单糖峰
选取自然界中常见的 12种单糖作为参照标准,来定性香菇多糖水解产物色谱分离图谱中的各个单糖峰。配制单糖的混合标准溶液(各单糖的质量浓度均为0.42 mg/mL左右)。将该混合标准溶液进行PMP衍生化后,进样分析得到色谱图(图4A)。由图可知,12种单糖的分离度较好,能够满足色谱指纹图谱的定性要求。
按照相同的液相色谱条件,分析香菇多糖的指纹图谱。对照12个单糖混合标样色谱图中各峰的相对保留时间,可以确定香菇多糖指纹共有特征峰中有7个是单糖峰,依次分别为甘露糖、氨基葡萄糖、核糖、葡萄糖、半乳糖、木糖、岩藻糖(图 4B)。其单糖组成摩尔比为:甘露糖∶氨基葡萄糖∶核糖∶葡萄糖∶半乳糖∶木糖∶岩藻糖=8∶1∶2∶155∶7∶1∶1。葡萄糖的摩尔百分比为 89%,半乳糖的摩尔百分比为 4%,甘露糖的摩尔百分比为5%。对81批次香菇多糖样品进行相似度评价,均在0.94以上,说明各批次间相似度良好。
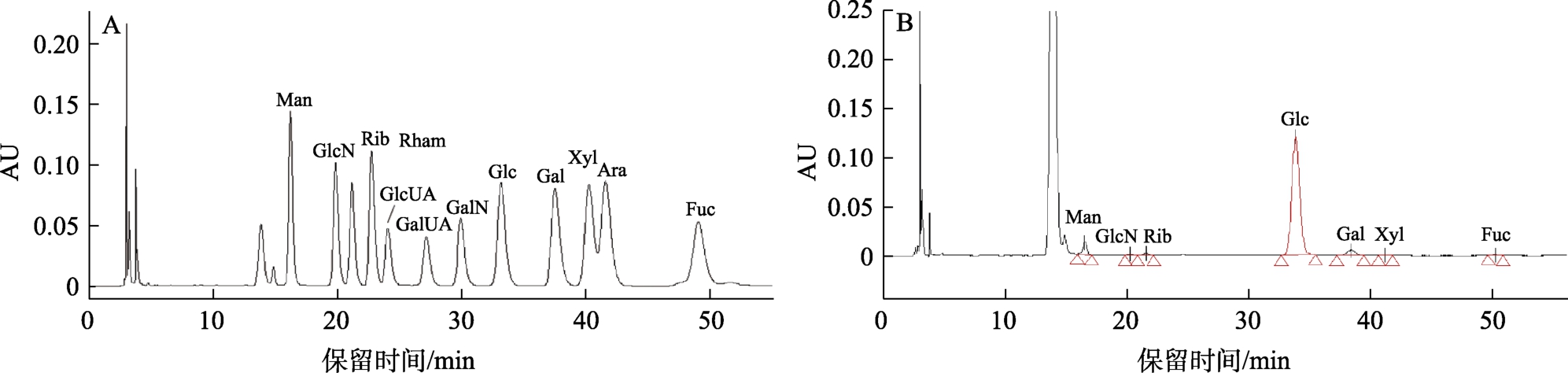
图4 12种单糖标样(A)和香菇多糖水解样品(B)的PMP-HPLC图谱
Fig.4 PMP-HPLC spectra of 12 standard monosaccharides (A) and lentinan hydrolyzed samples (B)
Xu等从香菇子实体中分离得到一种杂多糖L2,由葡萄糖(87.5%)、半乳糖(9.6%)及阿拉伯糖(2.8%)组成[14]。Chen等从香菇子实体中分离得到三种香菇多糖 LEPA1,LEPB1和LEPC1,LEPA1的单糖组成摩尔比为果糖∶阿拉伯糖∶甘露糖∶半乳糖∶葡萄糖=0.1∶0.1∶1.0∶1.2∶2.4;LEPB1和LEPC1均由甘露糖、半乳糖、葡萄糖和葡萄糖醛酸组成,其摩尔比分别为 1.3∶3.7∶2.8∶1.6 和 0.7∶1.7∶3.1∶2.5[15]。Zhao等从香菇中分离得到多糖碎片 LEP1和LEP2,LEP1 仅由葡萄糖组成,而 LEP2的单糖组成摩尔比为甘露糖∶半乳糖∶葡萄糖=5.9∶8.4∶88.7[16]。Jeff 等从香菇子实体中分离纯化得到三种多糖,主要由葡萄糖组成,并含有少量的半乳糖和甘露糖[17]。Tian 等从巨型香菇中分离得到中性多糖LGPS-1,由甘露糖、葡萄糖和半乳糖组成,摩尔比为3.0∶4.1∶7.1[18]。综上所述,从香菇子实体和菌丝体中分离得到的多糖主要由葡萄糖、甘露糖和半乳糖组成,有的还可能含有少量的阿拉伯糖、木糖、果糖等[13],与本研究结果相似。
2.3 香菇多糖PMP-HPLC指纹图谱与其免疫活性的谱效关系
2.3.1 不同浓度香菇多糖溶液对RAW264.7细胞活力的影响
由表 6可知,香菇多糖溶液浓度在 25~100 μg/mL的范围内,其对细胞存活率的影响是随着多糖溶液浓度的增大细胞存活率呈现升高的趋势。然而,当采用高浓度香菇多糖溶液(500 μg/mL)处理细胞时,细胞存活率下降较为明显,仅为58%,说明该浓度会抑制巨噬细胞生长。这一趋势和铁皮石解多糖对RAW264.7细胞的增殖活性影响相似[13]。多糖溶液浓度为100和200 μg/mL时,其对细胞存活率的影响基本一致。因此,选择100 μg/mL香菇多糖溶液用于后续细胞实验。
表6 不同浓度多糖溶液对RAW264.7细胞活力的影响
Table 6 Effects of different concentrations of polysaccharides on RAW264.7 cell viability %

?
2.3.2 PMP-HPLC指纹图谱与免疫活性相关性
RAW264.7小鼠巨噬细胞是一种免疫细胞,本研究选用该细胞模型来研究不同批次香菇多糖样品对免疫细胞增殖的影响,从而初步探讨多糖提取物的免疫调节活性。不同批次香菇多糖对RAW264.7细胞活力的影响如表 7所示,细胞存活率范围为 136.76%~152.35%,说明香菇多糖可刺激免疫细胞的增殖。
表7 香菇多糖对RAW264.7细胞活力的影响
Table 7 Effect of lentinan on the activity of RAW264.7 cells %
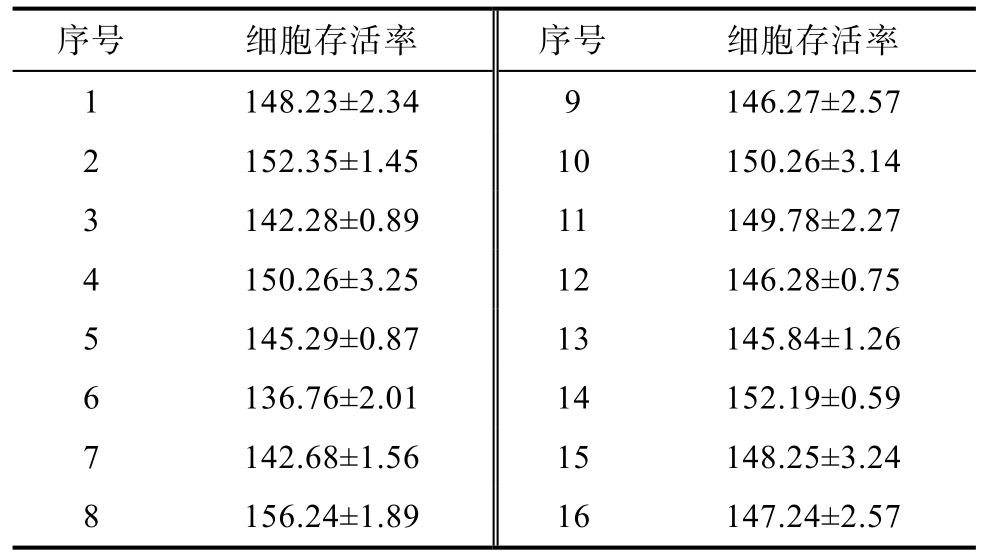
序号 细胞存活率 序号 细胞存活率1 148.23±2.34 9 146.27±2.57 2 152.35±1.45 10 150.26±3.14 3 142.28±0.89 11 149.78±2.27 4 150.26±3.25 12 146.28±0.75 5 145.29±0.87 13 145.84±1.26 6 136.76±2.01 14 152.19±0.59 7 142.68±1.56 15 148.25±3.24 8 156.24±1.89 16 147.24±2.57
以指纹图谱为基础建立的多糖指纹图谱谱效相关性研究,就是将“谱”中的多糖活性成分群的特征峰和化学成分的含量变化与“效”所代表的生理功效结果相对应,研究其中的规律,探索谱效相关性。将 16个香菇多糖样品酸水解PMP-HPLC指纹图谱的7个共有色谱峰面积百分比数据整理成矩阵,如表8所示。根据同一色谱条件下标准品的相对保留时间定性共有峰1到共有峰7分别为甘露糖、氨基葡萄糖、核糖、葡萄糖、半乳糖、木糖、岩藻糖。
表8 香菇多糖PMP-HPLC指纹图谱峰数据矩阵
Table 8 Peak data matrix of PMP-HPLC fingerprint of lentinan %
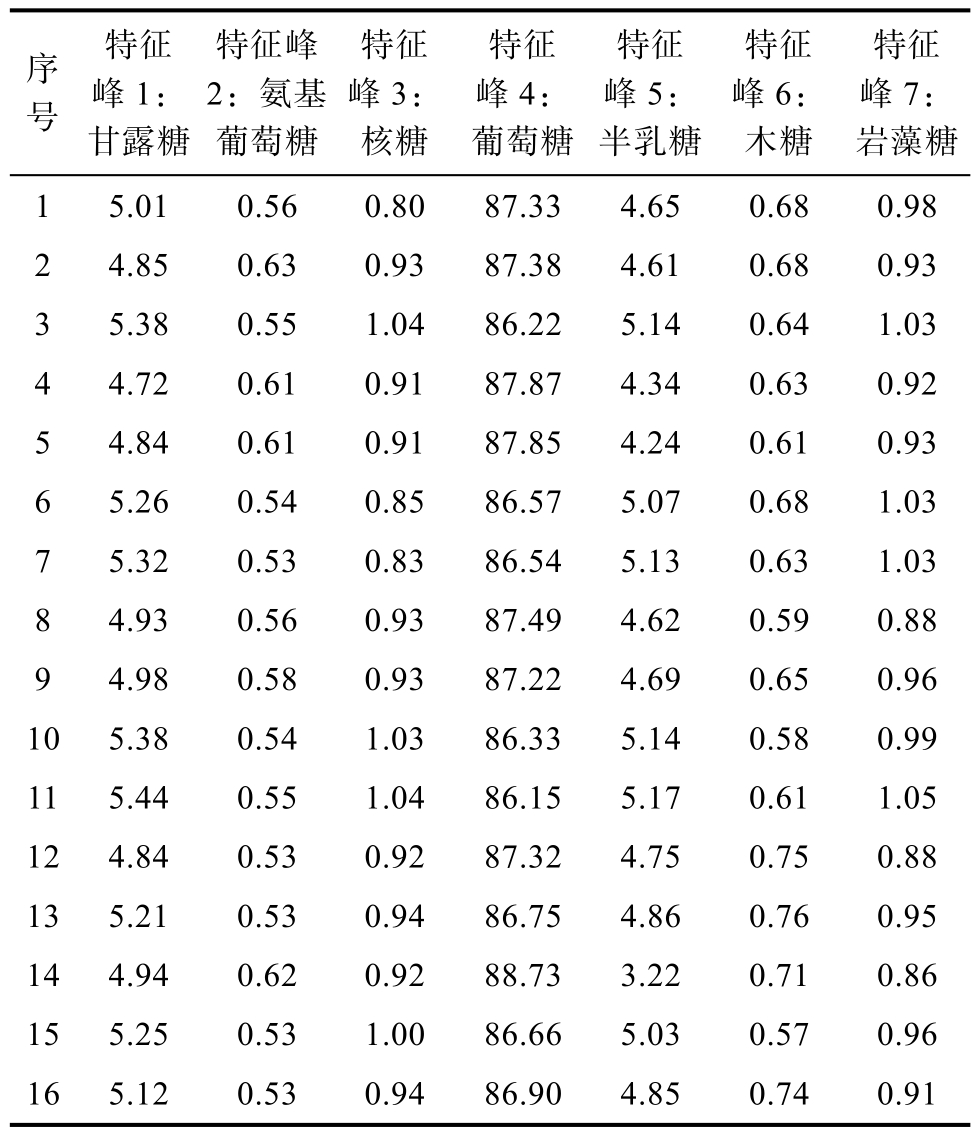
序号特征峰1:甘露糖特征峰2:氨基葡萄糖特征峰3:核糖特征峰4:葡萄糖特征峰5:半乳糖特征峰6:木糖特征峰7:岩藻糖1 5.01 0.56 0.80 87.33 4.65 0.68 0.98 2 4.85 0.63 0.93 87.38 4.61 0.68 0.93 3 5.38 0.55 1.04 86.22 5.14 0.64 1.03 4 4.72 0.61 0.91 87.87 4.34 0.63 0.92 5 4.84 0.61 0.91 87.85 4.24 0.61 0.93 6 5.26 0.54 0.85 86.57 5.07 0.68 1.03 7 5.32 0.53 0.83 86.54 5.13 0.63 1.03 8 4.93 0.56 0.93 87.49 4.62 0.59 0.88 9 4.98 0.58 0.93 87.22 4.69 0.65 0.96 10 5.38 0.54 1.03 86.33 5.14 0.58 0.99 11 5.44 0.55 1.04 86.15 5.17 0.61 1.05 12 4.84 0.53 0.92 87.32 4.75 0.75 0.88 13 5.21 0.53 0.94 86.75 4.86 0.76 0.95 14 4.94 0.62 0.92 88.73 3.22 0.71 0.86 15 5.25 0.53 1.00 86.66 5.03 0.57 0.96 16 5.12 0.53 0.94 86.90 4.85 0.74 0.91
以指纹图谱中共有峰的峰面积百分比为自变量X,多糖对RAW264.7细胞存活率为因变量Y,采用SPSS 26.0软件进行偏最小二乘回归分析,得到回归方程为:
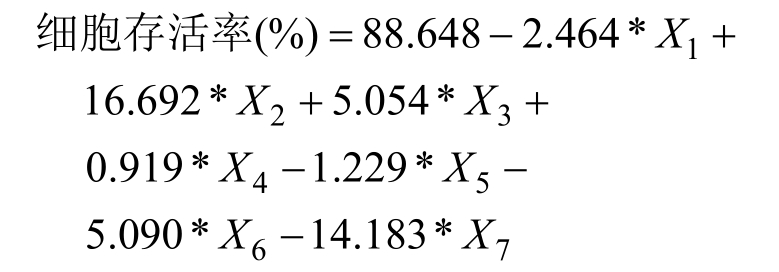
回归系数如表 9所示,7个共有峰中,峰 1(甘露糖)、峰5(半乳糖)、峰6(木糖)和峰7(岩藻糖)是活性负相关峰,峰2(氨基葡萄糖)、峰3(核糖)和峰4(葡萄糖)为活性正相关峰,其对RAW264.7细胞存活作用的贡献大小排序为峰2(氨基葡萄糖)>峰3(核糖)>峰4(葡萄糖)。有研究表明茶多糖中的甘露糖、鼠李糖、半乳糖和阿拉伯糖与其抗氧化活性密切相关,其中木糖和半乳糖其抗氧化能力呈负相关,而鼠李糖呈正相关[19]。此外,多糖的单糖组成也与抗肿瘤活性相关,通常含有葡萄糖多糖抗肿瘤活性较好,可能原因是在人类巨噬细胞中具有葡萄糖受体[20]。
表9 PLS分析结果
Table 9 Analysis results of PLS

特征峰 回归系数峰1:甘露糖Man –2.464峰2:氨基葡萄糖GlcN 16.692峰3:核糖Rib 5.054峰4:葡萄糖Glc 0.919峰5:半乳糖Gal –1.229峰6:木糖Xyl –5.090峰7:岩藻糖Fuc –14.183
3 结论
本研究建立了一种柱前 PMP衍生化液相色谱测定香菇多糖单糖组成的方法,方法学研究表明该方法准确度高,重现性、稳定性好,可应用于香菇多糖样品的单糖组成分析。采用该方法对81批次香菇多糖样品进行分析,构建了基于多糖单糖组成信息的液相色谱指纹图谱。为香菇多糖的质量控制和活性测定提供更全面的参考。此外,以指纹图谱为基础,运用偏最小二乘回归分析关联香菇多糖单糖组成与RAW264.7细胞存活率,建立的多糖指纹图谱谱效相关性研究,本研究将“谱”中的多糖活性成分群的特征峰与“效”所代表的生理功效结果相对应,研究其中的规律,初步探索香菇多糖的谱效相关性。
[1] 张俊霞, 王利.仪器分析技术[M].重庆: 重庆大学出版社,2015: 307.ZHANG J X, WANG L.Instrumental analysis technology [M].Chongqing: Chongqing University Press, 2015: 307.
[2] YU Y, LIU X F, MIAO J K, et al.Chitin from Antarctic krill shell: eco-preparation, detection, and characterization.International Journal of Biological Macromolecules[J].2020, 164: 4125-4137.
[3] HU J, LIU Y, CHENG L, et al.Comparison in bioactivity and characteristics of Ginkgo biloba seed polysaccharides from four extract pathways.Int J Biol Macromol[J].2020, 159: 1156-1164.
[4] 王浩豪, 戴军, 陈尚卫, 等.灵芝孢子粉多糖的PMP-HPLC指纹分析[J].食品与发酵工业, 2011, 37(12): 133-136.WANG H H, DAI J, CHEN S W, et al.Analysis of PMP-HPLC fingerprints of polysaccharides from ganoderma lucidum spores[J].Food and Fermentation Industries, 2011, 37(12): 133-136.
[5] 胡明华, 王琴, 戴军, 等.多糖组分色谱指纹图谱聚类分析可可粉的掺假鉴别[J].食品与发酵工业, 2012, 38(8): 173-177.HU M H, WANG Q, DAI J, et al.Adulteration detection of cocoa powder by clustering analysis of polysaccharide components[J].Food and Fermentation Industries, 2012, 38(8): 173-177.
[6] LI C, LI X, YOU L, et al.Fractionation, preliminary structural characterization and bioactivities of polysaccharides from Sargassum pallidum[J].Carbohydr Polym, 2017, 155: 261-270.
[7] ZHANG Y, ZHOU T, WANG H, et al.Structural characterization and in vitro antitumor activity of an acidic polysaccharide from Angelica sinensis (Oliv.) Diels[J].Carbohydr Polym, 2016, 147:401-408.
[8] WANG M, YANG X B, ZHAO J W, et al.Structural characterization and macrophage immunomodulatory activity of a novel polysaccharide from Smilax glabra R oxb[J].Carbohydr Polym, 2017, 156: 390-402.
[9] WANG S, LI Q, ZANG Y, et al.Apple Polysaccharide inhibits microbial dysbiosis and chronic inflammation and modulates gut permeability in HFD-fed rats[J].Int J Biol Macromol, 2017, 99:282-292.
[10] SHI G J, ZHENG J, WU J, et al.Beneficial effects of Lycium barbarum polysaccharide on spermatogenesis by improving antioxidant activity and inhibiting apoptosis in streptozotocininduced diabetic male mice[J].Food & Function, 2017, 8(3):1215-1226.
[11] REN L, PERERA C, HEMAR Y.Antitumor activity of mushroom polysaccharides: a review[J].Food & Function, 2012,3(11): 1118-1130.
[12] SUN X, WANG H, HAN X, et al.Fingerprint analysis of polysaccharides from different Ganoderma by HPLC combined with chemometrics methods[J].Carbohydr Polym, 2014, 114:432-439.
[13] 张勇.铁皮石斛茎、叶、花多糖理化性质及抗氧化、免疫调节活性研究[D].杭州: 浙江大学, 2016.ZHANG Y.Physicochemical properties, antioxidant and immunomodulatory activities of polysaccharides from the stem,leave and flower of Dendr obium candidum[D].Hangzhou:Zhejiang University, 2016.
[14] XU X, YAN H, ZHANG X.Structure and immuno- stimulating activities of a new heteropolysaccharide from Lentinula edodes[J].J Agric Food Chem, 2012, 60(46): 11560- 11566.
[15] CHEN H, JU Y, LI J, et al.Antioxidant activities of polysaccharides from Lentinus edodes and their significance for disease prevention[J].Int J Biol Macromol, 2012, 50(1): 214-218.
[16] ZHAO Y M, WANG J, WU Z G, et al.Extraction, purification and anti-proliferative activities of polysaccharides from Lentinus edodes[J].Int J Biol Macromol, 2016, 93(Pt A): 136-144.
[17] JEFF I B, YUAN X, SUN L, et al.Purification and in vitro anti-proliferative effect of novel neutral polysaccharides from Lentinus edodes[J].Int J Biol Macromol, 2013, 52: 99-106.
[18] TIAN Y, ZHAO Y, ZENG H, et al.Structural characterization of a novel neutral polysaccharide from Lentinus giganteus and its antitumor activity through inducing apoptosis[J].Carbohydr Polym, 2016, 154: 231-240.
[19] 艾于杰.抗氧化活性茶多糖构效关系研究[D].武汉: 华中农业大学, 2019.AI Y J, Study on the structure-activity relationship of antioxidant tea polysaccharides[D].Wuhan: Huazhong Agricultural University,2019.
[20] 张琪琳.香菇多糖的结构鉴定及抗肿瘤作用机制研究[D].武汉: 华中科技大学, 2015.ZHANG Q L.Structural elucidation and antitumor mechanisms of polysaccharides isolated from Lentinus edodes[D].Wuhan:Huazhong University of Science and Technology, 2015.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/index.axpx)、中国知网、万方、维普、超星等数据库下载获取。