乳液是一种或多种液体以液滴形式分散在另一种与之不相溶的液体中形成的分散体系[1]。相较于表面活性剂稳定的传统乳液,由固体颗粒稳定的 Pickering乳液展现出更好的贮藏稳定性,抗聚集,抗絮凝,可调控等特点[2-3]。近年来,Pickering乳液在医药和食品领域受到越来越多的关注,不仅因为其出色的稳定性,还因为生物基固体颗粒的广泛开发。这些生物基固体颗粒,包括蛋白、淀粉、纤维素、壳聚糖等等,赋予Pickering乳液更好的生物安全性和环境相容性,使得乳液具有广阔的应用前景。
作为最常用的生物聚合物之一,纤维素因其非常丰富的来源,低成本,生物可降解性和生物相容性等特点已成为食品级Pickering乳化稳定剂的良好候选物。目前,具有纳米尺寸的纳米纤维素受到广泛的关注,根据纳米纤维素的尺寸、形态和制备方法,其主要分为三种:纤维素纳米晶体(cellulose nanocrystals,CNCs)、纤维素纳米丝(cellulose nanofibrils,CNFs)和细菌纳米纤维素(bacterial nanocellulose,BNC)[4-6]。已经有很多研究人员利用农林废料制备出纳米纤维素,比如菠萝叶[7],棕榈树[8],米糠[9],开心果壳[10]等。这些纳米纤维素可以有效稳定Pickering乳液,其稳定机制为纳米纤维素不可逆地吸附在油水界面处,形成致密的界面膜,将油相包裹在内部,同时结合空间位阻效应,阻止液滴之间相互絮凝和聚集[11]。
但需要注意的是,目前有关纳米纤维素制备和应用的研究重点主要集中在 CNCs上,CNFs的研究相对较少。相较于酸水解制备的 CNCs,CNFs无需水解通过机械处理即可制备[5]。这种物理加工方法也有利于保护环境。另外,我国是第一大白果生产国,每年有大量白果被消耗,随之产生了大量白果壳废料。从果壳废物中生产纳米纤维素可以大大提高这些废弃物的经济价值。因此,本研究以白果壳纤维素为原料,通过高压均质制备CNFs,并研究其在Pickering乳液中的应用,为果壳废弃物的利用提供一定的方法。
1 材料和方法
1.1 材料与仪器
白果,去除果仁得到白果壳:江苏泰州;氢氧化钠、亚氯酸钠、乙酸,均为分析纯:国药集团化学试剂有限公司。
AH-2010型高压均质机:安拓思纳米技术(苏州)有限公司;多角度粒度与高灵敏度Zeta电位分析仪:美国布鲁克海文仪器公司;原子力显微镜:德国布鲁克公司;傅里叶红外光谱仪(FTIR):美国 Nicolet公司;X-ray衍射仪(X-ray):德国布鲁克AXS有限公司;S3500激光粒度分析仪:美国Microtrac公司;Axio Vert A1倒置荧光显微镜:德国蔡司公司;T18高速匀浆机:美国IKA公司;OCA15光学接触角测量仪:德国Dataphysics公司。
1.2 白果壳CNFs的制备
按照Ni等[2]的方法对白果壳进行纯化处理。将粉碎的白果壳和 4%的氢氧化钠溶液按照料液比1∶25(w/v)的比例混合,在90 ℃水浴下加热2 h,随后过滤去除氢氧化钠溶液,用去离子水洗涤。此过程重复 2次,在 50 ℃条件下热风干燥。随后将干燥的纤维素按照料液比1∶25(w/v)的比例与漂洗液(每100 mL漂洗液中含有1.5 g亚氯酸钠,2.5 g氢氧化钠和8 mL乙酸)混合,在80 ℃水浴下加热2 h,过滤去除漂洗液。此过程重复2次,用去离子水反复清洗至纤维素悬浮液的pH至中性。
采用高压均质进一步处理纯化后的纤维素颗粒。取4份100 mL的0.3%(w/v)的纤维素悬浮液置于高压均质机中,均质压力分别调节为10、30、50和70 MPa,处理过后得到的CNFs依次记为 CNFs-10,CNFs-30,CNFs-50,CNFs-70。
1.3 CNFs的性质表征
1.3.1 颗粒尺寸和电位
纤维素悬浮液稀释100倍,采用多角度粒度与高灵敏度Zeta电位分析仪测量CNFs颗粒的尺寸和电位。
1.3.2 CNFs形态
采用原子力显微镜观察CNFs颗粒的形态[2]。悬浮液浓度稀释至0.003%(w/v),随后取10 μL稀释的悬浮液小心滴在云母片上,室温下干燥。干燥的云母片放置于设备中进行观察颗粒形态。Bruker Dimension Fast Scan AFM软件进行样品分析。
1.3.3 FTIR和X-ray测量
FTIR和X-ray用于观察不同均质压力得到的CNFs的化学基团和结晶度的差异。干燥的CNFs颗粒粉末和溴化钾按照1∶50的比例进行压片。FTIR的扫描波长范围4 000~400 cm–1。X-ray测量的 2θ 范围 3°到 50°(1 °/min)。纤维素结晶度根据公式(1)计算:
1.3.4 颗粒静水接触角
CNFs的静水接触角按照 Li等[12]的方法。CNFs悬浮液干燥成薄膜,将薄膜铺平在光学接触角仪器测量平台上,缓慢低落2 μL的去离子水到薄膜上,平衡2 min后,采用高速摄像头进行照片采集,并用OCA15软件进行数据处理。
1.4 Pickering乳液的制备
参照Ni等[2]的方法制备乳液。将CNFs悬浮液稀释至0.3%(w/v),随后按照V(油)∶V(水)=20∶80的比例将油相和水相进行混合,制备乳液。高速匀浆机以10 000 r/min的速率处理混合体系2 min得到粗乳液,随后高压均质机进一步处理粗乳液(30 MPa,循环2次)得到Pickering乳液。
1.5 乳液性质表征
1.5.1 乳液粒径尺寸和粒径分布
乳液的粒径尺寸和粒径分布采用激光粒度分析仪进行测定。乳滴的折射率设置为 1.49。乳液样品用去离子水进行分散,每个样品测量3次。
1.5.2 乳液微观结构
采用倒置显微镜对乳液微观结构进行观察。乳液用去离子水稀释10倍,随后吸取20 μL的样品,仔细滴在载玻片上,轻轻盖上盖玻片进行观察。
1.5.3 乳液离心稳定性
参照Ni等[2]的方法测量乳液离心稳定性。吸取5 mL乳液加入到离心管中,在10 000 r/min转速下室温离心10 min,考察乳液离心稳定性。
1.5.4 乳液储藏稳定性
将制备好的乳液装入样品瓶中,盖好瓶盖,在25 ℃环境中,放置3个月。
1.6 数据统计与分析
各组实验重复3次,采用SPSS18.0进行统计分析,Origin 9.0软件进行作图处理。
2 结果与讨论
2.1 CNFs的尺寸和形态
不同均质压力分别得到的 CNFs尺寸和形态见表1和图1。由表1可知,对照样品(纯化后的纤维素)经过高压均质处理后,纤维素颗粒尺寸显著下降,并且所得到的纤维素展现出丝状形态(图1)。相似的丝状CNFs形态也出现在香蕉皮[13]、槟榔皮[14]和麦秸纤维[15]等研究中。随着均质压力的提高,CNFs的长度从11 450 nm降低至5 987 nm,直径也从78 nm减少到47 nm。这种尺寸的变化清晰的展示在图1中,CNFs-10展现出长、粗的丝状形态,当均质压力提高,CNFs逐渐变短变细。这意味着提高均质压力可以有效降低CNFs尺寸。不同于 CNCs,CNFs是一种由结晶区和非结晶区交替排列而成的长而柔韧的纳米纤维素纤维[5]。因此,在高压、高速剪切和激烈的湍流作用下,部分结晶区和非结晶区会发生断裂,使得纤维素尺寸发生变化。相对于直径的变化,纤维素长度受均质压力的影响更大。但是当均质压力超过50 MPa,CNFs的尺寸变化相对小很多。此外,不同均质压力得到的 CNFs悬浮液的电位也存在着差异。CNFs-50和CNFs-70的电位绝对值显著高于CNFs-10和CNFs-30的电位,这可能是因为更高的均质压力造成更多结晶区和非结晶区的断裂,从而暴露更多的阴离子基团[13]。Costa,等[13]和 Ni等[2]也报道了高压均质会引起纤维素悬浮液电位的降低。
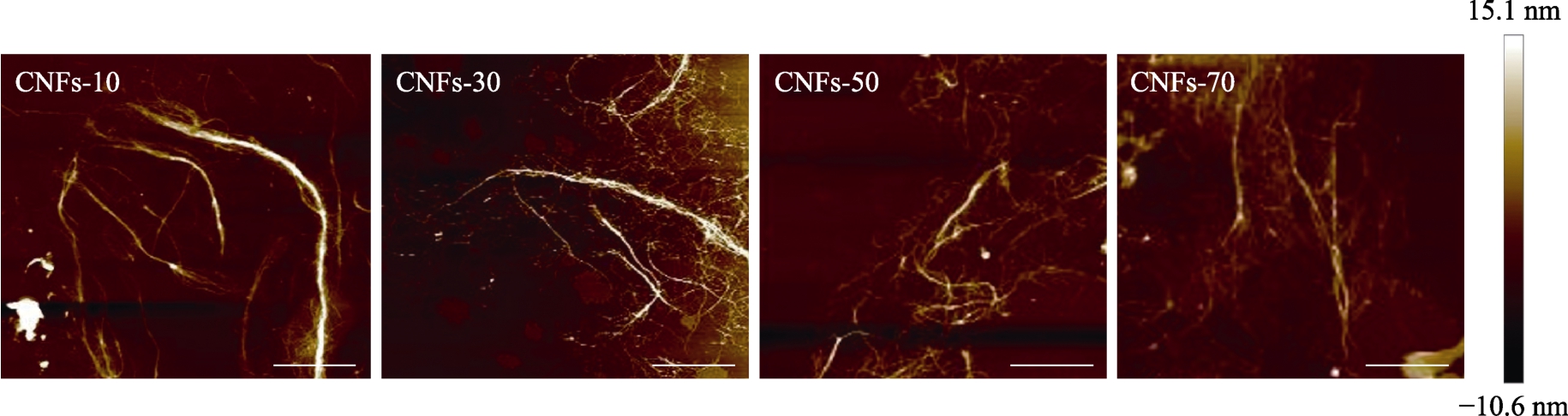
图1 CNFs颗粒形态
Fig.1 The morphology of different CNFs
2.2 CNFs的FTIR和X-ray
FTIR用于观察不同CNFs之间功能基团的变化。图2中,所有样品在3 400~3 300 cm–1和1 630~1 640 cm–1处都有宽吸收峰,它们分别对应羟基的拉伸振动和弯曲振动。2 920 cm–1处的峰是由C-H脂肪键的拉伸引起的。在所有样品中也都能看到1 029.21 cm–1处的宽峰,其对应的是C-O-C吡喃糖环骨架振动。值得注意的是,相比白果壳原料的光谱,纯化后的白果壳光谱中1 735 cm–1、1 500 cm–1、1 270 cm–1三个峰几乎消失。1 735 cm–1峰的出现归因于白果壳中半纤维素和木质素组分中羰基、酯基和乙酰基中C=O键的拉伸特性[16]。1 500 cm–1峰归因于木质素芳香环中的C=C键。1 270 cm–1与木质素中芳基的C-O伸缩有关[17]。结果说明,白果壳的纯化过程可以有效去除壳中的半纤维素和木质素。但是,纯化后的纤维素的光谱和CNFs光谱之间没有差异,并且不同CNFs之间也没有峰的消失或增加,说明高压均质处理对纤维素的功能基团没有影响。结果跟前人的研究一致[2,13]。
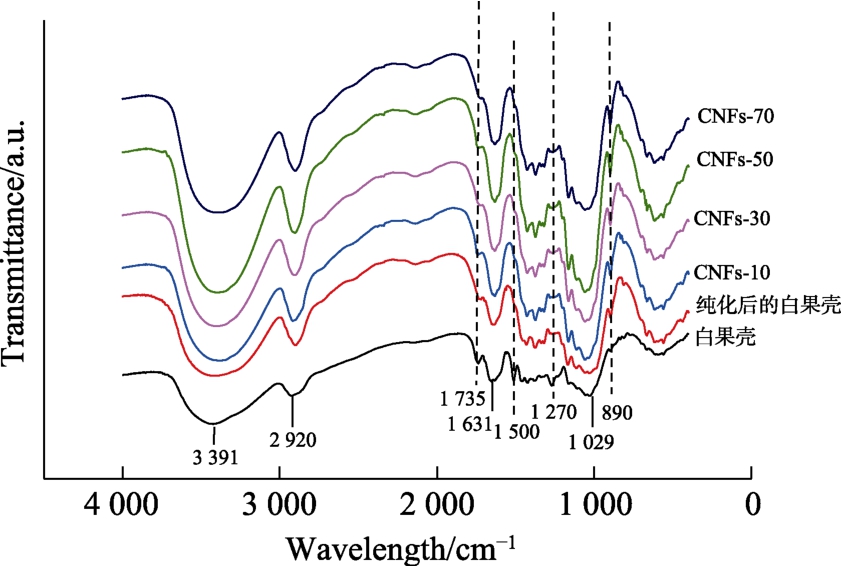
图2 CNFs的FTIR图谱
Fig.2 FTIR spectra of raw ginkgo seed shells and CNFs
X-ray衍射用于探究高压均质对于CNFs结晶度的影响。表1展示了不同CNFs颗粒的结晶度值。很明显,随着均质压力的增加,所得到的CNFs的结晶度值显著下降。相较于纯化后的纤维素(47%),CNFs-70的结晶度值(33%)下降了14%。Winuprasith等[18]在制备山竹壳微纤化纤维素(MFCs)过程中,也发现高压均质处理会降低MFCs的结晶度。结晶度的降低可能因为高压均质使得纤维素分子间的氢键被破坏,导致纤维素中的部分晶体结构崩溃[18]。
表1 不同均质压力得到的CNFs的物理性质
Table 1 The physical properties of CNFs under different homogenization pressure

注:每列中不同的小写字母代表样品之间存在显著性差异(P<0.05)。
样品 长度/nm 直径/nm 纵横比 电位/mV 结晶度/%对照 / 89 250 ± 6 280a / –0.9 ± 0.1d 47.84 ± 0.36a CNFs-10 11 450 ± 587a 78.47 ± 3.64b 146 –13.6 ± 1.0c 42.26 ± 1.22b CNFs-30 8 475 ± 247b 60.54 ± 5.21c 141 –24.5 ± 2.5b 37.27 ± 0.98c CNFs-50 6 324 ± 354c 50.21 ± 3.55d 126 –27.0 ± 1.5a 35.21 ± 0.52d CNFs-70 5 787 ± 148d 47.75 ± 4.27d 123 –27.6 ± 1.7a 33.11 ± 0.46e
2.3 CNFs的静水接触角
静水接触角有助于揭示CNFs疏水性的变化。图3展示了不同CNFs的静水接触角,可以发现越高压力制备的 CNFs具有越大的静水接触角。CNFs-10的静水接触角仅仅为20.4°,意味着其具有相对强的亲水性。当均质压力增加到70 MPa,CNFs-70的静水接触角增加到36.4°,说明纤维素颗粒的疏水性提高。Costa等[13]也报道了相似的现象,高压均质处理后,香蕉皮 CNFs的疏水性增加。前人研究发现,纤维素纳米晶体的疏水性跟其疏水(200)β晶体边缘有着密切的关系[19-20]。在油/水体系中,这个(200)β疏水晶体边缘对于纳米纤维素的润湿性起到非常重要的作用,会直接与油界面相互作用,使得纳米纤维素吸附在油/水界面。但是(200)β疏水晶面通常位于纤维素晶体的角落,更多亲水晶面处在纤维素表面[20]。均质处理过程会导致纤维素断裂,并且结晶区域会受到影响,可能导致更多的(200)β疏水晶面暴露。因此,纤维素的疏水性得到提高。

图3 不同CNFs的静水接触角
Fig.3 The static water contact angles of different CNFs
2.4 CNFs稳定的Pickering乳液
2.4.1 乳液粒径大小和粒径分布
图 4显示的是乳液的粒径分布,可以看出所有乳液呈现双峰分布。其中大峰应该归因于乳液中的乳滴,小峰应该是未吸附的CNFs颗粒。Du等[21]利用疏水改性CNCs制备Pickering乳液也发现了相似的双峰乳液粒径分布。从小峰的变化可以看出,随着均质压力的提高,小峰占比以及尺寸逐渐变小,意味着未吸附的 CNFs颗粒数量和尺寸都变小。另外,更高压力制备的 CNFs稳定的乳液的高峰逐渐从大尺寸位置向小尺寸位置移动,并且乳滴尺寸从 50.41 μm(CNFs-10)下降到30.20 μm(CNFs-70)。乳液的微观结构(图5)也清晰证明了乳液尺寸的降低,CNFs-70的乳滴尺寸明显小于CNFs-10。这说明CNFs-70具有更好的乳化性质。CNFs颗粒乳液性质的提高可能归因于颗粒尺寸的减小和疏水性的提高[22]。相对于大颗粒,小尺寸的颗粒更容易吸附在油水界面由于其更低的吸附能障碍[23]。增加的疏水性也进一步促进 CNFs吸附到油水界面。结果跟 Ni等[24]的报道一致。

图4 CNFs稳定乳液的粒径分布
Fig.4 Particle size distribution of emulsions stabilized by CNFs

图5 CNFs稳定乳液的微观结构
Fig.5 The microstructure of emulsions stabilized CNFs
2.4.2 乳液稳定性
图 6分别展示乳液的离心稳定性(图 6-A)和储藏稳定性(图6-B)。从图6-A中可以看出,乳液离心后分为三相,最上层的油相,中层的乳液相和下层的水相,但是不同 CNFs稳定的乳液的相厚度有着明显的差异。CNFs-10乳液离心后,油相和水相几乎完全分离,仅仅一层薄薄的乳液层,说明CNFs-10具有较差的乳化性质,其形成的乳液很容易被破坏。CNFs-30乳液离心后,最上层的油相明显减少,乳液相也明显增加,意味着CNFs-30具有比CNFs-10更强的乳化性质,乳液不易被破坏。而CNFs-70乳液离心后,其展现出最少的油相,最高的乳液相,意味着 CNFs-70具有最好的乳化性质。结果跟乳液尺寸结果一致。图7-B显示的是贮藏3个月后的乳液,很明显,CNFs-10乳液已经不稳定,而其余三种乳液仍然具有较好的稳定性,表2中的乳液粒径在贮藏前后的变化也证实 CNFs-30,CNFs-50和 CNFs-70乳液具有较好的稳定性,尤其是CNFs-70乳液。这些结果意味着从白果壳中制备的 CNFs可以有效稳定Pickering乳液。
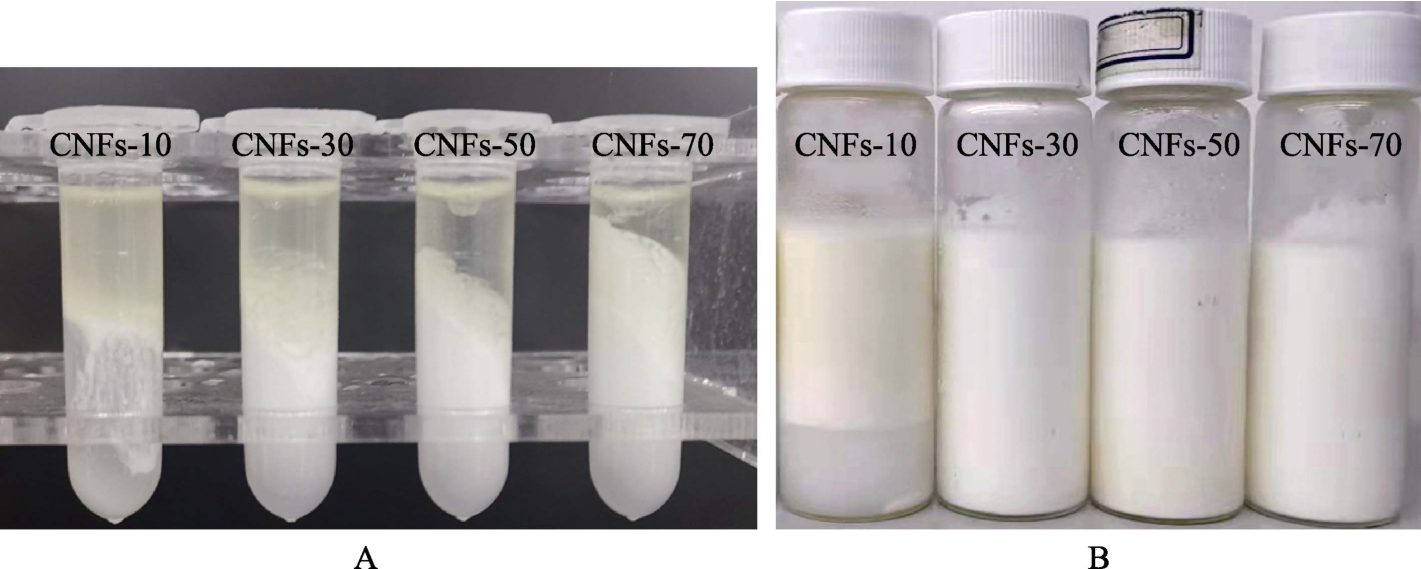
图6 CNFs乳液离心稳定性(A)和储藏稳定性(B)
Fig.6 The centrifugation stability (A) and storage stability (B) of CNFs stabilized emulsions
表2 乳液贮藏前后的尺寸
Table 2 The droplet size of emulsions before and after storage μm
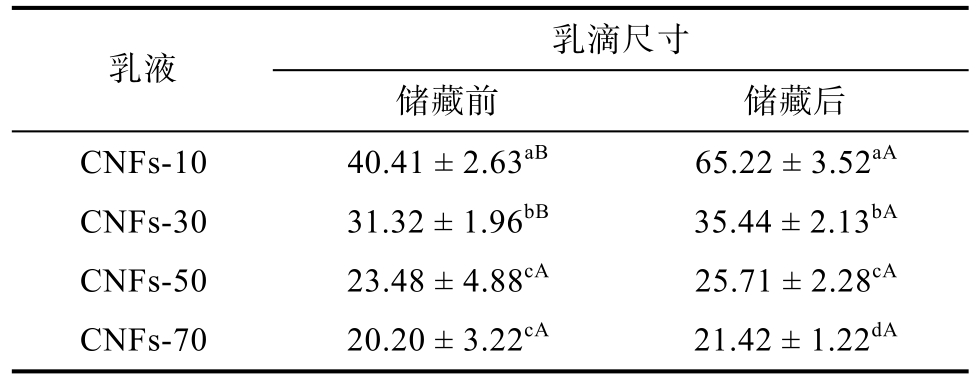
注:不同的小写字母代表贮藏前或者贮藏后乳滴尺寸存在显著性差异(P<0.05);不同的大写字母代表贮藏前后乳滴尺寸存在显著性差异(P<0.05)。
乳滴尺寸乳液 储藏前 储藏后CNFs-10 40.41 ± 2.63aB 65.22 ± 3.52aA CNFs-30 31.32 ± 1.96bB 35.44 ± 2.13bA CNFs-50 23.48 ± 4.88cA 25.71 ± 2.28cA CNFs-70 20.20 ± 3.22cA 21.42 ± 1.22dA
3 结论
本文以白果壳为原料,通过调节均质压力10~70 MPa制备不同尺寸的 CNFs,并对这些 CNFs进行表征。结果表明,CNFs呈现丝状形态,均质压力对于 CNFs的物理性质有显著影响,当均质压力从10 MPa增加到70 MPa,CNFs长度从11 450 nm降低到 5 787 nm,悬浮液电位从–13.6 mV下降到–27.6 mV,结晶度从47.84下降到33.11,并且CNFs的疏水性提高。Pickering乳液的稳定性跟 CNFs的物理性质有着密切的关系,CNFs-10制备的乳液展现出较差的稳定性因为其大尺寸和低疏水性,而CNFs-70制备的乳液具有出色的稳定性由于其小尺寸和相对较高的疏水性。
[1] 田怀香, 卢卓彦, 胡静.食品级皮克林乳液制备及应用研究进展[J].中国食品学报, 2018, 18(1): 225-232.TIAN H X, LU Z Y, HU J.Preparation and application of foodgrade pickering emulsion[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(1): 225-232.
[2] NI Y, LI J, FAN L.Production of nanocellulose with different length from ginkgo seed shells and applications for oil in water Pickering emulsions[J].Int J Biol Macromol, 2020, 149: 617-626.
[3] TAVERNIER I, WIJAYA W, VAN DER MEEREN P, et al.Foodgrade particles for emulsion stabilization[J].Trends in Food Science & Technology, 2016, 50: 159-174.
[4] 陈媛, 张欢, 余永, 等.纤维素纳米晶稳定Pickering乳液及其环境响应性研究进展[J].食品与发酵工业, 2020, 46(24):238-245.CHEN Y, ZHANG H, YU Y, et al.Research progress of cellulose nanocrystals stabilized Pickering emulsion and its environmental responsiveness[J].Food and Fermentation Industries, 2020,46(24): 234-241.
[5] GARCÍA A, GANDINI A, LABIDI J, et al.Industrial and crop wastes: A new source for nanocellulose biorefinery[J].Industrial Crops and Products, 2016, 93: 26-38.
[6] PHANTHONG P, REUBROYCHAROEN P, HAO X, et al.Nanocellulose: Extraction and application[J].Carbon Resources Conversion, 2018, 1(1): 32-43.
[7] SANTOS R M D, FLAUZINO NETO W P, SILVÉRIO H A,et al.Cellulose nanocrystals from pineapple leaf, a new approach for the reuse of this agro-waste[J].Industrial Crops and Products,2013, 50: 707-714.
[8] OKAHISA Y, FURUKAWA Y, ISHIMOTO K, et al.Comparison of cellulose nanofiber properties produced from different parts of the oil palm tree[J].Carbohydr Polym, 2018, 198: 313-319.
[9] ANGKURATIPAKORN T, SRIPRAI A, TANTRAWONG S, et al.Fabrication and characterization of rice bran oil-in-water Pickering emulsion stabilized by cellulose nanocrystals[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017,522: 310-319.
[10] KASIRI N, FATHI M.Production of cellulose nanocrystals from pistachio shells and their application for stabilizing Pickering emulsions[J].Int J Biol Macromol, 2018, 106: 1023-1031.
[11] KALASHNIKOVA I, BIZOT H, BERTONCINI P, et al.Cellulosic nanorods of various aspect ratios for oil in water Pickering emulsions[J].Soft Matter, 2013, 9(3): 952-959.
[12] LI X, LI J, GONG J, et al.Cellulose nanocrystals (CNCs) with different crystalline allomorph for oil in water Pickering emulsions[J].Carbohydr Polym, 2018, 183: 303-310.
[13] COSTA A L R, GOMES A, TIBOLLA H, et al.Cellulose nanofibers from banana peels as a Pickering emulsifier: High-energy emulsification processes[J].Carbohydr Polym, 2018, 194: 122-131.
[14] C.S J C, GEORGE N, NARAYANANKUTTY S K.Isolation and characterization of cellulose nanofibrils from arecanut husk fibre[J].Carbohydrate Polymers, 2016, 142: 158-166.
[15] ZIMMERMANN T, BORDEANU N, STRUB E.Properties of nanofibrillated cellulose from different raw materials and its reinforcement potential[J].Carbohydrate Polymers, 2010, 79(4):1086-1093.
[16] HENRIQUE M A, SILVERIO H A, FLAUZINO NETO W P,et al.Valorization of an agro-industrial waste, mango seed, by the extraction and characterization of its cellulose nanocrystals[J].J Environ Manage, 2013, 121: 202-209.
[17] SUN X F, XU F, SUN R C, et al.Characteristics of degraded cellulose obtained from steam-exploded wheat straw[J].Carbohydr Res, 2005, 340(1): 97-106.
[18] WINUPRASITH T, SUPHANTHARIKA M.Microfibrillated cellulose from mangosteen (Garcinia mangostana L.) rind:Preparation, characterization, and evaluation as an emulsion stabilizer[J].Food Hydrocolloids, 2013, 32(2): 383-394.
[19] KALASHNIKOVA I, BIZOT H, CATHALA B, et al.Modulation of cellulose nanocrystals amphiphilic properties to stabilize oil/water interface[J].Biomacromolecules, 2012, 13(1): 267-275.
[20] CHERHAL F, COUSIN F, CAPRON I.Structural description of the interface of pickering emulsions stabilized by cellulose nanocrystals[J].Biomacromolecules, 2016, 17(2): 496-502.
[21] DU LE H, LOVEDAY S M, SINGH H, et al.Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals:Responsiveness to pH and ionic strength[J].Food Hydrocolloids,2020, 99: 105344.
[22] NI Y, LI J, FAN L.Effects of ultrasonic conditions on the interfacial property and emulsifying property of cellulose nanoparticles from ginkgo seed shells[J].Ultrason Sonochem, 2020, 70: 105335.
[23] TAMAYO TENORIO A, GIETELING J, NIKIFORIDIS C V,et al.Interfacial properties of green leaf cellulosic particles[J].Food Hydrocolloids, 2017, 71: 8-16.
[24] NI Y, FAN L, SUN Y.Interfacial properties of cellulose nanoparticles with different lengths from ginkgo seed shells[J].Food Hydrocolloids, 2020, 109: 106121.
备注:本文的彩色图表详见本期 PC13-C14,也可从本刊官网(http://lyspkj.ijournal.cn/ch/ index.axpx)、中国知网、万方、维普、超星等数据库下载获取。