近年来,由固体颗粒稳定的Pickering乳液在食品、医药和化妆品领域受到越来越多的关注。相较于表面活性剂稳定的传统乳剂,Pickering乳液展现出更好的贮藏稳定性、抗聚集、抗絮凝、可调控等特点。这种出色的乳液稳定性归因于固体颗粒不可逆的吸附在油水界面形成致密的界面膜[1]。通常,固体颗粒作为Pickering乳液稳定剂需要具备以下几点性质[1]:1)颗粒应被连续相和分散相部分润湿,但不溶于任何一个相;2)颗粒应保持适当的部分润湿性,以获得足够的界面吸收效率;3)颗粒尺寸应远小于目标乳液的乳滴大小(至少小一个数量级)。目前,用于稳定Pickering乳液的固体颗粒主要包括二氧化硅、二氧化钛等无机颗粒,蛋白质、多糖等有机颗粒。但是无机颗粒的使用可能对健康存在潜在的危害,限制了其在食品领域的应用[2-3]。因此,从天然资源中开发生物基Pickering乳液颗粒稳定剂具有重要意义。
纤维素由 β-1,4-糖苷键线性连接的脱水葡萄糖单元组成,是自然界分布最广,含量最丰富的生物聚合物[4]。由于纤维素具有良好的生物相容性,生物降解性,可再生性,低成本等特点,受到越来越多的关注。纤维素纳米晶体(CNCs),也被称为纳米晶纤维素或纤维素纳米晶须,是一种从木质纤维素生物质中提取出来的呈现宽棒状或针状的具有高结晶度(CrI)和高纵横比的纳米纤维颗粒[4-5]。目前,CNCs已经广泛应用到多个领域,比如生物医药、纳米复合材料、食品等。在食品工业中,CNCs可以作为食品增稠剂、稳定剂、功能性成分和食品包装材料等。尤其,作为生物相容性的纳米颗粒,CNCs已经成为食品级Pickering乳化稳定剂的良好候选物之一。本综述主要总结了 CNCs的制备方法及其影响稳定Pickering乳液的因素。
1 CNCs的来源和制备方法
1.1 CNCs的来源
纤维素材料广泛存在于自然界中,从天然的植物纤维素来源可以将纤维素资源分为六大类[6]:黄麻,亚麻等韧皮纤维;剑麻,菠萝等叶子纤维;椰壳纤维,棉花等种子纤维;洋麻,大麻等内芯纤维;水稻,玉米等秸秆纤维和木头等其他类型。此外,细菌(Acetobacter xylinum)[7]和海洋生物[8]也是纤维素的来源之一。不管这些分类如何,来源于工业和农业废料的木质纤维素资源是优良的纤维素原料。充分利用这些资源,不仅可以减少资源浪费,还可以提高废料的附加值。天然纤维素颗粒存在大量的羟基,具有很强的亲水性,展现出较差的润湿性,无法稳定Pickering乳液。因此,需要通过一定的方法处理天然纤维素制备出具有一定双亲性的纳米纤维素。
1.2 CNCs的制备方法
通常,植物纤维素原料含有复杂的成分,主要包括纤维素、木质素、半纤维素和其他成分(果胶、蛋白和腊质等)。这些非纤维素成分的存在不仅会降低 CNCs的结晶度,还会影响其机械和乳化性质[5,9]。因此,在制备CNCs颗粒前,需要对纤维素进行纯化提取处理。目前,纤维素的纯化方法主要包括三步[10-11]:(1)通过清洗、研磨(或蒸煮)去除原料中的灰尘和可溶性杂质;(2)利用碱液去除原料中的半纤维素和木质素成分;(3)随后进行漂白处理(也称为脱木质素)进一步去除残留的木质素。其中,KOH和NaOH是最常用的碱,漂白液可以选择NaClO2、NaClO或者H2O2。Ni等[12]利用 4%的 NaOH溶液和 1.7%的 NaClO漂白液对粉碎的白果壳进行纯化处理。Winuprasith等[13]利用 25%的 NaOH溶液和 30%的H2O2按照0.013 4∶1(w/w)的料液比对山竹壳纤维素进行纯化处理。Pelissari等[14]采用了5%的KOH溶液和1%的NaClO2溶液对香蕉皮纤维进行纯化处理。更多的前处理方法见表1。
表1 不同方法制备得到的CNCs
Table 1 CNCs were obtained using different methods

注:TEMPO为:2,2,6,6-四甲基哌啶氧化物(2,2,6,6-Tetramethyl-1-piperidinyloxy);TBAA为:四正丁基乙酸铵(Tetrabutylammonium acetate);DMAc为:二甲基乙酰胺(Dimethylacetamide)。
纤维素来源 纯化方法 制备方法 尺寸/nm 参考文献宽/高 长度白果壳 4% NaOH,1.7% NaClO2 62% H2SO4,45 ℃,30 min 24~50 406~1 500 [12]芦笋 NaOH,H2O2 60% H2SO4,50 ℃,1.5~3.5 min / 178.2~261.8 [15]谷物秸秆[16] 甲苯和乙醇(2:1),1.4% NaClO2,5% KOH 64% H2SO4,50 ℃,75 min 10~25 120~800 [16]微晶纤维素 / 6 mol/L HCl,110 ℃,3 h 16~20 255~286 [17]葛根渣 0.1 mol/L NaClO,4% NaOH 80% H3PO4,50 ℃,7 h 2~6 100~330 [18]木糖渣 3% NaOH,NaClO 1 mmol/L TEMPO,10 mmol/L NaBr,10 mmol NaClO,2 h 2.1 483 [19]桉树浆 NaClO,4% NaOH images/BZ_55_1148_881_1348_929.png有机酸( ),90~120 ℃,240 min / 275~380 [20]香蕉皮 5% KOH,1% NaClO2 木聚糖酶(30~70 U/g原料),pH=6,45 ℃,24 h 3.7 >1 000 [21]商业木浆 / 离子液体(TBAA/DMAc体系),65 ℃,1.5 h 10~30 200~300 [22]
纯化后的纤维素通常是细长的纤维素原纤维,由结晶区和非结晶区交替组成[4],需要采用一定的方法将纤维素原纤维进一步制备成纳米纤维素,见表 1。目前,酸水解法是制备 CNCs最常用的方法之一,其原理为强酸催化水解破坏纤维素的无定形区(非结晶区),留下结晶区[18,23-24]。常用的酸种类主要有硫酸、盐酸、磷酸及磷钨酸等[10]。值得注意的是,在酸水解过程,酸的种类、浓度、水解温度、水解时间、料液比以及纤维素的来源都会影响CNCs的物理化学性质[4,12,25]。硫酸是制备CNCs最常用的酸,经硫酸水解后得到的 CNCs表面会带有负电荷的磺基[4],这种带负电的性质会提供一定的静电排斥作用有利于CNCs悬浮液具有较好的胶体稳定性,但是负电荷太多也会影响CNCs作为Pickering稳定剂的稳定效果[26]。本课题组倪洋等[12]以白果壳为原料,采用62%浓度的硫酸,在45 ℃下,水解30 min,可以有效去除纤维素非结晶区,然后通过调节高压均质压力10~70 MPa,可以得到400~1 500 nm的CNCs。Wang等[15]以芦笋为原料,通过浓度为60%的硫酸,在 50 ℃下水解 1.5~3.5 h,可以得到178.2~261.8 nm的CNCs。考虑到硫酸水解得到的CNCs具有较低的得率,较差的热稳定性和低的结晶度[27],盐酸、磷酸等也被用于制备CNCs。Kasiri等[11]以开心果壳为原料,以3 mol/L盐酸溶液水解 180 min,可以得到直径为(68.8 ±20.7) nm,具有高结晶度(79.4%)的球形CNCs,且CNCs得率高达77.1%。Kontturi等[28]以棉花纤维为原料,采用盐酸蒸汽水解法制备得到长度为100~300 nm、直径为7~8 nm的CNCs,其得率高达97.4%,此方法对纤维素基质的形态影响小,不会在纤维素表面引入电荷,降解速度快、产量高,但存在成本高的问题。Camarero等[29]比较了硫酸水解、盐酸水解和磷酸水解对棉花CNCs性质的影响,发现磷酸水解得到的CNCs具有更好的热稳定性。
由于强酸会严重腐蚀设备且污染环境,国内外研究者尝试了很多绿色可循环利用的化学物质来制备CNCs,比如有机酸[30]、离子液体[22]、固化酸[31]等。除了酸水解法外,酶法[21,32]和机械法[33-35]也可以用于制备 CNCs。值得注意的是,不同的提取制备方法和不同的纤维素来源都会影响制备得到的纳米纤维素的形态和性质。比如图1,分别采用酶解法、机械破坏法和硫酸水解法处理木头纤维素,用原子力显微镜(AFM)进行形态表征,可以发现不同方法得到的纳米纤维素在形态上存在非常明显的差异。图2展示的是采用酸水解法处理不同纤维素原料得到的CNCs原子力显微镜图片,也可以清晰看出,原料对CNCs的形态也有一定的影响。
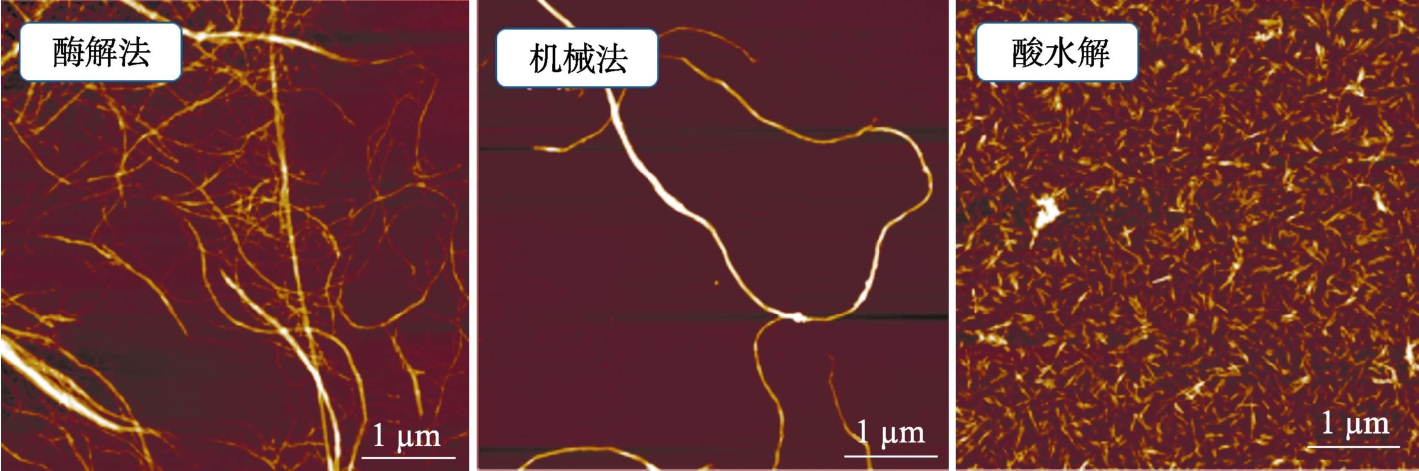
图1 不同方法制备得到的木头纳米纤维素[36]
Fig.1 Nanocellulose from wood pulp were obtained from different methods

图2 不同纤维素原料制备的CNCs原子力显微镜图像。芦笋[15];白果壳[37];软木[36];大蒜秸秆[38];菠萝叶[23];细菌纤维素[36]。
Fig.2 AFM images of CNCs obtained from various lignocellulosic materials.Asparagus[15]; Ginkgo seed shells[37]; Softwood[36];Garlic straw residues[38]; Pineapple leaf[23]; Bacterial cellulose[36].
2 影响CNCs稳定Pickering乳液的因素
2.1 CNCs自身性质的影响
2.1.1 CNCs形态的影响
不同于球状的颗粒,比如淀粉和蛋白质,CNCs是一种具有高纵横比的短棒状或针状颗粒。这种棒状颗粒可以在界面连接并形成桥式结构,可以更好的稳定Pickering乳液[39]。即使CNCs颗粒都呈现出相似的棒状形态,但不同来源,不同制备方法得到的CNCs在颗粒长度、纵横比方面存在着一定的差异(见图1和图2)。这种形态上的差异会影响 CNCs颗粒稳定乳液的表现。Kalashnikova等[40]制备了三种不同纵横比的CNCs,分别为:纵横比13的棉花CCN,纵横比47的细菌BCN和纵横比160的刚毛藻CLACN。作者分别利用这些不同纵横比 CNCs制备Pickering乳液,结果发现乳液的乳滴尺寸相似,但是颗粒纵横比直接影响乳滴上CNCs的表面覆盖率。纵横比13的CCN可以达到84%的表面覆盖率,而纵横比160的CLACN的表面覆盖率仅仅为44%。这是因为低纵横比CNCs可以紧密吸附在油水界面,而高纵横比 CNCs吸附在油水界面后会产生较大的空间位阻,阻碍了部分颗粒的吸附。另一方面,扫描电镜清晰显示吸附在乳滴表面的高纵横比的CLACN之间发生了纠缠,形成了三维网络结构,见图 3(A)。所形成的三维网络结构可以增加乳液体系黏度,提高乳液的稳定性。Ni等[12]以白果壳为原料,经硫酸水解后得到纤维素微米晶体,然后调节高压均质压力10~70 MPa,制备出不同长度的CNCs(400~1 500 nm),结果发现高压得到的短的 CNCs具有更好的乳化性质。Wang等[15]以芦笋为研究对象,通过延长硫酸水解时间来降低 CNCs尺寸,结果发现水解时间越长,得到的 CNCs尺寸越小,且乳化性质越好。
2.1.2 CNCs表面电荷的影响
利用酸水解制备 CNCs的过程中,尤其是硫酸和磷酸,会导致CNCs表面引入带负电的基团。尽管这些负电荷会提供一定的静电排斥促进CNCs稳定悬浮在水溶液中而不聚集沉淀,但强的静电排斥力也会导致CNCs无法稳定Pickering乳液[41]。Kalashnikova等[42]采用盐酸脱硫法对硫酸水解制备的棉花CNCs颗粒进行脱硫处理以调节CNCs的表面电荷密度。作者通过改变盐酸处理时间(1~10 h)制备出电荷密度为0.123~0.019 e/nm2的CNCs颗粒。结果发现,当CNCs表面电荷密度<0.03 e/nm2,CNCs可以有效稳定乳液;而CNCs表明电位密度>0.03 e/nm2,CNCs则无法制备出稳定的乳液,见图 3(B)。这是因为高电荷密度产生了过量的静电排斥,阻碍了 CNCs在油水界面的吸附和排列。因此,很多研究人员利用 CNCs制备Pickering乳液或者研究CNCs的界面吸附行为时,会在 CNCs体系中加入一定浓度的氯化钠溶液以起到静电屏蔽效应,从而降低CNCs之间的静电排斥行为[41-43]。
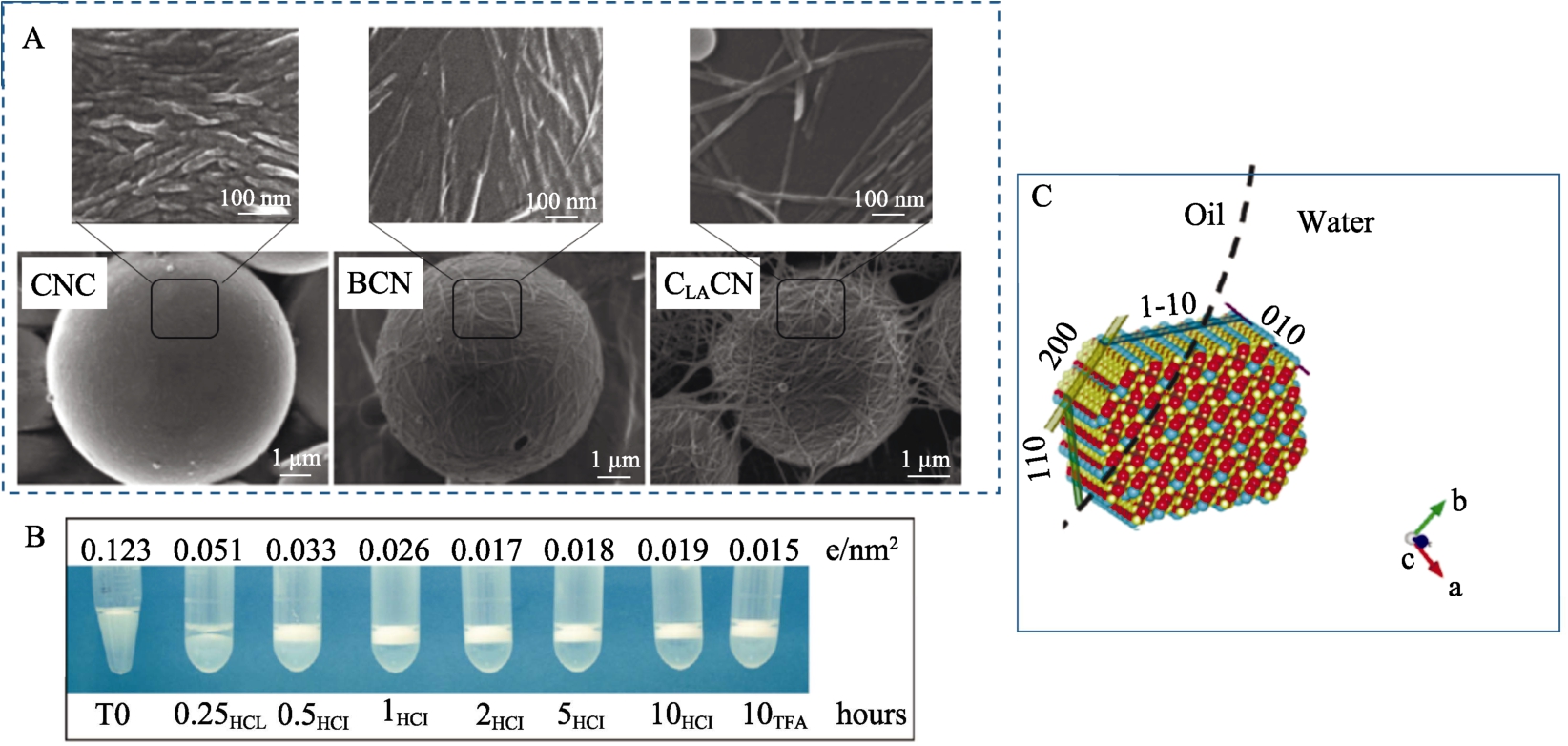
图3 A:CNCs纵横比对乳滴表面覆盖率的影响[40];B:CNCs表面电荷对乳液稳定性的影响[42];C:棉花CNCs在油/水界面稳定的示意图,(200)β疏水边缘和油相接触[42]。
Fig.3 A represents the effect of CNCs aspect ratios on the surface coverage ratio of droplets [40]; B represents the effect of CNCs surface charged density on the stability of emulsions[42]; C represents Schematic representation of cotton CNCs stabilization at the oil/water interface, exposing the hydrophobic edge (200) to the oil phase[42].
2.1.3 颗粒润湿性的影响
固体颗粒要成为Pickering乳液的稳定剂,需要具备被连续相和分散相部分润湿的性质。这种润湿性可以有助于固体颗粒吸附在油水界面。一般采用油水界面的三相接触角(θ)去衡量颗粒的润湿性[10]。三相接触角越大代表颗粒具有越高的疏水性。CNCs的疏水性主要归因于纤维素中的(200)β结晶边缘[42]。如图 3(C)所示,这个结晶边缘直接和界面相互作用,使得 CNCs可以吸附在油水界面。但是相较于蛋白质颗粒,未改性的CNCs颗粒具有相对较弱的疏水性。因此,提高CNCs疏水性一直受到研究者的关注。本课题组倪洋[12,44]分别利用高压均质和超声处理白果壳CNCs,采用静水接触角衡量CNCs颗粒的润湿性,结果表明,高压均质和超声都可以提高白果壳CNCs颗粒的疏水性。这可能是因为高压均质和超声处理可以破坏纤维素结晶结构,导致很多起初在角落的(200)β疏水区域得以暴露。Costa等[21]也发现超声处理可以提高香蕉皮纳米纤维素的疏水性。除了机械处理之外,很多研究者尝试化学改性的方法提高 CNCs的疏水性。比如,Chen等[45]利用辛烯基琥珀酸酐(OSA)对CNCs进行疏水改性,改性后的CNCs的三相接触角显著提高(85.0°)。作者利用这些疏水性增强的CNCs成功制备出高内相乳液。Du Le等[46]也利用了OSA对CNCs进行疏水改性,改性后颗粒的接触角从56°增加到80.2°,所制备的乳液展现出很好的稳定性。
2.2 环境因素的影响
由于CNCs的带电特性,体系中离子强度和pH的变化会影响 CNCs的电荷密度和相互作用[47]。Bertsch等[48]以硫酸制备的CNCs为研究对象,探究一价(Na+)和二价(Ca2+)阳离子对CNCs体系的影响。结果显示,阳离子的加入会改变CNCs悬浮液的zeta电位和流变性质,当离子强度达到一定范围,CNCs颗粒会相互聚集最终形成水凝胶。其中二价阳离子的影响更大,更少的二价阳离子就可以诱导 CNCs体系形成水凝胶。这种现象是因为阳离子会引起 CNCs的静电屏蔽效应,导致起初带电的 CNCs颗粒之间静电排斥程度降低,允许更多的CNCs颗粒之间发生聚集,最终形成水凝胶体系。这意味着,在乳液制备过程中,体系中存在高离子强度不利于 CNCs稳定乳液。Wen等[49]利用 CNCs稳定 D-柠檬烯 Pickering乳液,研究体系中离子强度对乳液稳定性的影响。当体系中盐浓度从0增加到100 mmol/L NaCl,乳液体系的电位绝对值从46.3 mV降低到16.7 mV,乳液稳定性下降。但是不少研究也发现一定浓度的低离子强度有利于CNCs吸附在油水界面。比如,Bertsch等[41,50]研究未改性的CNCs在油水界面/气水界面的界面吸附行为时,会在CNCs体系中加入一定浓度的 NaCl溶液,起到静电屏蔽作用,促使CNCs颗粒更容易吸附在界面。
同样,乳液体系 pH的变化也会影响 CNCs乳液的稳定性。Mikulcová等[51]研究 pH 对羧化CNCs颗粒稳定Pickering乳液稳定性的影响,结果显示,pH=4和7条件下制备的乳液具有很好的稳定性,没有显著的乳析和分层现象,而 pH=2条件下制备的乳液,水相和乳相完全分层。Wen等[49]制备CNCs乳液时,当体系pH从4.2升高到7.8,乳液电位绝对值增加,乳液的稳定性也提高。简而言之,低pH值或高盐浓度环境不利于CNCs稳定Pickering乳液。
3 CNCs稳定Pickering乳液在食品体系中的应用
3.1 递送生物活性成分
很多脂溶性活性成分的生物可及率和生物利用度往往会因为它们糟糕的水溶性、从食物基质中不完全释放以及消化过程中的降解而降低。CNCs稳定的Pickering乳液可以作为活性物质的运载体系来保护并提高活性物质的生物可及率。Asabuwa等[52]利用胺化的 CNCs颗粒制备Pickering乳液,成功将香豆素和姜黄素包封在乳液中。包封效率达到90%以上。包封了香豆素和姜黄素的乳液展现出良好的体外抗癌和抗菌作用。Winuprasith等[53]将维生素 D3包封在山竹壳纳米纤维素稳定的Pickering乳液中,采用模拟胃肠道(GIT)模型研究纳米纤维素对脂肪消化率和维生素D3生物可及率的影响。结果表明,提高纤维素浓度,可以降低乳液油脂消化程度和缓解维生素D3的降解。Le等[54]利用OSA改性的CNCs作为乳液稳定剂递送短链脂肪酸。作者希望CNCs稳定的乳液可以在肠道消化过程中保护短链脂肪酸,从而允许更多的短链脂肪酸在结肠靶向释放。测量乳液在体外胃肠道中的油脂消化率和脂肪酸释放率,结果发现,经过体外小肠消化后仍然有约65%的短链脂肪酸保留,这表明CNCs稳定的Pickering乳液在结肠靶向递送短链脂肪酸方面很有潜力。不同于淀粉、蛋白质颗粒,纤维素在胃肠道内不容易被消化酶水解[55]。这个特性有利于被包埋在乳液中的活性物质尽量少受到胃环境的影响。另外,低 pH和高盐的胃肠道环境会引起CNCs体系的静电屏蔽效应,使得CNCs颗粒聚集在一起[54,56]。这种现象会使得 CNCs稳定的Pickering乳液在经过胃肠道消化时发生乳滴聚集,从而导致乳液结构的变化。正是这种聚集的乳液结构使得CNCs乳液不易被胃肠道中的酶利用,从而保护包埋在乳液中的活性物质,并提高它们的生物可及率。
3.2 提高油脂氧化稳定性
CNCs稳定的Pickering乳液还可以用于提高油脂氧化稳定性。油脂含量多的食品,尤其多不饱和脂肪酸多的食品,在贮藏期间容易发生油脂氧化,导致营养成分的损失和异味的产生,从而影响产品的货架稳定性和感官特性[10]。Wang等[57]通过简单的剪切乳化法制备了CNCs和丹宁酸复合颗粒,并且利用复合颗粒成功制备出鳄梨油高内相乳液。经过加速贮藏实验,乳液展现出良好的油脂稳定性,复合颗粒有效防止乳液中的油脂氧化。Angkuratipakorn等[58]通过静电相互作用制备出 CNCs和精氨酸月桂酸酯复合颗粒,并制备出Pickering乳液。结果显示,0.2%CNCs和0.1%月桂酸酯形成的复合颗粒可以很好的延缓乳液中的油脂氧化。
4 总结和展望
CNCs作为天然来源的食品级纳米颗粒,具有来源广、成本低、两亲性、可再生性、生物降解性、高纵横比、无毒性等性质,可作为一种理想的Pickering乳液稳定剂。CNCs的制备过程包含几个关键步骤,包括原料预处理,木质素和半纤维素的去除,以及通过化学处理或机械破坏分离CNCs。但需要注意的是,纤维素的来源和CNCs的制备方法都会影响CNCs的性质。所选择的制备方法和制备条件应取决于最终的目的。目前,传统的 CNCs制备方法主要还是集中在强酸水解、高能机械和酶法。这些方法存在这明显的缺点,比如强酸的腐蚀和产生的废水,机械法所消耗的高能,酶法的长时间等。因此,开发出一些简易、高效的适合大规模生产 CNCs的绿色环保技术是非常有意义的。
已经有很多研究证明了 CNCs可以不可逆的吸附在油水界面,形成坚固的界面膜,防止乳滴之间的聚集,从而稳定Pickering乳液。但CNCs稳定乳液的能力会受到其形态、表面电荷和疏水性等自身性质的影响,也会受到环境中 pH和离子强度的影响。相比较于蛋白质颗粒,CNCs在油水界面的相关研究较少,并且CNCs和其他物质(比如,蛋白质、多酚、表面活性剂、无机颗粒等)在油水界面的动态吸附过程、相互作用还需要进一步明确。CNCs作为一种膳食纤维,其稳定的Pickering乳液在食品中的应用具有重大潜力。目前,CNCs乳液的应用主要集中在作为活性物质的运载体系、提高稳定性等,但在实际食品体系中的应用研究相对很少,比如奶油、沙拉酱、蛋黄酱、冰淇淋等。另一方面,基于 CNCs材料制备响应型Pickering乳液的研究还比较少,尤其应用于食品体系的响应型乳液,这CNCs在Pickering乳液应用中的重要研究方向。
[1] XIAO J, LI Y, HUANG Q.Recent advances on food-grade particles stabilized Pickering emulsions: fabrication, characterization and research trends[J].Trends in Food Science & Technology,2016, 55: 48-60.
[2] PETERS R, KRAMER E, OOMEN A G, et al.Presence of nano-sized silica during in vitro digestion of foods containing silica as a food additive[J].Acs Nano, 2012, 6(3): 2441.
[3] LI Q, WANG Y, WU Y, et al.Flexible cellulose nanofibrils as novel pickering stabilizers: The emulsifying property and packing behavior[J].Food Hydrocolloids, 2019, 88: 180-189.
[4] YOUSSEF H, LUCIA L A, ROJAS O J.Cellulose nanocrystals:chemistry, self-assembly, and applications[J].Chemical Reviews,2010, 110(6): 3479-3500.
[5] ABDUL KHALIL H P, DAVOUDPOUR Y, ISLAM M N, et al.Production and modification of nanofibrillated cellulose using various mechanical processes: a review[J].Carbohydrate Polymers,2014, 99: 649-65.
[6] GARCÍA A, GANDINI A, LABIDI J, et al.Industrial and crop wastes: A new source for nanocellulose biorefinery[J].Industrial Crops and Products, 2016, 93: 26-38.
[7] GALLEGOS A, CARRERA S H, PARRA R, et al.Bacterial cellulose: a sustainable source to develop value-added products –a review[J].Bioresources, 2016, 11(2): 5641-5655
[8] JONOOBI M, OLADI R, DAVOUDPOUR Y, et al.Different preparation methods and properties of nanostructured cellulose from various natural resources and residues: a review[J].Cellulose,2015, 22(2): 935-969.
[9] PHANTHONG P, REUBROYCHAROEN P, HAO X, et al.Nanocellulose: Extraction and application[J].Carbon Resources Conversion, 2018, 1(1): 32-43.
[10] DAI H, WU J, ZHANG H, et al.Recent advances on cellulose nanocrystals for Pickering emulsions: Development and challenge[J].Trends in Food Science & Technology, 2020, 102: 16-29.
[11] KASIRI N, FATHI M.Production of cellulose nanocrystals from pistachio shells and their application for stabilizing Pickering emulsions[J].Int J Biol Macromol, 2018, 106: 1023-1031.
[12] NI Y, LI J, FAN L.Production of nanocellulose with different length from ginkgo seed shells and applications for oil in water Pickering emulsions[J].International Journal of Biological Macromolecules, 2020, 149: 617-626.
[13] WINUPRASITH T, SUPHANTHARIKA M.Microfibrillated cellulose from mangosteen (Garcinia mangostana L.) rind:Preparation, characterization, and evaluation as an emulsion stabilizer[J].Food Hydrocolloids, 2013, 32(2): 383-394.
[14] PELISSARI F M, SOBRAL P J D A, MENEGALLI F C.Isolation and characterization of cellulose nanofibers from banana peels[J].Cellulose, 2013, 21(1): 417-432.
[15] WANG W, DU G, LI C, et al.Preparation of cellulose nanocrystals from asparagus ( Asparagus officinalis L.) and their applications to palm oil/water Pickering emulsion[J].Carbohydrate Polymers, 2016, 151: 1-8.
[16] OUN A A, RHIM J W.Isolation of cellulose nanocrystals from grain straws and their use for the preparation of carboxymethyl cellulose-based nanocomposite films[J].Carbohydrate Polymers,2016, 150: 187-200.
[17] YU H, QIN Z, LIANG B, et al.Facile extraction of thermally stable cellulose nanocrystals with a high yield of 93% through hydrochloric acid hydrolysis under hydrothermal conditions[J].Journal of Materials Chemistry A, 2013, 1(12): 3938.
[18] WANG Z, YAO Z, ZHOU J, et al.Isolation and characterization of cellulose nanocrystals from pueraria root residue[J].International Journal of Biological Macromolecules, 2019, 129: 1081-1089.
[19] LIU C, LI B, DU H, et al.Properties of nanocellulose isolated from corncob residue using sulfuric acid, formic acid, oxidative and mechanical methods[J].Carbohydrate Polymers, 2016, 151:716-724.
[20] CHEN L, ZHU J Y, BAEZ C, et al.Highly thermal-stable and functional cellulose nanocrystals and nanofibrils produced using fully recyclable organic acids[J].Green Chemistry, 2016, 18(13):3835-3843.
[21] COSTA A L R, GOMES A, TIBOLLA H, et al.Cellulose nanofibers from banana peels as a Pickering emulsifier:High-energy emulsification processes[J].Carbohydrate Polymers,2018, 194: 122-131.
[22] MIAO J, YU Y, JIANG Z, et al.One-pot preparation of hydrophobic cellulose nanocrystals in an ionic liquid[J].Cellulose, 2016,23(2): 1209-1219.
[23] SANTOS R M D, FLAUZINO NETO W P, SILVÉRIO H A, et al.Cellulose nanocrystals from pineapple leaf, a new approach for the reuse of this agro-waste[J].Industrial Crops and Products,2013, 50: 707-714.
[24] SILVÉRIO H A, FLAUZINO NETO W P, DANTAS N O, et al.Extraction and characterization of cellulose nanocrystals from corncob for application as reinforcing agent in nanocomposites[J].Industrial Crops and Products, 2013, 44: 427-436.
[25] LI X, LI J, GONG J, et al.Cellulose nanocrystals (CNCs) with different crystalline allomorph for oil in water Pickering emulsions[J].Carbohydrate Polymers, 2018, 183: 303-310.
[26] CHERHAL F, COUSIN F, CAPRON I.Structural description of the interface of pickering emulsions stabilized by cellulose nanocrystals[J].Biomacromolecules, 2016, 17(2): 496-502.
[27] LI Q, WU Y, FANG R, et al.Application of Nanocellulose as particle stabilizer in food Pickering emulsion: Scope, Merits and challenges[J].Trends in Food Science & Technology, 2021, 110:573-583.
[28] KONTTURI E, MERILUOTO A, PENTTIL P A, et al.Degradation and crystallization of cellulose in hydrogen chloride vapor for high-yield isolation of cellulose nanocrystals[J].Angewandte Chemie, 2016.
[29] CAMARERO ESPINOSA S, KUHNT T, FOSTER E J, et al.Isolation of thermally stable cellulose nanocrystals by phosphoric acid hydrolysis[J].Biomacromolecules, 2013, 14(4): 1223-30.
[30] BIAN, HY, CHEN, et al.Effect of fiber drying on properties of lignin containing cellulose nanocrystals and nanofibrils produced through maleic acid hydrolysis[J].Cellulose, 2017, 24(10): 4205-4216.
[31] LIU Y, WANG H, YU G, et al.A novel approach for the preparation of nanocrystalline cellulose by using phosphotungstic acid[J].Carbohydrate Polymers, 2014, 110: 415-422.
[32] CHEN X Q, PANG G X, SHEN W H, et al.Preparation and characterization of the ribbon-like cellulose nanocrystals by the cellulase enzymolysis of cotton pulp fibers[J].Carbohydrate Polymers, 2019, 201: 713-719.
[33] KHAN A, VU K D, CHAUVE G, et al.Optimization of microfluidization for the homogeneous distribution of cellulose nanocrystals (CNCs) in biopolymeric matrix[J].Cellulose, 2014,21(5): 3457-3468.
[34] AMIN K, ANNAMALAI P K, MORROW I C, et al.Production of cellulose nanocrystals via a scalable mechanical method[J].RSC Advances, 2015, 5: 57133.
[35] NAE-MAN, PARK, SUKYUNG, et al.Facile extraction of cellulose nanocrystals[J].Carbohydrate Polymers, 2019, 223:115114.
[36] SACUI I A, NIEUWENDAAL R C, BURNETT D J, et al.Comparison of the properties of cellulose nanocrystals and cellulose nanofibrils isolated from bacteria, tunicate, and wood processed using acid, enzymatic, mechanical, and oxidative methods[J].ACS Applied Materials & Interfaces, 2014, 6(9):6127-6138.
[37] NI Y, LI J, FAN L.Effects of ultrasonic conditions on the interfacial property and emulsifying property of cellulose nanoparticles from ginkgo seed shells[J].Ultrasonics Sonochemistry,2020, 70: 105335.
[38] KALLEL F, BETTAIEB F, KHIARI R, et al.Isolation and structural characterization of cellulose nanocrystals extracted from garlic straw residues[J].Industrial Crops and Products,2016, 87: 287-296.
[39] WU J, MA G H.Recent studies of pickering emulsions: particles make the difference[J].Small, 2016, 12(34): 4633-4648.
[40] KALASHNIKOVA I, BIZOT H, BERTONCINI P, et al.Cellulosic nanorods of various aspect ratios for oil in water Pickering emulsions[J].Soft Matter, 2013, 9(3): 952-959.
[41] BERGFREUND J, SUN Q, FISCHER P, et al.Adsorption of charged anisotropic nanoparticles at oil–water interfaces[J].Nanoscale Advances, 2019, 1(11): 4308-4312.
[42] KALASHNIKOVA I, BIZOT H, CATHALA B, et al.Modulation of cellulose nanocrystals amphiphilic properties to stabilize oil/water interface[J].Biomacromolecules, 2012, 13(1): 267-75.
[43] BERTSCH P, FISCHER P.Interfacial rheology of charged anisotropic cellulose nanocrystals at the air-water interface[J].Langmuir, 2019, 35(24): 7937-7943.
[44] NI Y, FAN L, SUN Y.Interfacial properties of cellulose nanoparticles with different lengths from ginkgo seed shells[J].Food Hydrocolloids, 2020, 109: 106121.
[45] CHEN Q H, ZHENG J, XU Y T, et al.Surface modification improves fabrication of pickering high internal phase emulsions stabilized by cellulose nanocrystals[J].Food Hydrocolloids,2018, 75: 125-130.
[46] DU LE H, LOVEDAY S M, SINGH H, et al.Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals: Responsiveness to pH and ionic strength[J].Food Hydrocolloids, 2020, 99: 105344.
[47] 陈媛, 张欢, 余永, 等.纤维素纳米晶稳定 Pickering乳液及其环境响应性研究进展[J].食品与发酵工业, 2020, 46(24): 234-241.CHEN Y, ZHANG H, YU Y, et al.Research progress of cellulose nanocrystals stabilized Pickering emulsion and its environmental responsiveness [J].Food and Fermentation Industries, 2020,46(24): 234-241.
[48] BERTSCH P, ISABETTINI S, FISCHER P.Ion-Induced hydrogel formation and nematic ordering of nanocrystalline cellulose suspensions[J].Biomacromolecules, 2017, 18(12):4060-4066.
[49] WEN C, YUAN Q, LIANG H, et al.Preparation and stabilization of D-limonene Pickering emulsions by cellulose nanocrystals[J].Carbohydrate Polymers, 2014, 112: 695-700.
[50] BERTSCH P, DIENER M, ADAMCIK J, et al.Adsorption and interfacial layer structure of unmodified nanocrystalline cellulose at air/water interfaces[J].Langmuir, 2018, 34(50): 15195-15202.
[51] MIKULCOVÁ V, BORDES R, MINAŘÍK A, et al.Pickering oil-in-water emulsions stabilized by carboxylated cellulose nanocrystals–Effect of the pH[J].Food Hydrocolloids, 2018, 80:60-67.
[52] ASABUWA NGWABEBHOH F, ILKAR ERDAGI S, YILDIZ U.Pickering emulsions stabilized nanocellulosic-based nanoparticles for coumarin and curcumin nanoencapsulations: In vitro release,anticancer and antimicrobial activities[J].Carbohydrate Polymers,2018, 201: 317-328.
[53] WINUPRASITH T, KHOMEIN P, MITBUMRUNG W, et al.Encapsulation of vitamin D 3 in pickering emulsions stabilized by nanofibrillated mangosteen cellulose: Impact on in vitro digestion and bioaccessibility[J].Food Hydrocolloids, 2018, 83:153-164.
[54] LE H D, LOVEDAY S M, SINGH H, et al.Gastrointestinal digestion of Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals: Release of short-chain fatty acids[J].Food Chem, 2020, 320: 126650.
[55] BAI L, LV S, XIANG W, et al.Oil-in-water Pickering emulsions via microfluidization with cellulose nanocrystals: 2.In vitro lipid digestion[J].Food Hydrocolloids, 2019, 96: 709-716.
[56] SCHEUBLE N, SCHAFFNER J, SCHUMACHER M, et al.Tailoring emulsions for controlled lipid release: establishing in vitro-in vivo correlation for digestion of lipids[J].ACS Applied Materials & Interfaces, 2018, 10(21): 17571-17581.
[57] WANG J S, WANG A B, ZANG X P, et al.Physical and oxidative stability of functional avocado oil high internal phase emulsions collaborative formulated using citrus nanofibers and tannic acid[J].Food Hydrocolloids, 2018, 82: 248-257.
[58] ANGKURATIPAKORN T, CHUNG C, KOO C K W, et al.Development of food-grade Pickering oil-in-water emulsions:Tailoring functionality using mixtures of cellulose nanocrystals and lauric arginate[J].Food Chemistry, 2020, 327: 127039.
备注:本文的彩色图表详见本期PC12-C13,也可从本刊官网(http://lyspkj.ijournal.cn/)、中国知网、万方、维普、超星等数据库下载获取。