苯并(α)芘是一种多环芳烃化合物,它对生育、发育、血液、心脏、神经及免疫系统等具有毒性作用,能诱发多种癌症[1-4]。其在环境中广泛存在,大气、地表水、沉积物和土壤、食物和脂肪组织中都有发现,能通过生物转化等多种途径进入食物链,参与机体的代谢作用[5-6]。食用油是人类对苯并(α)芘的主要暴露途径之一[6]。因此,准确测定食用油中苯并(α)芘含量,对评估食用油的质量安全及保障人们的餐桌健康具有重要意义。
由于食用油中苯并(α)芘含量少,其亲油性较强,且油中基质干扰大,对其准确分析具有较大的挑战[7]。食用油中苯并(α)芘的分析主要包括样品处理和检测两部分。目前,已报道的前处理方法主要有以下几种:液液萃取法、微波萃取法、超声萃取法、凝胶渗透色谱法、固相萃取法、超临界流体萃取法、固相微萃取法等;检测方法包括液相色谱-荧光法、气相色谱法、液相色谱-质谱联用法、气相色谱-质谱联用法及免疫学等多种方法[8-12]。其分析方法虽然已有较多报道,但是综合考虑实验操作过程难易及实验仪器普及程度等因素,固相萃取结合液相色谱-荧光光谱法为最常用的方法。测量不确定度是分析结果的重要组成部分,可以定量地说明测量结果的质量,是对数据的真实性、客观性及可信性的科学评价[13-14]。虽然食用油中苯并(α)芘的分析方法众多,但是关于其检测结果的不确定度评定的研究较少。目前,已有报道主要针对已废止国标法(GB/T 22509—2008)[15]及凝胶渗透色谱净化-气相色谱/质谱联用法测定结果不确定度的评定[16]。且已有文献常忽略试剂膨胀的影响;容量瓶、移液管等量器的测量不确定度在选择矩形分布、三角分布或正态分布计算方式时尚不清晰。当前,我国检测食用油中苯并(α)芘主要采用已修订国标法(GB 5009.27—2016)[17],但对其测定结果不确定度评价还未见报道。
为了系统科学地评价食用油中苯并(α)芘含量检测数据的不确定度,本文依据国家计量技术规范JJF 1059—2012《测量不确定度评定与表示》规定的基本方法和程序[14],以大豆油为例,采用GB 5009.27—2016中新增前处理方法——苯并(α)芘分子印迹柱净化法进行样品前处理,高液相色谱-荧光法进行样品检测,并对测定结果进行不确定度分析评定。本研究可为食用油中苯并(α)芘含量检测的实验室评定不确定度提供参考范例。
1 材料与方法
1.1 仪器与试剂
1.1.1 材料与试剂
大豆油市售。
苯并(a)芘标准品:德国Dr.Ehrenstorfer公司;乙腈、甲苯、正己烷及二氯甲烷均为色谱纯:德国默克公司;超纯水(电阻率18.2 mΩ·cm-1):Millipore纯水仪制备。苯并(a)芘分子印迹柱(500 mg,6 mL):天津博纳艾杰尔。
1.1.2 仪器与设备
Waters e2695高效液相色谱仪,配备荧光检测器:美国Waters公司;H54AR精密分析天平:瑞士METTLER TOLEDO公司;RV10-D-V型旋转蒸发器:艾卡(广州)仪器设备有限公司。
1.2 实验方法
1.2.1 样品前处理
参考国家标准GB 5009.27—2016,测定步骤为:称取约0.5 g试样(精确到0.000 1 g),加入5 mL正己烷,涡旋混合0.5 min,待净化。采用苯并(a)芘分子印迹柱,依次用5 mL二氯甲烷及 5 mL正己烷活化柱子。将待净化液转移进柱子,待液面降至柱床时,用 6 mL正己烷淋洗柱子,弃去流出液。用 6 mL二氯甲烷洗脱并收集净化液到试管中。将净化液在 40 ℃下减压浓缩至干,准确吸取1 mL乙腈涡旋复溶0.5 min,过微孔滤膜后进样测定。
1.2.2 高效液相色谱条件
色谱柱:C18色谱柱(Waters, 4.6 mm×250 mm,5 μm)。柱温:35 ℃;样品室温度:10 ℃。荧光检测器,激发波长384 nm,发射波长406 nm。流动相:乙腈+纯水(88∶12,V∶V),等度洗脱。流速为1.0 mL/min。进样量10 μL。
1.2.3 数学模型

式中:X—式样中苯并(a)芘含量,单位为微克每千克(μg/kg);C—由标准曲线得到的样品净化溶液浓度,单位为纳克每毫升(ng/mL);V—试样最终定容体积,单位为毫升(mL);m—试样质量,单位为克(g);1 000—由ng/g换算成μg/kg的换算因子。
2 结果与讨论
2.1 不确定度来源分析
不确定度估算方法分为两类,包括自上而下及自下而上。自上而下方法评定需要大量数据支持,周期较长,分析人员较难获得完整资料;自下而上方法依据检测过程,对全过程中影响不确定度的步骤进行分解,估算各个步骤对合成不确定度的贡献[18]。虽然后种方法过程繁琐、复杂,但对分析人员了解测定过程的关键点,尽可能降低测定不确定度具有重要价值,因此本研究采用自下而上方法进行不确定度评定。
结合公式(1)及测量全过程,影响苯并(a)芘测量不确定度的来源包括:标准品纯度、称样过程、标准溶液配制过程、样品前处理过程、样品重复测定过程、标准曲线拟合、添加回收率及样品重复性的测定。
2.2 不确定度评定
不确定度评定参数分为A和B两类,A类评定是指在规定测量条件下测得量值用统计分析的方法进行测量不确定度分量的评定,B类评定是指用不同于测量不确定度A类评定的方法对测量不确定度分量进行评定[14]。
2.2.1 不确定度的B类评定参数
2.2.1.1 标准物质纯度引入的相对标准不确定度Urel1 根据标准物质证书提供的信息,苯并芘标准物质的扩展不确定度为0.3%(g/g),包含因子k=2,其相对标准不确定度为:
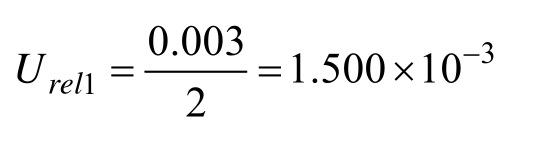
2.2.1.2 标样称量产生的不确定度 Urel2 天平数显非常稳定,故称量重复性引入的不确定度可忽略不计。精确称取标准样品0.001 40 g,天平最大允许误差为±0.000 02[18],按均匀分布,包含因子![]() 故其相对不确定度为:
故其相对不确定度为:
2.2.1.3 标准储备溶液配制的相对标准不确定度Urel3 标准储备液配制时,将精确称取的苯并芘标准品用甲苯溶解,并定容成25 mL的储备液。该过程涉及容量瓶及环境温度变化导致的试剂膨胀引入的不确定度。根据《化学分析中不确定度的评估指南》[20],玻璃量器引入的不确定度服从三角分布,包含因子为k= 6;温度变化引起溶液体积膨胀引入的不确定度服从矩形分布,![]()
25 mL单标线容量瓶(A级)最大允差为±0.030 mL[21],按三角分布考虑,k = 6,计算其相对标准不确定度为:
标准溶液的配制实验室温度为(20±5)℃,标准储备液由甲苯配制,其体积膨胀系数 β甲苯/℃=1.08×10-3。由温度变化引起的试剂膨胀带来的不确定度服从矩形分布,故温度导致甲苯体积变化引起的相对不确定度为:
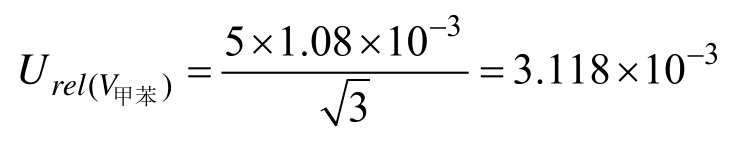
标准储备液配制引入的相对不确定度为:
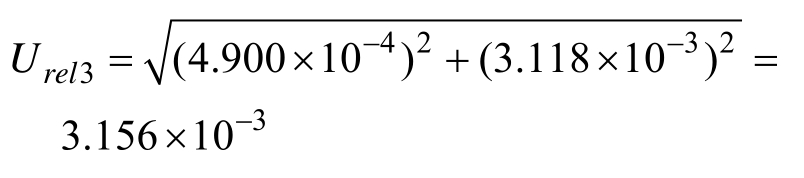
2.2.1.4 标准中间液配制引入的不确定度 Urel4 标准中间液配制时,用0.1 mL的A级吸量管移取0.1 mL标准储备液于10 mL容量瓶中,用乙腈定容,配制成中间液。该过程中不确定度来源包括:容量瓶、分度吸量管及温度变化导致的试剂膨胀引入的不确定度。
10 mL的 A级单标线容量瓶最大允差为±0.020,按三角分布考虑,k = 6,计算相对标准不确定度为:
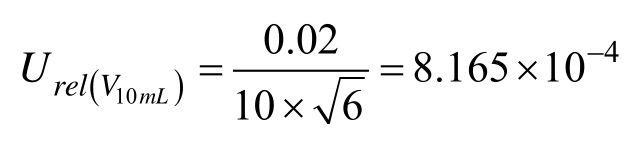
0.1 mL分度吸量管(A级)最大允差为±0.002,吸取0.1 mL溶液,按三角分布考虑,k = 6,计算相对标准不确定度为:
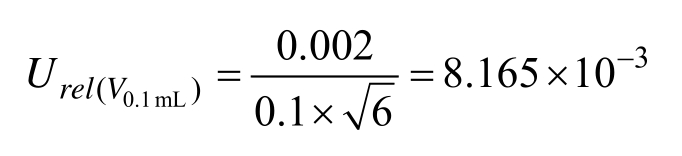
中间液的配制实验室温度为(20±5)℃,中间液由乙腈配制,其体积膨胀系数 β乙腈/℃=1.37×10-3。按矩形分布,故温度导致乙腈体积变化引起的相对不确定度为:
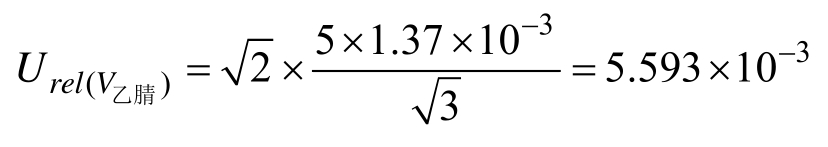
中间液配制引入的相对不确定度为:
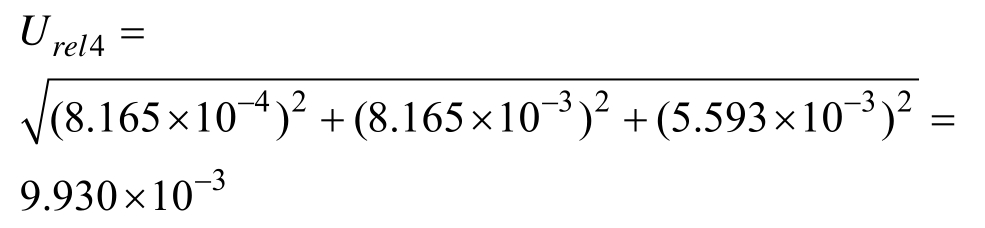
2.2.1.5 标准工作液配制引入的不确定度 Urel5 用A级1 mL分度吸量管吸取1 mL标准中间液于50 mL容量瓶中,用乙腈定容至刻度,配成浓度为11.20 ng/mL的标准工作液;用10 mL、5 mL、1 mL分度吸量管分别吸取8 mL、5 mL、2.5 mL、1 mL标准工作液(11.20 ng/mL)于10 mL容量瓶中,用乙腈定容,配制成浓度分别为1.12 ng/mL、2.80 ng/mL、5.60 ng/mL、8.96 ng/mL的校准曲线溶液。该过程所涉及容量瓶、分度吸量管及环境温度变化导致的试剂膨胀引入的不确定度。
1 mL分度吸量管(A级)最大允差为±0.008,按三角分布考虑,k = 6,计算相对标准不确定度为:
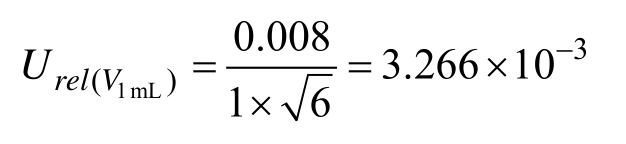
50 mL单标线容量瓶(A级)最大允差为±0.05,按三角分布考虑,k = 6,计算相对标准不确定度为:
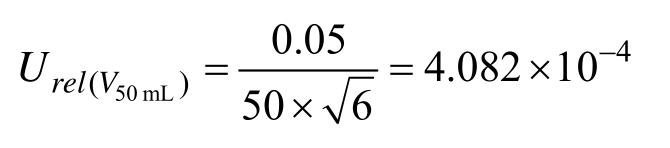
10 mL分度吸量管(A级)最大允差为±0.05,吸取8 mL 标准工作液,5 mL分度吸量管(A级)最大允差为±0.025,分别吸取2.5 mL、5 mL标准工作液,1 mL分度吸量管(A级)最大允差为±0.008,按三角分布考虑,k = 6,计算相对标准不确定度为:
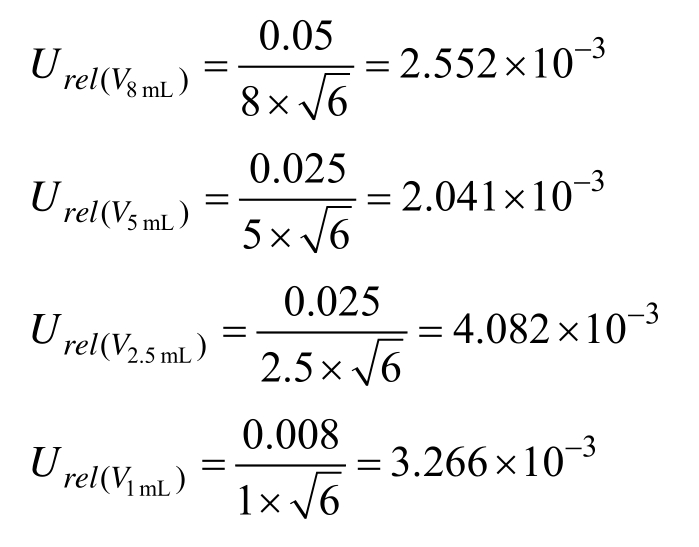
10 mL单标线容量瓶(A级)最大允差为±0.020,按三角分布考虑,k = 6,计算 4个容量瓶相对标准不确定度为:
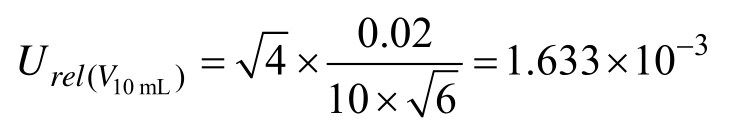
标准工作液的配制实验室温度为(20±5)℃,工作液由乙腈配制,其体积膨胀系数β乙腈/℃=1.37×10-3。按矩形分布,故由温度引起的相对不确定度为:
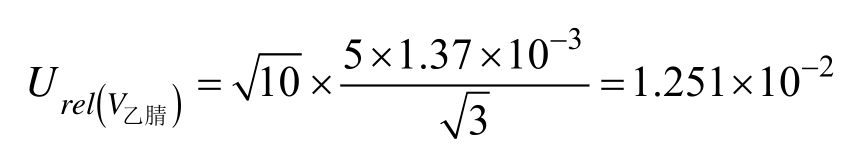
标准工作液配制引入的相对不确定度为:
2.2.1.6 样品称量产生的不确定度 Urel6 由于样品严格根据操作规程制备,故样品均匀性引入的不确定度可忽略。称取约 0.5 g油样,重复称量10次,称量结果见表2,平均值为0.530 g,称量重复天平最大允许误差为±0.005,按均匀分布,其相对不确定度:
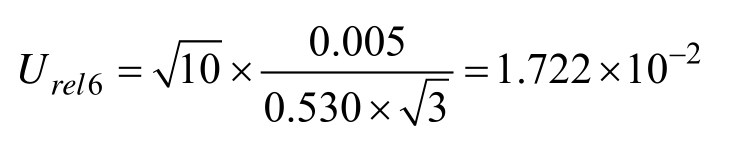
2.2.1.7 样品定容过程引入的不确定度 Urel7 净化后样品经氮吹仪吹干后用 1.0 mL分度吸量管加入1.0 mL乙腈定。该过程涉及分度吸量管及温度对溶液体积膨胀的影响产生的不确定度。
1.0 mL的 A级分度吸量管最大允许误差为±0.008,按三角分布考虑,k = 6,计算相对标准不确定度为:
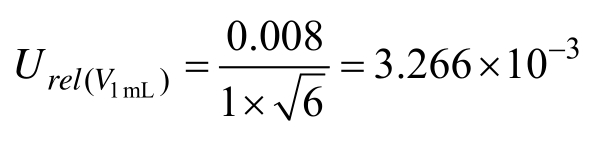
样品定容实验室温度为(20±5)℃,样品由乙腈定容,其体积膨胀系数 β乙腈/℃=1.37×10-3。按矩形分布,由温度引起的相对不确定度为:
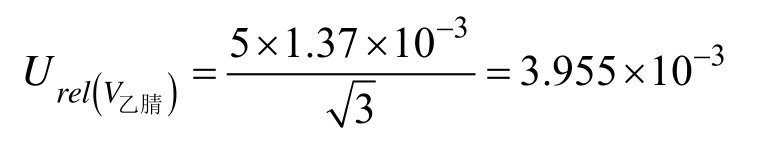
由样品定容过程产生的不确定度为:
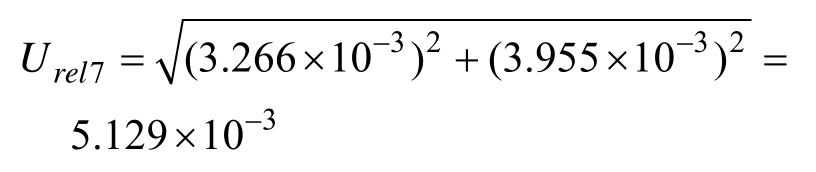
2.2.2 不确定度的A类评定
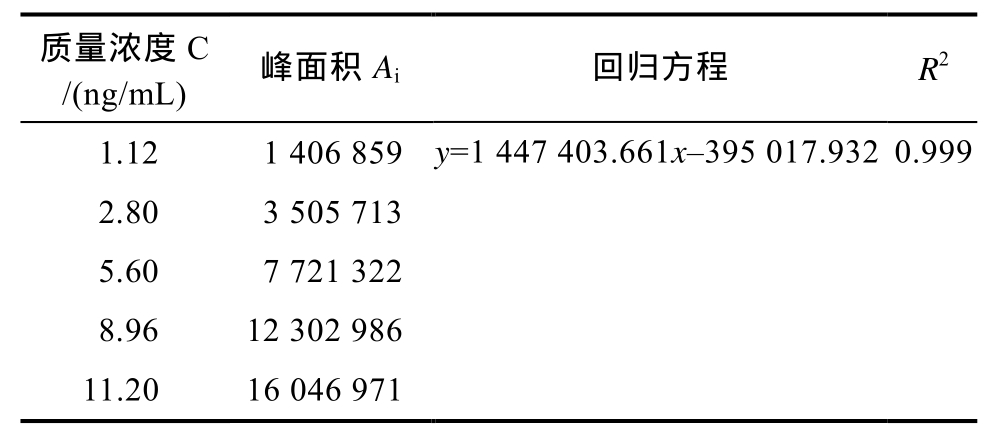
2.2.2.1 标准曲线拟合引入的不确定度 Urel8 本研究对 5个不同浓度的苯并芘标准溶液进行检测,每个浓度测定1次,共测定6次,根据浓度与其相应的色谱峰面积Ai,拟合而成的线性回归方程为A=aC+b,其中,a为拟合曲线的斜率,b为拟合曲线的截距,测定数据及计算结果如表1所示。
根据公式(2)计算纵坐标标准溶液峰面积所产生的标准误差s=332 777.803。对样品溶液进行10次重复测定,按照回归方程计算测定样中苯并芘平均浓度为Cp=4.625 ng/mL。根据公式(3)计算最小二乘拟合法校准曲线引入的标准不确定度 u=0.131。则拟合曲线引入的相对标准不确定度为:
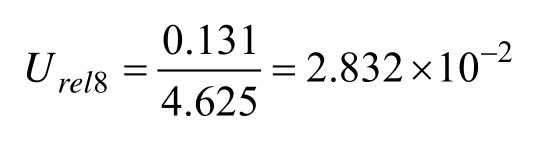
表1 标准曲线拟合回归方程及相关系数
质量浓度C/(ng/mL) 峰面积Ai 回归方程 R2 1.12 1 406 859y=1 447 403.661x-395 017.9320.999 2.80 3 505 713 5.60 7 721 322 8.96 12 302 986 11.20 16 046 971
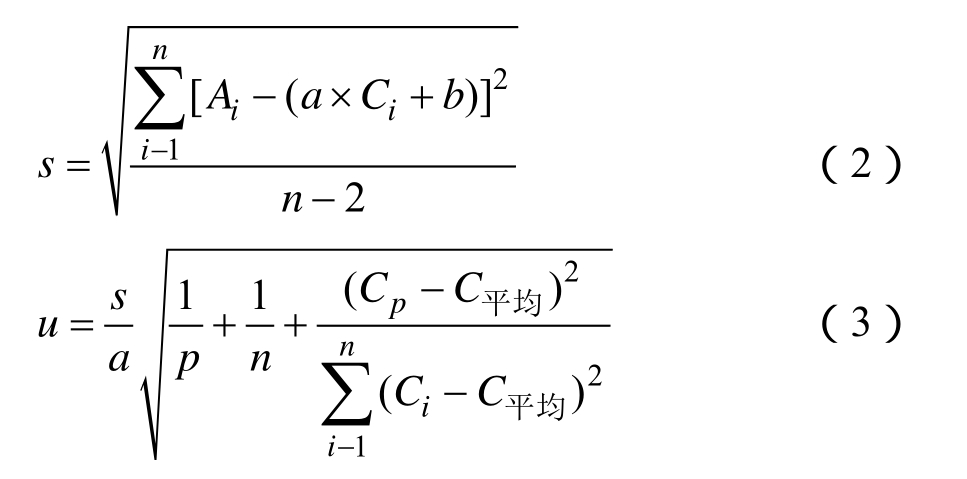
式中:s—按贝塞尔公式求出的标准溶液残差的标准偏差;a—标准曲线的斜率,a=1 447 403.661;b—标准曲线的斜率,b= -395 017.932;p—样品溶液的重复测定次数,p=10;n—标准溶液点的测定总次数,n=5;Cp—标准曲线求出的测试样中苯并芘的平均浓度;Ci—各标准溶液对应的苯并芘浓度(ng/mL);C平均—标准溶液苯并芘浓度的平均值,C平均=5.936 ng/mL;Ai—各标准溶液点对应的苯并芘峰面积。
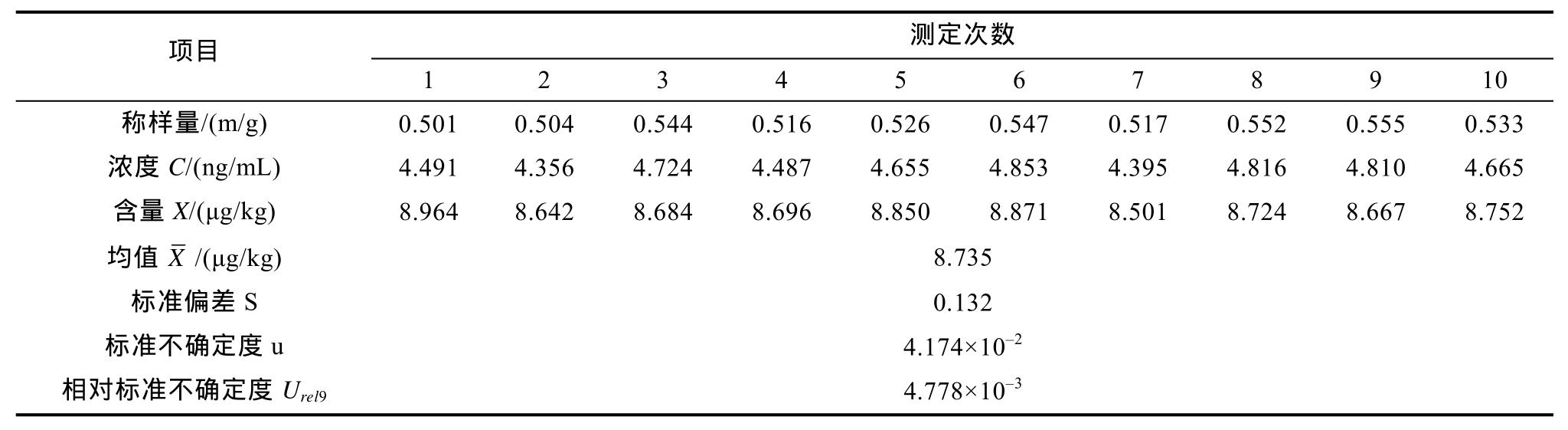
2.2.2.2 样品重复测定引入的不确定度 Urel9 本实验对大豆油苯并芘含量进行10次重复性测定,结果见表2。重复性测定属于A类评定,应用公式(4)计算实验重复性引入的相对标准不确定度为 4.778×10-3。
表2 样品重复测定结果和不确定度
项目测定次数1 2 3 4 5 6 7 8 9 10称样量/(m/g) 0.501 0.504 0.544 0.516 0.526 0.547 0.517 0.552 0.555 0.533 8.735标准偏差S 0.132标准不确定度u 4.174×10-2相对标准不确定度Urel9 4.778×10-3浓度C/(ng/mL) 4.491 4.356 4.724 4.487 4.655 4.853 4.395 4.816 4.810 4.665含量 X/(μg/kg) 8.964 8.642 8.684 8.696 8.850 8.871 8.501 8.724 8.667 8.752均值X/(μg/kg)
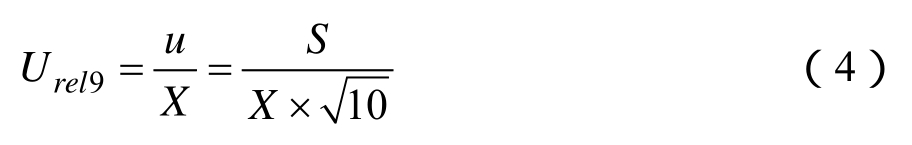
2.2.2.3 样品添加回收产生的相对标准不确定度Urel10 方法回收率是方法准确度的一种评价方法,而方法准确度对实验结果的不确定度存在显著影响。本研究对方法进行添加回收率考察。在11 μg/kg添加水平下,进行 5次平行实验,结果见表3。应用公式(4)计算样品添加回收引入的标准不确定度为2.307×10-2。
表3 样品添加回收率和不确定度
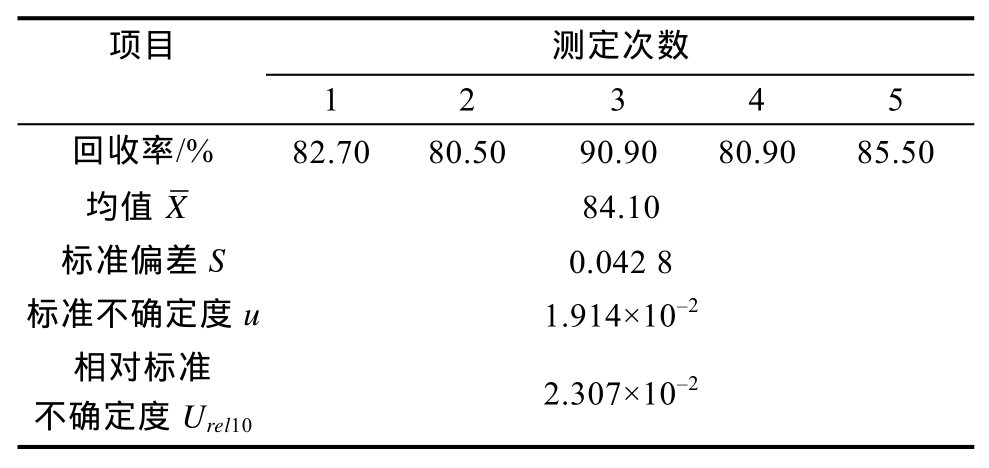
项目 测定次数1 2 3 4 5回收率/% 82.70 80.50 90.90 80.90 85.50 X 84.10标准偏差S 0.042 8标准不确定度u 1.914×10-2相对标准不确定度Urel10均值2.307×10-2
2.3 合成不确定度
根据上述不确定度分量,见表 4,由计算公式(5)可得合成不确定度Urel为4.546×10-2。
表4 相对不确定度的合成
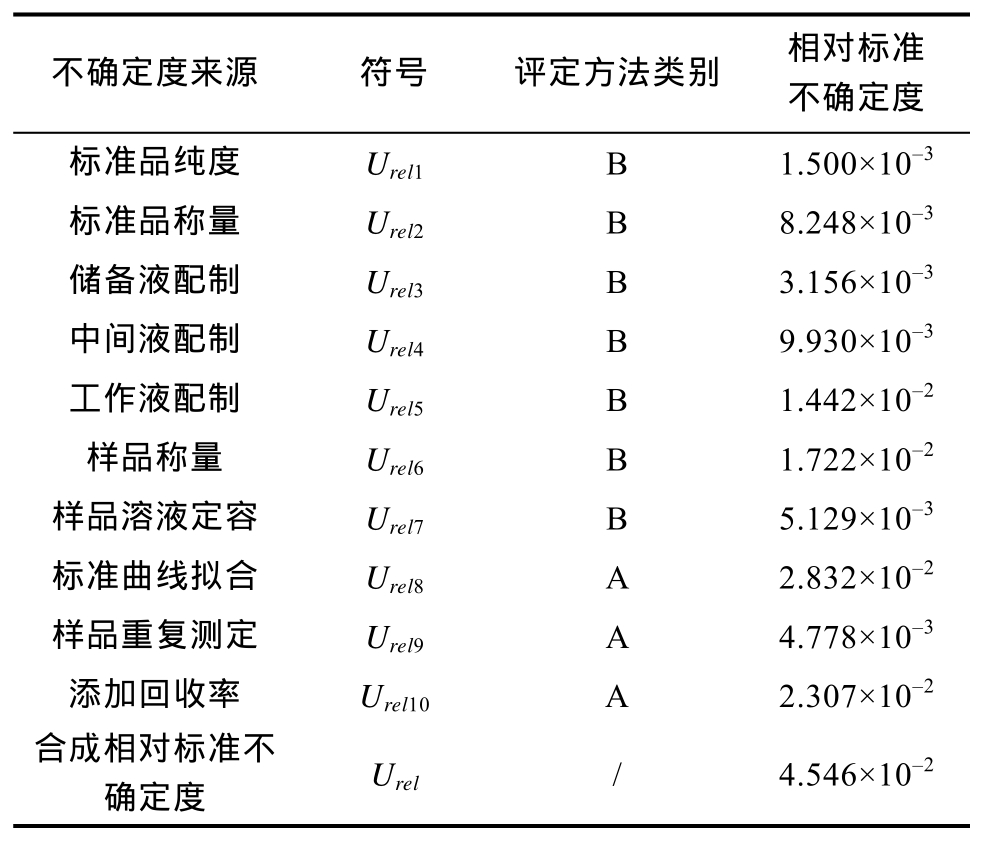
不确定度来源 符号 评定方法类别 相对标准不确定度标准品纯度 Urel1 B 1.500×10-3标准品称量 Urel2 B 8.248×10-3储备液配制 Urel3 B 3.156×10-3中间液配制 Urel4 B 9.930×10-3工作液配制 Urel5 B 1.442×10-2样品称量 Urel6 B 1.722×10-2样品溶液定容 Urel7 B 5.129×10-3标准曲线拟合 Urel8 A 2.832×10-2样品重复测定 Urel9 A 4.778×10-3添加回收率 Urel10 A 2.307×10-2合成相对标准不确定度 Urel / 4.546×10-2
各不确定度分量对合成不确定度的贡献如图1所示,从贡献度来看,对合成不确定度影响最大的为标准曲线拟合过程(38.81%),其次为添加回收率(25.75%)、样品称量(14.35%)、工作液配制(10.06%)及中间液配制(4.77%);而标准品称量等其它因素对合成不确定贡献较小,依据《化学分析中不确定度的评估指南》[20]中规定,小于最大分量三分之一的分量无需深入评估。从不确定度计算过程来看,标准曲线拟合的不确定度来源为仪器稳定性及标准溶液配制,因为高效液相色谱仪稳定性较好,未考虑仪器进样量及稳定性的影响,标准溶液配制为其主要影响因素。由不确定分量计算可以看出,标准溶液配置过程中实验室温度变化引起试剂膨胀对不确定度的影响较大。添加回收率的大小体现的是方法的准确度及萃取效率,方法的准确度及萃取效率同样受到溶液配制的影响,提高方法的准确度及萃取效率可有效减低不确定度,而对实验环境温度的控制不可忽视。

图1 不确定度分量对合成不确定度的贡献图
2.4 扩展不确定度及结果表示
扩展不确定度![]() 其中Urel=4.546×10-2,k=2,¯X=8.735,则扩展不确定度为:
其中Urel=4.546×10-2,k=2,¯X=8.735,则扩展不确定度为:
苯并芘测定结果表示为:8.735±0.794 μg/kg。
3 结论
本文对分子印迹柱净化,HPLC荧光法测定食用油中苯并(α)芘含量的不确定度来源进行全面的分析,并对各分量进行计算及合成。在分析过程中发现标准曲线拟合过程、添加回收率、样品称量及工作液配制过程是不确定度的主要来
源。对主要因素计算过程分析发现,溶液配制过程中环境温度变化引起的溶液体积膨胀引入的不确定度不可忽视。因此在实际操作中需对标准曲线拟合过程、添加回收率、样品称量及工作液配制过程进行严格控制,特别注意环境温度的影响。
[1]刘明延.高效液相色谱法测定水中苯并(α)芘[J].洁净煤技术,2016, 22(5): 127-129.
[2]魏利清, 郝全英, 俞寅.油料中苯并(α)芘含量的测定[J].中国油脂, 2019, 44 (4): 146-148.
[3]李进伟, 王兴国, 金青哲.食用油中苯并(α)芘的来源、检测和控制[J].中国油脂, 2011, 36 (6): 7-11.
[4]SEGAM, PENNECCHIF, RINALDI S, et al.Uncertainty evaluation for the quantification of low masses of benzo[α]pyrene: Comparison between the law of propagation of uncertainty and the monte carlo method[J].Anal Chim Acta,2016, 920: 10-17.
[5]高玮, 邓智辉.检测食品中苯并芘的方法研究[J].粮食科技与经济, 2018, 43(8): 69-73.
[6]侯利霞, 仇记红.食用油中多环芳烃研究进展[J].河南工业大学学报(自然科学版), 2017, 38(3): 115-122.
[7]房芳, 宁晖, 邵亮亮, 等.联用凝胶色谱净化和超高效液相色谱定量分析植物油中的苯并芘[J].中国粮油学报, 2018,33(9): 131-134.
[8]ALFARHANIB, AL-TAMEEMI M, GOICOECHEA H C, et al.Direct analysis of benzo[α]pyrene metabolites with strong overlapping in both the spectral and lifetime domains[J].Microchem J, 2018, 137: 51-61.
[9]DU C Y, HU Y Q, LI Y C, et al.Electrochemical detection of benzo (α) pyrene in acetonitrile-water binary medium[J].Talanta,2015, 138: 46-51.
[10]DARWISH W S, CHIBA H, EL-GHAREEB W R, et al.Determination of polycyclic aromatic hydrocarbon content in heat-treated meat retailed in Egypt: Health risk assessment,benzo[α]pyrene induced mutagenicity and oxidative stress in human colon (CaCo-2) cells and protection using rosmarinic and ascorbic acids[J].Food Chem, 2019, 290: 114-124.
[11]BELOGLAZOVANV, LENAIN P, RYCKE E D, et al.Capacitive sensor for detection of benzo (α) pyrene in water[J].Talanta, 2018, 190: 219-225.
[12]邓丽娟, 洪霞, 钱滢文, 等.二甲亚砜提取—冷冻离心净化测定食品中苯并[α]芘及苯并[e]芘[J].粮油食品科技, 2017,25(2): 69-73.
[13]胡坪, 罗国安, 赵中振, 等.中药材定量分析中测量不确定度的评定方法及其影响因素的研究[J].药物分析杂志, 2005, 25(4): 455-460.
[14]测量不确定度评定与表示: JJF 1059.1-2012[S].
[15]杨静, 单祝庚, 周小波.动植物油脂中苯并(α)芘含量测定不确定度的评定[J].广州化工, 2013, 41 (4): 132-134.
[16]郭翠, 王建华, 杜恒清, 等.辣椒油中苯并芘参考标准物质的制备与定值[J].食品科学, 2010, 31 (4): 194-197.
[17]食品安全国家标准食品中苯并(α)芘的测定: GB 5009.27—2016 [S].
[18]Guidelines on estimation of uncertainty of results.CAC/GL 59-2006[S].Codex Committee on Pesticide Residue (CCPR),Amendment 2011.
[19]电子天平检定规程: JJG 1036-2008[S].
[20]化学分析中不确定度的评估指南: CNAS-GL006-2019[S].
[21]常用玻璃量器检定规程: JJG 196-2006[S].