油脂体是油料作物内储存脂肪的重要亚细胞结构[1-2],是由磷脂单分子层、膜蛋白和中性脂组成的简单细胞器,具有易提取、乳化性好[3-4]的特点,在食品、医药、化妆品及饲料[5-6]等领域具有广阔的开发前景,但新鲜油脂体氧化稳定性差、贮藏期短等不足限制其在工业上的应用。高油酸花生作为新培育的花生品种,油脂体含量高且含有丰富的油酸和维生素 E[7],能改善油脂体氧化稳定性,延长产品货架期。因此,制备高油酸花生油脂体对拓展油脂体的应用具有现实意义。
水剂法因其操作简便、适合工业化生产等特点成为目前提取油脂体常用的方法,但其油脂体得率和生产效率都不高,且制备过程中蔗糖、无机盐等外源性杂质的存在对油脂体应用特性(如冻融稳定性)影响显著[8],为减少花生油脂体后续纯化工序,最大限度的保留花生油脂体优异的应用特性,开发一种更加绿色简便的花生油脂体制备工艺尤为必要。随着酶制剂行业的发展和价格的下浮,越来越多的学者采用酶法辅助提取油脂体,Rujira[9]采用酶法提取玉米中的油脂体,表明温度、酶等是影响油脂体得率的重要因素,纤维素酶能显著提高玉米胚芽油脂体的得率(23.09%)。Kapchie等[10]在水剂法提取油脂体的基础上,应用β-葡聚糖酶、纤维素酶和果胶酶配比而成的复合酶处理大豆粉得到油脂体。随着研究的不断深入,Loman等[11]发现酶法不仅能完整提取出油脂体,还能将蛋白体和水解碳水化合物同时回收出来。因而利用酶制剂辅助提取油脂体逐渐成为一个极具发展前景的提取方法。
关于酶法提取普通油酸花生油脂体方面的研究已有报道[12],由于我国高油酸花生新品种的培育起步较晚,有关高油酸花生油脂体的研究还十分欠缺。且郝莉花等[13]研究表明不同品种花生油脂体品质差异显著,因而有必要采用合适方法提取高油酸花生油脂体,并对其进行系列深入研究。本研究以高油酸花生(豫花37)为原材料,利用优化配比后的复合酶制备高油酸花生油脂体,并采用响应面法确定最佳提取工艺,以期为高油酸花生产品的开发利用和花生油脂体工业化发展奠定基础。
1 材料与方法
1.1 材料与试剂
高油酸花生:豫花 37[粗脂肪含量(46.94±0.66)%,粗蛋白含量(25.60±0.13)%,水分含量(4.26±0.20)%,灰分含量(2.68±0.04)%]:国家油料改良中心河南花生分中心;纤维素酶(酶活2.0×104 U/g)、果胶酶(酶活 3.0×104 U/g)、木聚糖酶(酶活 3.0×104 U/g):庞博生物工程有限公司。
1.2 仪器与设备
Agilent 7890A/5975C型气相色谱-质谱联用仪:美国安捷伦科技有限公司;LC-2998型高效液相色谱仪:美国Waters公司;T-18-DS-25型数显高速分散机:德国艾卡有限公司;UV-6300型紫外分光光度计:上海美谱达仪器有限公司;DXF-060型手提式中药粉碎机:广州市大祥电子机械设备有限公司;PL203型电子天平:梅特勒-托利多仪器(上海)有限公司;SHA-B型水浴恒温振荡器:常州金坛精达仪器制造有限公司;DL-5-B型大容量低速离心机:上海安亭科学仪器厂;D2X-6022B型真空干燥箱:上海福玛实验设备有限公司。
1.3 方法
1.3.1 酶法提取高油酸花生油脂体的工艺流程
称取脱红衣高油酸花生80 g,高速粉碎机间歇性短暂粉碎后过100目筛备用。按液料比4∶1(mL/g)在花生粉中加入去离子水,搅拌均匀后12 000 r/min均质5 min。取适量(500 U/g)复合酶加入样品悬浮液中,调节pH为6.0,并将其放入50 ℃恒温水浴锅中酶解3.0 h。酶解充分后取出,置于恒温水浴锅中90 ℃灭酶10 min,待其冷却至室温4 500 r/min离心10 min,收集上层即得高油酸花生油脂体(工艺流程图见图1)。油脂体的得率按公式(1)计算:
式中:Y—油脂体得率,%;m—油脂体干基质量,g;M—脱红衣花生质量,g。
1.3.2 单因素实验

图1 酶法提取高油酸花生油脂体的工艺流程图
据前期的研究结果确定复合酶的最佳复配比例为纤维素酶∶果胶酶∶木聚糖酶(U/U/U)=63∶24∶13。通过单因素实验考察各因素对酶法提取高油酸花生油脂体得率的影响。其中液料比分别为 1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1(mL/g);酶用量分别为 100、200、300、400、500、600、700、800 U/g;酶解时间分别为40、60、80、100、120、140、160、180 min;酶解温度分别为40、45、50、55、60、65、70 ℃。
1.3.3 响应面实验设计
在单因素实验的基础上,确定酶解反应的pH=5.5,根据Box-Behnken实验设计原理,选取对高油酸花生油脂体得率影响显著的液料比、酶用量、酶解时间和酶解温度4个因素为自变量,以油脂体得率(Y)为响应值,采用Design-Expert V8.0.6设计四因素三水平实验进行响应面优化。实验因素与水平见表1。
表1 Box-Behnken实验设计因素与水平

水平 A液料比/(mL/g)B酶用量/(U·g-1)C酶解时间/min D酶解温度/℃-1 5∶1 300 60 55 0 6∶1 400 80 60 1 7∶1 500 100 65
1.3.4 油脂体组成成分测定
水分及易挥发物的测定:参照GB/T 5009.3—2010《食品中水分的测定减压干燥法》。
粗脂肪的测定:参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》。
粗蛋白的测定:参照GB/T 5009.5—2010《食品中蛋白质的测定凯氏定氮法》。
灰分的测定:参照GB 5009.4—2016《食品中灰分的测定食品中总灰分的测定》。
1.3.5 脂肪酸组成测定
样品甲酯化:将新鲜油脂体经 60 ℃真空干燥后用索氏抽提法提取其中的油脂。油脂甲酯化及气相色谱检测条件参照文献[14]的方法。分别参照脂肪酸标样的保留时间和采用面积归一化法对花生油脂体中各脂肪酸组分进行定性和定量分析。
1.3.6 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
取 1.3.1中提取的花生油脂体 0.1 g加入到1.5 mL样品处理液中(0.05 mol/L Tris-HCl缓冲液,5%(V/V)巯基乙醇,2%(m/V)SDS,0.1%(m/V)溴酚蓝,10%(V/V)甘油),震荡摇匀,沸水浴10 min,12 000 r/min离心 15 min,吸取 8 μL 上清液上样。浓缩胶浓度为3%,电流为15 mA;分离胶浓度为12.5%,分离电流为30 mA。采用考马斯亮蓝R-250染色2 h,脱色液(含0.1 g/mL冰乙酸和0.1 g/mL甲醇)脱色至背景清楚。
1.4 数据处理与分析
所有实验进行 3个平行实验,采用 Excel 2010、Origin 8.5和Design-Expert.V8.0.6软件对数据进行分析。样品间差异采用SPSS 2.0软件进行显著性分析,P<0.05为差异显著,图2~图6中不同字母表示差异性显著。
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对高油酸花生油脂体得率的影响
由图2可知,液料比对高油酸花生油脂体得率影响显著(P<0.05)。得率随加水量的增加而增大,当体系液料比为6∶1(mL/g)时,得率达到最高。这是因为当加水量太小时,底物浓度太高,酶被完全饱和,酶分子迁移和油脂体游离受到抑制,不利于油脂体的提取。而加水量过大,导致体系中酶和底物的浓度降低,降低了酶与底物接触几率[15],酶反应速率受到影响,油脂体得率有所降低。综合考虑油脂体得率和用水量等经济因素,确定提取高油酸花生油脂体的液料比为 5∶1~7∶1(mL/g)。

图2 液料比对高油酸花生油脂体得率的影响
2.1.2 酶用量对高油酸花生油脂体得率的影响
由图 3可知,高油酸花生油脂体得率随酶用量的增加而增大,酶用量为400 U/g时油脂体得率最大。当酶用量低于400 U/g时,酶用量的变化对油脂体得率无显著性影响(P>0.05),这是由于低剂量的复合酶尽管能一定程度上水解细胞壁,但对细胞壁的水解程度不足以释放出大量油脂体;当酶用量超过400 U/g时,油脂体得率趋于平缓,这是因为底物浓度固定时,随着酶用量增加,底物与酶的接触几率增大[16],细胞壁的破坏程度相应增加,细胞内的物质被充分释放;当酶用量继续增加时,反应体系达到了相对平衡状态,油脂体得率变化平稳。综合考虑油脂体得率和生产成本,确定提取高油酸花生油脂体的酶用量为 300~500 U/g。

图3 酶用量对高油酸花生油脂体得率的影响
2.1.3 酶解时间对高油酸花生油脂体得率的影响酶解时间的长短是影响油脂体得率的关键因素之一。如图4所示,随酶解时间的延长,高油酸花生油脂体得率大致呈上升趋势,这是由于一定酶解时间内,酶与底物接触充分[17],油脂体释放量增加;进一步延长酶解时间,油脂体已经充分释放,而底物浓度相对降低,体系反应速率缓慢。综合考虑得率和时间成本,确定提取高油酸花生油脂体的酶解时间为60~100 min。
2.1.4 酶解温度对高油酸花生油脂体得率的影响温度是酶解反应的另一关键因素。如图5所示,当酶解温度低于 60 ℃时,高油酸花生油脂体的得率随温度升高而增加;酶解温度60 ℃时,得率达到最高,这是因为一定范围内升高温度能提高酶活性,增加酶促反应和油脂体迁移的速率,有利于油脂体的释放和聚集。当温度超过 60 ℃后,由于温度过高,导致部分酶结构发生改变,引起失活[16],另外温度过高会引起油脂体稳定性降低,因此油脂体得率呈下降趋势。综合考虑油脂体得率和品质,确定酶解温度为55~65 ℃。
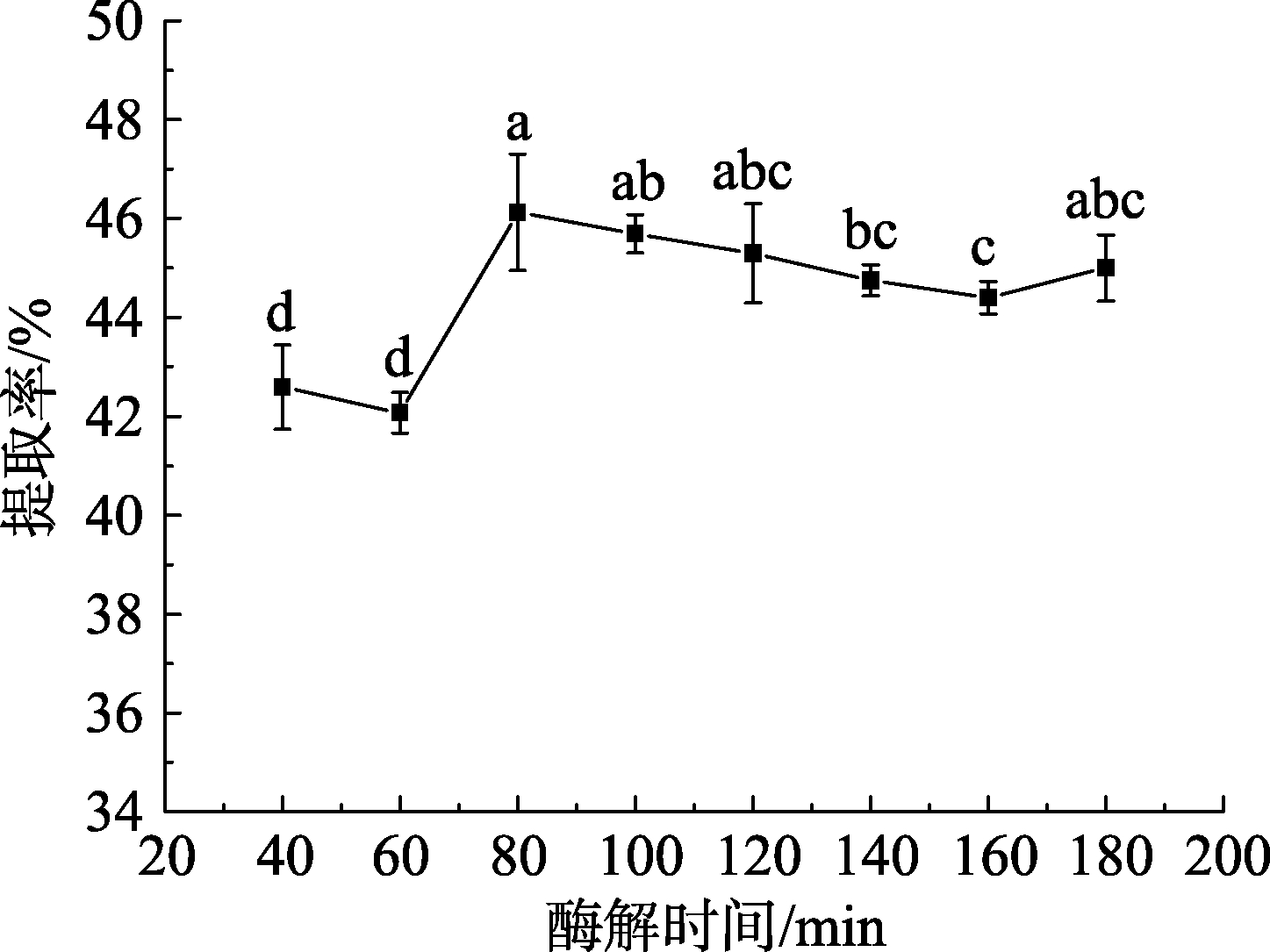
图4 酶解时间对高油酸花生油脂体得率的影响
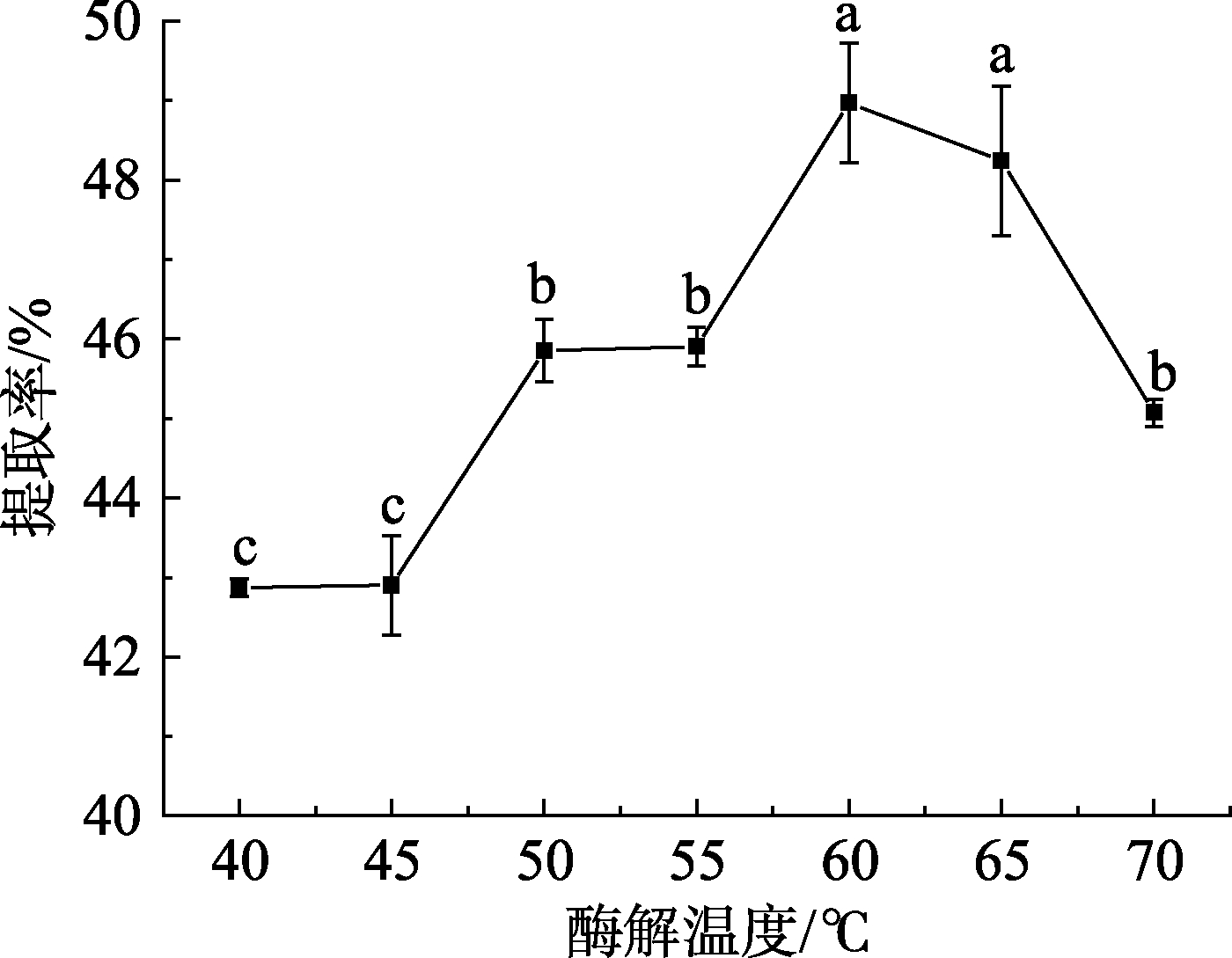
图5 酶解温度对高油酸花生油脂体得率的影响
2.1.5 酶解pH对高油酸花生油脂体得率的影响
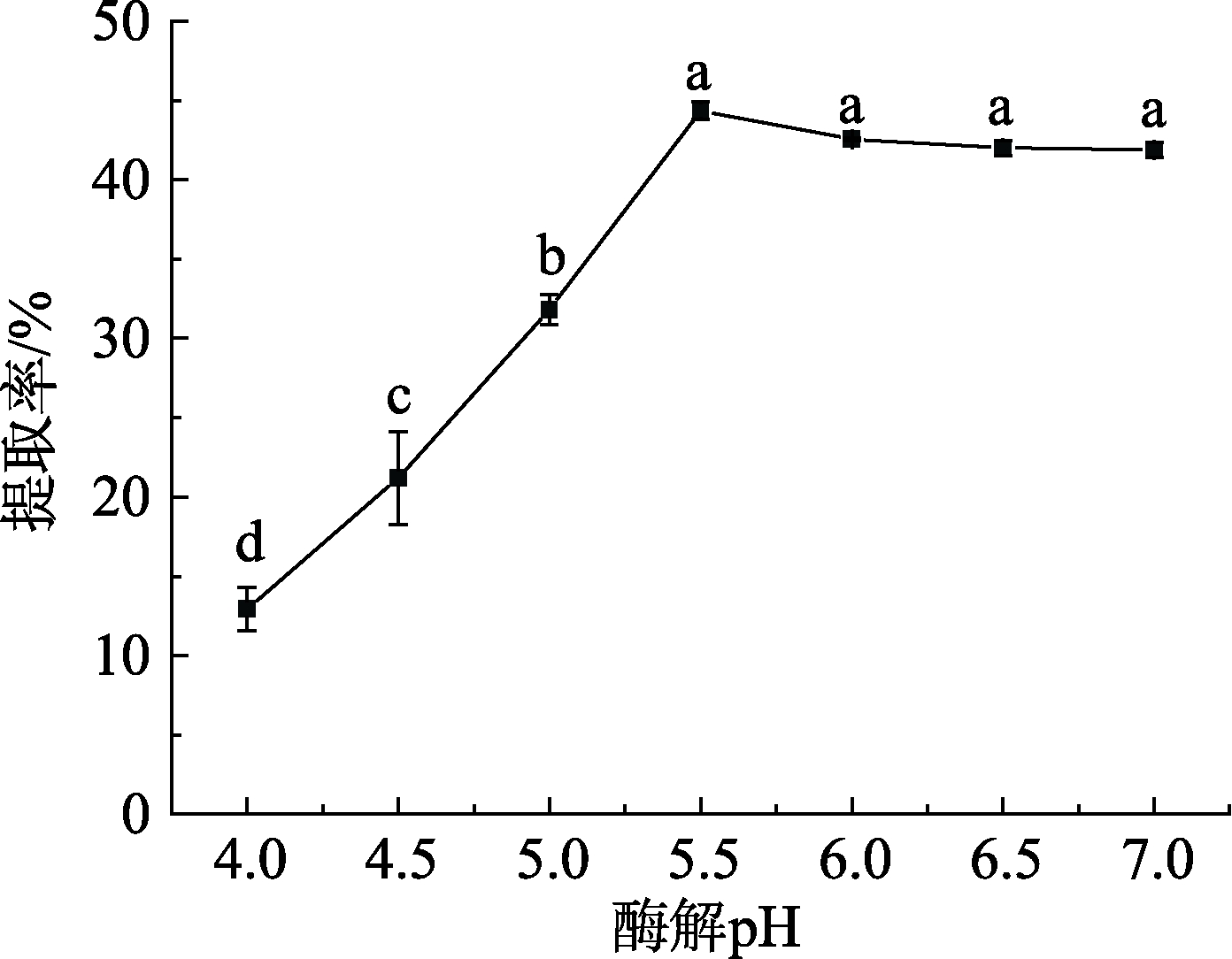
图6 酶解pH对高油酸花生油脂体得率的影响
如图6所示,在pH<7,随pH的升高,高油酸花生油脂体得率呈先上升后平缓的趋势,在pH5.5时得率最高;当pH<5.5时,体系pH越低,油脂体的得率越低且体系中有游离油的出现,说明较低的 pH破坏了油脂体表面蛋白电荷平衡,致使游离油脂出现;且 pH值过低时酶活性中心构象发生改变,降低酶与底物的结合几率[18],因而油脂体得率较低。因此确定高油酸花生油脂体提取的酶解pH为5.5。
2.2 响应面实验结果与分析
2.2.1 数学模型建立与显著性检验
响应面实验设计及结果见表 2。根据表 2响应面设计和结果,利用Design-Expert V8.0.6对实验结果进行多元回归拟合分析,建立高油酸花生油脂体得率与液料比、酶用量、酶解时间和酶解温度的二次多项回归模型,该模型对应的回归方程为:
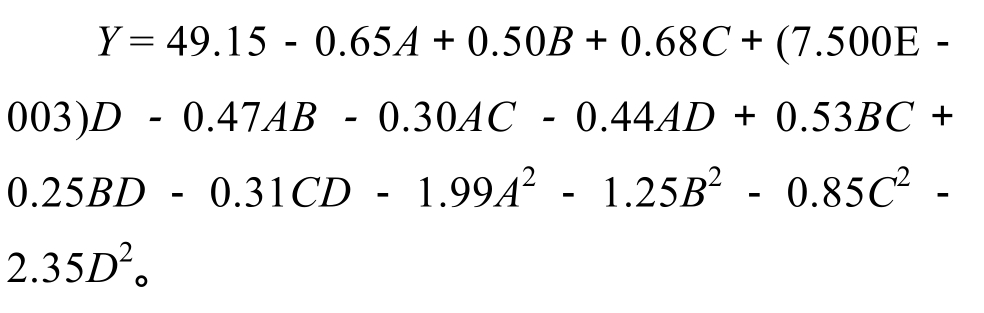
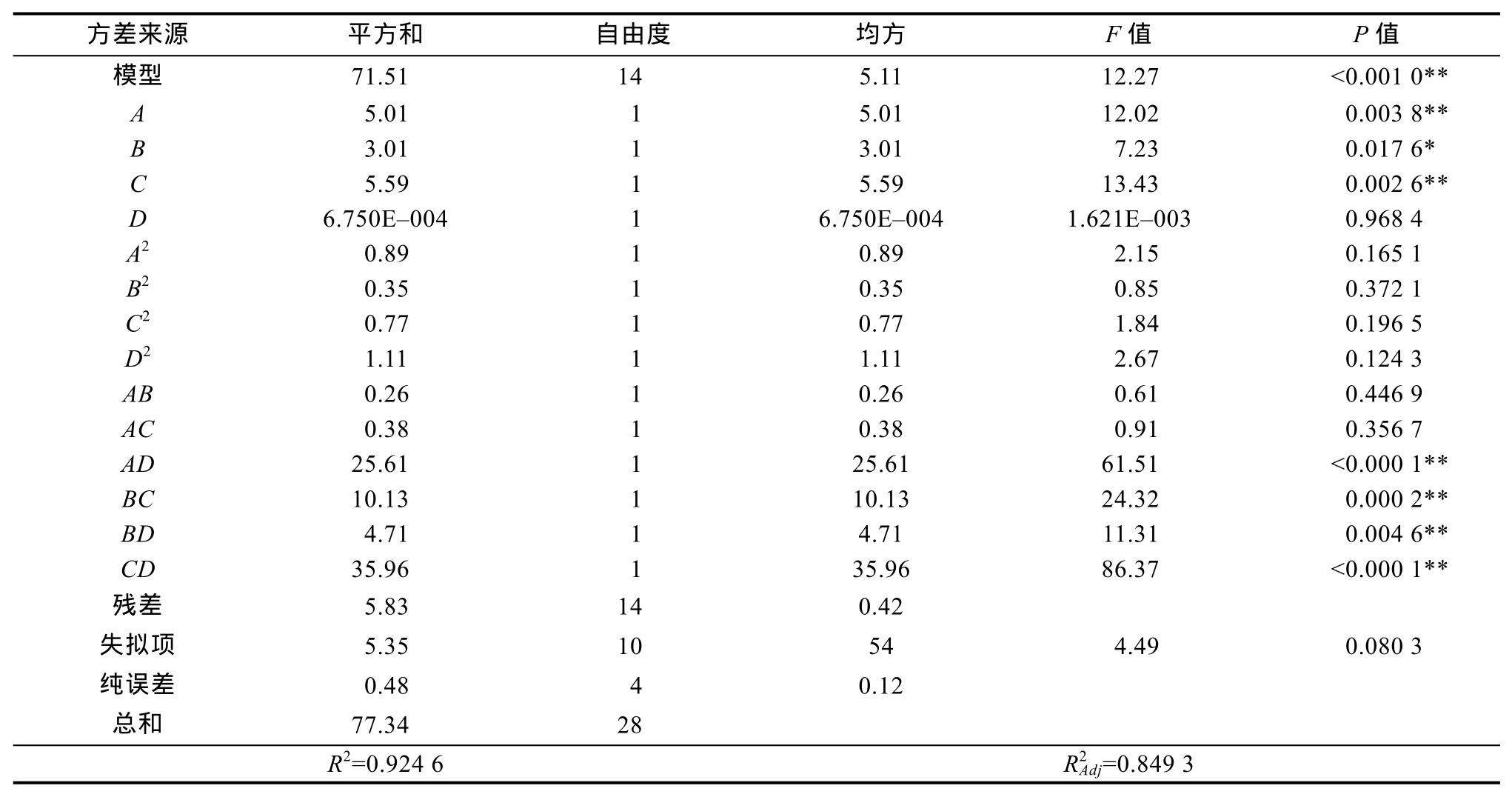
由表3可知,模型达到极显著水平模型(P<0.01),同时失拟项不显著(P>0.05),且模型![]() 说明该模型拟合程度好,实验误差小[19],能较好地反映出高油酸花生油脂体得率与液料比、酶用量、酶解时间和酶解温度间的关系。模型中一次项 A、C和二次项AD、BC、BD、CD 影响极显著(P<0.01),一次项B影响显著(P<0.05),可推测出各因素对响应值的影响并非简单的线性关系,而是一个复杂的多元回归过程[20]。由F值大小可知,在实验范围内各因素对高油酸花生油脂体得率的影响大小依次为酶解时间>液料比>酶用量>酶解时间。
说明该模型拟合程度好,实验误差小[19],能较好地反映出高油酸花生油脂体得率与液料比、酶用量、酶解时间和酶解温度间的关系。模型中一次项 A、C和二次项AD、BC、BD、CD 影响极显著(P<0.01),一次项B影响显著(P<0.05),可推测出各因素对响应值的影响并非简单的线性关系,而是一个复杂的多元回归过程[20]。由F值大小可知,在实验范围内各因素对高油酸花生油脂体得率的影响大小依次为酶解时间>液料比>酶用量>酶解时间。
表2 响应面实验设计及结果

序号 A B C D 实际值 预测值 序号 A B C D 实际值 预测值Y/%Y/%1 0 0 0 0 49.10 49.15 16 -1 1 0 0 47.69 47.53 2 1 0 0 1 43.60 43.73 17 0 -1 0 -1 44.90 45.29 3 0 0 0 0 48.67 49.15 18 -1 0 0 1 46.18 45.90 4 0 1 0 1 47.11 46.30 19 1 -1 0 0 45.22 45.24 5 0 0 0 0 49.58 49.15 20 -1 0 0 -1 44.58 45.01 6 0 0 0 0 49.03 49.15 21 0 0 1 -1 47.37 46.92 7 1 1 0 0 45.34 45.29 22 0 0 1 1 45.73 46.32 8 0 0 -1 1 45.27 45.57 23 0 1 1 0 47.85 48.76 9 0 1 -1 0 45.76 46.34 24 1 0 -1 0 45.44 45.28 10 0 0 0 0 49.36 49.15 25 0 -1 1 0 46.72 46.70 11 0 0 -1 -1 45.68 44.94 26 0 -1 0 1 44.74 44.80 12 1 0 0 -1 43.75 44.59 27 -1 0 1 0 48.19 47.93 13 -1 -1 0 0 45.68 44.94 28 1 0 1 0 46.83 46.05 14 -1 0 -1 0 45.61 45.98 29 0 1 0 -1 46.26 45.78 15 0 -1 -1 0 46.74 46.39
表3 回归与方差分析结果
注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。
方差来源 平方和 自由度 均方 F值 P值模型 71.51 14 5.11 12.27 <0.001 0**A 5.01 1 5.01 12.02 0.003 8**B 3.01 1 3.01 7.23 0.017 6*C 5.59 1 5.59 13.43 0.002 6**D 6.750E-004 1 6.750E-004 1.621E-003 0.968 4 A2 0.89 1 0.89 2.15 0.165 1 B2 0.35 1 0.35 0.85 0.372 1 C2 0.77 1 0.77 1.84 0.196 5 D2 1.11 1 1.11 2.67 0.124 3 AB 0.26 1 0.26 0.61 0.446 9 AC 0.38 1 0.38 0.91 0.356 7 AD 25.61 1 25.61 61.51 <0.000 1**BC 10.13 1 10.13 24.32 0.000 2**BD 4.71 1 4.71 11.31 0.004 6**CD 35.96 1 35.96 86.37 <0.000 1**残差 5.83 14 0.42失拟项 5.35 10 54 4.49 0.080 3纯误差 0.48 4 0.12总和 77.34 28 R2=0.924 6 R2Adj=0.849 3
2.2.2 因素间交互作用影响结果
液料比、酶用量、酶解时间和酶解温度的两因素交互作用响应面见图 7,可直观地根据响应面图坡度的陡峭程度判断各交互项对高油酸花生油脂体得率的影响。如图7所示,液料比和酶用量、液料比和酶解时间对高油酸花生油脂体得率影响明显,液料比和酶解温度、酶用量和酶解时间、酶用量和酶解温度、酶解时间和酶解温度交互作用显著,与方差分析结果一致。

图7 各因素交互作用对高油酸花生油脂体得率影响的响应面图
根据所得到的回归模型,采用Design-Expert V8.0.6对实验结果进一步处理分析得到酶法提取高油酸花生油脂体的最佳工艺条件为液料比5.75∶1(mL/g)、酶用量 436 U/g、酶解时间91 min、酶解温度 60.04 ℃。考虑到实验的可操作性,将工艺条件调整优化为液料比 6∶1(mL/g)、酶用量440 U/g、酶解时间90 min、酶解温度60 ℃,在此条件下进行3组平行实验,实际平均得率为49.30%,与理论预测值(49.51%)接近,说明响应面法优化得到的回归模型和最佳条件切实可靠,重复性好,可以用来优化酶法提取高油酸花生油脂体的提取工艺。
2.3 油脂体成分分析
为考察上述工艺提取的花生油脂体的品质,对所提取花生油脂体的基本成分、脂肪酸组成及蛋白质组成进行了测定,结果分别见表4、5和图8。
表4 高油酸花生油脂体的基本成分表 %(湿基)

水分及易挥发物 粗脂肪 粗蛋白 灰分 其他28.77±4.50 60.14±3.75 8.06±0.63 0.51±0.0632.52±1.31
表5 高油酸花生油脂体脂肪酸组成及含量 %

注:∑SFA总饱和脂肪酸;∑MUFA总单不饱和脂肪酸;∑PUFA总多不饱和脂肪酸;∑UFA总不饱和脂肪酸。
序号 名称 花生原料 油脂体1 C16:0(棕榈酸) 6.31±0.05 6.23±0.13 2 C18:0(硬脂酸) 3.15±0.11 3.16±0.02 3 C18:1(油酸) 77.59±0.07 77.87±0.10 4 C18:2(亚油酸) 5.07±0.10 4.98±0.21 5 C20:0(花生酸) 1.51±0.12 1.49±0.08 6 C20:1(花生一烯酸) 1.63±0.15 1.60±0.10 7 C22:0(二十二碳烷酸) 2.80±0.07 2.78±0.12 8 C22:1(二十二碳一烯酸) 1.64±0.04 1.60±0.06 9 C24:0(二十四烷酸) 0.30±0.06 0.29±0.04— ∑SFA 14.07 13.95— ∑MUFA 80.86 81.07— ∑PUFA 5.07 4.98— ∑UFA 85.93 86.05
由表4可以看出,高油酸花生油脂体中脂肪和蛋白质含量分别为(60.14±3.75)%和(8.06±0.63)%,与康波[21]酶法提取花生油脂体的结果[脂肪含量(69.94±0.06)%,蛋白质含量(1.96±0.03)%]具有一定差异性,可能是本实验对提取的油脂体清洗不完全,致使很多吸附于油脂体表面的外源蛋白未被洗脱[22],从而使蛋白质含量增加,粗脂肪相对含量降低。

图8 高油酸花生油脂体蛋白的SDS-PAGE电泳分析
注:条带1:Marker;条带2:花生油脂体
由表 5可知,高油酸花生原料和高油酸花生油脂体脂肪酸均由油酸、棕榈酸、亚油酸、二十二碳烷酸、二十二碳一烯酸和花生酸等成分组成,其中油酸含量最高,棕榈酸次之。高油酸花生油脂体总饱和脂肪酸含量为14.17%,总单不饱和脂肪酸含量为 81.76%,总多不饱和脂肪酸含量为4.08%。油脂体脂肪酸组成与花生原料脂肪酸组成无明显差异(P>0.05),这是因为油料作物种子中的油脂绝大多数储存于油脂体中[23]。
通过SDS-PAGE电泳表征所提取高油酸花生油脂体的蛋白组成,由图8可以看出高油酸花生油脂体中蛋白质分子质量为 16~81 kDa,共有 9个条带,其中1条为油体固醇蛋白(Steroleosin),3条为油体膜蛋白(17、18、24 kDaOleosin),这与陈雅静等[24]研究结果类似。通过Image Lab软件对电泳条带分析知:所提取的花生油脂体蛋白中特征性内源油体蛋白(油体膜蛋白、油体钙蛋白和油体固醇蛋白)[25]含量近80%,表明上述目标产物确为花生油脂体且纯度较高。此外,所提取的油脂体中外源性蛋白含量近20%,这可能与酶解过程外源蛋白质的吸附行为和粗油脂体的清洗不完全有关。
3 结论
本研究在单因素实验的基础上,根据 Box-Behnken实验设计原理对酶法提取高油酸花生油脂体的工艺进行了响应面优化。通过回归数学模型得到最佳工艺条件为 pH 5.5、液料比 6∶1(mL/g)、酶用量440 U/g、酶解时间90 min、酶解温度 60 ℃,在此条件下高油酸花生油脂体得率为 49.30%,与理论预测值 49.51%接近,证明响应面法优化设计应用于酶法提取高油酸花生油脂体的工艺中切实可行,重复性好。对所提取花生油脂体的基本成分、脂肪酸组成及蛋白质组成测定:油脂体中粗脂肪含量为(60.14±3.75)%、粗蛋白含量为(8.06±0.63)%。与花生原料相比,高油酸花生油脂体中脂肪酸组成与相对含量无显著差异(P>0.05)。电泳结果显示高油酸花生油脂体中含两种特征性内源油体蛋白(油体膜蛋白和油体固醇蛋白),其总含量近80%。酶法提取高油酸花生油脂体工艺的研究结果,为高油酸花生的产品开发和高油酸花生油脂体的应用提供参考。
[1]DE S C, DI V B, FOSTER T, et al.Enhancing the recovery of oilseed rape seed oil bodies (oleosomes) using bicarbonate-based soaking and grinding media [J].Food Chemistry, 2017, 241:419-426.
[2]CHEN Y M, CHEN Y J, ZHAO L P, et al.A two- chain aspartic protease present in seeds with high affinity for peanut oil bodies[J].Food Chemistry, 2018, 241: 443-451.
[3]丁俭, 张巧智, 韩天翔, 等.热处理对大豆油脂体乳液特性的影响[J].食品科学, 2016, 37(19): 8-14.
[4]MATSAKIDOU A, BILIADERIS C G, KIOSSEOGLOU V.Preparation and characterization of composite sodium caseinate edible films incorporating naturally emulsified oil bodies [J].Food Hydrocolloids, 2013, 30(1): 232-240.
[5]SHIMADA T L, HAYASHI M, HARA-NISHIMURA I.Membrane dynamics and multiple functions of oil bodies in seeds and leaves [J].Plant Physiology, 2018, 176(1): 199-207.
[6]胡琪, 郭诗文, 吕莹, 等.油脂体组成、结构及油脂体蛋白研究进展[J].食品科学, 2015, 36(11): 230-235.
[7]郑畅, 杨湄, 周琦, 等.高油酸花生油与普通油酸花生油的脂肪酸、微量成分含量和氧化稳定性[J].中国油脂, 2014,39(11): 40-43.
[8]ZHU X F, ZHANG N, LIN W F, et al.Freeze-thaw stability of pickering emulsions stabilized by soy and whey protein particles[J].Food Hydrocolloids, 2017, 69: 173-184.
[9]RUJIRA S.玉米胚芽油脂体的水-酶法提取及其物理化学特性[D].北京: 中国农业大学, 2014.
[10]KAPCHIE V N, WEI D, HAUCK C, et al.Enzyme-assisted aqueous extraction of oleosomes from soybeans (glycine max)[J].Journal of Agricultural and Food Chemistry, 2008,56(5): 1766-1771.
[11]LOMAN A A, CALLOW N V, ISLAM S M M, et al.Single-step enzyme processing of soybeans into intact oil bodies, protein bodies and hydrolyzed carbohydrates[J].Process Biochemistry,2018, 68: 153-164.
[12]赵自通, 郝莉花, 李宇健, 等.复合植物水解酶提取花生油脂体工艺研究[J].食品科学技术学报, 2017, 35(3): 31-35.
[13]郝莉花, 陈复生, 刘昆仑, 等.不同品种花生油脂体粒径电位和蛋白质组成的分析[J].农业工程学报, 2016, 32(18):279-284.
[14]张丽霞, 芦鑫, 宋国辉, 等.芝麻林素对煎炸过程中大豆油品质的影响[J].食品科学, 2018, 39(1): 78-83.
[15]张玉峰, 王挥, 宋菲, 等.水酶法提取棕榈油的工艺研究[J].粮油食品科技, 2019, 27(2): 24-28.
[16]吉惠杰, 杨艳俊, 沈启慧, 等.超声辅助酶解法提取仙人草多糖的工艺研究[J].粮油食品科技, 2017, 25(2): 74-77.
[17]王伟旭, 汪丽萍, 于雷, 等.酶解条件对麦麸低聚木糖含量及其性质的影响[J].粮油食品科技, 2017, 25(4): 17-23.
[18]辜雪冬, 肖娟, 周康, 等.纤维素酶辅助水蒸气蒸馏提取柠檬果皮精油工艺优化[J].食品与机械, 2018, 34 (8): 145-152.
[19]李玉珍, 肖怀秋.碎籼米蛋白质中性蛋白酶酶法提取工艺优化[J].粮油食品科技, 2017, 25(2): 22-27.
[20]吕小京, 操德群, 徐年军.响应面试验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺[J].食品科学, 2018, 39(6):183-188.
[21]康波.花生油体乳液稳定性及乳液凝胶的研究[D].广州: 华南理工大学, 2010.
[22]RODELAS AJD, REGALADO E S, BELA-ONG D B, et al.Isolation and characterization of the oil bodies and oleosin of coconut (cocosnucifera L.) [J].Philippine Agricultural Scientist,2008, 91(4): 389-394.
[23]TZEN J T, LIE G C, HUANG A H.Characterization of the charged components and their topology on the surface of plant seed oil bodies [J].Journal of Biological Chemistry, 1992,267(22): 15 626-15 634.
[24]陈雅静, 赵路苹, 华欲飞, 等.植物种子油体的提取及其性质的初步研究[J].中国粮油学报, 2017, 32(5): 62-67.
[25]LIN L J, LIAO P C, YANG H H, et al.Determination and analyses of the N-termini of oil-body proteins, steroleosin,caleosin and oleosin[J].Plant Physiology and Biochemistry(Paris), 2005, 43(8): 770-776.