表1 菌株ASAGF58发酵重悬液不同处理时间下蚊子幼虫的致死率 %
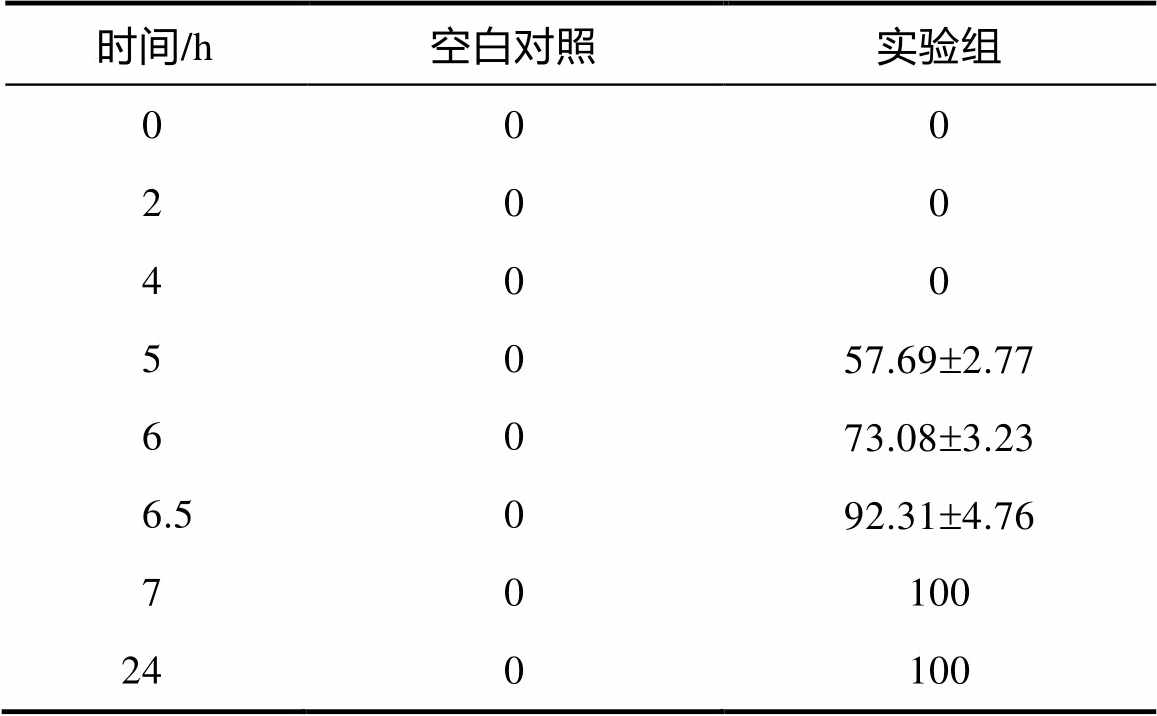
时间/h空白对照实验组 000 200 400 5057.69±2.77 6073.08±3.23 6.5092.31±4.76 70100 240100
摘 要:杀虫抗生素因为具有环保、高效的特点,适合粮食储藏过程中病虫害防治的技术要求。为获取新型杀虫抗生素,采集162份不同地区土壤样品,采用多种方法分离出大量放线菌。利用高通量发酵平台及蚊子幼虫生物测定的方法筛选具有杀虫活性的微生物,得到一株放线菌ASAGF58。经 16S rDNA测序及构建系统发育树,将其归属为糖多孢菌属(Saccharopolyspora)。对其发酵液进行HPLC及LC-MS分析,鉴定得到两个生物活性组分,质荷比分别为758.483 8与772.471 2,与糖多孢菌属须糖多孢菌(Saccharopolyspora pogona)代谢产物丁烯基多杀菌素相符。获得一株产丁烯基多杀菌素的菌株,为我国高效、绿色杀虫化合物的研发提供技术储备。
关键词:丁烯基多杀菌素;高通量筛选;杀虫活性检测
放线菌作为微生物源生物活性物质的主要来源,其分离及代谢产物的研究备受瞩目。至2010年,约有13 700种生物活性物质来源于放线菌,在微生物源生物活性物质中占比约40.9%[1],因此获取丰富的放线菌资源是得到新的生物活性物质的有效手段。杀虫活性检测是一种快速有效的生测方法,以对某些昆虫的抑制和灭杀效果为标准进行筛选,已成功分离多种具有生物活性代谢产物的菌株[2-4]。陈园等[5]以蚊子幼虫为靶标动物,基于多杀菌素浓度与蚊子幼虫致死率的相关性,建立多杀菌素高产菌株高通量快速筛选模型,显著提高了多杀菌素高产菌株的筛选效率。周淑芳构建了以果蝇幼虫为指示动物、刺糖多孢菌菌块为检测对象的活体筛选模型,运用该快速初筛模型,通过比较不同刺糖多孢菌菌块对果蝇幼虫的致死率,初步筛选出多杀菌素高产菌株[6]。多杀菌素兼具生物农药的安全性和化学合成农药的速效性,作为农用抗生素的杰出代表,有望成为新一代杀虫剂的主要品种,其作为储粮防护剂目前已在国内开展了实仓应用示范。采用拌粮法,在处理浓度为1 mg/kg的条件下,对粮库中常见的储粮害虫(谷蠹、米象、赤拟谷盗等)具有显著防治效果,且对粮食品质基本无影响[7]。
丁烯基多杀菌素是须糖多孢菌NRRL30141的次级代谢产物,该菌株由美国陶氏益农公司于1999年在美国印第安纳州的土壤样品中分离得 到[8]。丁烯基多杀菌素与多杀菌素A的主要区别为C21位由丁烯基取代了乙基[9],二者结构上的相似性使它们的理化性质和作用机理都比较相近[10],但丁烯基多杀菌素的杀虫活性更高,作用范围更广,对多杀菌素杀虫谱外的苹果蠹蛾、烟青虫等都具有良好的杀虫活性[11]。现阶段国内外对丁烯基多杀菌素的相关研究比较少,Daeuble J等[12]通过烯烃交叉歧化反应对丁烯基多杀菌素进行了成功改造,结果表明延长鼠李糖3’-C烷基部分长度能够明显提高其生物活性,而对21-C烷基部分的延长改造仅使其生物活性略有增加。邬洋等[13]用核糖体工程技术,对须糖多孢菌进行巴龙霉素抗性筛选,突变株相比原始菌株丁烯基多杀菌素的产量提高2.2倍,罗林根等[14]对其进行链霉素抗性筛选,丁烯基多杀菌素产量提高1.79倍,并且获得了新的组分spinosyn α1。目前尚没有丁烯基多杀菌素商业化产品,也没有满足丁烯基多杀菌素工业化生产的菌种及发酵生产技术的报道。
本研究利用课题组建立的96孔板发酵培养结合生物测定的高通量筛选方法,在5 458株放线菌中筛选得到了一株产丁烯基多杀菌素的菌株,为新的储粮防护剂的开发提供数据支撑。
刺糖多孢菌ATCC49460:国家粮食和物资储备局科学研究院提供;埃及伊蚊虫卵:中国疾病预防控制中心传染病预防控制所媒介生物防治室提供。
分离培养基I:葡萄糖1.0 g/L,可溶性淀粉2.0 g/L,酶水解酪蛋白0.5 g/L,酵母粉0.5 g/L,CaCO3 0.1 g/L,琼脂15.0 g/L,pH 7.5,115 ℃灭菌25 min。灭菌完成后冷却至60 ℃左右,加入利福平至终浓度1.25 μg/mL,制霉菌素至终浓度50 μg/mL。
分离培养基II:800 mL自来水中加入20 g燕麦,60 ℃搅拌加热30 min,8层纱布过滤,将滤液定容至1 L,琼脂15.0 g,115 ℃灭菌25 min。灭菌完成后冷却至65 ℃左右,加入新生霉素至终浓度12.5 μg/mL,制霉菌素至终浓度50 μg/mL。
分离培养基III:精氨酸2.5 g/L,甘油20.0 g/L,NaCl 1.0 g/L,K2HPO4 1.0 g/L,FeSO4·7H2O 0.1 g/L,MgSO4·7H2O 0.1 g/L,CaCO3 0.1 g/L,琼脂15.0 g/L,115 ℃灭菌25 min。灭菌完成后冷却至65 ℃左右,加入萘啶酮酸至终浓度25 μg/mL,制霉菌素至终浓度50 μg/mL。
种子培养基:葡萄糖10.0 g/L,大豆蛋白胨30.0 g/L,酵母提取物3.0 g/L,MgSO4·7H2O 2.0 g/L,pH 7.2,400 μL/孔分装,115 ℃灭菌25 min。
发酵培养基:葡萄糖50.0 g/L,棉籽蛋白20.0 g/L,NaCl 3.0 g/L,K2HPO4 0.2 g/L,FeSO4·7H2O 0.05 g/L,CaCO3 5.0 g/L,pH 7.2,500 μL/孔分装,115 ℃灭菌25 min。
固体培养基GYM:葡萄糖4.0 g/L,酵母提取物4.0 g/L,麦芽浸粉10.0 g/L,CaCO3 2.0 g/L,琼脂15.0 g/L,pH 7.2,115 ℃灭菌25 min。
选取受人类活动干扰少,有机物质丰富或具有特异性的地区作为土壤样品采集地点。取表层以下5~15 cm的土样200 g,40 ℃烘干,充分研磨后密封,常温保存。本研究共采集土壤样品162个,地域分布为:甘肃省49个、河南省22个、山东省15个、河北省12个、北京市12个、浙江省10个、山西省10个、江西省6个、四川省6个、内蒙古自治区6个、湖北省5个、新疆维吾尔自治区3个、贵州省2个、辽宁省2个、安徽省2个。
取1 g土样于10 mL 0.01 M磷酸盐缓冲液(pH 7.4,0.05%十二烷基磺酸钠)中,加入20颗玻璃珠,经涡旋震荡、超声波处理后将土样悬液分为两部分,一部分60 ℃水浴10 min,另一部分不做处理。将两份土壤悬液稀释后分别涂布于3种不同分离培养基中,29 ℃培养21 d。
挑取筛选平板上菌落形态不同的放线菌单菌落接种于96孔板种子培养基中,280 r/min、29 ℃培养3 d后以15%接种量转接于96孔板发酵培养基中,280 r/min、29 ℃培养7 d[15]。
种子培养:300 mL三角瓶接种量3%,240 r/min、29 ℃培养48 h。发酵培养:300 mL三角瓶接种量10%,240 r/min、29 ℃培养7 d。发酵过程中的第3~7 d每天分别取发酵液进行生物量、pH值、葡萄糖浓度、产量等各参数检测。
向发酵完成后的体系中加入2倍体积甲醇,充分振荡均匀,4 ℃静置过夜。将萃取物4 000 r/min离心10 min,取上清液100 μL于96浅孔板吹干,加入100 μL超纯水重悬,超声2 min,每孔加入5~8只2日龄埃及伊蚊幼虫,对照为同样处理的空白培养基[5]。定时检测蚊子幼虫的死亡率。
采用通用引物27F、1492R对菌株ASAGF58和刺糖多孢菌ATCC49460进行16S rDNA序列扩增,PCR产物送至上海生工生物工程有限公司测序。测序结果在NCBI上使用Blast比对,与糖多孢菌属的其他种使用MEGA 5.1软件作系统发育树。
样品处理:取一定体积的发酵液,加入2倍体积甲醇,充分振荡后,4 ℃静置过夜。萃取物4 000 r/min离心10 min,取上清液采用0.22 μm滤膜过滤。
分析条件为:C18反相柱(ZORBAX Ecllipe XDB-C18,4.6 mm×100 mm,3.5 μm);流动相为V乙腈∶V甲醇∶V水=45∶45∶10,水中含0.05%乙酸铵;进样量为10 μL;流速为1.0 mL/min;检测波长为254 nm[16]。
色谱条件:Agilent 1200;C18色谱柱(4.6 mm× 100 mm,3.5 μm);流动相为V乙腈∶V甲醇∶V水=45∶45∶10,水中含0.05%乙酸铵;流速0.3 mL/min;进样量20 μL。
质谱设置:ESI离子源,正离子模式;扫描范围为m/z 50~1 500,外标法校正。
利用1.4中方法在162个土样中获得了5 458株放线菌。以致死率达到100%时所需时间为评判标准,得到一株杀虫活性最强的菌株ASAGF58。菌株ASAGF58实验组中蚊子幼虫在经菌株ASAGF58发酵重悬液处理5 h后致死率达到50%以上,7 h致死率达到100%,对照组蚊子幼虫培养24 h后仍存活良好(表1)。实验结果重复性良好。
表1 菌株ASAGF58发酵重悬液不同处理时间下蚊子幼虫的致死率 %

时间/h空白对照实验组 000 200 400 5057.69±2.77 6073.08±3.23 6.5092.31±4.76 70100 240100
将菌株ASAGF58接种于GYM固体培养基,30 ℃培养7 d后形成菌落如图1A所示。菌株ASAGF58菌落白色,直径约2~3 mm,边缘整齐,有气生菌丝及孢子,无色素产生。菌株ASAGF58液体培养2 d后菌丝形态如图1B所示,菌丝伸展、有分支和隔膜,成团聚集,呈放射状。菌落与菌丝形态均与刺糖多孢菌类似。
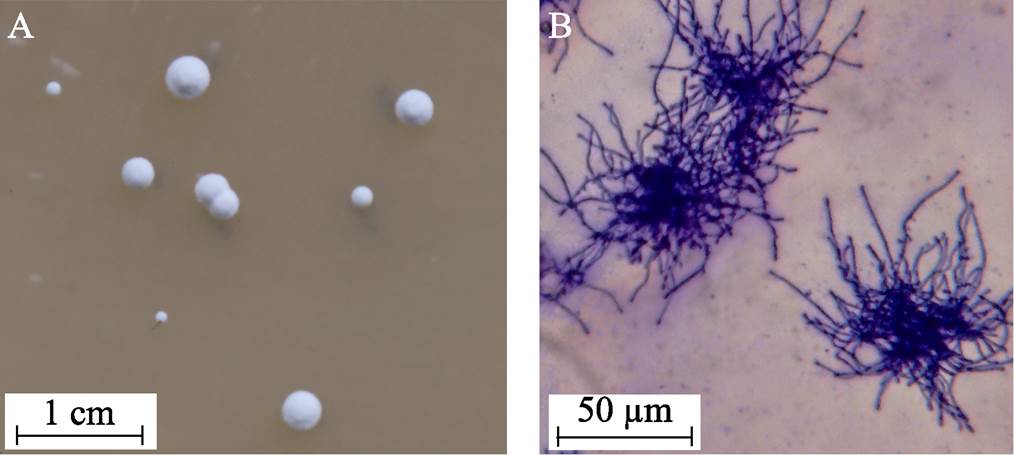
图1 菌株ASAGF58平板菌落形态(A)和显微形态10´40倍(B)
菌株ASAGF58 16S rDNA测序后经Blast比对,结果显示,其与糖多孢菌属标准菌株同源性达96%以上,与刺糖多孢菌同源性达99%。选取糖多孢菌属的标准菌株与菌株ASAGF58构建系统发育树,结果显示(图2),菌株ASAGF58与须糖多孢菌(Saccharopolyspora pogona)同源性最高,由于目前未见须糖多孢菌全基因组序列报道,ASAGF58初步确定为糖多孢菌属(Saccharopolyspora)。
参照1.8对刺糖多孢菌ATCC49460及菌株ASAGF58发酵液进行萃取,并用HPLC检测发酵液组分。结果显示,刺糖多孢菌ATCC49460发酵液中多杀菌素A、D组分的保留时间分别为5.6 min和6.2 min。菌株ASAGF58发酵液中出现2个新组分,保留时间分别为6.4 min和7.2 min(图3)。
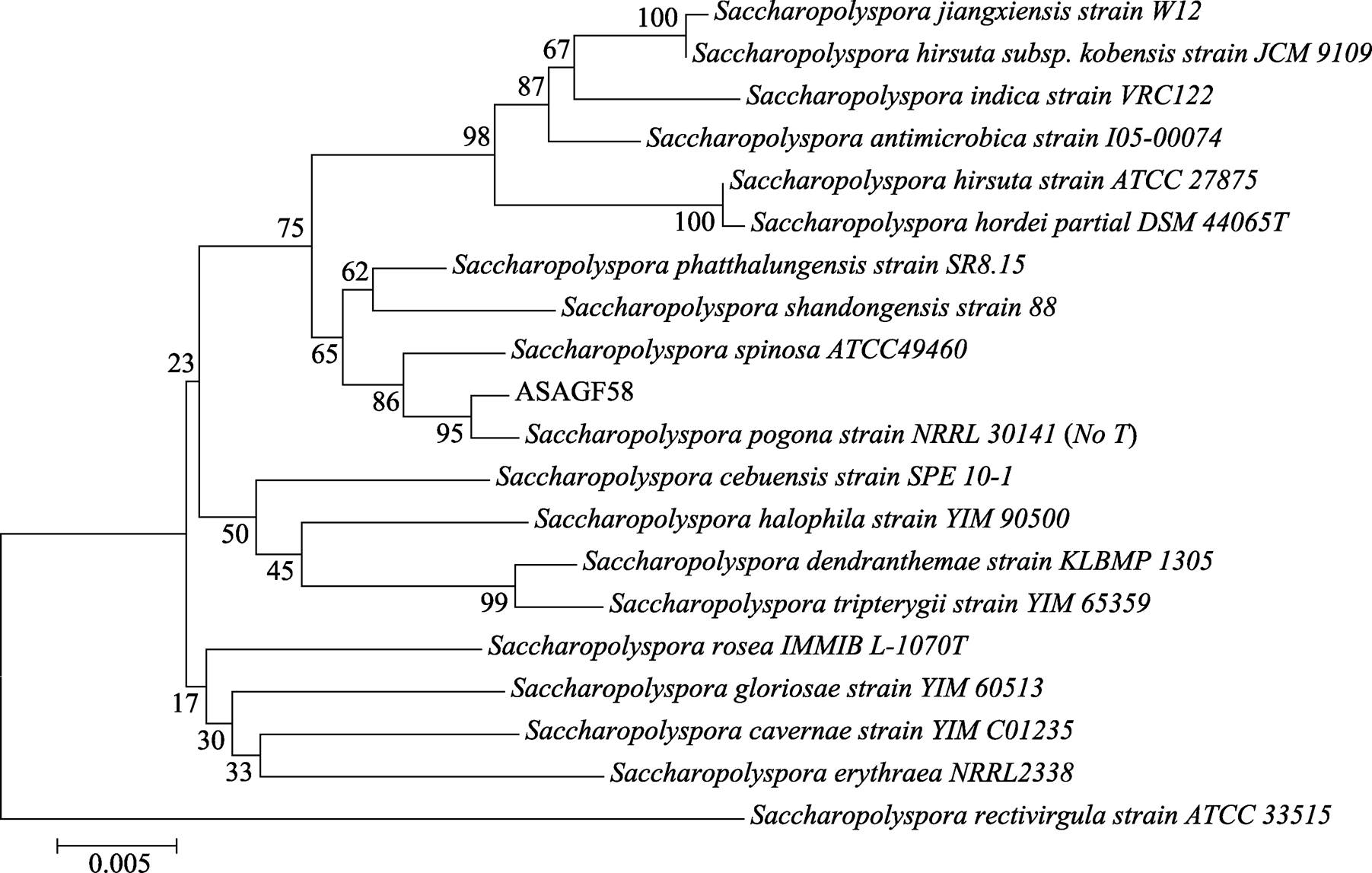
图2 菌株ASAGF58及糖多孢菌属标准菌株16S rDNA基因系统发育树
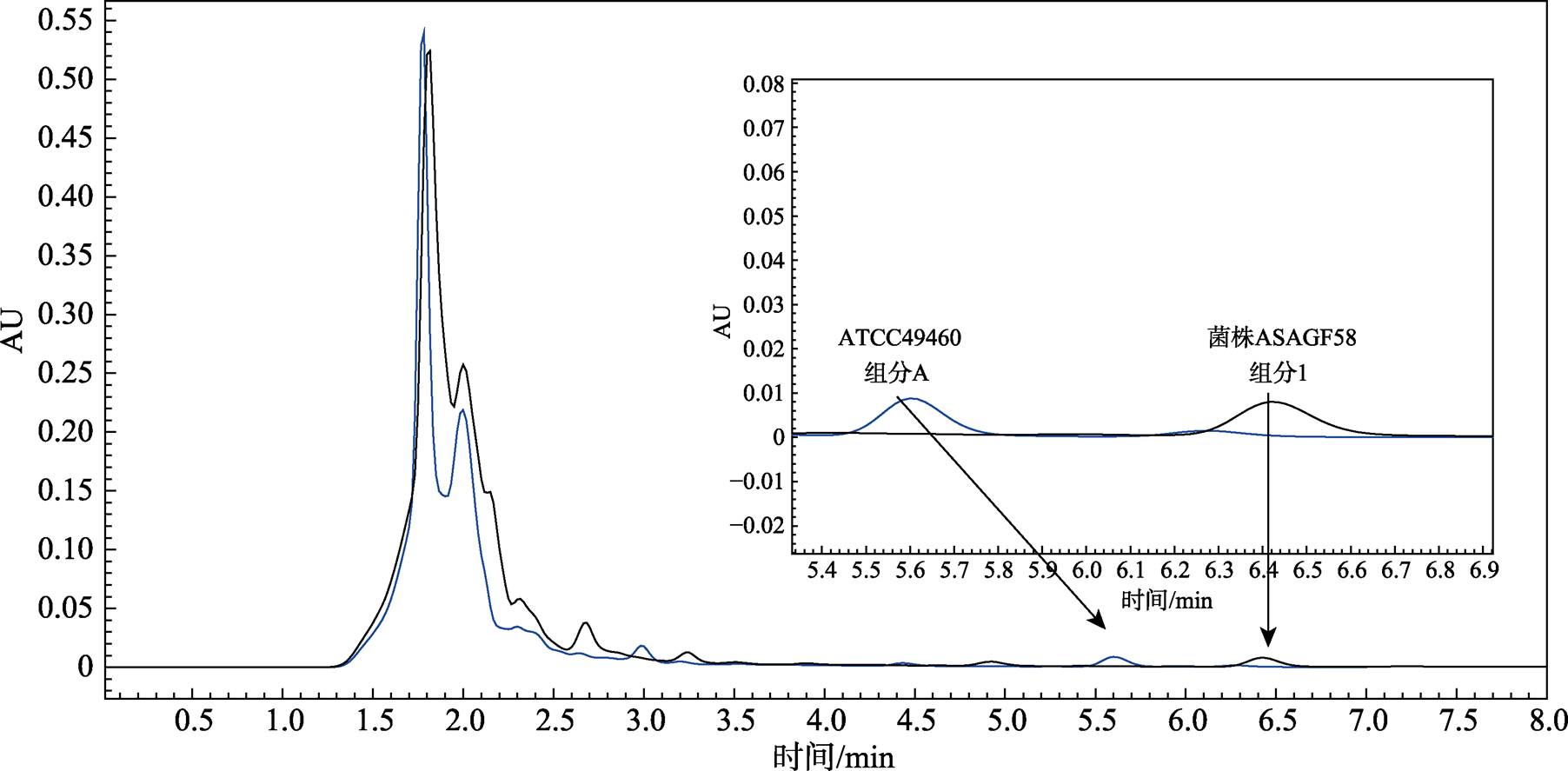
图3 菌株ASAGF58组分1与刺糖多孢菌ATCC49460组分A的HPLC图谱比较
对液相色谱检测到的两个特异性组分进行LC-MS分析,发现所含物质质荷比[M+H]+分别为758.483 8(分子量757)和772.471 2(分子量771)(图4),二者的分子量与多杀菌素A、D在C21上以丁烯基取代乙基的分子量相吻合,且与文献报道丁烯基多杀菌素两组分1、2的分子量相同[17]。

图4 菌株ASAGF58发酵液提取物质谱分析和组分1、2的质荷比
分别对菌株ASAGF58及刺糖多孢菌ATCC49460进行发酵过程分析。结果发现,菌株ASAGF58生长速度较刺糖多孢菌ATCC49460慢,前者的比生长速率在第6 d达到峰值,而后者在第4 d即开始下降;对葡萄糖的消耗速度与生物量增长速度一致,说明葡萄糖的利用率直接影响菌株ASAGF58生物量的增长;ASAGF58在发酵过程中pH基本稳定在6.2;刺糖多孢菌ATCC49460多杀菌素产量在第5 d达到峰值,ASAGF58菌株在第7 d丁烯基多杀菌素产量仍在缓慢增长,7 d后二者产量均达到3.5 ×10-2 g/L左右(图5)。
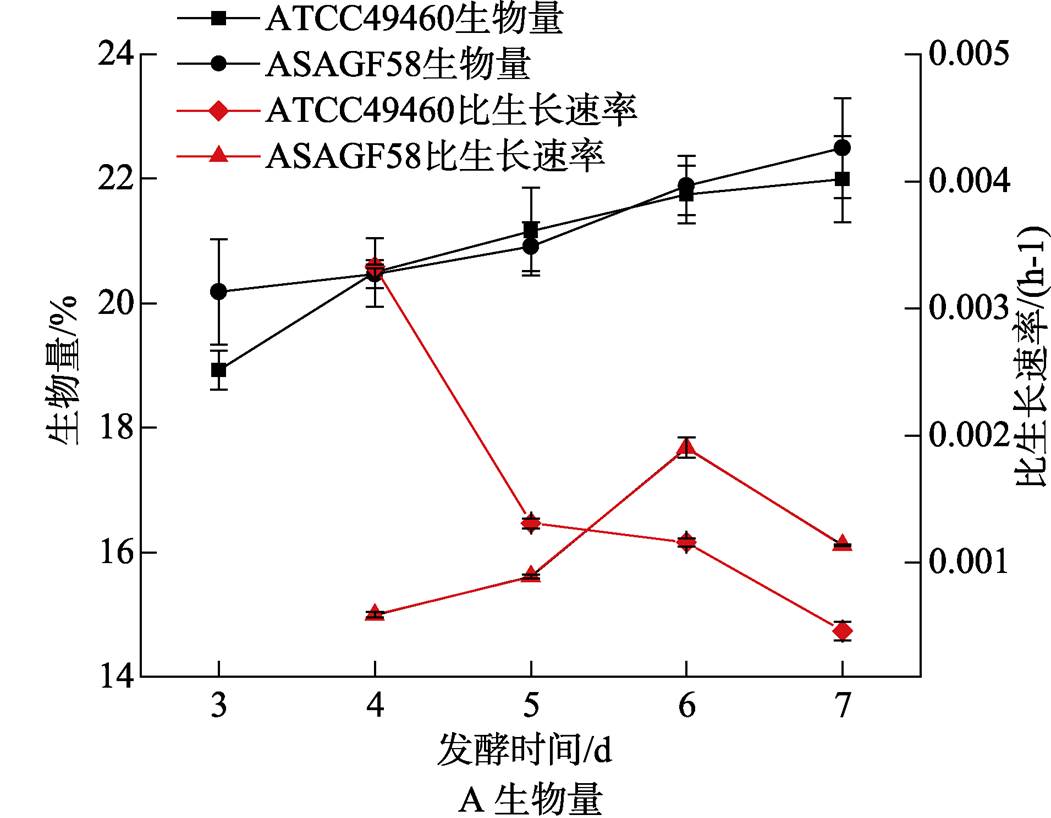
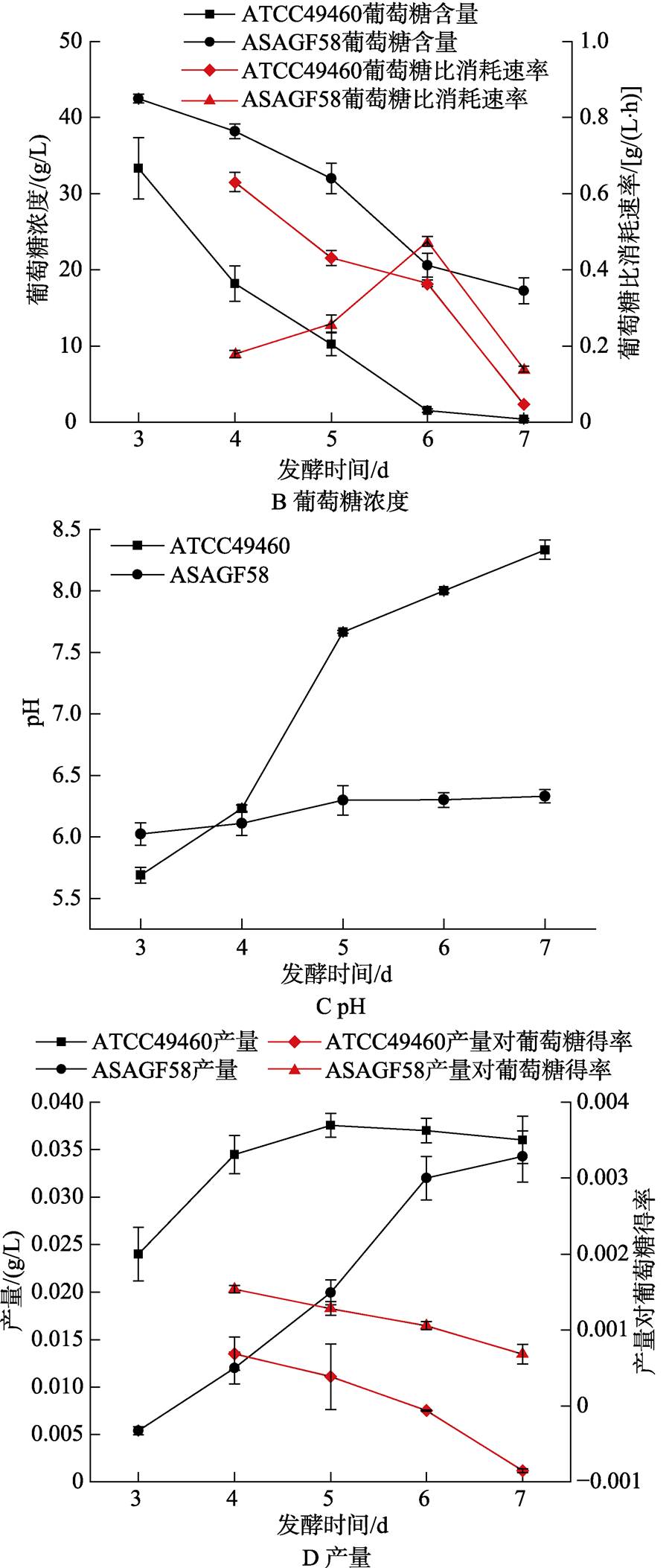
图5 ASAGF58与刺糖多孢菌ATCC49460发酵液生物量、葡萄糖浓度、pH和产量随发酵时间的变化情况
本研究采集大量土壤样品,进行土壤放线菌的分离纯化,并通过高通量生物活性检测,进行杀虫活性物质筛选,获得一株高杀虫活性的放线菌菌株ASAGF58。经16S rDNA测序、构建系统发育树分析,确定其属于糖多孢菌属。HPLC、LC-MS分析发现菌株ASAGF58发酵液中含有两个活性组分,分子量分别为757与771,与糖多孢菌属须糖多孢菌活性产物丁烯基多杀菌素的分子量大小相符。
丁烯基多杀菌素作为多杀菌素新型结构类似物,具有重要的社会应用效益及广阔的市场前景。目前菌株ASAGF58产量较低,在后续研究中,可通过理化诱变、分子育种技术、工艺优化等手段,提高丁烯基多杀菌素的产量,开发新的生物农药。
参考文献:
[1] Bérdy J. Thoughts and facts about antibiotics: Where we are now and where we are heading[J]. J Antibiot (Tokyo), 2012, 65 (8): 385-395.
[2] 何海波, 钟娟, 杨杰, 等. 一株具有杀虫活性真菌的筛选及活性物质稳定性研究[J]. 生物技术通报, 2015, 9: 109-113.
[3] 刘昕超.臭常山和飞龙掌血的杀虫活性成分[D]. 北京: 中国农业大学, 2017.
[4] 刘俊霞. 五味子藤茎化学成分及其杀虫活性研究[D]. 北京: 中国农业科学院, 2016.
[5] 陈园, 熊犍, 王超, 等. 多杀菌素高产菌株快速筛选方法的研究[J]. 粮油食品科技, 2013, 21(4): 99-102.
[6] 周淑芳. 刺糖多孢菌基因组重排育种及快速筛选模型的研究[D]. 杭州: 浙江工业大学, 2014.
[7] 祝星星. 多杀菌素防治储粮害虫应用技术研究[D]. 武汉: 武汉轻工大学, 2014.
[8] Lewer P, Hahn D R, Karr L L, et al. Pesticidal macrolides: US6800614B2[P]. 2004.
[9] Huang K X,Xia L Q, Zhang Y M, et al. Recent advances in the biochemistry of spinosyns[J]. Appl Microbiol Biotechnol, 2009, 82: 13-23.
[10] 寿佳丽, 裘娟萍. 新型生物农药-丁烯基多杀菌素[J]. 农药, 2011, 50(4): 239-243, 272.
[11] Millar N S, Denholm I. Nicotinic acetylcholine receptors: targets for commercially important insecticides[J].Invert Neurosci, 2007, 7(1):53-66.
[12] Daeuble J, Sparks T C, Johnson P, et al. Modification of the butenyl-spinosyns utilizing cross-metathesis[J]. Bioorganic & Medicinal Chemistry, 2009, 17(12): 4197-4205.
[13] 邬洋, 徐妙, 罗林根, 等. 丁烯基多杀菌素高产菌株的巴龙霉素抗性筛选[J]. 中国生物防治学报, 2015, 31(1): 106-114.
[14] 罗林根, 杨燕, 魏慧, 等. 须糖多孢菌Saccharopolyspora pogona的核糖体工程改造对丁烯基多杀菌素合成的影响[J]. 生物工程学报, 2016, 32(2): 259-263.
[15] 罗莉斯, 李能威, 李丽, 等. 96孔板高通量筛选多杀菌素高产菌株的研究[J]. 中国农业科技导报, 2010, 12(2): 133-137.
[16] 熊犍, 李能威, 叶君, 等. 多杀菌素的高效液相色谱测定[J]. 现代食品科技, 2009, 25(6): 704-706.
[17] Lewer P, Hahn D R, Karr L L, et al. Discovery of the butenyl-spinosyn insecticides: novel macrolides from the new bacterial strain saccharopolyspora pogona[J]. Bioorg Med Chem, 2009, 17(12): 4185-4196. 
Screening and identification of the strain producing butenyl-spinosyns
Abstract:Insecticidal antibiotics, due to their high efficiency and environmental protection, meet the technical requirements of controlling crop diseases and insect during storage. In order to obtain new insecticidal antibiotics, numerous actionmycetes were separated from 162 soil samples collected from different districts by different methods. The high activity strain ASAGF58 was screened out by high throughput fermentation platform and mosquito larvae bioassay. Basing on the 16S rDNA sequencing and the construction of phylogenetic tree, ASAGF58 is preliminarily identified as a kind of Saccharopolyspora. Using HPLC and LC-MS, two bioactive components were extracted from the fermentation broth, whose mass-to-charge ratios were 758.483 8 and 772.471 2, respectively, which was consistent with butenyl- spinosyns, the metabolite of Saccharopolyspora pogona. A strain producing butenyl-spinosyns was obtained, which provided technical reserves for the research and development of efficient and green insecticidal compounds in China.
Key words:butenyl-spinosyns; high throughput screening; insecticidal activity detection
DOI: 10.16210/j.cnki.1007-7561.2019.02.011
中图分类号:TS201.3
文献标识码:A
文章编号:1007-7561(2019)02-0055-06
收稿日期:2018-11-16
基金项目:粮食公益性行业科研专项(ZL1302-3-1);北京市科技计划(Z171100001317014)