
摘 要:对比研究A、B、C三种果蔬发酵液产品的抗氧化能力和免疫调节能力。采用偶氮二异丁脒盐酸盐(AAPH)诱导的HepG2细胞氧化应激模型评价三种发酵液产品对细胞内活性氧簇(ROS)的影响,应用刀豆蛋白A(ConA)和脂多糖(LPS)诱导小鼠T/B淋巴细胞,检测其增殖能力,应用LPS诱导小鼠腹腔巨噬细胞,检测其吞噬能力和NO释放量。结果表明:三种果蔬发酵液具有较强的降低细胞内ROS含量的能力,果蔬发酵液A可使胞内ROS含量降低至55%;三种果蔬发酵液可提高淋巴细胞的增殖能力和腹腔巨噬细胞的吞噬能力,促进NO释放,在稀释倍数为104时果蔬发酵液A处理组NO释放量最高(4.06 μmol/L)。三种果蔬发酵液具有较好的抗氧化活性和增强免疫的功能。
关键词:果蔬发酵液;抗氧化;免疫调节
酵素(发酵液)发酵主要是利用酵母菌、乳酸菌和霉菌对原料(水果、蔬菜、糙米、菇类、药食同源中药等)进行微生物代谢活动,实现糖类、蛋白质、脂质三大物质之间的转化[1]。酵素是一种混合物,富含多种维生素、矿物质、低聚糖、多酚、有机酸、功能性酶类等,具有美白抗衰老[2]、解酒护肝[3]、调节肠道菌[4]等功能。果蔬酵素是从植物原材料中提取出来的一种植物综合发酵液,原料包括西蓝花、柠檬、西番莲、苦瓜、黑木耳、甜椒、橙子、番茄、菠萝等多达几十种甚至上百种水果和蔬菜,经过多次发酵后研制而成。
酵素起源于日本,在日本已有上百年的历史,且日本发明了独有的氨基酸、核酸发酵技术,至今为止在此方面日本位居世界前列[5]。天然果蔬发酵液系列产品在发达地区和国家已经非常流行,而国内发酵液属于新型产品,主要用于美容院,口服果蔬发酵液类产品较为稀缺,质量参差不齐,相关报道较少,因此对果蔬发酵液的研究显得十分重要。抗氧化是指抵抗氧化的作用,使细胞免受自由基的损伤,果蔬原料中含有丰富的VC、VE、类胡萝卜素、酚类等化合物,它们所具有的抗氧化活性对于促进人体健康有重要作用[6]。免疫系统是机体执行免疫应答及免疫功能的重要系统,包含免疫器官、免疫细胞以及免疫分子[7]。有实验表明双歧杆菌发酵的果蔬发酵液能够显著增强巨噬细胞吞噬功能,增加血清溶血素抗体水平[8]。本文主要对三种果蔬发酵液产品的抗氧化性和免疫调节方面进行研究,为后续相关产品的开发奠定基础。
果蔬发酵液A:完美(中国)有限公司(中试车间生产样品,批号20170831);果蔬发酵液B:B公司生产样品;果蔬发酵液C:C公司生产样品。小鼠(Balb/c,6~8周龄):北京维通利华实验动物技术有限公司。RPMI-1640培养基:Hyclone公司;胎牛血清、青霉素链霉素溶液(双抗):四季青公司;胰蛋白酶、红细胞裂解液、Hepes、CCK-8、缓冲液PBS:碧云天生物技术研究所;HepG2细胞株:北京协和细胞资源中心;刀豆蛋白A(ConA)、脂多糖(LPS)、2’,7’-二氢二氯荧光素二乙酸酯(DCFH-DA)、偶氮二异丁脒盐酸盐(AAPH):美国Sigma公司;中性红:Amresco公司。
BD C6流式细胞仪、240i直热式二氧化碳培养箱:美国 Thermofisher公司;Spectra MR多功能酶标仪:美国Dynex公司;恒温水浴锅:苏州珀西瓦尔实验设备有限公司;ESCO AC2-6S1生物安全柜:新加坡艺思高科技有限公司。
1.3.1 三种果蔬发酵液对HepG2氧化应激的影响
将生长状态良好的HepG2细胞密度调整为105 cfu/mL,2 mL/孔加入到6孔板中,于37 ℃、5% CO2恒温培养箱中培养24 h,待细胞单层贴壁后换上含样的DMEM不完全培养基2 mL,设置空白对照组、模型组和样品组,空白对照组和模型组只加不完全培养基。3.5 h后弃掉培养液,用PBS清洗两次,每孔加入终浓度为10 µmol/L的DCFH-DA荧光染料,孵育30 min。对照组加不完全培养基,模型组和样品组加入终浓度为 600 µmol/L的AAPH孵育30 min,流式细胞仪检测细胞内的荧光值,以细胞内活性氧簇(ROS)含量表示发酵液对氧化应激的影响,计算公式[9]为:

1.3.2 三种果蔬发酵液对小鼠淋巴细胞增殖的影响
1.3.2.1 小鼠脾细胞悬液的制备
小鼠脾细胞悬液的制备方法参照文献[10],操作过程及要点如图1所示。
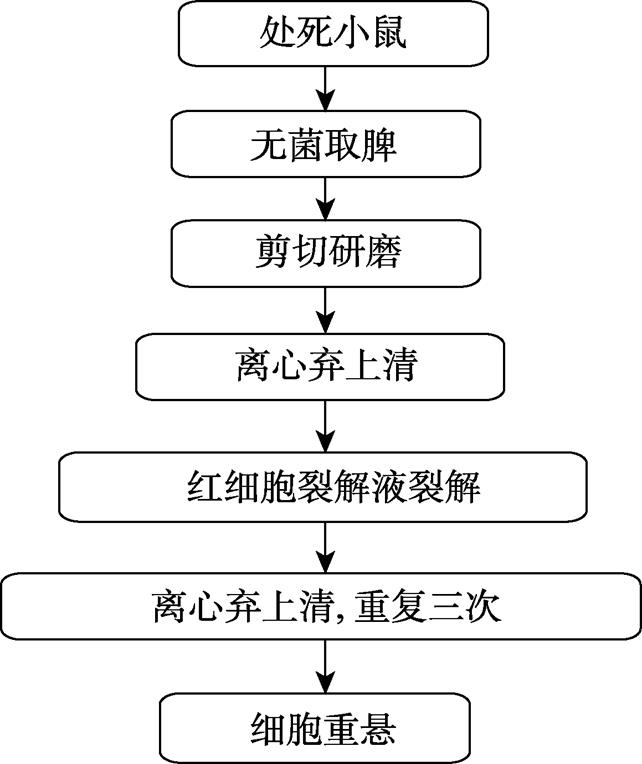
图1 小鼠脾细胞悬液制备方法
1.3.2.2 果蔬发酵液对脾淋巴细胞增殖的影响
将所得重悬细胞加入RPMI-1640完全培养基,调整细胞浓度为2×106 cfu/mL,90 μL/孔接入到96孔板中。将细胞分为空白对照组和样品组,空白组加入不完全培养基,样品组加入不同浓度的果蔬发酵液样品10 μL/孔,每组5个复孔。于CO2培养箱内培养72 h,用CCK-8试剂盒测定样品对脾细胞增殖能力的影响,结果用增殖率表示,计算公式为:

1.3.2.3 果蔬发酵液对T/B淋巴细胞增殖的影响
将调整好细胞浓度的脾细胞悬液按90 μL /孔加入到96孔板中,设置空白对照组、模型组、样品组,其中空白对照组:每孔添加20 μL PBS;模型组:每孔添加10 μL ConA/LPS(终浓度为 10 μg/mL),10 μL PBS;样品组:每孔添加10 μL ConA/LPS(终浓度为10 μg/mL),和10 μL不同浓度的果蔬发酵液样品溶液。每个处理5个复孔,于37 ℃、5% CO2恒温培养箱中培养72 h。CCK-8 法测定细胞增殖率,结果用刺激指数 (SI) 表示,计算公式为:


1.3.3 三种果蔬发酵液对小鼠腹腔巨噬细胞的影响
1.3.3.1 小鼠腹腔巨噬细胞的制备
小鼠腹腔巨噬细胞制备方法参考文献[11],操作步骤及要点如图2所示。
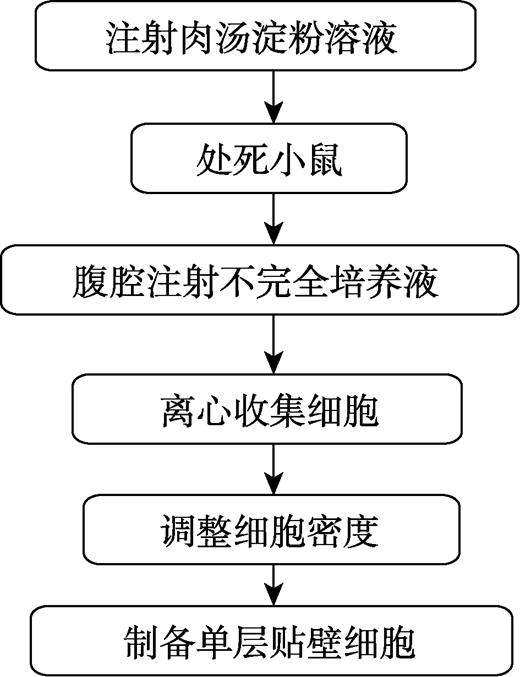
图2 小鼠腹腔巨噬细胞制备方法
1.3.3.2 小鼠腹腔巨噬细胞吞噬活性的测定[10]
将细胞分为空白对照组、模型组和实验组,空白对照组每孔加入20 μL PBS,模型组加入LPS(终浓度30 μg/mL)和PBS各10 μL/孔,实验组加入LPS(终浓度30 μg/mL)与不同浓度的果蔬发酵液各10 μL/孔。每组各设 5个复孔,于CO2培养箱内培养24 h。收集上清液,洗涤细胞2次,每孔加入100 μL预温的0.1%中性红溶液,于CO2培养箱内继续培养1 h,弃掉上清液并洗涤细胞3次,每孔加入200 μL细胞溶解液[含1 %(v/v)乙酸的50 %(v/v)乙醇溶液],室温放置2 h,待细胞溶解后,酶标仪测定OD 550值。结果用吞噬指数(PI)表示,计算公式为:

1.3.3.3 果蔬发酵液对小鼠腹腔巨噬细胞NO生成量的影响
小鼠腹腔巨噬细胞经果蔬发酵液干预24 h后,收集上清液,用NO试剂盒测定样品对小鼠腹腔巨噬细胞NO生成量的影响。
采用Origin 8.5统计软件对数据进行处理,实验结果以均值±标准偏差表示。采用组间t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
ROS是需氧生物在代谢过程中产生的比氧活泼的含氧活性物质,过量的ROS会引起机体组织细胞氧化应激反应,造成生物大分子物质损伤,甚至引起疾病和死亡,而机体为保持活性氧自由基平衡,就必须通过抗氧化防御体系及时清除过量的活性氧自由基[12]。超氧化物歧化酶(SOD)是活性氧清除反应过程中第一个发挥作用的抗氧化酶,可催化O2-·转化为H2O2和O2,从而清除O2-·。发酵液主要的功效酶类包括超氧化物歧化酶、蛋白酶、脂肪酶等[13],其中也含有多酚、维生素、有机酸等多种抗氧化功效成分,能有效地清除自由基,实现抗氧化功能。本实验中AAPH是自由基产生剂,DCFH-DA是一个自由基捕捉剂。HepG2细胞加入DCFH-DA后,被细胞膜中脂酶水解形成DCFH,DCFH被细胞内的自由基ROS氧化生成具有荧光的DCF-,荧光强度直接反应了细胞内的ROS含量和氧化应激的水平[14]。ROS含量越低,抗氧化活性越强。
三种果蔬发酵液对HepG2细胞内ROS含量的影响见图3。由图可知,三种发酵液能降低HepG2细胞内ROS含量。在果蔬发酵液A中,各浓度均能显著降低ROS含量(P<0.05),在稀释倍数为102的浓度下,ROS含量最低,为55%。在B发酵液中,稀释倍数为102、103、104时能显著降低ROS含量(P<0.05),在稀释倍数为103的浓度下,ROS含量最低,为61%。在发酵液C中,稀释倍数为10、102、103、104浓度能显著降低ROS含量(P<0.05),在稀释倍数为103浓度下,ROS含量最低,为71%。相较于其他两种发酵液,发酵液A更能明显降低ROS含量,具有更好的抗氧化能力。

图3 三种果蔬发酵液对HepG2细胞内ROS产生量的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
2.2.1 果蔬发酵液对小鼠脾淋巴细胞增殖的影响
由图4可看出,三种果蔬发酵液的7个浓度均能促进正常脾淋巴细胞的增殖。果蔬发酵液A在稀释倍数为10和102时增殖率很高,脾细胞增殖能力强;发酵液B和C分别在稀释倍数为105、104时增殖率最高,脾细胞增殖能力强。在三种发酵液中,增殖率最高的为稀释倍数为10的A发酵液,其值为127%,其他两种发酵液增殖率分别为107%、112%,发酵液A促进脾淋巴细胞增殖的能力明显高于其他两种发酵液。

图4 三种果蔬发酵液对小鼠脾淋巴细胞增殖能力的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
2.2.2 果蔬发酵液对小鼠T/B淋巴细胞增殖的影响
脾脏在特异性免疫反应中具有重要的作用,淋巴细胞是生物体内执行免疫功能的主要细胞,淋巴细胞的激活是产生免疫应答的关键环节之 一[15]。ConA可以通过促进T淋巴细胞活化过程中重要信号分子的表达来刺激T淋巴细胞,使其增殖活化[16];LPS可以通过促进Toll样受体和样受体蛋白的表达直接促进B淋巴细胞的分化成熟[17]。本实验采用ConA和LPS对提取的脾淋巴细胞进行刺激诱导,刺激指数是评价细胞增殖活性的一个指标,它的高低反映了T/B淋巴细胞增殖率的高低,后者的高低又体现了T/B淋巴细胞功能的强弱,故可以T/B淋巴细胞刺激指数的变化来评估T/B淋巴细胞功能的变化,而后者是机体细胞免疫功能变化的重要标志[18]。
三种果蔬发酵液对Con A诱导的T淋巴细胞增殖的影响结果见图5,由图5可看出三种果蔬发酵液均能促进Con A诱导的T淋巴细胞的增殖。发酵液A在稀释倍数为102时,SI值最高,为130%,对比于B和C果蔬发酵液的SI值,分别提高了19%、18%,更好地促进T淋巴细胞的增殖,提高细胞免疫功能。
三种果蔬发酵液对LPS诱导的B淋巴细胞增殖的影响结果见图6,由图6可看出三种果蔬发酵液对LPS诱导的B淋巴细胞增殖具有明显的促进作用。A发酵液在稀释倍数为10和102时,SI值很高,B淋巴细胞增殖效果极显著。在稀释倍数为102浓度时,B和C果蔬发酵液的SI值分别为130%、126%,A果蔬发酵液的SI值为157%,相较于其他两种发酵液,A发酵液分别提高了27%、31%,更好地促进B淋巴细胞的增殖,提高体液免疫功能。
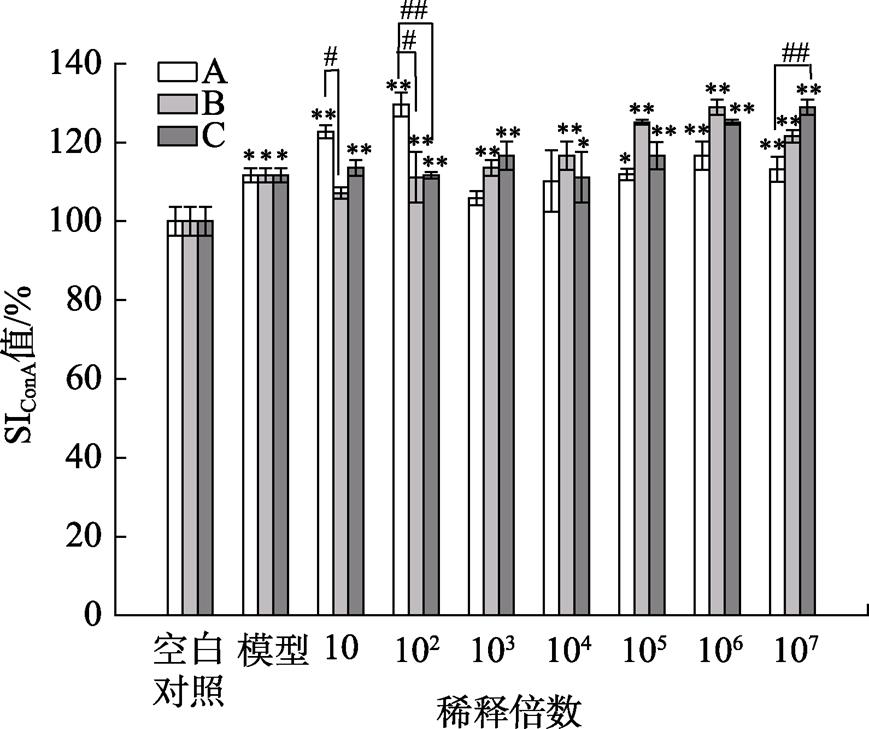
图5 三种果蔬发酵液对Con A诱导的T淋巴细胞增殖的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
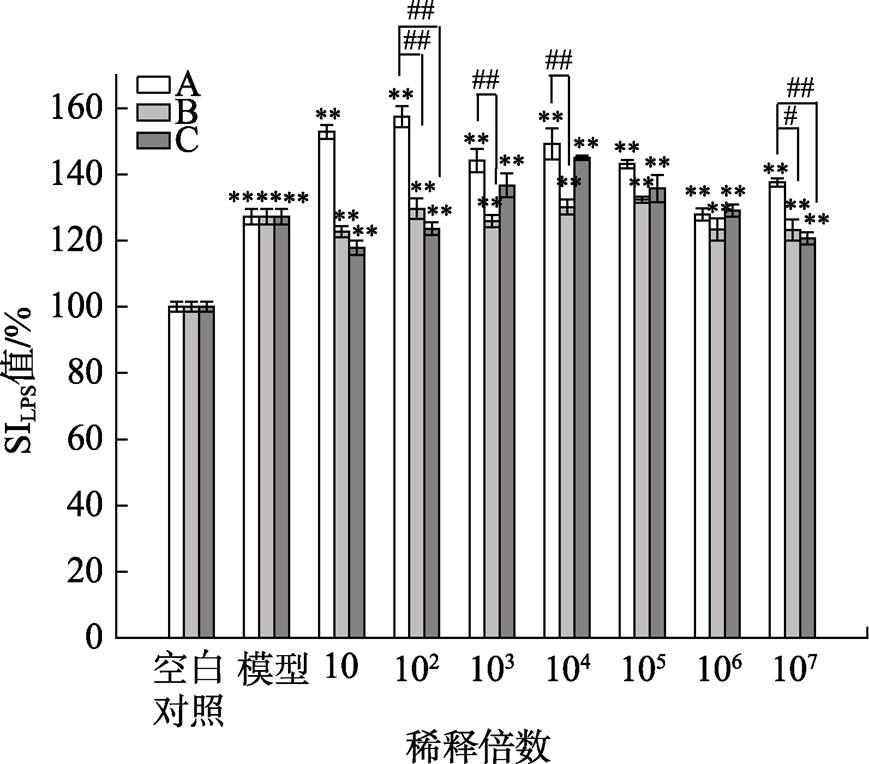
图6 三种果蔬发酵液对LPS诱导的B淋巴细胞增殖的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
综合三种果蔬发酵液对脾淋巴细胞增殖能力的影响结果,A发酵液在稀释倍数为102时既能极显著促进T淋巴细胞增殖,又能极显著促进B淋巴细胞增殖,且效果优于其他两种发酵液。
2.2.3 果蔬发酵液对小鼠腹腔巨噬细胞吞噬能力的影响
巨噬细胞属于机体固有免疫细胞,在非特异免疫反应和特异性免疫反应中起着关键作用,巨噬细胞受到不同抗原刺激会分化为不同类型的巨噬细胞,进而促进或抑制炎症反应的发生。巨噬细胞经典激活方式是受LPS、干扰素-γ( IFN-γ) 及肿瘤坏死因子 ( TNF) 激活,释放细胞毒性物质 NO 和活性氧中间体,清除细胞内的病原体[19]。在LPS的刺激下,巨噬细胞从静息状态转向活化状态,细胞增大,代谢增强,溶酶体增多,细胞的变形运动及吞噬能力均增强[20]。
三种果蔬发酵液对LPS诱导的腹腔巨噬细胞吞噬能力的影响如图7所示,对于LPS诱导的腹腔巨噬细胞,三种果蔬发酵液均能提高其吞噬中性红的能力,在稀释倍数为102时,B发酵液处理组的吞噬指数高于其他两种发酵液;稀释倍数大于103后,其吞噬指数均小于其他两种发酵液,且相对于对照组而言,没有统计学意义上的差异。在A发酵液中,稀释倍数为102时的PI值相较于其他浓度的PI值高,综合考虑,102的稀释倍数有借鉴意义。
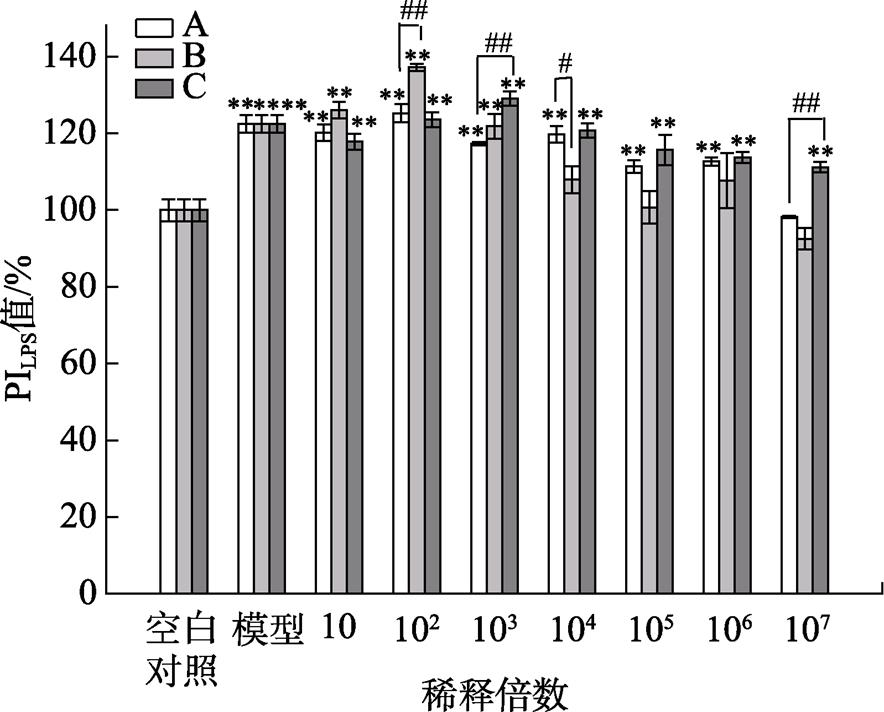
图7 三种果蔬发酵液对LPS诱导的腹腔巨噬细胞吞噬能力的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
2.2.4 果蔬发酵液对小鼠腹腔巨噬细胞NO释放量的影响
三种果蔬发酵液对LPS诱导的腹腔巨噬细胞NO释放量的影响结果见图8,在7个浓度下三种果蔬发酵液均能极显著促进NO的释放。稀释倍数为104的A发酵液处理组NO释放量最高,为4.06 μmol/L。在稀释倍数为104、105时,三种果蔬发酵液促进吞噬细胞释放NO的能力明显高于其他浓度的释放能力。

图8 三种果蔬发酵液对LPS诱导的腹腔巨噬细胞NO释放量的影响
注:*表示与对照组相比差异显著(P<0.05),**表示差异极显著(P<0.01);#表示与A发酵液处理组比较差异显著(P<0.05),##表示差异极显著(P<0.01)。
本实验对果蔬发酵液的抗氧化和免疫功能进行研究,结果表明A、B、C三种果蔬发酵液均能提高其抗氧化能力,果蔬发酵液A在稀释倍数为102时,可使胞内ROS含量达最低,为55%。三种果蔬发酵液可促进小鼠淋巴细胞的增殖,尤以B淋巴细胞明显,刺激指数最高达157%;且能提高小鼠腹腔巨噬细胞的吞噬能力并促进NO的释放,稀释倍数为104的A发酵液处理组NO释放量最高,为4.06 μmol/L,从而加强免疫调节作用。A果蔬发酵液在稀释倍数为102时,实验范围内SI值和PI值均最高,为后续免疫调节相关产品的研发提供理论依据。
参考文献:
[1] 刘加友, 王振斌. 微生物发酵液食品研究进展[J]. 食品与发酵工业, 2016, 42(1): 273-276.
[2] 任清, 于晓艳, 潘妍, 等. 微生物酵素美白抗衰老功效研究[J]. 香料香精化妆品, 2008(3): 28-32.
[3] 曲佳乐, 赵金凤, 皮子凤, 等. 植物发酵液解酒护肝保健功能研究[J]. 食品科技, 2013, 38(9): 51-55.
[4] 赵金凤, 曲佳乐, 皮子凤, 等. 植物发酵液润肠通便保健功能研究[J]. 食品与发酵科技, 2012, 48(3): 54-56.
[5] 潘宣如, 毛旸昊. 浙江果蔬发酵液新兴产业现状分析及对策[J]. 北方经贸, 2015(11): 103-105.
[6] 陈守江, 姜松. 果蔬中的酚类化合物及其抗氧化作用(综述)[J]. 安徽技术师范学院学报, 2003, 17(2): 144-148.
[7] 李婧文, 周长林. 多糖的免疫调节作用及多糖药物的研究进展[J]. 中国生化药物杂志, 2016, 36(4): 24-28.
[8] 管晓冉, 张德纯, 李金玲, 等. 双歧杆菌发酵果蔬汁对小鼠免疫功能的影响[J]. 中国微生态学杂志, 2010, 22(2):110-113.
[9] 尹曼, 魏颖, 马勇, 等. 胶原肽和大米肽对黑色素生成的影响[J]. 食品科技, 2017(10):244-247.
[10] 魏颖, 刘艳, 林峰,等. 刺玫果免疫调节和体外抗氧化活性研究[J]. 中国食品学报, 2014, 14(8): 41-46.
[11] 魏颖, 谷瑞增, 林峰,等. 乌鸡肽免疫调节作用的研究[J]. 食品研究与开发, 2014(16): 1-4.
[12] 洪美玲, 陈立侨. 水产动物养殖胁迫评价及预防[M]. 北京:中国林业出版社, 2012.
[13] 于晓艳, 任清, 卢舒娴,等. 微生物发酵液主要功效酶活力的测定[J]. 食品科技, 2008, 33(7): 193-196.
[14] 贾刚, 谢丽阳, 张迪, 等. 黄酮对AAPH诱导的HepG2细胞氧化应激的作用[J]. 食品科技, 2011(9): 23-26.
[15] 曾丛梅, 蔡树涛, 周凤兰,等. ConA激活小鼠胸腺T淋巴细胞增殖过程中c-myc与核骨架蛋白的结合[J]. 中国科学, 1996, 39(4): 511-516.
[16] 周灵, 彭代智, 陈博,等. PHA、ConA及CD3ε单克隆抗体对小鼠淋巴细胞迁移及分泌趋化因子的影响[J]. 免疫学杂志, 2012, 28(4): 295-299.
[17] Hirotaka O, Su I H, Kensuke M, et al. The toll-like receptor protein Rp105 regulates lipopolysaccharide signaling in B cells:[J]. Journal of Experimental Medicine, 2000, 192(1): 23.
[18] 复方中药对感染NIB鸡淋巴细胞刺激指数的影响[J]. 山西农业大学学报(自然科学版), 2009, 29(6): 575-578.
[19] Mantovani A, Sica A, Sozzani S, et al. The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends in Immunology, 2004, 25(12): 677-686.
[20] Pengal R A, Ganesan L P, Wei G, et al. Lipopolysaccharide-induced production of interleukin-10 is promoted by the serine/threonine kinase Akt[J]. Molecular Immunology, 2006, 43(10): 1557-1564.
Research on antioxidant and immunity regulation function of three kinds of fruit and vegetable zymotic fluid
Abstract:The antioxidant activity and immunoregulationon of three kinds of fruit and vegetable zymotic fluid, which were named A, B and C, were researched. The effect of the three kinds of fruit and vegetable zymotic fluid on ROS level in cell was evaluated by AAPH-induced in HepG2 cells model. To study the immunomodulatory ability, concanavalin A and lipopolysaccharide were used to induce the proliferation of mouse T/B lymphocytes, and lipopolysaccharide was used to induce mouse peritoneal macrophages, detecting phagocytic ability and NO release. The results showed that the three kinds of fruit and vegetable zymotic fluid had strong ability to eliminate ROS in cells, A fruit and vegetable zymotic fluid can make intracellular ROS content as low as 55%. They can improve lymphocyte proliferation ability, phagocytic ability of peritoneal macrophages and promote NO release, A fruit and vegetable zymotic fluid has a maximum NO release of 4.06 μmol/L at dilution ratio of 104. These results indicated that the three kinds of fruit and vegetable zymotic fluid have good antioxidant activity and enhance immune function.
Key words: fruit and vegetable zymotic fluid; antioxidant; immunity regulation
DOI: 10.16210/j.cnki.1007-7561.2019.02.008
中图分类号:TS201.3
文献标识码:A
文章编号:1007-7561(2019)02-0039-06
收稿日期:2018-10-12
基金项目:首都食品质量安全保障专项(Z171100001317006)