表1 正交实验设计
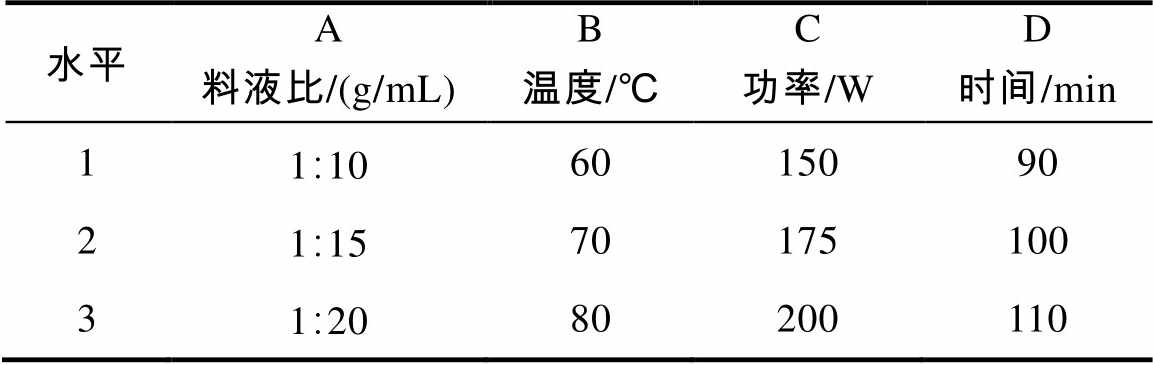
水平A料液比/(g/mL)B温度/℃C功率/WD时间/min 11∶106015090 21∶1570175100 31∶2080200110
摘 要:以脱脂米糠为原料,采用淀粉酶和糖化酶水解除去淀粉,采用胃蛋白酶除去蛋白,在酸性条件和碱性条件下各提取一次,优化米糠多糖提取工艺。实验结果表明,脱脂米糠以1∶15 g/mL料液比加水充分混匀后,以3%的淀粉酶水解2 h、3%糖化酶水解1 h、3%胃蛋白酶水解1 h除去淀粉和蛋白,分别在酸性和碱性条件下70 ℃、200 W超声提取90 min,得到米糠多糖的得率为8.12%。冷冻干燥后的粗多糖含有84.2%的米糠多糖,6.6%的粗蛋白,2.1%的灰分和5.8%的水分。
关键词:米糠多糖;超声提取;酶
米糠是稻米加工的主要副产物,含有油脂、蛋白质、碳水化合物、谷维素、维生素、钙、铁、镁、锰、钾、钠、锌等多种人体必需的营养成分[1-2]。在这些物质中,米糠多糖是最具有开发价值的功能成分之一[3]。米糠多糖是以α-1,3-葡聚糖为主链,以木糖(Xyl)、半乳糖(Gal)、甘露糖(Man)、鼠李糖(Rha)、阿拉伯糖(Ara)、核糖(Rib)等多种单糖单元为侧链组成的杂聚糖,相对分子质量超过1 000 000Da[4-5]。米糠多糖具有抗氧化、抗肿瘤、提高免疫、降血压、降血糖等多种生理活性[6-7]。
米糠多糖多使用热水或碱水提取,但是由于米糠多糖存在于米糠的细胞中,不容易溶出,所以提取效率较低。针对这种情况,一般辅以超声[8-9]、微波[10-11]、高温高压[12]等手段。根据已有的文献报道,使用超声或者微波辅助后,米糠多糖的得率一般在2%左右,提高不是很明显。主要原因一是米糠多糖与蛋白质、淀粉等其他物质以复合态形式结合,单纯提取多糖不易;二是由于米糠主要在细胞内,使用超声、微波等手段不能有效破坏细胞壁,无法使多糖有效溶出。
本实验以脱脂米糠为材料,在酸性环境下使用酸破坏细胞壁使胞内物充分溶出,用淀粉酶、糖化酶除掉淀粉,用蛋白酶除去蛋白质,然后使用超声提取米糠多糖。提取液通过调节pH值除去植酸钙,使用超滤设备制备米糠多糖,获得较高的米糠多糖提取率。
稳定化脱脂米糠:购自河南四维生物技术有限公司。
α-淀粉酶(3 700 U/g)和糖化酶(100 000 U/g):购自北京奥博星生物技术有限责任公司;胃蛋白酶(3 000 U/mg):购自生工生物工程(上海)股份有限公司。实验所需其他试剂均为分析纯,购自国药集团化学试剂有限公司。
电热恒温培养箱(DRP-9162型):上海森信实验仪器有限公司;离心机(5810R型):Eppendorf;电子天平(PL3002-IC型):Mettler- Toledo;Lambda 35 紫外/可见分光光度计:Perkin Elmer;超滤膜系统:Sartorius,Vivaflow 200微型膜包,3 000 Da。
1.3.1 超声提取法
准确称取脱脂米糠5.0 g置于250 mL三角瓶,按照设定料液比加入去离子水,充分浸润后,在设定条件下超声提取一定时间,提取液离心 (4 000 r/min)15 min,调节上清液pH至5.5,加入淀粉酶和糖化酶各50 mg,在55 ℃反应2 h,调节pH 至4,加入胃蛋白酶38 ℃反应2 h。反应完成后95 ℃水浴10 min灭酶活,取少量提取液检测淀粉和蛋白残留。提取液使用饱和Ca(OH)2水溶液调节pH至中性,过滤,加入4倍体积的95%乙醇,4 ℃静置24 h,离心,收集下层残渣,加入少量95%乙醇洗涤后离心,残渣使用去离子水溶解后稀释定容到一定体积,使用外标法通过苯酚–硫酸法[13]检测多糖得率。
1.3.2 单因素实验条件的确定
提取温度:5.0 g脱脂米糠中加入100 mL水,分别在30、40、50、60、80 ℃下,使用125 W超声提取60 min。
提取功率:5.0 g脱脂米糠中加入100 mL水,在60 ℃下,分别使用50、75、125、150、200、250 W超声提取60 min。
提取时间:5.0 g脱脂米糠中加入100 mL水,在60 ℃下,使用125 W分别超声提取60、70、80、100、120 min。
料液比:5.0 g脱脂米糠中分别加入25、50、75、125、150、200 mL水,在60 ℃下,使用125 W超声提取60 min。
1.3.3 生物酶协同超声提取方法
准确称取脱脂米糠5.0 g置于250 mL三角瓶,按照设定的料液比加入去离子水,充分浸润,调节pH至6.0,加入设定量的α-淀粉酶后60 ℃条件下反应一定时间,调节pH至5.0,加入设定量糖化酶后50 ℃反应一定时间,分别取少量酶解液,使用碘液检测,调节pH至4,加入设定量胃蛋白酶溶液,38 ℃反应一定时间,使用双缩脲法检测蛋白去除效果。调节pH值,在设定条件下超声提取,过滤,提取液使用Ca(OH)2调节pH至中性,90 ℃水浴10 min灭酶活,离心,过滤,醇沉后离心,合并下层残渣,加入少量95%乙醇洗涤后离心,取残渣使用去离子水溶解后稀释定容到一定体积,使用外标法通过苯酚–硫酸法检测多糖得率。
酶种类:取三份脱脂米糠各5.0 g,按1∶15的比例加入蒸馏水,混匀后,分别使用3% α-淀粉酶(pH 6、60 ℃水解2 h)、3%糖化酶(pH 5、50 ℃水解1 h)和3%胃蛋白酶(pH 4、38 ℃水解1 h)水解,反应结束后150 W、80 ℃超声提取60 min,提取液醇沉后检测总多糖含量。另取5.0 g脱脂米糠,先后使用3% α-淀粉酶(pH 6、60 ℃水解2 h)、3%糖化酶(pH 5、50 ℃水解1 h)和3%胃蛋白酶(pH 4、38 ℃水解1 h)水解,提取后检测总多糖含量。
酶解时间:在三角瓶中加入5.0 g脱脂米糠,按1∶15的比例加入蒸馏水,混匀后,添加3% α-淀粉酶,在pH 6.0、60 ℃下反应0.5、1、1.5、2 h,使用碘液检测淀粉残留,直至碘液不变蓝;糖化酶水解除糊精:在三角瓶中加入5 g脱脂米糠,按1∶15的比例加入蒸馏水,混匀后,添加3%糖化酶,在pH 5.0、50 ℃下反应0.5、1、1.5、2 h,使用碘液检测糊精残留,直至碘液变为淡黄色;胃蛋白酶水解除蛋白:在三角瓶中加入5 g脱脂米糠,按1∶15的比例加入蒸馏水,混匀后,添加3%胃蛋白酶,在pH 4.0、38 ℃下反应0.5、1、1.5、2 h,使用双缩脲反应检测,直至除去蛋白。
加酶量:三种酶分别按照0.5%、1%、2%、3%的添加量依此加入反应,其余工艺与酶种类筛选工艺相同,计算多糖得率。
正交实验设计:在超声提取工艺的单因素实验和酶解–超声协同提取实验的基础上设计L9(34)正交实验,正交实验因素水平设计如表1所示。
表1 正交实验设计

水平A料液比/(g/mL)B温度/℃C功率/WD时间/min 11∶106015090 21∶1570175100 31∶2080200110
1.3.4 粗多糖成分测定方法
粗多糖中成分检测方法如表2所示。
表2 粗多糖中成分检测方法

指标测定方法 总糖量苯酚–硫酸法[13] 水分采用135 ℃烘干法[14] 粗蛋白采用凯氏定氮法[15] 灰分AOAC(1995, 900.02)[16] γ-谷维素《米糠中γ-谷维醇测定方法的研究》[17]
1.3.5 米糠多糖的理化性质分析
取适量冷冻干燥后的粗多糖,观察其颜色、形状、气味、水溶性及在有机试剂中的溶解性等。加入适量的蒸馏水配置成多糖溶液后,分别与碘–碘化钾、考马斯亮蓝、苯酚–硫酸试剂反应检测粗多糖的化学性质。
1.3.6 米糠多糖组成分析
准确称取乳糖酶、β-甘露聚糖酶、半纤维素酶、木聚糖苷酶、β-葡聚糖苷酶、纤维素酶和α-葡聚糖苷酶各20 mg,分别使用超纯水溶解后定容至100 mL,配成20%的不同糖苷酶的酶溶液,在冰水浴中缓慢加入研磨后的硫酸铵,至终浓度为80%,4 ℃过夜沉淀,离心去上清,沉淀加入PBS缓冲液重悬,4 ℃透析除盐,然后用超滤管进行浓缩,获得硫酸铵沉淀初步纯化的蛋白。准确称取所提取米糠多糖5 mg,使用超纯水定容至100 mL配成5%的多糖溶液。量取40 μL多糖溶液和10 μL不同酶溶液,混匀后37 ℃反应3 h,使用薄层层析检测。
图1为5 g米糠使用超声方法分别在不同温度、功率、时间、加水量条件下的米糠多糖得率。
当温度由30 ℃升到80 ℃时,米糠多糖得率由0.13%增加到0.25%,几乎呈线性增加(图1a),因此使用热水提取效果较好,但是在超声波的影响下温度太高有可能会破坏多糖的糖链,因此以80 ℃为宜。
提取超声波功率为150 W时米糠多糖得率最高,为0.34%,在75 W时最低,仅0.13%(图1b)。超声功率越高,产生的空化作用越大,有利于物料中有效成分的溶出;但如果功率过高,空化作用时会产生大量气泡,产生空化屏障,同时也易引起局部升温,不利于实验进行。
提取时间在60~80 min之间时,随着时间的延长,米糠多糖提取得率上升趋势明显(由0.20%到0.27%),但是80 min以后继续延长超声时间,多糖提取得率开始下降(图1c)。由于超声时间过长易破坏多糖结构,超声提取时间不宜过长。
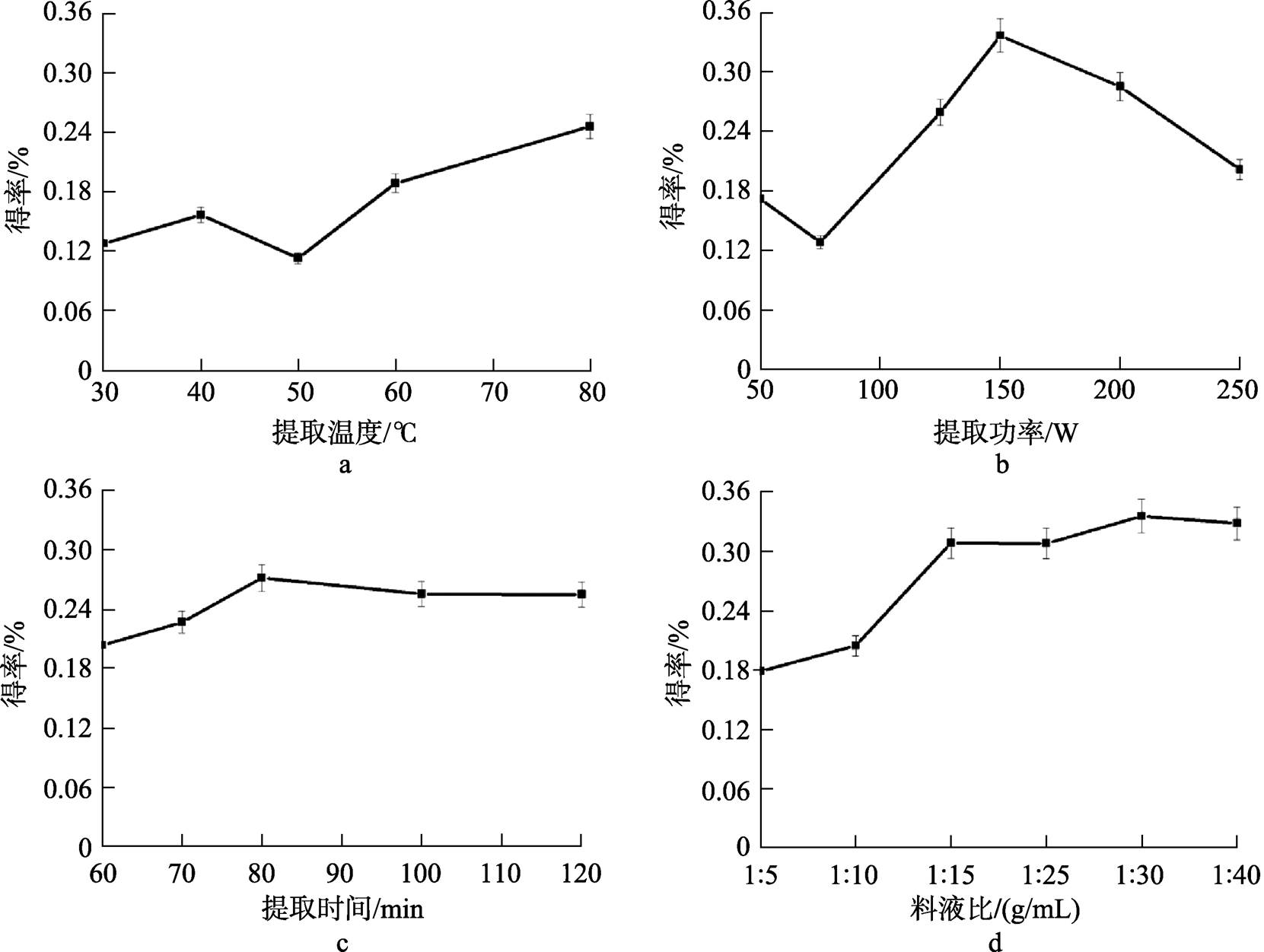
图1 不同单因素条件下米糠多糖的提取得率
每5 g脱脂米糠使用75 mL水,即料液比 1∶15 g/mL时,提取得率达到0.31%,随着料液比的减小变化趋势不大(图1d)。提取溶剂用量过大造成后续醇沉时成本增加,因此以1∶15 g/mL的料液比为宜。
单纯的超声提取效率低下,所有单因素实验得率均低于1%,没有进一步优化提取参数的必要。
2.2.1 酶解条件优化
在米糠中,多糖经常与淀粉、蛋白质等一起以结合状态存在,单纯超声方法对溶出度的影响有限,因此,可以尝试采用水解去除淀粉、蛋白以释放结合态多糖的方法提高得率。本研究选择淀粉酶和糖化酶水解淀粉,胃蛋白酶水解蛋白。
三种酶水解不同时间后淀粉和蛋白的去除效果如表3所示。使用3%的α-淀粉酶反应2 h,取少许提取液使用碘液检测显淡紫色,说明淀粉水解完全,而尚有糊精;使用3%的糖化酶进一步水解1 h,取少量提取液使用碘液检测显淡黄色,而后颜色不变,说明糊精水解完全;使用3%的胃蛋白酶水解1 h后,使用双缩脲反应显蓝色,说明蛋白得到充分降解。因此,淀粉酶、糖化酶、蛋白酶酶解时间分别是水解2、1、1 h。
表3 酶解时间对米糠多糖得率的影响

酶0.5 h1 h1.5 h2 h α-淀粉酶蓝色蓝色蓝紫色紫色 糖化酶紫色淡黄色淡黄色淡黄色 胃蛋白酶紫色蓝色蓝色蓝色
不同酶处理脱脂米糠后多糖的得率如图2所示。使用单酶处理时,α-淀粉酶处理后的多糖得率最高,为1.67%,其次为糖化酶,胃蛋白酶最低,说明与淀粉结合的多糖较多。使用依次加入α-淀粉酶、糖化酶和胃蛋白酶的混合酶处理方法,可提高米糠多糖得率,达1.96%,因此使用复合酶对脱脂米糠进行处理。
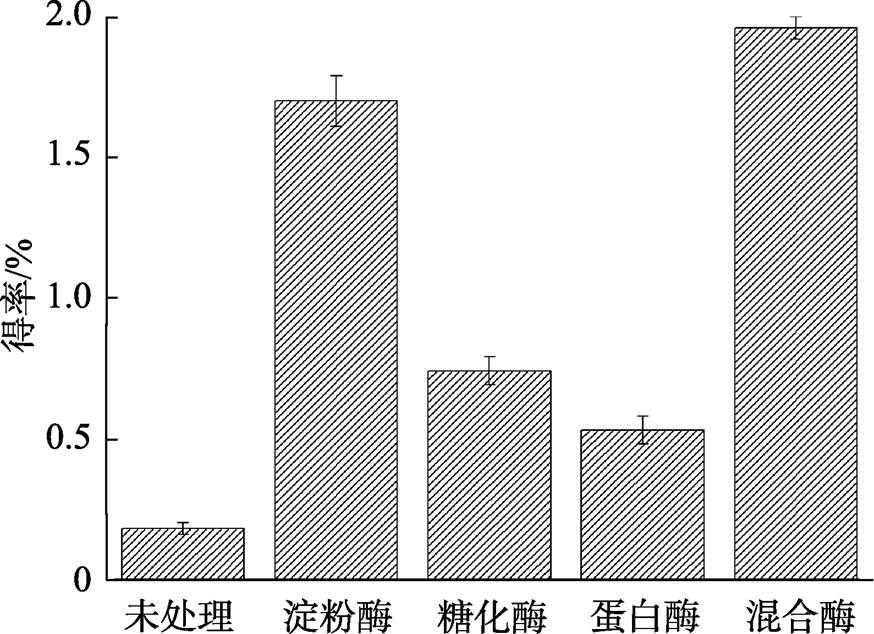
图2 不同酶对米糠多糖提取得率的影响
酶添加量对粗多糖性状及多糖得率的影响如表4所示。使用0.5%的酶水解米糠时,得到的粗多糖黏度较大,呈黄色块状,使用苯酚–硫酸法检测多糖得率为1.52%;当加酶量提高到3%时,粗多糖为淡黄色粉末,得率有所提高,为2.28%,因此,最适加酶量为3%。
表4 酶添加量对米糠多糖提取得率的影响

项目0.5%1%2%3% 粗多糖性状黏,深黄色大块状物黏,深黄色小块状物,少许粉末淡黄色粉末,少许深黄色块状物淡黄色粉末,极少深黄色块状物 得率/%1.521.812.172.28
2.2.2 提取方法优化
在不同pH条件下米糠多糖的得率如图3所示。酸性(pH 4.0)条件、中性(pH 7.0)条件和碱性(pH 8.0)条件下,米糠多糖的提取得率分别为1.48%、0.83%和1.19%,提取效率分别是酸性 > 碱性 > 中性。
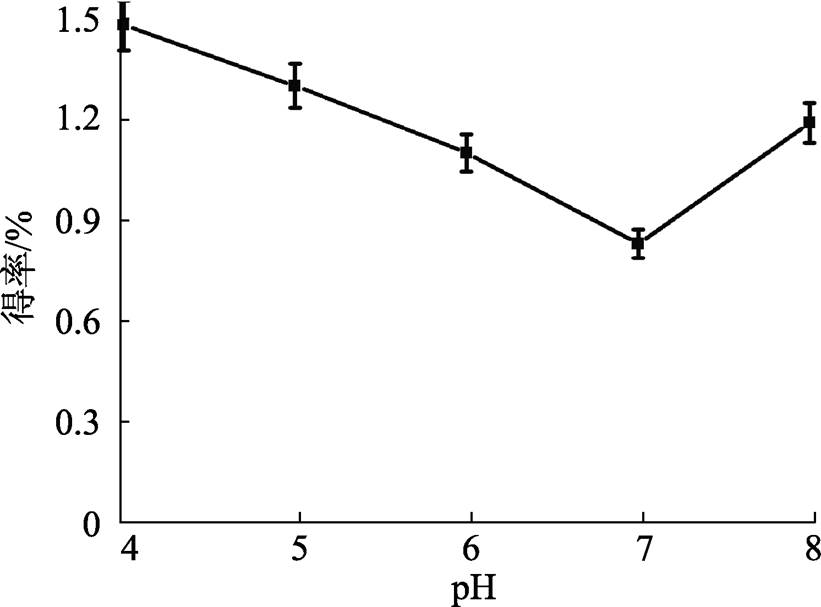
图3 不同pH条件下的米糠多糖得率
脱脂米糠在酸性(pH 4)条件下超声提取一次后的残渣在碱性(pH 8)条件下再提取一次,酸提液和碱提液分别加入4倍体积70%乙醇,4 ℃静置12 h后离心,取上清液以旋转蒸发仪回收乙醇,残留水液加入4倍体积80%乙醇,4 ℃静置12 h后离心,取上清液以旋转蒸发仪回收乙醇,残留水液加入4倍体积95%乙醇,4 ℃静置12 h后离心,分别收集不同乙醇浓度沉淀所得粗多糖,检测多糖得率,结果如表5所示。
表5 酸、碱条件下水提液在不同醇沉条件下的米糠多糖得率 %
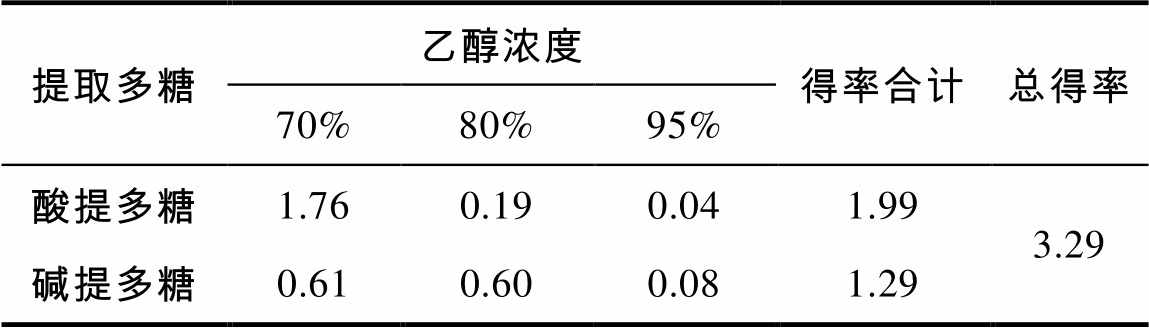
提取多糖乙醇浓度得率合计总得率 70%80%95% 酸提多糖1.760.190.041.993.29 碱提多糖0.610.600.081.29
脱脂米糠水提液使用70%乙醇醇沉后的得率为1.76%,占酸提总多糖的88.4%,使用80%乙醇和95%乙醇醇沉得率分别是0.19%和0.04%,分别占9.5%和2.0%。碱提多糖使用70%乙醇和80%乙醇醇沉的多糖得率分别是0.61%和0.60%,分别占碱提总多糖得率的47.3%和46.5%,95%乙醇醇沉得率为0.08%,占6.2%。酸提多糖和碱提多糖得率分别为1.99%和1.29%,分别占多糖总得率的60.7%和39.3%。可见,在酸性和碱性条件下提取的多糖种类和结构有所区别,在提取过程中,应该考虑酸碱条件下各提取一次。
在超声提取工艺的单因素实验和酶解–超声协同提取实验的基础上设计L9(34)正交实验,结果见表6~表7。
表6 正交实验结果

实验号A.BCD多糖得率/% 111113.85 212224.56 313334.34 421237.11 522317.88 623126.32 731325.77 832136.54 933216.30 k14.2505.5775.5706.010 k27.1036.3275.9905.550 k36.2035.6535.9975.997 R2.8530.7500.4270.460
各因素对多糖得率影响程度的大小顺序为料液比(A)>温度(B)>时间(D)>功率(C),最佳提取工艺为A2B2C3D1,即料液比1∶15 g/mL,温度70 ℃,功率200 W,时间90 min,该条件下多糖得率可达7.88%,远远高于未改良前多糖提取得率。
表7 方差分析

因素偏差平方和自由度F比显著性 A38.332103.20** B3.0528.22** C1.0622.85 D1.2423.35
注:**表示P<0.01。
以多糖得率为指标,当F0.05(2,18)=3.55和F0.01(2,18)=6.01时,因素A和B均显著。结合上述结果可知,A2B2C3D1为较理想的组合。
米糠多糖提取制备方法:脱脂米糠按照 1∶15 g/mL的料液比加入去离子水,充分混匀后调节pH至 6,加入3%的α-淀粉酶,60 ℃水解2 h,调节pH为5,加入3%糖化酶50 ℃水解1 h,调节pH至4,加入3%胃蛋白酶,38 ℃水解1 h,在温度70 ℃下以200 W的功率超声提取90 min,离心,残渣调节pH至8,相同条件下超声提取90 min,合并提取液,95 ℃灭酶5 min,使用Ca(OH)2调节pH为7,离心,适度浓缩后取上清液加入4倍体积的95%乙醇,4 ℃过夜后离心。收集沉淀,使用少量乙醇洗涤后以少量水溶解,冷冻干燥,取少量冻干粉检测多糖得率,同样条件下提取三次的多糖得率分别为8.12%、8.08%、8.15%,平均8.12%,相对标准偏差(RSD)为0.43%。
2.2.3 米糠多糖的成分和理化性质
冷冻干燥后得到的粗多糖主要成分(表8)为米糠多糖,此外还含有少量粗蛋白、灰分和水分,所得多糖几乎不含具有脂溶性的γ-谷维素。
表8 米糠多糖基本成分的含量 %

成分米糠多糖粗蛋白灰分水分γ-谷维素 含量84.15±0.886.58±0.612.13±0.395.82±0.270.01±0.00
冷冻干燥后的粗多糖为粉末状固体,呈淡黄色,无味,不挥发,易溶于水,不溶于有机溶剂,与碘–碘化钾反应不变色,与考马斯亮蓝反应呈浅蓝色,与苯酚–硫酸反应最终颜色为红棕色。由此可见,得到的米糠多糖为包含少量蛋白质的非淀粉多糖。
2.2.4 米糠多糖的特异性糖苷酶水解
采用不同提取工艺可以获得不同种类的米糠多糖。姜元荣等[18]通过低温热水提取、高温热水提取和碱提取法从脱脂米糠中分别获得了LWSRBP、HWSRBP、ASRBP、AISRBP四种多糖,其中LWSRBP和HWSRBP单糖组成为鼠李糖∶木糖∶甘露糖∶葡萄糖∶半乳糖=1∶1∶2∶8∶16,ASRBP的单糖组成为鼠李糖∶阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖=1∶32∶30∶2∶5∶13,AISRBP的单糖组成则为阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖=19∶14∶l∶107∶13。米糠多糖的组成不是单一的,相同的提取工艺可以获得多种多糖。Hikino等[19]利用低温提取法从米糠中获得Oryzabran A、Oryzabran B、Oryzabran C和Oryzabran D四种米糠多糖组分,在相对分子质量和单糖组成方面差别较大。通过检测不同糖苷酶水解后的水解产物可以推断所提取米糠多糖的组成,结果如图4所示。
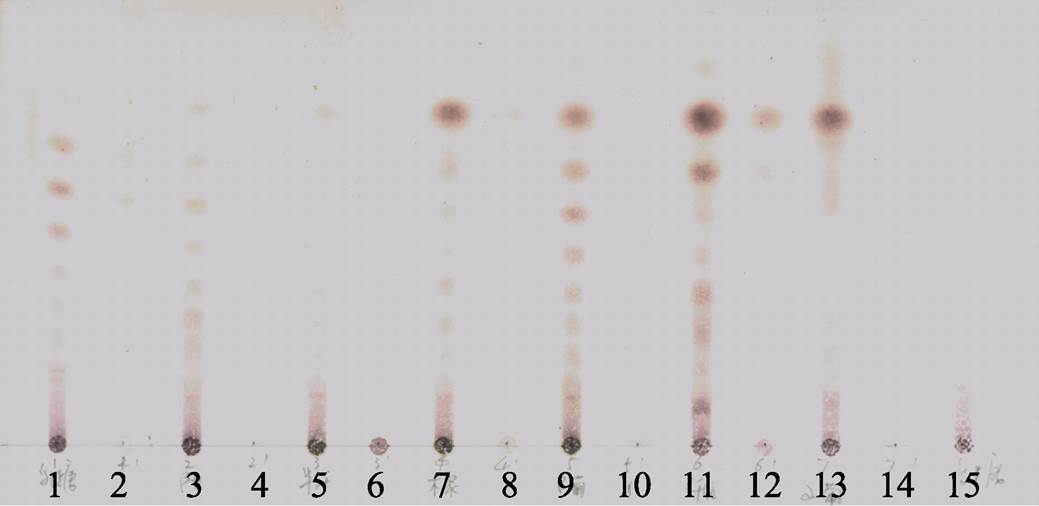
图4 米糠多糖使用不同糖苷酶水解后的薄层色谱图
注:1,乳糖酶水解产物;2,乳糖酶;3,β-甘露聚糖酶水解产物;4,β-甘露聚糖酶;5,半纤维素酶水解产物;6,半纤维素酶;7,木聚糖苷酶水解产物;8,木聚糖苷酶;9,β-葡聚糖苷酶水解产物;10,β-葡聚糖苷酶;11,纤维素酶水解产物;12,纤维素酶;13,α-葡聚糖苷酶水解产物;14,α-葡聚糖苷酶;15,米糠多糖。
图4中硫酸铵沉淀后的糖苷酶在薄层色谱(TLC)中无明显斑点,已排除糖苷酶中杂质对实验结果的干扰。乳糖酶、β-甘露聚糖酶、木聚糖苷酶、β-葡聚糖苷酶、纤维素酶、α-葡聚糖苷酶等对米糠多糖具有明显的水解作用,反应后产生了一系列水解产物。由此推断所提米糠多糖为多种多糖结构的混合物,TLC结果有可能是多糖主链水解的产物,也有可能是支链结构的水解产物,具体结构还需要进一步确定。
本实验在传统超声提取方法的基础上使用生物酶解协同处理,使米糠多糖得率得到大幅提高。实验结果表明,以脱脂米糠为原料,按料液比 1∶15 g/mL加入水,充分混匀后以淀粉酶水解 2 h、糖化酶水解1 h、胃蛋白酶水解1 h除去淀粉和蛋白,在酸性和碱性环境下分别超声提取一次,提取条件为70 ℃的温度下,以200 W超声提取90 min,残渣调至碱性后再次提取,合并两次提取液,浓缩后以95%乙醇醇沉得到米糠多糖的得率为8.12%。冷冻干燥后的粗多糖含有84.2%的米糠多糖、6.6%的粗蛋白、2.1%的灰分和5.8%的水分。
参考文献:
[1] Sharif M K, Butt M S, Anjum F M, et al. Rice Bran: A Novel Functional Ingredient[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(6): 807-816.
[2] BARBER S, BENEDITO-DE-BARBER C. Rice bran, an under-utilized raw material[M]. New York: United Nations publication, 1985.
[3] Revill E, Santa-Marí C, Miramontes E, et al. Antiproliferative and immunoactivatory ability of an enzymatic extract from rice bran[J]. Food Chemistry, 2013, 136(2): 526-531.
[4] Zha X Q, Wang J H, Yang X F, et al. Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J]. Carbohydrate Polymers, 2009, 78: 570-575.
[5] 聂莹, 罗非君, 曾晓楠. 米糠多糖生理功能研究及应用新进展[J]. 粮食与油脂, 2015, 28(11): 10-13.
[6] 肖云, 张迎庆, 糜志远. 米糠多糖提取纯化工艺的研究进展 [J]. 食品与药品, 2012, 14(11): 448-450.
[7] Watanabe M, Maeda I, Koyama M, et al. Simultaneous recovery and purification of rice protein and phosphorus compounds from full-fat and defatted rice bran with organic solvent-free process[J]. Journal of Bioscience and Bioengineering, 2015, 119(2): 206-211.
[8] 周雪松, 张娜, 刘晓飞, 等. 超声辅助提取米糠多糖工艺参数研究[J]. 中国林副特产, 2013(1): 4-7.
[9] 舒春林, 周巍熹. 超声辅助提取米糠多糖的工艺研究[J]. 农业机械, 2013(3): 51-54.
[10] 王莉, 陈正行, 张潇艳. 微波辅助提取米糠多糖的工艺[J]. 江苏大学学报自然科学版, 2007, 28(3): 193-196.
[11] 丁宏伟. 超声波结合微波辅助提取米糠多糖的研究[J]. 核农学报, 2013, 27(3): 329-333.
[12] 殷涌光, 卢敏, 丁宏伟. 高压电脉冲提取米糠多糖的影响因素研究[J]. 中国粮油学报, 2006, 21(5): 20-23.
[13] 食用菌中粗多糖含量的测定: NY-T 1676-2008[S]. 北京: 中国农业出版社出版, 2008.
[14] Moisture-Air-Oven Method, Drying at 135 ℃: AACC (2000, 10th ed.) 44-19 [S].
[15] Improved Kjeldahl Method, Copper CatalystModification: AACC (2000, 10th ed.) 46-11 A [S].
[16] Ash of sugar and syrups. In: Cunniff P (ed) Offic Meth Anal AOAC Intern, 16th edn: AOAC Association of Analytical Chemists Official Method 900.02 1995[S].
[17] Belguendouz H, Messaoud N E D, Lahmar K, et al. Interferon-γ and nitric oxide production during Behcet uveitis: immunomodulatory effect of interleukin-10 [J]. Journal of Interferon & Cytokine Research, 2011, 31(9): 643-651.
[18] 姜元荣, 姚惠源, 陈正行, 等. 米糠粗多糖对小鼠免疫调节功能影响研究[J]. 粮食与油脂, 2004 (5): 20-23.
[19] Hikino H, Takahashi M, Oshima Y, et al. Related Isolation and hypoglycemic activity of oryzabrans A, B, C and D, glycans of Oryza sativa bran [J]. Planta Medica, 1988, 54 (1): 1-3.
Preparation of rice bran polysaccharides by biological enzymes-ultrasonic extraction
Abstract:Defatted rice bran was hydrolyzed by amylase, glucoamylase and pepsin to remove starch and protein. Then the rice bran polysaccharides were extracted from the treated defatted rice bran under acidic conditions and basic conditions once respectively. The result showed that defatted rice bran was mixed with distilled water with the ratio of 1∶15 g/mL. The mixture was hydrolyzed by 3% α-amylase for 2 h, 3% glucoamylase for 1 h and 3% pepsin for 1 h to remove starch and protein, extracted for 90 min in acidic and alkaline environments once respectively with ultra-sonic condition as 70 ℃, 200 W. The yield of the rice bran polysaccharides was 8.12%. After freeze-drying, the crude polysaccharides contained 84.2% rice bran polysaccharides, 6.6% crude protein, 2.1% ash and 5.8% water.
Key words:rice bran polysaccharides; ultrasonic extraction; enzymes
DOI: 10.16210/j.cnki.1007-7561.2019.01.011
中图分类号:TS210.9
文献标识码:A
文章编号:1007-7561(2019)01-0056-07
收稿日期:2018-10-15
基金项目:十三五国家重点研发计划课题(2016YFD0400804);国家粮食局科学研究院自选课题(ZX1726)