 (1)
(1)摘 要:为了优化复合植物水解酶(Viscozyme L)预处理花生粕结合乙醇洗涤法制备花生浓缩蛋白的工艺条件,以花生粕为原料,采用单因素实验和响应面实验设计方法,研究花生浓缩蛋白制备工艺条件对蛋白质量百分含量和提取率的影响。结果表明,Viscozyme L预处理花生粕结合乙醇洗涤法制备花生浓缩蛋白的最优工艺参数为:酶添加量6.1 FBG/g、pH值4.2、酶解温度43 ℃、酶解时间4.5 h,在最佳工艺条件下,蛋白的质量百分含量和提取率验证实验值分别为73.21%±0.59%和85.23%±0.67%,两者与模型预测值的差异均小于1%。为进一步开发利用花生粕提供了一种新途径。
关键词:Viscozyme L;预处理;花生粕;乙醇洗涤;花生浓缩蛋白
花生是一年生草本植物,榨油后的花生粕含有约50%的蛋白质[1],是一种优质的植物蛋白资源,可直接应用到肉制品、面制品的生产中,但其附加值较低。通过一些提取、分离和改性技术,从花生粕中获得花生浓缩蛋白[2]、分离蛋白[3]、功能性蛋白肽[4]、磷酸化改性花生蛋白[5]等高附加值的蛋白产品,进而拓宽花生粕的应用领域。目前,一般采用乙醇洗涤法制备花生浓缩蛋白,其蛋白纯度达到65%以上,与花生粕相比具有较好的持水性、吸油性等功能性质[6]。
复合植物水解酶(Viscozyme L)是一种包括阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶和木聚糖酶在内的复合多酶,能降解物料中的碳水化合物和非淀粉多糖类物质,使得其中的活性成分释放出来,广泛的应用在水溶性膳食纤维[7]、多酚和黄酮类物质[8]的提取中。近年来,有学者将Viscozyme L用在蛋白的辅助提取中,取得了较好的效果。Guan等[9]用Viscozyme L预处理燕麦麸,在Viscozyme L浓度3 FBG/g燕麦麸(FBG为酶活单位)、pH 4.6、温度44 ℃、酶解时间2.8 h的条件下,燕麦蛋白提取率达到56.2%,远高于碱性条件(pH 9.5)下14.76%的提取率。Liu等[10]用Viscozyme L从大豆皮中辅助提取一种富含二硫化合物的生物活性蛋白,其提取率为39.01%,远高于水提法4.52%的提取率。Zhang等[11]将乙醇和Viscozyme L预处理相结合,从绿茶渣中提取富含精氨酸、苏氨酸和丝氨酸的碱性蛋白质,该工艺能减少25%的碱提取剂用量,终产物的褐化度减少59%。Ansharullah等[12]在pH 3.8、温度50 ℃、时间5 h条件下,用Viscozyme L预处理米糠,得到蛋白的含氮量为57%。以上研究表明,Viscozyme L预处理后能提高蛋白的提取率和纯度。本研究在乙醇洗涤法提取花生浓缩蛋白的工艺基础上,增加了Viscozyme L预处理花生粕的步骤,旨在将花生浓缩蛋白的纯度提高到70%以上,同时提高浓缩蛋白的提取率。
花生粕:青岛长寿食品有限公司。复合植物水解酶(Viscozyme L,100 FBG/g):丹麦Novozymes公司。
将花生粕加入到蒸馏水中(固液比1∶10 g/mL),调节pH值,加入一定量的Viscozyme L,在一定温度下酶解一定时间,以4 000 r/min离心10 min,沉淀加入80 ℃的蒸馏水洗涤1次,以4 000 r/min离心10 min,沉淀加入70%乙醇(固液比1∶10 g/mL),在50 ℃恒温水浴中浸提2 h,以4 000 r/min离心10 min,沉淀用70%乙醇和蒸馏水分别洗涤2~3次,冷冻干燥得到花生浓缩蛋白。
1.3.1 单因素实验
以酶添加量(0、2.5、5.0、7.5、10.0、12.5 FBG/g)、pH值(3.4、3.8、4.2、4.6、5.0、5.4)、酶解温度(35、40、45、50、55、60 ℃)和酶解时间(1、2、3、4、5、6、8、10、12 h)为实验因素,蛋白质量百分含量和蛋白提取率为考察指标进行单因素实验。各因素的基本条件为:酶添加量 5 FBG/g、pH 4.2、温度45 ℃、时间4 h。
1.3.2 响应面实验设计
以酶添加量(X1,2.5、5.0、7.5 FBG/g)、pH值(X2,3.4、3.8、4.2)、酶解温度(X3,35、40、45 ℃)、酶解时间(X4,4、5、6 h)为自变量,蛋白质量百分含量(Y)和蛋白提取率(Y′)为响应变量,进行4因素3水平的响应面实验。
采用瑞典FOSS 2300型凯氏定氮仪测定花生浓缩蛋白和花生粕的蛋白质量百分含量,蛋白换算系数为5.46,蛋白提取率的计算公式为:
 (1)
(1)采用SPSS Statistics 17.0软件中的最小显著性差异法(least significant difference, LSD),对结果进行方差分析。实验设计与分析采用Design-expert软件(Static Made Easy, Minneapolis, MN, USA. Version 8.0, 2011)。
2.1.1 酶添加量对花生浓缩蛋白提取的影响
酶添加量对花生浓缩蛋白提取的影响如图1所示。酶添加量在0~12.5 FBG/g范围内,随着酶添加量的增加蛋白质量百分含量先增加后减小,酶添加量为7.5 FBG/g时,蛋白质量百分含量最大,为63.09 %,显著高于0~5 FBG/g时的水平值(P<0.05);蛋白提取率随酶的增加总体呈现减小的趋势。当不添加Viscozyme L直接乙醇洗涤提取浓缩蛋白时,蛋白提取率是80.51 %,显著高于除5 FBG/g以外的其它水平值(P<0.05)。酶添加量在0~7.5 FBG/g时,花生粕中的纤维素、半纤维素等碳水化合物类物质的水解量随着酶添加量的增加而增多,使得花生粕原料中的蛋白质充分暴露于乙醇洗涤液中,有利于后续的乙醇洗涤处理,得到的产物中蛋白质含量高,表现为蛋白质量百分含量逐渐增加。但是,由于花生粕中的碳水化合物水解为可溶成分,乙醇洗涤得到的固形物质减少,蛋白提取率减小。综合评价两个指标,选取酶添加量2.5、5.0、7.5 FBG/g作为酶添加量响应面实验水平。
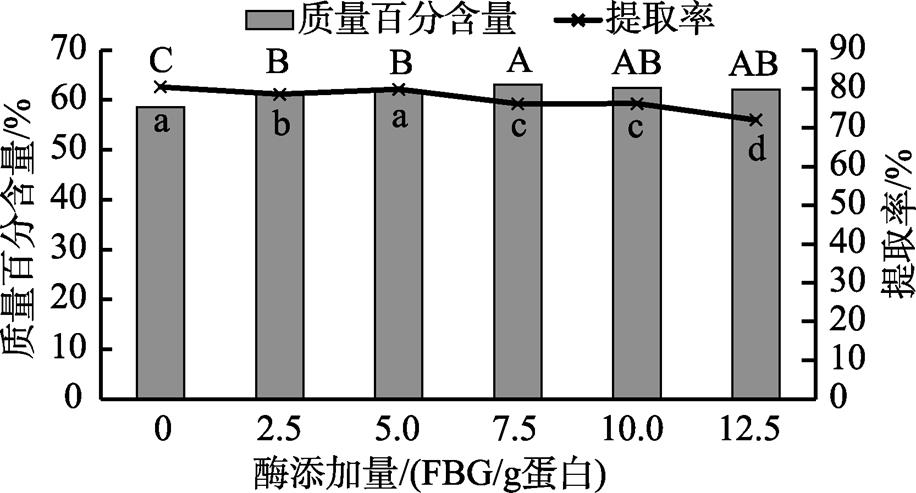
图1 酶添加量对花生浓缩蛋白提取的影响
注:不含相同大写字母表示质量百分含量差异显著(P<0.05);不含相同小写字母表示提取率差异显著(P<0.05)。下同。
2.1.2 pH对花生浓缩蛋白提取的影响
图2为pH对花生浓缩蛋白提取的影响。pH值在3.4~5.4范围内,随着pH提高蛋白质量百分含量先增加后减小,pH为3.8和4.2时蛋白质量百分含量最高;蛋白提取率呈现先增加后减小的趋势,pH值为4.2时蛋白提取率显著大于其它水平值(P<0.05)。酶的水解活性受pH值影响,pH值在3.4~4.2时,随着pH提高Viscozyme L水解活性逐渐增加,花生粕中的碳水化合物类物质水解量增大,乙醇洗涤出的蛋白质增多,蛋白质量百分含量增加;在较适宜的pH值条件下,得到的花生浓缩蛋白量增大,蛋白提取率增大。当pH值大于4.2时,Viscozyme L水解活性下降,蛋白质量百分含量和蛋白提取率均减小。因此,选取pH 3.4、3.8、4.2作为pH值响应面实验水平。

图2 pH对花生浓缩蛋白提取的影响
2.1.3 酶解时间对花生浓缩蛋白提取的影响
图3表示酶解时间对花生浓缩蛋白提取的影响。酶解时间在1~12 h范围内,随着酶解时间的延长蛋白质量百分含量呈现增加的趋势,酶解时间为12 h时的蛋白质量百分含量显著大于其它水平值(P<0.05);蛋白提取率随着酶解时间的延长先增加后减小,酶解时间为2 h时蛋白提取率显著高于其它水平值(P<0.05)。酶解时间延长,Viscozyme L水解效率增加,乙醇洗涤得到的浓缩蛋白纯度提高,蛋白质量百分含量增大;花生粕中的碳水化合物类物质随着酶解时间的延长,生成可溶物质,乙醇洗涤得到的浓缩蛋白质量减小,蛋白提取率下降。选取酶解时间4、5、6 h作为酶解时间响应面实验水平。

图3 酶解时间对花生浓缩蛋白提取的影响
2.1.4 酶解温度对花生浓缩蛋白提取的影响
酶解温度对花生浓缩蛋白提取的影响如图4所示。酶解温度在35~60 ℃范围内,随着温度的提高蛋白质量百分含量和蛋白提取率均呈现先增加后减小的趋势,蛋白质量百分含量和蛋白提取率分别在酶解温度为45 ℃和40 ℃时达到最高。温度是影响酶活性的重要因素,酶解温度在35~45 ℃时,随着温度的提高Viscozyme L水解速率增加,花生粕中的纤维素等物质水解量随之增大,乙醇洗涤出的蛋白质量增加,蛋白质量百分含量和提取率增大;酶解温度超过45 ℃时,Viscozyme L活性受到抑制,水解效率降低,继续提高温度蛋白质量百分含量和蛋白提取率均减小。选取酶解温度35、40、45 ℃作为酶解温度响应面实验水平。
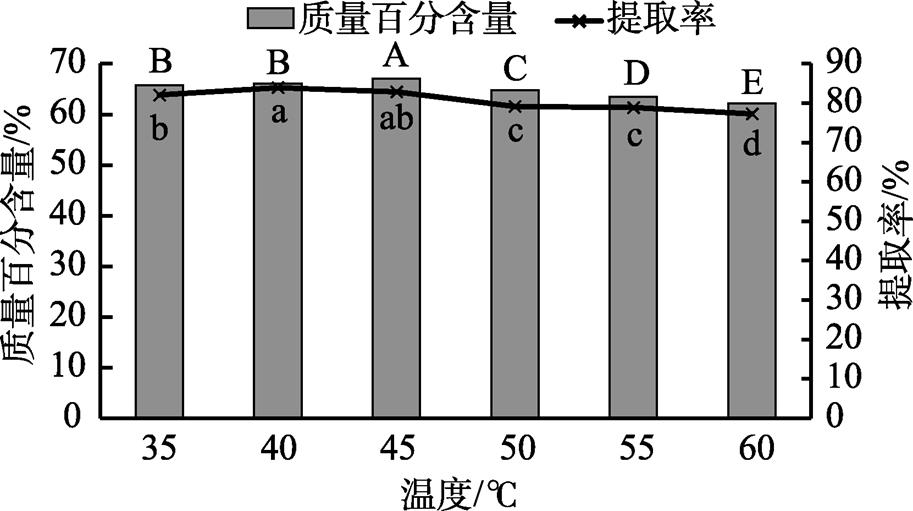
图4 酶解温度对花生浓缩蛋白提取的影响
2.2.1 模型的建立与显著性分析
根据响应面(RSM)设计,选取29个实验点,表1为RSM设计及蛋白质量百分含量和蛋白提取率。对表1结果进行二次多项式回归拟合,分别得到响应值蛋白质量百分含量(Y)和蛋白提取率(Y¢)与酶用量(X1)、pH值(X2)、温度(X3)和时间(X4)的二次回归方程:
Y=73.29+1.79X1+0.52X2+1.1X3+0.9X4–0.34X1X2+ 0.24X1X3–0.67X1X4+0.95X2X3+0.29X2X4+0.71X3X4– 1.64X12–0.46X22–1.47X32–1.49X42(2)
Y¢=80.3–0.91X1–0.33X2–3.1X3+0.026X4–0.28X1X2+ 1.25X1X3–2.53X1X4+3.48X2X3–5.79X2X4–0.87X3X4–3.31X12+1.64X22–1.37X32+0.071X42(3)
对两个模型方程进行方差分析,结果见表2。两个模型极显著(P<0.001),表明方程对实验结果的拟合情况良好,因此可以用回归方程对实验真实值进行分析和预测。模型的校正决定系数(Adjusted coefficient of determination,RAdj2)分别为0.855 8和0.846 3,表明两个响应值大约有85%和84%的变异分布在所研究的4个相关因素中,其总变异度仅有15%和16%不能用模型来解释。模型的相关系数(Correlation coefficient,R)分别为0.963 3和0.960 8,表明两个响应值的预测值和实验值之间具有高度的相关性。失拟项P值分别为0.169 3和0.381 6,均大于0.05,表明方程的拟合不足检验不显著,二次响应面回归方程能较好拟合本实验所得的结果,自变量与响应值之间线性关系显著,两个模型可分别用于响应值的理论预测。模型的变异系数分别为1.09%和2.09%,表明方程拟合度较好。两个模型的信噪比分别为12.83和13.432,均大于4,表明模型可用于蛋白质量百分含量和提取率的理论预测。
表1 RSM设计及结果
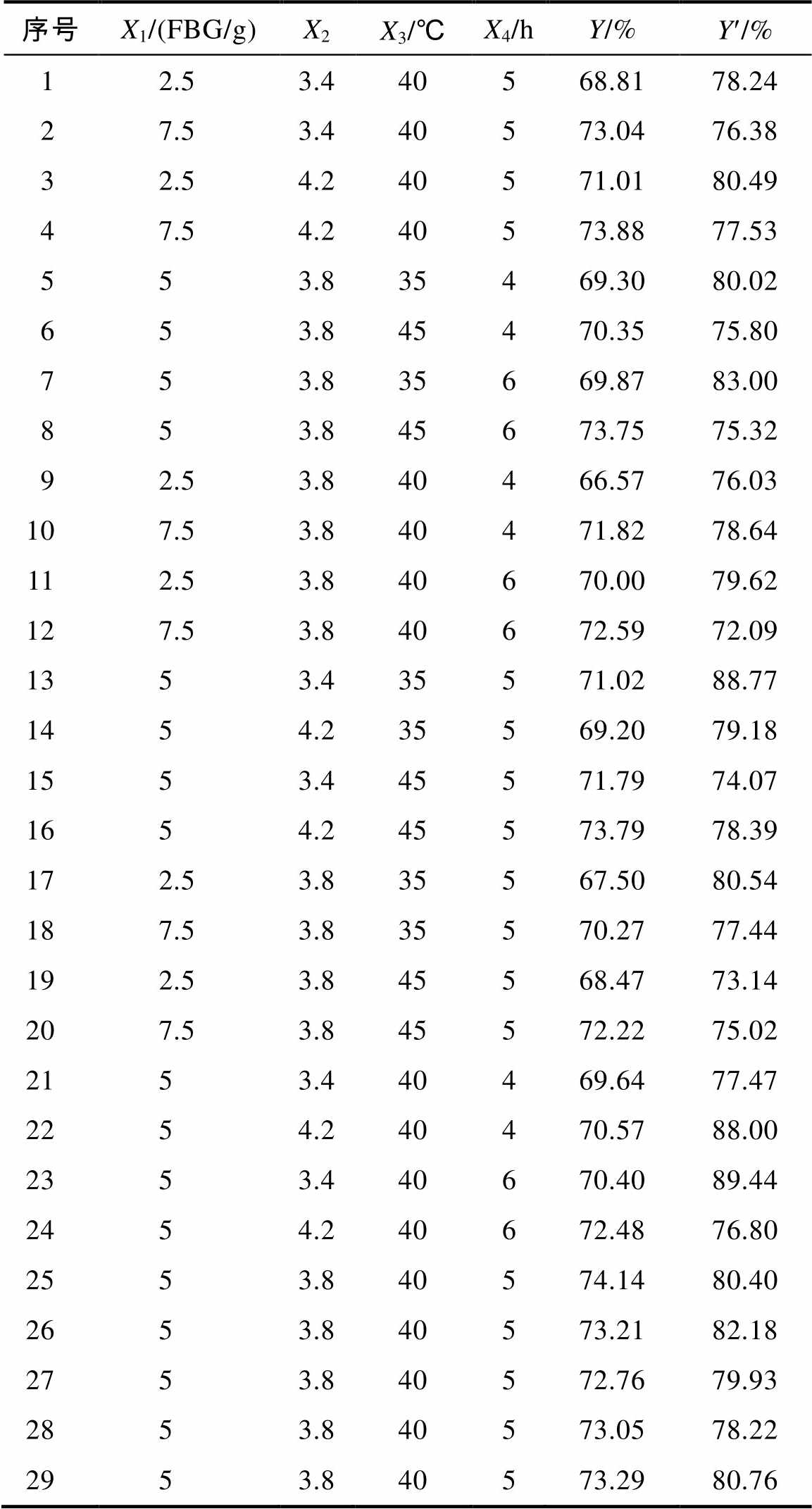
序号X1/(FBG/g)X2X3/℃X4/hY/%Y¢/% 12.53.440568.8178.24 27.53.440573.0476.38 32.54.240571.0180.49 47.54.240573.8877.53 553.835469.3080.02 653.845470.3575.80 753.835669.8783.00 853.845673.7575.32 92.53.840466.5776.03 107.53.840471.8278.64 112.53.840670.0079.62 127.53.840672.5972.09 1353.435571.0288.77 1454.235569.2079.18 1553.445571.7974.07 1654.245573.7978.39 172.53.835567.5080.54 187.53.835570.2777.44 192.53.845568.4773.14 207.53.845572.2275.02 2153.440469.6477.47 2254.240470.5788.00 2353.440670.4089.44 2454.240672.4876.80 2553.840574.1480.40 2653.840573.2182.18 2753.840572.7679.93 2853.840573.0578.22 2953.840573.2980.76
表2 回归模型方差分析
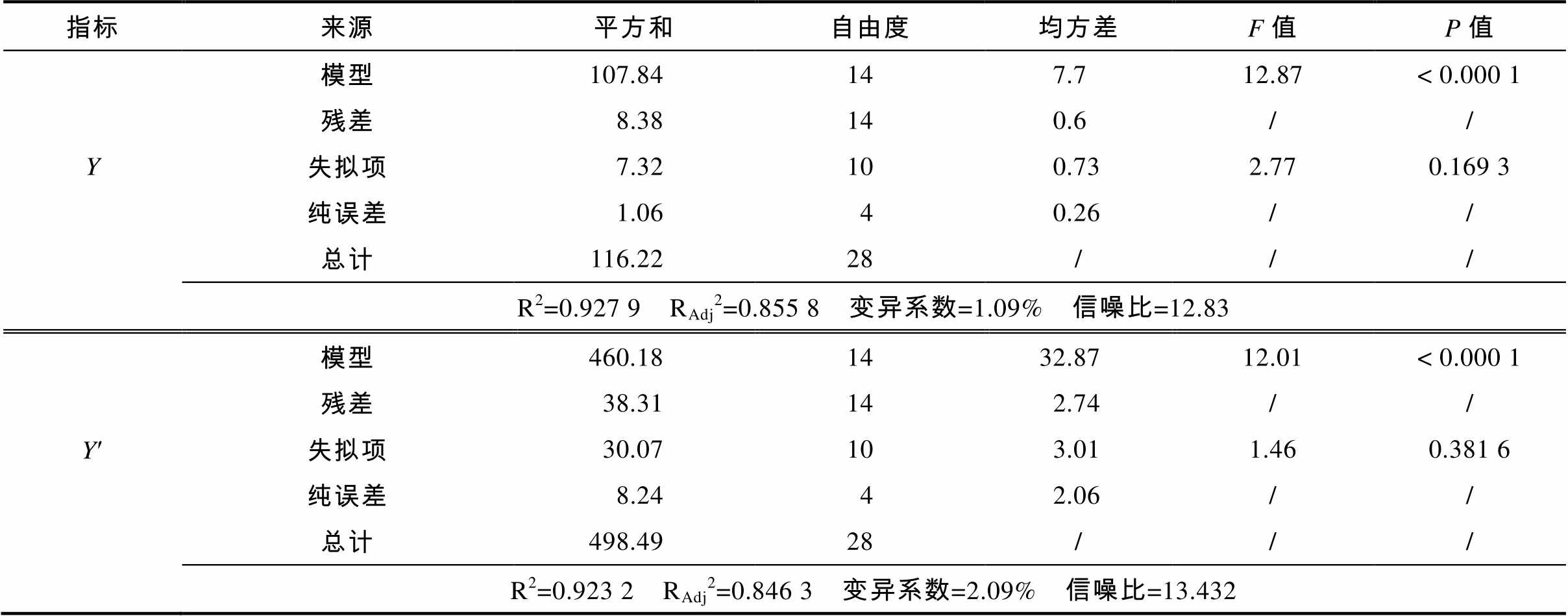
指标来源平方和自由度均方差F值P值 模型107.84147.712.87< 0.000 1 残差8.38140.6// Y失拟项7.32100.732.770.169 3 纯误差1.0640.26// 总计116.2228/// R2=0.927 9 RAdj2=0.855 8 变异系数=1.09% 信噪比=12.83 模型460.181432.8712.01< 0.000 1 残差38.31142.74// Y¢失拟项30.07103.011.460.381 6 纯误差8.2442.06// 总计498.4928/// R2=0.923 2 RAdj2=0.846 3 变异系数=2.09% 信噪比=13.432
两个二次模型回归系数的显著性检验见表3。在Y模型中,因素X2对蛋白质量百分含量影响显著,X4对蛋白质量百分含量影响高度显著,X1和X3对蛋白质量百分含量影响极显著;X12、X32和X42对蛋白质量百分含量影响极显著;X2X3对蛋白质量百分含量影响显著。在Y¢模型中,因素X3对蛋白提取率影响极显著;X22对蛋白提取率影响显著,X12对蛋白提取率影响极显著;X1X4对蛋白提取率影响高度显著,X2X3和X2X4对蛋白提取率影响极显著。两个二次模型的显著性检验表明实验因素对响应值不是简单的线性关系,二次项对响应值也有很大的影响,交互项影响显著。比较响应面模型二次多项式方程中一次项的方差大小,可以判断影响因素的主次顺序。各因素对蛋白质量百分含量影响程度大小顺序为X1>X3>X4>X2,对蛋白提取率影响程度大小顺序为X3>X1>X2>X4。
表3 回归方程系数显著性检验
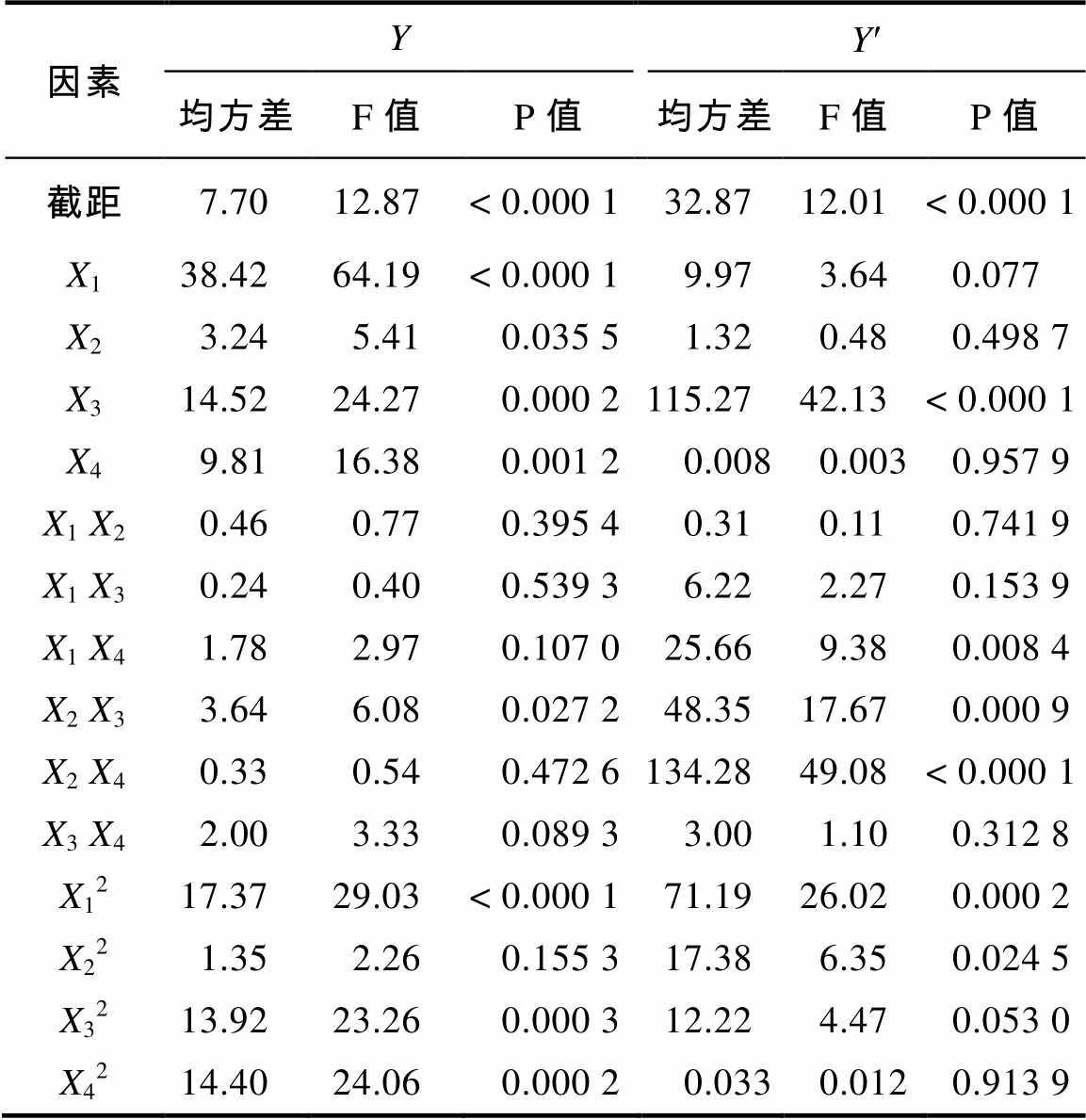
因素YY¢ 均方差F值P值均方差F值P值 截距7.7012.87< 0.000 132.8712.01< 0.000 1 X138.4264.19< 0.000 19.973.640.077 X23.245.410.035 51.320.480.498 7 X314.5224.270.000 2115.2742.13< 0.000 1 X49.8116.380.001 20.0080.0030.957 9 X1 X20.460.770.395 40.310.110.741 9 X1 X30.240.400.539 36.222.270.153 9 X1 X41.782.970.107 025.669.380.008 4 X2 X33.646.080.027 248.3517.670.000 9 X2 X40.330.540.472 6134.2849.08< 0.000 1 X3 X42.003.330.089 33.001.100.312 8 X1217.3729.03< 0.000 171.1926.020.000 2 X221.352.260.155 317.386.350.024 5 X3213.9223.260.000 312.224.470.053 0 X4214.4024.060.000 20.0330.0120.913 9
注:P≤0.05,影响显著;P≤0.01,影响高度显著;P≤0.001,影响极显著;P>0.05,影响不显著。
2.2.2 响应面直观分析
由蛋白质量百分含量响应面模型回归方程可以得出,在影响蛋白质量百分含量的因素中,加酶量、pH值、温度、时间与蛋白质量百分含量均呈正相关;由蛋白提取率响应面模型回归方程可以得出,在影响蛋白提取率的因素中,加酶量、pH值、温度与蛋白提取率呈负相关,时间与蛋白提取率呈正相关。图5为加酶量、pH值、温度和时间4个因素交互影响对两个响应值的响应面分析图。从图5a中可以看出,pH值一定时,蛋白质量百分含量随温度的升高先增加后减小;在温度一定时,蛋白质量百分含量随pH值的增加而增大,在pH 4.2出现最大值,两者交互作用显著(P<0.05)。从图5b可以看出,加酶量一定时,蛋白提取率随时间的延长而增大;在时间一定时,蛋白提取率随加酶量的增大先缓慢增加再减小,两者交互影响高度显著(P<0.01)。从图5b可知,pH值一定时,蛋白提取率随温度的升高先增加后减小;在温度一定时,蛋白提取率随pH值的增加而增大,两者交互影响极显著(P<0.001)。pH值一定时,蛋白提取率随时间的延长而减小;时间一定时,蛋白提取率随pH值的增加而缓慢减小,两者交互影响极显著(P<0.001)。

图5 各影响因素对蛋白质量百分含量和蛋白提取率的交互影响
注:X1,酶用量;X2,pH值;X3,温度;X4,时间。
2.2.3 最优工艺条件的确定
对两个实验模型进行典型性分析,获得花生浓缩蛋白的最优制备工艺条件为:X1=6.04 FBG/g、X2=4.2、X3=42.8 ℃、X4=4.3 h,在该条件下,蛋白质量百分含量和蛋白提取率的理论值分别为72.78%和85.73%。
为了检验响应面方法的可行性,并综合考虑实际操作的便利性,将工艺参数修正为:加酶量6.1 FBG/g、pH值4.2、温度43 ℃、时间4.5 h,进行Viscozyme L预处理花生蛋白粉乙醇浸提制备花生浓缩蛋白实验。3次平行实验得到的蛋白质量百分含量和蛋白提取率的平均值分别为73.21%± 0.59%和85.23%±0.67%,与理论值的差异均小于1 %,说明模型与实际情况拟合较好,验证了所预测模型的正确性。因此,采用响应面法对Viscozyme L预处理花生蛋白粉乙醇浸提制备花生浓缩蛋白工艺条件参数进行优化是可行的,得到的工艺条件具有实际应用价值。
测定了花生粕和浓缩蛋白的氨基酸组成,结果见表4。浓缩蛋白的氨基酸总量和总必需氨基酸量分别比花生粕高62.55%和71.24%。刘玉兰等[13]研究发现冷榨花生饼浓缩蛋白总必需氨基酸含量高于花生粕,营养价值明显提高,本研究的结果与其结论一致。可能的原因是,在Viscozyme L酶解花生粕过程中,原来与蛋白质结合的碳水化合物如纤维素、半纤维素等被酶解成小分子多糖溶于酶解液中,离心时被除去;大分子蛋白被释放出来到离心后的沉淀中,再经乙醇洗涤时,其长链大分子蛋白的空间构象可能改变,疏水性氨基酸(酪氨酸、色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丙氨酸和蛋氨酸,除酪氨酸和丙氨酸外,其余6种氨基酸为必需氨基酸)暴露于分子表面,增加了蛋白的疏水性,有利于乙醇洗涤提取浓缩蛋白,提高蛋白质量百分含量和提取率,使得浓缩蛋白的氨基酸总量和总必需氨基酸含量增高。刘玉兰等[14]分别以浓缩蛋白和花生粕为蛋白源制备合成饲料饲喂大鼠,结果显示浓缩蛋白的营养生理学综合指标和抗动脉粥样硬化指数都高于花生粕,说明花生浓缩蛋白可以作为一种优质的蛋白源应用在高端蛋白产品中。
表4 花生浓缩蛋白和花生粕中各氨基酸的含量 %
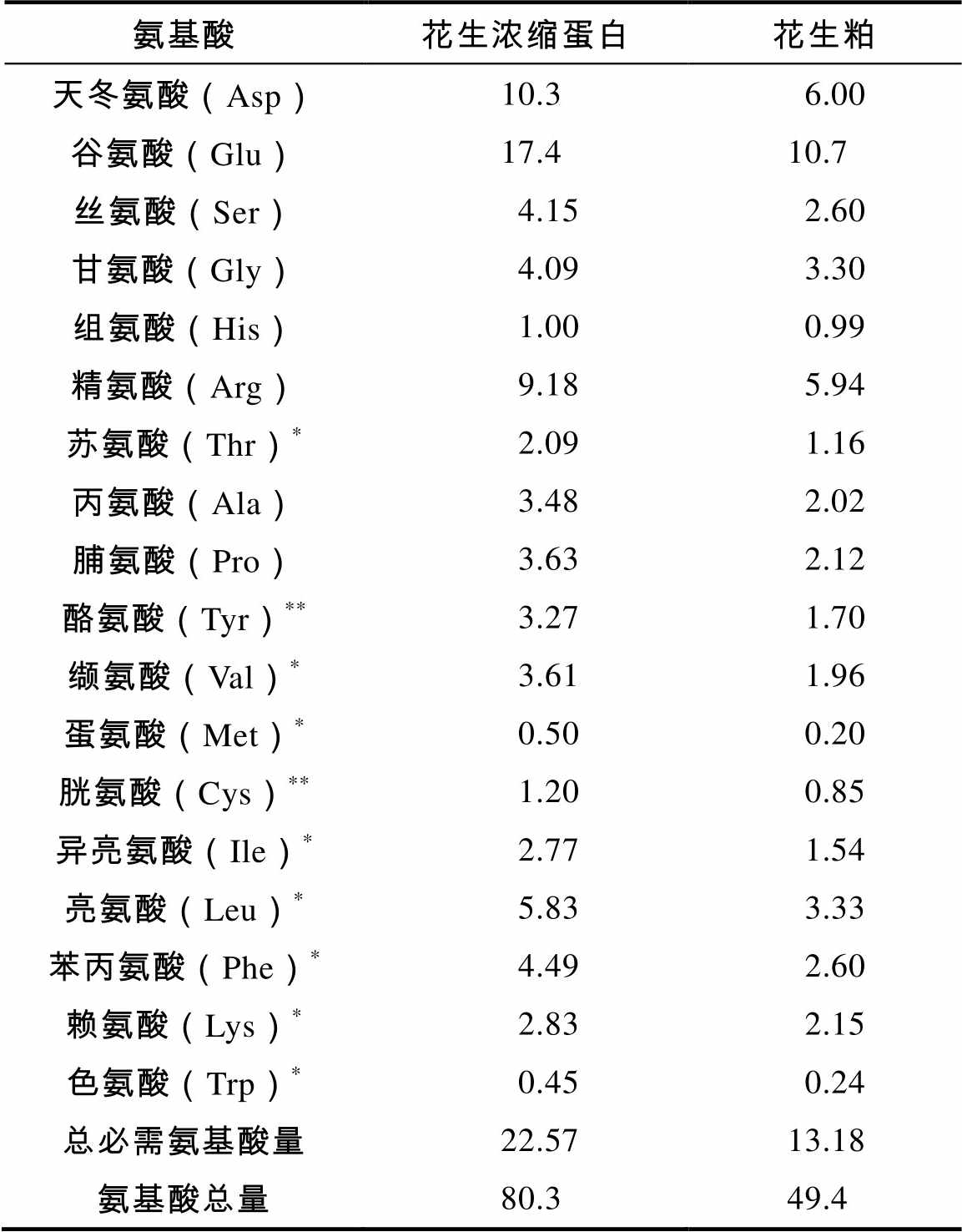
氨基酸花生浓缩蛋白花生粕 天冬氨酸(Asp)10.36.00 谷氨酸(Glu)17.410.7 丝氨酸(Ser)4.152.60 甘氨酸(Gly)4.093.30 组氨酸(His)1.000.99 精氨酸(Arg)9.185.94 苏氨酸(Thr)*2.091.16 丙氨酸(Ala)3.482.02 脯氨酸(Pro)3.632.12 酪氨酸(Tyr)**3.271.70 缬氨酸(Val)*3.611.96 蛋氨酸(Met)*0.500.20 胱氨酸(Cys)**1.200.85 异亮氨酸(Ile)*2.771.54 亮氨酸(Leu)*5.833.33 苯丙氨酸(Phe)*4.492.60 赖氨酸(Lys)*2.832.15 色氨酸(Trp)*0.450.24 总必需氨基酸量22.5713.18 氨基酸总量80.349.4
注:*为必需氨基酸,**为半必需氨基酸。
采用单因素和响应面实验对Viscozyme L预处理花生粕制备花生浓缩蛋白的工艺进行优化,得到最优工艺条件为:加酶量6.1 FBG/g、pH值4.2、温度43 ℃、时间4.5 h。最优条件下制备的花生浓缩蛋白的蛋白质量百分含量和蛋白提取率分别为73.21%和85.23%。氨基酸分析表明,花生浓缩蛋白的氨基酸总量和总必需氨基酸量均高于花生粕。因此,将Viscozyme L预处理技术应用在花生浓缩蛋白的提取工艺中,有利于推进花生浓缩蛋白的生物活性、改性、应用等方面的研究进展。
参考文献:
[1] Kain R J, Chen Z X. Physico-functional properties of peanut meal flour as affected by processing methods[J]. Journal of Food Biochemistry, 2010, 34(2): 229-243.
[2] Ma T Z, Wang Q, Wu H W. Optimization of extraction conditions for improving solubility of peanut protein concentrates by response surface methodology [J]. LWT - Food Science and Technology, 2010, 43: 1450-1455.
[3] 矫丽媛, 吕敬军, 陆丰升, 等. 花生分离蛋白提取工艺优化研究[J]. 食品科学, 2010, 31(20): 196-201.
[4] Yu L N, Sun J, Liu S F, et al. Ultrasonic-assisted enzymolysis to improve the antioxidant activities of peanut (Arachin conarachin L.) antioxidant hydrolysate[J]. International Journal of Molecular Sciences, 2012, 13: 9051-9068.
[5] Yu L N, Yang W Q, Sun J, et al. Preparation, characterisation and physicochemical properties of the phosphate modified peanut protein obtained from Arachin Conarachin L[J]. Food Chemistry, 2015, 170: 169-179.
[6] Wu H W, Wang Q, Ma T Z, et al. Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J]. Food Research International, 2009, 42(3): 343-348.
[7] Pérez-López E, Mateos-Aparicio I, Rupérez P. Determination of soluble dietary fibre content of Okara treated with high hydrostatic pressure and enzymes: a comparative evaluation of two methods (AOAC and HPLC-ELSD)[J]. Journal of food science and technology, 2017, 54(5): 1333-1339.
[8] Kitrytė V, Kraujalienė V, Šulniūtė V, et al. Chokeberry pomace valorization into food ingredients by enzyme- assisted extraction: Process optimization and product characterization[J]. Food and Bioproducts Processing, 2017, 105: 36-50.
[9] Guan X, Yao H Y. Optimization of viscozyme L-assisted extraction of oat bran protein using response surface methodology[J]. Food Chemistry, 2008, 106(1): 345-351.
[10] Liu C, Cheng F F, Liu X, et al. Improved extraction of disulphiderich bioactive proteins from soya hulls: characterisation of a novel aspartic proteinase[J]. International Journal of Food Science & Technology, 2016, 51(6): 1509-1515.
[11] Zhang C, Krimpen M M V, Sanders J P M, et al. Improving yield and composition of protein concentrates from green tea residue in an agri-food supply chain: Effect of pre-treatment[J]. Food and Bioproducts Processing, 2016, 100: 92-101.
[12] Ansharullah, Hourigan J A, Chesterman C F. Application of carbohydrases in extracting protein from rice bran [J]. Journal of the Science of Food and Agriculture, 1997, 74: 141-146.
[13] 刘玉兰, 高经梁, 马宇翔, 等. 花生饼粕制取醇洗浓缩蛋白的品质比较[J]. 粮油食品科技, 2013, 21(3): 57-61.
[14] 刘玉兰, 高经梁, 张慧茹, 等. 醇洗花生浓缩蛋白的营养生理学探讨[J]. 中国粮油学报, 2015, 30(1): 60-64.
Research on extraction of peanut protein concentrate by pretreatment of peanut meal with Viscozyme L
Abstract:In order to optimize the preparation process conditions of peanut protein concentrate by Viscozyme L pretreatment combined with ethanol washing method, the influence of preparation process conditions on protein quantity percentage and extraction rate was investigated by single factor experiments and response surface methodology with peanut meal as the raw material. The results showed that the optimum conditions obtained were enzyme dosage 6.1 FBG/g, pH value 4.2, enzyme hydrolysis temperature 43 ℃ and time 4.5 h, respectively. Under the optimum conditions, the verification experiment values of protein quantity percentage and extraction rate were 73.21%±0.59% and 85.23%±0.67%, respectively. The difference between the predicted values and the verified values was less than 1%, which provided a new way for further development and utilization of peanut meal.
Key words:Viscozyme L; pretreatment; peanut meal; ethanol washing; peanut protein concentrate
DOI: 10.16210/j.cnki.1007-7561.2019.01.007
中图分类号:TS229
文献标识码:A
文章编号:1007-7561(2019)01-0034-07
收稿日期:2018-06-07
基金项目:山东省自然科学基金(ZR2016CM43,ZR2016YL021,ZR2017MC060,ZR2017MC062);山东省农业科学院农业科技创新工程(CXGC2016B16,CXGC2018E21);山东省农科院重大科技成果培育计划(2016CGPY10)