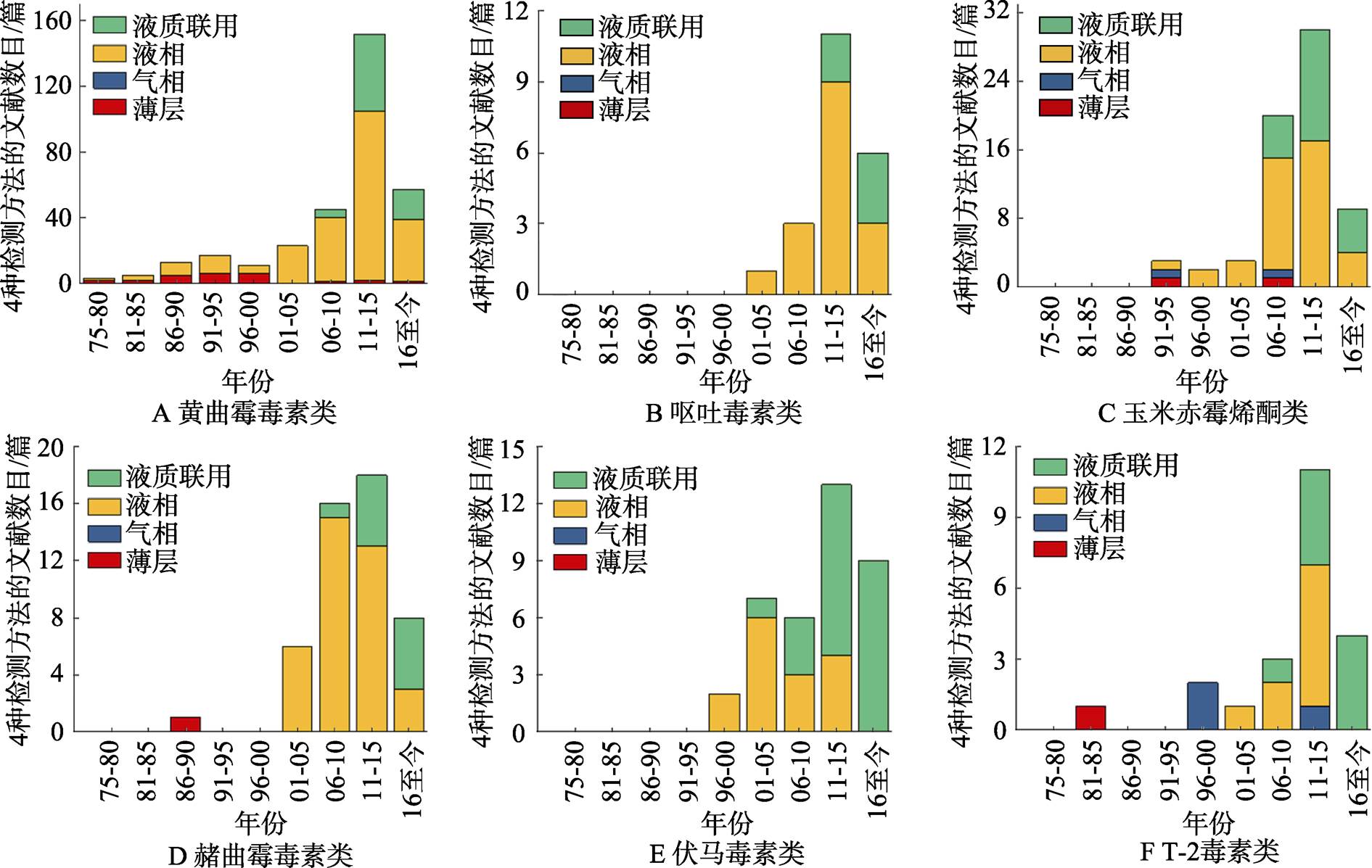
图1 常见真菌毒素的四种检测方法分布情况
徐一达1,2,袁 晓2,王海鸣2,孙秀兰1
(1. 江南大学 食品科学与技术国家重点实验室 食品学院国家功能食品工程研究中心食品安全与营养协同创新中心,江苏 无锡 214122;2. 广州广电计量检测股份有限公司,广东 广州 510627)
摘 要:色谱法在物质分离和检测方面应用广泛。真菌毒素在低浓度下就有明显毒性,采用色谱法可实现对真菌毒素的分离和微量检测。依据真菌毒素的自身特性采用不同的色谱方法进行检测,但不同的色谱法有不同的应用范围。薄层色谱法用于对真菌毒素的快速定性,气相色谱法需要对真菌毒素衍生化汽化后才可检测,液相色谱法对本身具有或衍生化后具有紫外和荧光吸收的真菌毒素才可检测,对无紫外和荧光吸收的则需质谱检测器。简述了色谱法在真菌毒素进行定性定量的研究情况,为利用色谱法对真菌素含量测定的实际运用和方法学开发提供参考。
关键词:色谱;真菌毒素;同步检测
色谱法(Chromatography)自20世纪初发现以来,经过百年来的不断发展和配合检测器的使用,革新衍生出多种色谱分离方法,如薄层色谱法(Thin-Layer Chromatography,TLC),气相色谱法(Gas Chromatography,GC),液相色谱法(Liquid Chromatography,LC),离子色谱法(Ion Chromatography,IC)等方法。由于色谱法可以对理化性质十分混合物中各组分实现分离,在化工、药品、食品等领域的应用广泛,包括实际生产和样品中目标物含量的测定[1]。真菌毒素(Mycotoxins)作为食品和饲料等的重要污染物之一,具有肝、肾毒性、致癌和致突变性、生殖毒性、致畸性等毒性,严重影响农产品质量,对人畜带来严重的安全威胁[2]。由于研究技术的发展, 对各种真菌毒素毒性了解不断深入,发现多数真菌毒素在极低浓度下就有毒性,为了保证日常饮食的安全,需要对真菌毒素的含量进行严格控制。薄层色谱法能够较快的对真菌毒素进行定性定量分析,最先用于真菌毒素的检测,随着气相色谱法和液相色谱法的不断改进,目前可以对大多数真菌毒素进行痕量测定。本文以真菌毒素为探讨对象,阐述用色谱法对真菌毒素进行定性定量的研究进展,为进一步利用色谱法对真菌素含量的测定提供参考。
薄层色谱法为色谱方法中经典的分离方法,作为快速分离和定性分析少量物质的一种很重要的实验手段。该方法对样品预处理要求低, 对固相、展开剂的选择自由度大, 参数调节多样化等特性,可产生多种具有专属性的薄层分析方法,并在跟踪化学反应进程, 多化合物分离情况分析,产品质量初步评价等方面扮演重要角色。该方法无需专门培训的人员操作,也无需特殊要求的仪器,实验成本低廉可控。
薄层色谱法是在真菌毒素检测的众多方法中最早使用的,由于真菌毒素大多水溶能力差,在样品中提取时多用中小极性有机溶剂提取,还常用混合溶剂调整提取溶剂的极性,如黄曲霉素B1(AFB1),呕吐毒素(DON),玉米赤霉烯酮(ZEN),赭曲霉毒素A(OTA),T-2等用甲醇或乙腈提取后用氯仿或二氯甲烷萃取,或直接用氯仿提取。为增加真菌毒素得率,通过调节pH,加入盐溶液等方式去除杂质并富集真菌毒素,同时改善检测准确性,如在提取处理中加入硫酸钠可增强AFB1的萃取率[3],用NaOH溶液调节pH至中性,脱盐脱脂处理后黄曲霉素检测结果明显改善[4],用磷酸或柠檬酸钠溶液和氢氧化钠溶液调节pH除杂改善DON、ZEN得率[5-7],用氢氧化钠除杂,减少T-2提取时的杂质带入等[8]。
试样使用展开剂展开,展开剂多为大小极性溶剂按一定比例混合,如甲苯-乙酸乙醋-甲酸-水,氯仿-丙酮-异丙醇等组合实现真菌毒素分离。但有时为增强薄层分离效果,如对DON、OTA样品采用双向展开(横向和纵向),以获得更好的样品斑点[5,9]。在具体观察薄层分离结果时常采用紫外灯观察,波长多为365 nm。AFB1紫外相应强度相对较弱,采用荧光灯观察,设定激发波长365 nm,发射波长450 nm进行观察,可得明显斑点,同时可利用三氟乙酸反应衍生化增强信号强度[3]。
薄层色谱法快速检测和定性分析真菌毒素,最低检测限约在3~500 μg/kg,但随着人们对真菌毒素危害性的认知进一步加深,对真菌毒素含量的控制越来越严格,并期待新的检测手段产生和加强对痕量检测。薄层色谱的分离和检测技术也有了改进,如加压薄层色谱法配合紫外发射二极管检测器增强薄层的分析能力,还应用了多功能净化柱净化以减少杂质对AFB1的检测干扰[10-12]。随着气相色谱、液相色谱等方法逐渐兴起,检测精度远超薄层色谱法,薄层色谱法多用于快速定性判断。
气相色谱法是现代仪器分析的重要研究领域之一,利用不同物质在固定相和流动相之间的保留能力不同,使得不同物质离开色谱柱的时间不同,被检测器检测分析。进入21世纪以来,气相色谱已经发展到全二维气相色谱,快速气相色谱和微型气相色谱等多种分离方式[13],检测器也由氢氧焰离子化检测器(FID)、电子捕获检测器(ECD)、火焰光度检测器(FPD)发展到四极杆质谱(QT-MS)和飞行时间质谱(TOF-MS),增强了检测精度[14]。配合专用色谱柱,自控技术,多功能色谱工作站,使得气相色谱新技术和新方法的应用变得越来越便利,在石油、化工、环保、农药残留等方面应用更加广泛。
有些真菌毒素分子结构中不含发色基团和荧光基团,或紫外和荧光吸收弱,而气相色谱可以解决部分毒素无法应用紫外光检测的问题,且大多数毒素稳定性良好,高温高压不易降解,因此气相色谱是分析镰刀菌毒素,特别是单端抱霉稀族化合物最常用、最理想的检测方法。
样品前处理多使用甲醇/乙腈-水或氯仿-乙醇/乙酸乙酯为溶剂提取真菌毒素,部分极性小的毒素如AFB2也可用CO2超临界萃取法提取[15]。提取ZEN时,可加入NaCl,调节pH等方式,以减少杂质干扰[16-17],进一步经C18小柱、硅藻土、固相萃取等方式净化后,可减少杂质对气相分析的干扰[16-19]。由于部分真菌毒素在GC分析中不易气化,需要通过衍生化方法使其可以用气相检测。如DON中含有多个羟基,需要通过加入三甲基硅咪哇(TMSI)、三甲基氯化硅烷(TMCS) 等衍生化试剂,使之硅烷化后才可加热气化并可用于GC分析[17],T-2和HT-2则需要通过七氟丁酰(HFB)咪唑-甲苯溶液使之氟酰化后进行分 析[20],ZEN则需要通过TBT试剂(三甲基氯硅烷,三甲基硅烷基咪哇和三甲基硅烷基乙酞胺)衍生化才可用于检测[17]。
用于气相分离的色谱柱多使用非极性毛细管色谱柱,如HP-5MS、HP-1701、HP-5等,且多使用梯度升温的方法实现物质分离。检测真菌毒素常使用ECD检测器和质谱(MS)检测器,如DON的不饱和结构使其对ECD敏感,使用ECD检测器检测限可达10~50 ng/kg[21];用ECD检测ZEN检测限可达20 ng/kg[16],用MS检测T-2与HT-2检测限可达0.05 μg/kg[20],检测ZEN检测限可达50 ng/kg[17]。
气相色谱技术的发展已渐趋成熟,基础性的创新成果十分有限。Mateo发现气相色谱分析中存在如下问题:样品的滞留和读数干扰,标准曲线代表性不足,同批样品的检测波动大和基质影响等[22]。且部分真菌毒素高温下不易气化,需要通过衍生化处理后才可以用于气相分析。有些真菌毒素因找不到合适的衍生化试剂而无法使用气相色谱检测,且衍生化等处理过程耗时复杂,非常考验实验人员的操作要求。以上多种因素限制了气相色谱在真菌毒素检测方面的应用。
液相色谱法(LC)是以液体作为流动相,采用颗粒极细的高效固定相的柱色谱分离技术。适用性广,对样品要求相对宽松,可对不易挥发和热不稳定的物质进行检测,弥补了气相色谱法检测方面的不足。目前多数化合物已采用液相色谱来分析。根据分离机理的不同可分为液液分配色谱、液固吸附色谱、离子交换色谱和凝胶渗透色谱[23]。配合众多高灵敏度的检测器,如紫外检测器、荧光检测器、二极管阵列检测器、质谱检测器等,液相色谱已经广泛应用食品、药品、化工、生物等方面的目标成分含量测定、组成分析、质量控制等方面。
很多真菌毒素稳定性高且不易挥发,已逐渐采用液相色谱分析。样品前处理多采用甲醇/乙腈-水溶液提取。在水中加入NaCl可减少提取过程蛋白质等杂质的溶解[24-25],或采用QuEChERS、加速溶剂萃取法 (Accelerated solvent extraction,ASE)、微波提取法 (Microwave-assisted extraction,MAE)、超临界流体萃取法 (Supercritical fluid extraction, SFE)等,减少杂质提出,并根据样品的理化性质选取最优提取方法[26-29]。提取部分样品用乙酸乙酯或聚乙二醇水溶液提取其中的真菌毒素[30-31]。而样品净化仍然是提取真菌毒素中必不可少的步骤。样品提取完成后多用乙酸乙酯、氯仿萃取、正己烷脱脂等方法,以减少杂质干扰[31-33]。样品基质成分复杂,很有可能在真菌毒素所在的保留时间处存在其他类似杂质,采用如专属性免疫亲和柱、固相萃取柱、C18小型制备柱、自制复合型固相萃取柱、强阴离子交换柱等净化方式可很大程度上改善样品基质效应带来的干扰,保证所得真菌毒素的检测质量[25,34-37]。
经过净、化处理后的样品多用C18反相色谱柱分离。由于液相色谱法多见高效液相色谱法(HPLC)和超高效液相色谱法(UPLC),所使用的色谱柱存在较大差别,主要体现在使用UPLC的分离度和柱效等方面超过HPLC,且分析时间也较HPLC短,有利于对样品进行快速分析。HPLC常用色谱柱有Zorbax SB C18,Zorbax Eclipse XDB C18/苯基柱/Extend C18,Symmetry C18等。UPLC常见色谱柱为Acquity UPLC BEH C18/HSS T3柱等。色谱分离时也多使用甲醇/水或乙腈/水梯度洗脱,但有时也采用甲醇-乙腈-水按照合适的比例混合后洗脱,以确保各物质能完全分离[25,36]。同时还需要依据毒素本身性质添加适量改性剂以改善各物质分离度和峰形,如甲酸,乙酸,乙酸铵,氨水等[31,36,38-39]。
由于真菌毒素在实际样品中含量不高,为增强对这些毒素的检测能力,在大多数的色谱分离方法中采用荧光检测器或质谱检测器。虽然有些真菌毒素在化学结构上具有荧光发色基团,如玉米赤霉烯酮类毒素本身具有苯环结构,在荧光激发下有荧光吸收[40]。但这些毒素的相应强度一般不够强,且本身在样品中含量很低,故使用荧光检测器时采用衍生化方法使其具有更强的信号。如黄曲霉素类可在0.05 %碘溶液70 ℃柱后衍生检测[24,34],T-2毒素可通过4-二甲基氨基吡啶(DMAP)和氰酸蒽(1-AN)混合柱前衍生[41-42],伏马毒素可通过邻苯二甲醛(OPA)柱前衍生[37,43]。利用荧光检测器检测真菌毒素时,如黄曲霉素类在植物油中检测限可达1 μg/kg[24],玉米赤霉烯酮类在玉米、小麦粉、小麦样品中检测限可达0.5 μg/kg[25],T-2类毒素在谷物中检测限可达5 μg/kg[41],呕吐毒素在小麦中检测限可达20 μg/kg[30],伏马毒素在玉米中检测限可达14 μg/kg[43]。但衍生化操作需要对整个反应过程严格操作且可能反应过程不完全,在痕量物质定量时可能存在误差。
在使用荧光检测器时,虽然可以通过控制发射波长和发射波长有效屏蔽较多杂质信号,实现真菌毒素的定性定量,但也难以排除在同等荧光参数下杂质的出现,尤其是和所需检测的毒素处于相近保留时间且难以分开的杂质将严重干扰测定结果。而采用质谱检测可以直接避免因衍生化过程引起的误差以及相近保留时间的杂质的干扰,且痕量检测能力超过荧光检测器。如黄曲霉素类在花生及其制品中检测限可达0.3 μg/kg[36],玉米赤霉烯酮在牛奶中检测限可达1 μg/L[38],T-2类毒素在海产品中检测限可达2 μg/kg[31],呕吐毒素在谷物中检测限可达0.1 μg/kg[39],伏马毒素在啤酒中检测限可达0.6 μg/kg[44],赭曲霉毒素在中草药中检测限可达1 μg/kg[45]。质谱主要是通过母离子、子离子对的选择实现对目标物质的定性定量,可以有效排除非选择条件下的杂质,同时可以应对相似保留时间下的两种或多种真菌毒素的定性定量,解决了紫外、荧光检测器等无法应对的检测难题。质谱检测器中的离子源常见为ESI离子源,有正负之分。因不同真菌毒素对不同离子源的信号强度有所不同,通常需要分类进行定性定量。如黄曲霉素类、T-2类、伏马毒素类、赭曲霉毒素类采用ESI正离子源[31-32,36,44-45];呕吐毒素类、玉米赤霉烯酮类多采用ESI负离子 源[35,38-39,46]。在质谱方法优化上,尤其在多种真菌毒素共同存在的情况下,需要优化流动相中的阳离子和阴离子及其浓度,如H+、Na+、K+、NH4+、CH3COO-等离子以使得需要分析的各种真菌毒素具有更好的信号[47]。同时还需要注意母离子、子离子对的选择组合,锥孔电压、碰撞电压等参数的优化,调试多反应监测MRM模式的相关参数,以避免出现部分杂质在相同条件下的信号干扰。同时,良好的色谱分离方法有助于增强检测器的灵敏度。
因我国地域辽阔,物产丰富,交通运输能力的发达,使得各个地方的物资可实现跨地域流动。而在运输过程中可能会出现因运输、保存不当导致的污染,如粮食、蔬菜等的真菌污染。不同地域的气候差异,温度、湿度、海拔等因素影响,使得不同地域环境中的细菌、真菌种类分布不同,进而导致污染产品中真菌毒素的种类多样和含量差异。目前研究人员也逐渐意识到这种污染所导致的一系列问题,逐步研究多种真菌毒素的检测方法。薄层色谱法分离能力和检出能力有限,仅作为快速定性使用。气相色谱法主本身需要对样品进行汽化后分析,大多数真菌毒素需要进行衍生化操作后才可汽化,目前报道的文献也仅有少数真菌毒素可以实现衍生化,且衍生化操作复杂,耗时长,使气相色谱法在真菌毒素检测方面应用受到很大限制。液相色谱法可以很好地弥补薄层色谱法和气相色谱法的不足,但检测器的选择至关重要。紫外检测器虽然可用于检测呕吐毒素,但终究因灵敏度不及荧光检测器和质谱检测器,不会优先被使用。就单一类真菌毒素的检测而言,随着液-质联用技术的不断改进和升级,国内外对真菌毒素的检测研究报道多采用液-质联用技术进行测定,并有进一步增加的趋势(图1,图2)。
针对多种真菌毒素,很多采用液相色谱串联荧光检测器或质谱检测器进行分析。但因荧光检测器自身限制,使其对自身或经过衍生化具有良好荧光吸收的真菌毒素进行定性和定量,且可同时检测的毒素种类少[48-49]。质谱检测器采用母离子和子离子对实现对物质的定性定量,可有效避免紫外检测器和荧光检测器所遇到的问题,以应对复杂基质样品中对真菌毒素的含量测定。

图1 常见真菌毒素的四种检测方法分布情况
注:基于cnki检索,以6种毒素名称和四种检测方法为检索词进行检索,结合可视化方式和文献筛选获取每年所发相关文献的数量,以每5年统计所发文献数量,截至2018年2月。
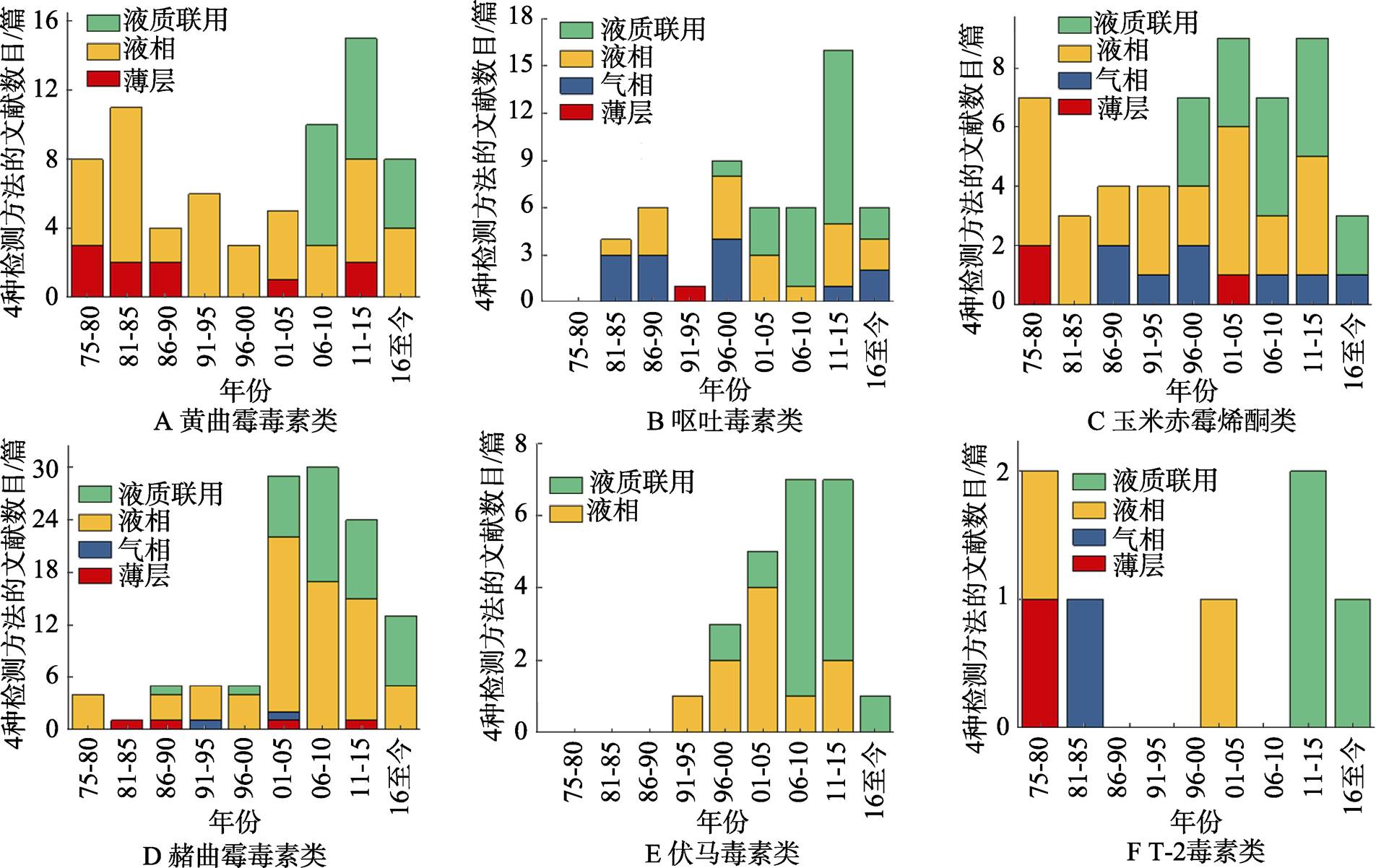
图2 外文文献中常见真菌毒素的四种检测方法分布情况
注:基于pubmed检索,以6种毒素名称和四种检测方法为检索词进行检索,经过文献筛选获取每年所发相关文献的数量,以每5年统计所发文献数量,截至2018年2月。
LC-MS在最近十几年的应用范围在不断扩大,为进一步提高各真菌毒素的分离效率和缩短分析时间,增强检测灵敏度,UPLC-MS/MS方法已经逐渐成为最近几年应对大多数真菌毒素检测的方法,并通过该方法实现了对花生、粮油中18种真菌毒素,玉米粉中10种真菌毒素,小麦粉中11种真菌毒素,中药材中14种真菌毒素等样品中真菌毒素含量的定性定量分析[50-53],并且对真菌毒素的检测种类可达106种[54]。
但尽管如此,很多真菌毒素检测方法存在回收率偏低,基质干扰大,检测限定量限不足等问题。因此,样品前处理方法非常重要。目前的净化处理大多依赖于净化柱,商品化的净化柱多为免疫亲和柱,HLB柱等,成本高昂且无法重复利用,大大增加前处理成本。而且真菌毒素对照品获取难度大,成本高,尤其是以同位素作为内标的真菌毒素对照品[55]。
目前对真菌毒素的检测很多集中在粮油及其产品。随着对真菌毒素认识的不断深入,人们也开始对其他产品中的真菌毒素进行检测,如植物类药材、畜牧业、水产品等[56-58]。但是,涉及的类别还比较少。同时,真菌毒素在动植物体内会产生复杂代谢,其代谢产物的存在形式复杂多变,结构性质未知,毒理机制未明,给多种真菌毒素的痕量检测带来很大难度。因此,HPLC/UPLC-MS在实现对真菌毒素痕量测定的同时,还要对真菌毒素衍生物进行更深探索,甄别更多真菌毒素衍生物和代谢产物。
色谱方法作为分离科学技术的里程碑式方法,经过多年发展,已经发展成薄层色谱法、气相色谱法、液相色谱法等多种分离方法,并配合多种精密检测器实现对多种物质的定性定量,广泛应用于食品、药品、化工、环境、生物等领域。真菌毒素作为众多化合物中的一种,也可通过色谱方法对其进行分析和定量。然而天然存在的真菌毒素含量低,化学性质稳定且不易挥发,而且为多种真菌毒素同时存在,薄层色谱法和气相色谱法难以做到,而液相色谱法也需要配合荧光检测器和质谱检测器才可实现对多种真菌毒素的痕量测定。且在实际的样品中存在多种杂质,且含量很多,则会严重干扰真菌毒素的含量测定,需要配合合适的样品前处理方法实现对杂质的分离与净化,以减少杂质干扰。同时,使用色谱方法在实现对真菌毒素的定性定量评价的同时,还应该发挥色谱方法本身的作用,探索在自然状态和经过动植物摄入机体后的代谢产物,分离和发现新的真菌毒素衍生物,结合质谱、核磁共振等手段实现结构鉴定,配合药理实验判断其毒理和作用通路,体现色谱方法在真菌毒素研究方面的重大作用。
参考文献:
[1] 刘桂荣. 色谱技术研究进展及应用[J]. 山西化工, 2006(1): 22-26.
[2] TURNER N W, BRAMHMBHAT T H, SZABO-VEZSE M, et al. Analytical methods for determination of mycotoxins: An update (2009-2014). Anal Chim Acta, 2015, 901: 12-33.
[3] 尚瑛达, 曹素芳. 薄层色谱法测定黄曲霉毒素B1探讨[J]. 粮食与油脂, 1993(4): 50-51.
[4] 王雄, 林巧, 林璐, 等. 薄层层析法测定苦荞中黄曲霉毒素B1影响因素的研究[J]. 农业与技术, 2015, 35(15): 24-26.
[5] 韩振国. 农产品中赭曲霉毒素A与呕吐毒素的检测方法研究[D]: 南京农业大学, 2009.
[6] 吴文达, 王宝杰, 蔡兰芬, 等. 薄层色谱和高效液相色谱联合检测玉米赤霉烯酮的方法研究[J]. 畜牧与兽医, 2010(7): 17-20.
[7] 罗雪云, 胡霞, 李玉伟. 小麦、小麦制品及玉米中玉米赤霉烯酮的薄层色谱测定[J]. 卫生研究, 1993(2): 112-115.
[8] 罗雪云, 胡霞, 李玉伟. 食品(小麦和玉米)中T-2毒素的薄层层析法[J]. 卫生研究, 1985(3): 31-34.
[9] 魏润蕴, 李文艳. 猪组织中赭曲霉毒素A的薄层色谱测定方法[J]. 中国食品卫生杂志, 1990(2): 21-24.
[10] OTTA K H, PAPP E, BAGOCSI B. Determination of aflatoxins in food by overpressured-layer chromatography. J Chromatogr A, 2000, 882(1-2): 11-16.
[11] STROKA J, ANKLAM E. Development of a simplified densitometer for the determination of aflatoxins by thin-layer chromatography. J Chromatogr A, 2000, 904(2): 263-268.
[12] 张鹏, 张艺兵, 赵卫东. 花生中黄曲霉毒素B1、B2、G1、G2的多功能净化柱-高效薄层色谱分析[J]. 分析测试学报, 1999(6): 62-64.
[13] 夏丹, 高丽荣, 郑明辉. 全二维气相色谱分析持久性有机污染物的应用进展[J]. 色谱, 2017(1): 91-98.
[14] 孙静. 气相色谱-质谱联用技术研究进展及前处理方法综述[J]. 当代化工研究, 2017(9): 4-5.
[15] 兰艳素, 牛江秀, 蒋余芳, 等. CO2超临界萃取荔枝草挥发油及成分分析[J]. 重庆工商大学学报(自然科学版), 2016(4): 22-27.
[16] 罗毅, 郑集声, 杨进生. 粮食中玉米赤霉烯酮的电子捕获气相色谱分析[J]. 环境化学, 1991(1): 59-63
[17] 陈必芳, 李兰. 饲料中镰刀菌毒素DON、T─2和ZEN气相色谱测定方法研究[J]. 中国饲料, 1995(10): 32-34.
[18] VALLE-ALGARRA F M, MEDINA A, Gimeno-Adelantado J V, et al. Comparative assessment of solid-phase extraction clean-up procedures, GC columns and perfluoroacylation reagents for determination of type B trichothecenes in wheat by GC-ECD. Talanta, 2005, 66(1): 194-201.
[19] 李德安, 周宏博, 李群伟, 等. 气相色谱仪宽口径毛细管柱检测谷物中T-2毒素方法[J]. 中国地方病学杂志, 2000(1): 71-72.
[20] 林缨, 陈佳, 吴弼东, 等. 固相萃取-气相色谱-串联质谱法检测粮食作物中的T-2与HT-2毒素[J]. 军事医学, 2013(5): 381-384.
[21] STEINMEYER S, TIEBACH R, WEBER R. Gas chromatographic study of deoxynivalenol and nivalenol in cereals following derivatization with heptafluorobutyrates. Z Lebensm Unters Forsch, 1985, 181(3): 198-199
[22] Mateo J J, Llorens A, Mateo R, et al. Critical study of and improvements in chromatographic methods for the analysis of type B trichothecenes. J Chromatogr A, 2001, 918(1): 99-112.
[23] 王昕. 高效液相色谱研究进展[J]. 光明中医, 2011(1): 56-58.
[24] 樊文研, 宋嵩文, 杨焕威. 柱后衍生高效液相色谱法测定食用植物油中的黄曲霉素B1的含量[J]. 中国药师, 2017(3): 591-593.
[25] 曾红燕, 黎源倩, 敬海泉. 高效液相色谱法测定粮食中玉米赤霉烯酮及其代谢物[J]. 分析化学, 2006(3): 351-354.
[26] LOPES R P, DE FREITAS PASSOS É E, DE ALKIMIM FILHO J F, et al. Development and validation of a method for the determination of sulfonamides in animal feed by modified QuEChERS and LC–MS/MS analysis. Food Control, 2012, 28(1): 192-198
[27] GRAZIANI G, SANTINI A, FERRACANE R, ET AL. Microwave-assisted extraction of ochratoxin A from roasted coffee beans: an alternative analytical approach. Journal of Food Research, 2012, 1(3): 121-127.
[28] ROYER D, HUMPF H U, GUY P A. Quantitative analysis ofFusarium mycotoxins in maize using accelerated solvent extraction before liquid chromatography/atmospheric pressure chemical ionization tandem mass spectrometry. Food Additives and Contaminants, 2004, 21(7): 678-692.
[29] HOLCOMB M, JR H C T, COOPER W M, et al. SFE extraction of aflatoxins (B1, B2, G1, and G2) from corn and analysis by HPLC. Journal of Supercritical Fluids, 1996, 9(2): 118-121.
[30] 何攀, 闫冬阁, 陈渠玲, 等. 免疫亲和高效液相色谱法测定小麦粉品中脱氧雪腐镰刀菌烯醇的方法改进[J]. 现代食品科技, 2018(1): 1-5.
[31] 王小博, 施琦, 王雅玲, 等. 高效液相色谱-串联质谱法测定3种水产品中的T-2毒素与HT-2毒素[J]. 食品科学, 2016(24): 164-169.
[32] 邓欣, 朱志鑫, 黄芳, 等. 液相色谱-串联质谱法测定食用油中4种黄曲霉素[J]. 广东化工, 2017(15): 237-239.
[33] 李玉平, 侯亚莉, 程千川, 等. 高效液相色谱法测定猪肾脏中赭曲霉毒素A[J]. 食品研究与开发, 2017(19): 152-155.
[34] 王建树, 时雪峰, 许彬. 高效液相色谱法测定武陟油茶中的黄曲霉毒素[J]. 河南预防医学杂志, 2017(5): 345-347.
[35] 周鸿艳, 黄方取, 刘洋. 高效液相色谱-串联质谱法测定谷物中呕吐毒素及其衍生物[J]. 实用预防医学, 2016(10): 1269-1271.
[36] 蔡增轩, 潘红锋, 王丽丽, 等. 应用超高压液相-质谱联用技术同时测定花生及其制品中的6种黄曲霉毒素[J]. 中国卫生检验杂志, 2009(5): 970-974.
[37] 李为喜, 郑床木, 武力, 等. 测定玉米中伏马毒素的免疫亲和层析净化高效液相色谱法[J]. 作物学报, 2012(3): 556-562.
[38] 韩镌竹, 田晓玲, 丛鑫, 等. 超高效液相色谱—串联质谱法测定牛奶中6种玉米赤霉烯酮类霉菌毒素的残留[J]. 中国畜牧兽医, 2013(s1): 46-49.
[39] 刘柱, 华颖, 徐潇颖, 等. 同位素稀释-超高效液相色谱-线性离子阱串联质谱分析谷物及其制品中呕吐毒素及其衍生物和代谢物[J]. 分析化学, 2016(11): 1728-1734.
[40] 谢刚, 王松雪, 崔华, 等. 超高效液相色谱法快速检测粮食中玉米赤霉烯酮的含量[J]. 粮油食品科技, 2014(2): 71-75.
[41] 李惠婧, 刘秋, 于一芒, 等. 免疫亲和柱-高效液相色谱法同时检测谷物中T-2毒素和HT-2毒素含量[J]. 食品与发酵工业, 2014(8): 190-193.
[42] 林淼, 赵志辉, 韩薇. 免疫亲和柱-高效液相色谱荧光检测法测定饲料中的T-2毒素[J]. 上海农业学报, 2013(1): 42-47.
[43] 王军淋, 胡玲玲, 蔡增轩, 等. 超高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3[J]. 食品安全质量检测学报, 2013(1): 215-223.
[44] 周贻兵, 吴坤, 李磊, 等. 超高效液相色谱串联质谱法测定啤酒中伏马毒素的含量[J]. 中国酿造, 2016(1): 152-155.
[45] 薛良辰, 刘陆, 郑璇, 等. 超高效液相色谱-串联质谱法检测中草药中赭曲霉毒素A[J]. 现代食品科技, 2016(10): 297-303.
[46] 崔晓娜, 李舫, 王洪涛, 等. 高效液相色谱串联质谱测定粮谷及饲料中玉米赤霉烯酮及其代谢物和伏马毒素B1、B2[J]. 中国畜牧杂志, 2015(4): 62-66.
[47] 韩铮. 中药材中常见真菌毒素分析方法学及代谢动力学研究[D]: 浙江大学, 2011.
[48] RAHMANI A, SELAMAT J, SOLEIMANY F. Optimization and validation of a HPLC method for simultaneous determination of aflatoxin B1, B2, G1, G2,ochratoxin A and zearalenone using an experimental design. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2011, 28(7): 902-912.
[49] 李军, 于一茫, 田苗, 等. 免疫亲和柱净化-柱后光化学衍生-高效液相色谱法同时检测粮谷中的黄曲霉毒素、玉米赤霉烯酮和赭曲霉毒素A[J]. 色谱, 2006(6): 581-584
[50] 宫小明, 任一平, 董静, 等. 超高效液相色谱串联质谱法测定花生、粮油中18种真菌毒素[J]. 分析测试学报, 2011(1): 6-12
[51] 葛宝坤, 赵孔祥, 王伟, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定中药材中的14种真菌毒素[J]. 色谱, 2011(6): 495-500.
[52] 刘家阳, 张月辉, 贾宏新. 凝胶渗透色谱净化-超高效液相色谱-串联质谱法同时检测玉米粉中10种真菌毒素[J]. 中国食品卫生杂志, 2016(6): 763-768.
[53] 李磊, 李海畅, 周贻兵, 等. 液相色谱-串联质谱测定小麦粉中11种真菌毒素[J]. 食品研究与开发, 2016(3): 156-160.
[54] SULYOK M, KRSKA R, SCHUHMACHER R. Application of an LC–MS/MS based multi-mycotoxin method for the semi- quantitative determination of mycotoxins occurring in different types of food infected by moulds. Food Chemistry, 2010, 119(1): 408-416
[55] RYCHLIK M, ASAM S. Stable isotope dilution assays in mycotoxin analysis. Anal Bioanal Chem, 2008, 390(2): 617-628.
[56] 王清. 动物源食品中氯霉素、玉米赤霉醇类化合物和黄曲霉毒素残留量测定[D]: 重庆医科大学, 2014.
[57] John Sweetman, Peter Spring, 敖志刚. 霉菌毒素水产养殖中需要关注的问题[J]. 饲料研究, 2008(10): 63-65.
[58] 梁乙川, 刘珈羽, 张鑫, 等. 真菌对中药材药效物质和安全性影响研究进展[J]. 中药材, 2016(11): 2657-2660.
Research progress in detection of mycotoxins by chromatography
XU Yi-Da1,2, YUAN Xiao2, WANG Hai-ming2, SUN Xiu-Lan1
(1. State Key Laboratory of Food Science and Technology, Synergetic Innovation Center of Food Safety and Nutrition, National Engineering Research Center for Functional Food, School of Food Science and Technology, Jiangnan University, Wuxi Jiangsu 214122; 2. Guangzhou GRG Metrology and Test Co. Ltd., Guangzhou Guangdong 510627)
Abstract:Chromatography is widely used in components separation and detection. Since mycotoxins display toxicity even at low concentration, they can be separated and detected in trace by chromatography. Different chromatography methods were applied according to the characteristics of the mycotoxins. Thin layer chromatography (TLC) is suitable for rapid qualitative of mycotoxins. Gas chromatography (GC) prefers to detect the mycotoxins after derivatization and vaporization. Liquid chromatography (LC) is only applied to analyze the mycotoxins with or without derivatization which were of ultraviolet and fluorescence absorption, while for those without ultraviolet and fluorescence absorption use mass spectrometry detector. The features of the qualitative and quantitative analysis on mycotoxins were introduced, which provides a theoretical basis for the subsequent use of chromatographic method in application of detection on mycotoxins, especially synchronous detection of multiple mycotoxins in samples.
Key words:chromatography; mycotoxin; synchronous detection
DOI:10.16210/j.cnki.1007-7561.2018.06.011
中图分类号:TS 210.7;TS 207.5
文献标识码:A
文章编号:1007-7561(2018)06-0054-08
收稿日期:2018-06-04
基金项目:国家粮食局行业公益项目(201513006-01-05);江苏省农业科技自主创新资金项目(CX(17)10032)
作者简介:徐一达,1992年出生,男,硕士学历.
通讯作者:孙秀兰,1976年出生,女,教授,博士生导师.