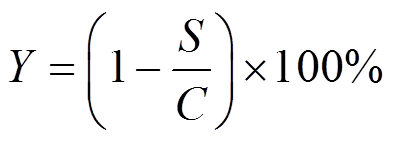
王明清 1 ,于丽娜 1 ,张初署 1 ,毕 洁 1 ,孙 杰 1,2 ,刘 宾 3
(1. 山东省花生研究所,山东 青岛 266100;2. 西海岸现代农业示范区管委会,山东 青岛 266000;3. 山东省农业科学院 农业质量标准与检测技术研究所,山东 济南 250000)
摘 要: 黄曲霉毒素B 1 (AFB 1 )具有极强的毒性和致癌性,严重危害人和动物健康。通过富集培养、初筛和复筛从土壤中筛选到能降解黄曲霉毒素的菌株,鉴定降解效率最高菌株并研究其降解特征。结果表明,筛选出多株能降解AFB 1 菌株,其中菌株A12降解效率最高,通过形态学、生理生化特征及16S rRNA基因系统进化分析鉴定菌株A12为枯草芽孢杆菌,命名为 Bacillus subtilis subsp. Inaquosorum A12。研究发现枯草芽孢杆菌A12上清液、菌悬液、胞内液能分别降解87.6%、17.3%和10.8%的AFB 1 ,表明菌株A12分泌至胞外活性物质主导生物降解作用。菌株A12上清液降解AFB 1 的最适反应温度为37 ℃,最适pH为7.0。将该菌接种到AFB 1 污染的花生样品,能显著降低AFB 1 的含量。为枯草芽孢杆菌A12应用于AFB 1 的生物脱毒奠定了基础。
关键词: 黄曲霉毒素B 1 ;筛选;菌株;降解;鉴定
黄曲霉毒素是一类由黄曲霉( Aspergillus flavus )和寄生曲霉( Aspergillus parasiticus )等真菌产生的次级代谢产物 [1] 。20世纪60年代英国发生了十万只火鸡死亡事件,调查发现火鸡食用了黄曲霉毒素污染的花生粕导致中毒死亡 [2] 。黄曲霉毒素具有致突变、致癌性、强肝毒性、致畸性,严重危害人和动物健康。黄曲霉毒素性质稳定,在花生、玉米等农产品及制品、饲料中广泛存在,污染后难以消除,能残留在肉、蛋、奶等畜产品中,并随着食物链的传递和富集而威胁人类健康和生命安全 [3] 。目前已经发现了二十多种黄曲霉毒素,如黄曲霉毒素B 1 (AFB 1 )、黄曲霉毒素B 2 (AFB 2 )、黄曲霉毒素G 1 (AFG 1 )、黄曲霉毒素G 2 (AFG 2 )、黄曲霉毒素M 1 (AFM 1 )、黄曲霉毒素M 2 (AFM 2 )等,其中AFB 1 毒性最强、分布最广、危害最大、致癌力最强 [4-5] 。因此,采取有效措施对已污染黄曲霉毒素的农产品和食品进行脱毒,成为粮油工业、食品工业、饲料业和畜牧业亟待解决的难题。
目前黄曲霉毒素脱毒的方法主要有物理法、化学法和生物法。物理法包括剔除发霉粮食颗粒法、硅藻土等吸附剂吸附法、紫外线辐照法、等离子体处理法、高温处理法、熏蒸法等 [6-7] ;化学法包括臭氧、过氧化氢等氧化法、有机试剂脱毒法、氨处理法等 [8] ;生物法主要包括生物吸附法和生物降解法 [9-10] 。物理法和化学法存在转移而未降解黄曲霉毒素、向食品中引入化学残留、破坏食品营养等问题,而生物降解法因为对毒素高度专一性、无污染、不破坏食品营养等优点,成为近年来黄曲霉毒素脱毒的研究热点 [11] 。本研究从土壤中筛选降解AFB 1 的菌株,研究其降解特征并对该菌株进行鉴定,为其应用于黄曲霉毒素的生物脱毒奠定基础。
土壤样品:山东省青岛市;AFB 1 标准品:以色列Fermentek公司;香豆素:上海融禾医药科技发展有限公司;色谱级甲醇:德国Merck公司;细菌基因组DNA提取试剂盒和DNA凝胶回收试剂盒: 天根 生化科技(北京)有限公司;Super GelRed荧光染色试剂:美国US Everbright Inc;pMD19-T: 宝生物 工程( 大连 )有限公司;黄曲霉毒素免疫亲和柱:北京华安麦科生物技术有限公司。
富集培养基为LB液体培养基(g/L):10 g胰蛋白胨,5 g酵母提取物,10 g NaCl,pH 7.0,121 ℃高压灭菌20 min。LB固体培养基:LB液体培养基中加入15 g/L琼脂。初筛培养基为香豆素固体筛选培养基 [12] (g/L):0.25 g KH 2 PO 4 ,0.25 g MgSO 4 ·7H 2 O,0.5 g KNO 3 ,0.5 g (NH 4 ) 2 SO 4 ,0.005 g CaCl 2 ,0.003 g FeCl 3 ·6H 2 O,15 g琼脂,1.0 g香豆素,pH 7.0,121 ℃高压灭菌15 min。复筛培养基(g/L):10 g蛋白胨,3 g牛肉膏,10 g NaCl,1 g KH 2 PO 4 ,1 g葡萄糖,pH 7.0,121 ℃高压灭菌15 min。
IS-RDV1恒温震荡器:美国精骐公司;5430R高速离心机:德国Eppendorf公司;S1000TM Thermal Cycler PCR仪和凝胶成像仪:美国Bio-Rad公司;pH计:德国赛多利斯公司;GI36T高压蒸气灭菌器:致微(厦门)仪器有限公司;1260型高效液相色谱仪:美国Agilent公司。
1.4.1 降解AFB 1 菌株的初筛
土壤样品用无菌水稀释十倍,稀释液按百分之一的接种量接种到富集培养基,在37 ℃ 120 r/min条件下震荡培养24~48 h。观察培养液的变化,当出现浑浊后取100 μL菌液涂布在初筛培养基上,在37 ℃培养箱中培养7~10 d,定期观察菌的生长情况,根据颜色形态等挑取单菌落,划线纯化3次。纯化的菌株在LB培养基培养后,加入20%甘油,于 - 20 ℃冰箱冻存。
1.4.2 降解AFB 1 菌株的复筛
筛选出的菌株接种于复筛培养基,培养2 d。1 980 μL菌液加入20 μL的10 mg/L AFB 1 标准品,加AFB 1 的培养基作为空白对照,37 ℃避光孵育3 d。
经10 000 r/min离心10 min后收集菌株上清液,上清液经0.22 μm滤膜过滤后加入免疫亲和柱,先用超纯水洗两遍免疫亲和柱,然后将色谱级甲醇加入亲和柱,收集洗脱液。采用高效液相色谱检测溶液中AFB 1 的含量,HPLC检测条件为:C-18色谱柱(4.6 mm×15 cm×5 μm),进样量为20 μL,流动相为V 甲醇 ∶V 水 =1∶1,流速0.8 mL/min,荧光检测器激发波长为360 nm,发射波长为440 nm。利用以下公式计算菌株对AFB 1 的降解率:
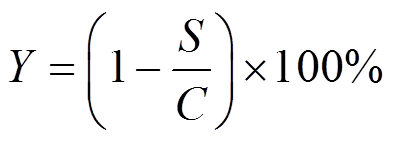
C 为空白对照样品AFB 1 的峰面积; S 为发酵菌液处理样品中残留AFB 1 的峰面积, Y 为AFB 1 降解率。
1.6.1 表型分析
菌株A12在LB固体培养基平板上37 ℃培养24 h后观察菌落形态、色泽。
1.6.2 生理生化特征分析
观察菌株A12革兰氏染色反应,以及其能利用的唯一碳源,其氧化酶、过氧化氢酶等实验。唯一碳源利用实验:将“1.2培养基”中的初筛培养基中的香豆素替换为某一底物碳源,115 ℃灭菌20 min,将菌株A12在唯一碳源平板上划线,37 ℃培养15 d,观察是否生长,碳源包括葡萄糖、乳糖、麦芽糖和甘露糖等碳源。氧化酶实验:用1%四甲基对苯二胺二盐酸盐溶液浸湿滤纸,挑取新鲜的菌株A12点在滤纸上,在10 s内呈现紫色的为阳性。过氧化氢酶实验:将30%过氧化氢滴在新鲜的A12菌落上,如果立即出现气泡为阳性,30 s后仍未产生气泡为阴性。
1.6.3 细菌16S rRNA基因序列分析
菌株A12接种到LB液体培养基,培养24 h后,采用细菌基因组DNA提取试剂盒提取细菌基因组DNA。细菌16S rRNA基因通用引物为27F和1492R [14] ,PCR反应体系12.5 μL: Taq buffer 1.25 μL,dNTPs 1 μL, Taq 聚合酶0.1 μL,引物P1和P2各0.5 μL,A12基因组模板 0.5 μL(浓度为20 μg/mL),水8.65 μL。PCR扩增程序:94 ℃预变性10 min;94 ℃变性40 s,50 ℃退火40 s,72 ℃延伸120 s,30个循环;72 ℃延伸8 min。反应结束后,取PCR产物上样于0.8%的琼脂糖凝胶,检测PCR结果,切下目的条带,通过DNA胶回收试剂盒纯化目的条带,连接到pMD19-T载体,转化到大肠杆菌,通过蓝白斑筛选挑取阳性菌落,经菌落PCR检测后,将菌液送到上海生工生物有限公司测序。测序得到的基因序列进行在线比对分析,选取相近的同源序列进行ClustalW分析,然后用MEGA6 软件构建系统进化树。
取10 mL的A12发酵液,经10 000 r/min离心20 min后,分离得到菌体和上清液。制备的菌体经无菌水洗涤后离心,加入10 mL无菌水悬浮菌体获得A12菌悬液。A12菌悬液经低温超声破碎后,10 000 r/min离心20 min得到的液体经0.22 μm滤膜过滤制备A12的胞内液。将A12上清液、菌悬液、胞内液三种组分分别加入AFB 1 ,在37 ℃孵育72 h后,检测分析各组分的AFB 1 降解率。
1.8.1 时间的影响
向菌株A12上清液中加入AFB 1 的标准品,使AFB 1 终浓度为100μg/L,37 ℃孵育,分别在6 、12、24、36、48、72 h取样,采用HPLC检测AFB 1 的浓度。
1.8.2 温度的影响
向五支无菌的孵育管中分别加入A12上清液,放入不同的温度培养箱中孵育,孵育温度分别为20、30、37、40 ℃,待温度达到要求后加入终浓度100μg/L的AFB 1 ,避光孵育72 h后,分析不同温度下菌株A12上清液的AFB 1 降解率。
1.8.3 pH的影响
将菌株A12上清液调整至不同pH值,分别为5.0、6.0、7.0、8.0,加入终浓度100μg/L的AFB 1 进行AFB 1 的降解实验,避光孵育72 h后,分析不同pH下菌株A12上清液的AFB 1 降解率。
将黄曲霉毒素超标的花生样品经研磨后分为三份,每份2 g,编号分别为S1、S2和S3。S1号样品作为对照;S2号样品经121℃灭菌15 min;S3号样品经121℃灭菌15 min处理后降温,接入A12菌液处理72 h。分别检测这三份样品中AFB 1 的含量。
通过富集培养和初筛,获得多株降解菌株,进一步复筛后发现8株菌株能不同程度地降解AFB 1 (图1),其中菌株A12的降解率最高,为87.6%。下面围绕着菌株A12进行研究,鉴定该菌株并分析其降解特征。
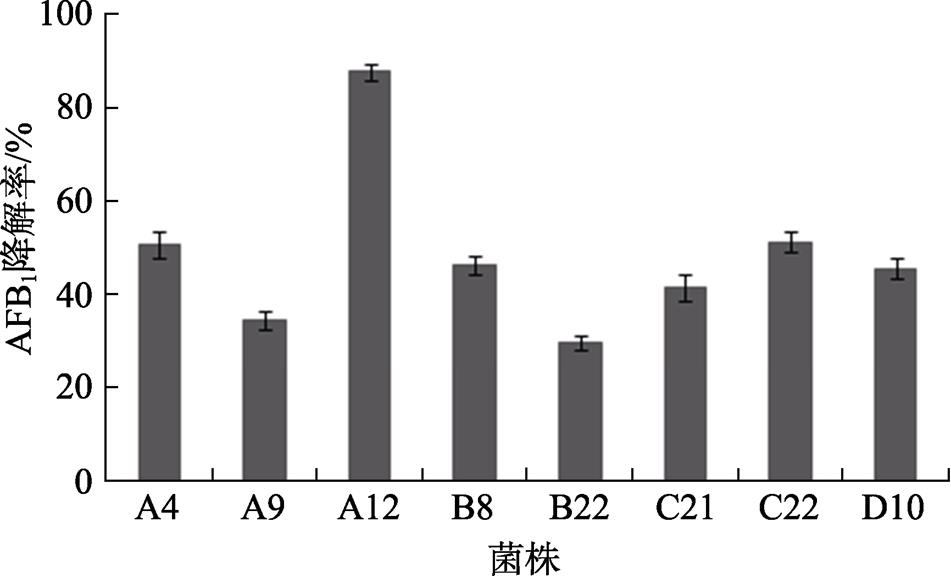
图1 各菌株降解AFB 1 的能力
2.2.1 菌株A12形态学特征
由图2可以看出,菌株A12在LB培养基上单菌落凸起,有皱褶,乳白色,不透明。
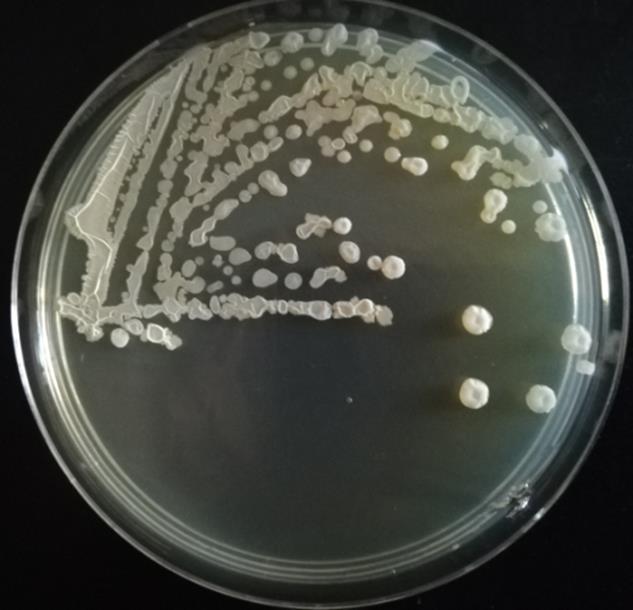
图2 菌株A12的菌落形态
2.2.2 菌株A12生理生化特征
菌株A12的革兰氏染色呈阳性,能利用葡萄糖、乳糖、麦芽糖、甘露糖等碳源,具有氧化酶和过氧化酶活性。根据菌株A12的生化反应特 征及形态学特征,初步判断菌株A12属于芽孢杆菌属 [15-16] 。
2.2.3 菌株A12的16S rRNA基因鉴定
以16S rRNA基因特异性引物进行PCR扩增,在约1 500 bp处获得一条特异性的扩增条带,且条带清晰亮度好(图3)。经测序得到16S rRNA基因长度为1 511 bp,该序列已提交GeneBank,登录号为MH236184。与已经公布的序列比对分析,发现菌株A12与芽孢杆菌属的菌株处于同一大的分支(图4),其中与标准菌株 Bacillus subtilis subsp. Inaquosorum KCTC 13429 T 聚类在一起,进化距离最近,并且与该菌株KCTC 13429 T 相似度最高,相似度高达99.86%。结合形态、生理生化特征和16S rRNA基因系统进化分析结果鉴定,菌株A12命名为 Bacillus subtilis subsp. Inaquosorum A12,中文名为枯草芽孢杆菌A12。
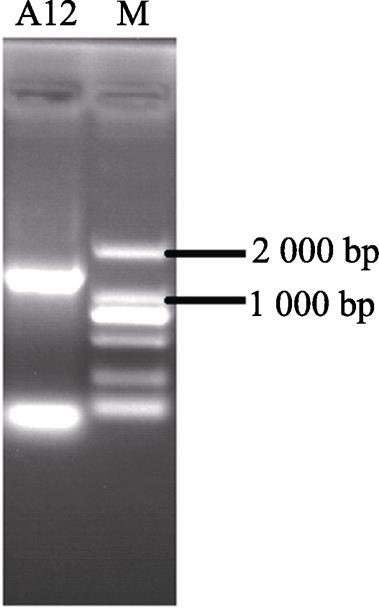
A12是菌株A12的16S rRNA基因;M是DL2000 DNA Marker
图3 菌株A12的16S rRNA基因PCR产物琼脂糖凝胶电泳分析
2.3.1 菌株A12各组分降解AFB 1 特性
比较菌株A12不同组分的降解能力,发现其上清液、菌悬液、胞内液能分别降解87.6%、17.3%和10.8%的AFB 1 (图5)。这表明菌株A12降解AFB 1 是细菌分泌至胞外的活性物质主导的生物降解作用,而不是细菌细胞壁的吸附作用。
2.3.2 时间对菌株A12上清液降解AFB 1 的影响
分析孵育时间对A12上清液降解AFB 1 的影响,研究6、12、24、36、48和72 h六个孵育时间点菌株A12上清液降解AFB 1 ,结果表明:降解率分别为15.7%、25.1%、32.6%、48.9%、76.7%和87.6%(图6)。
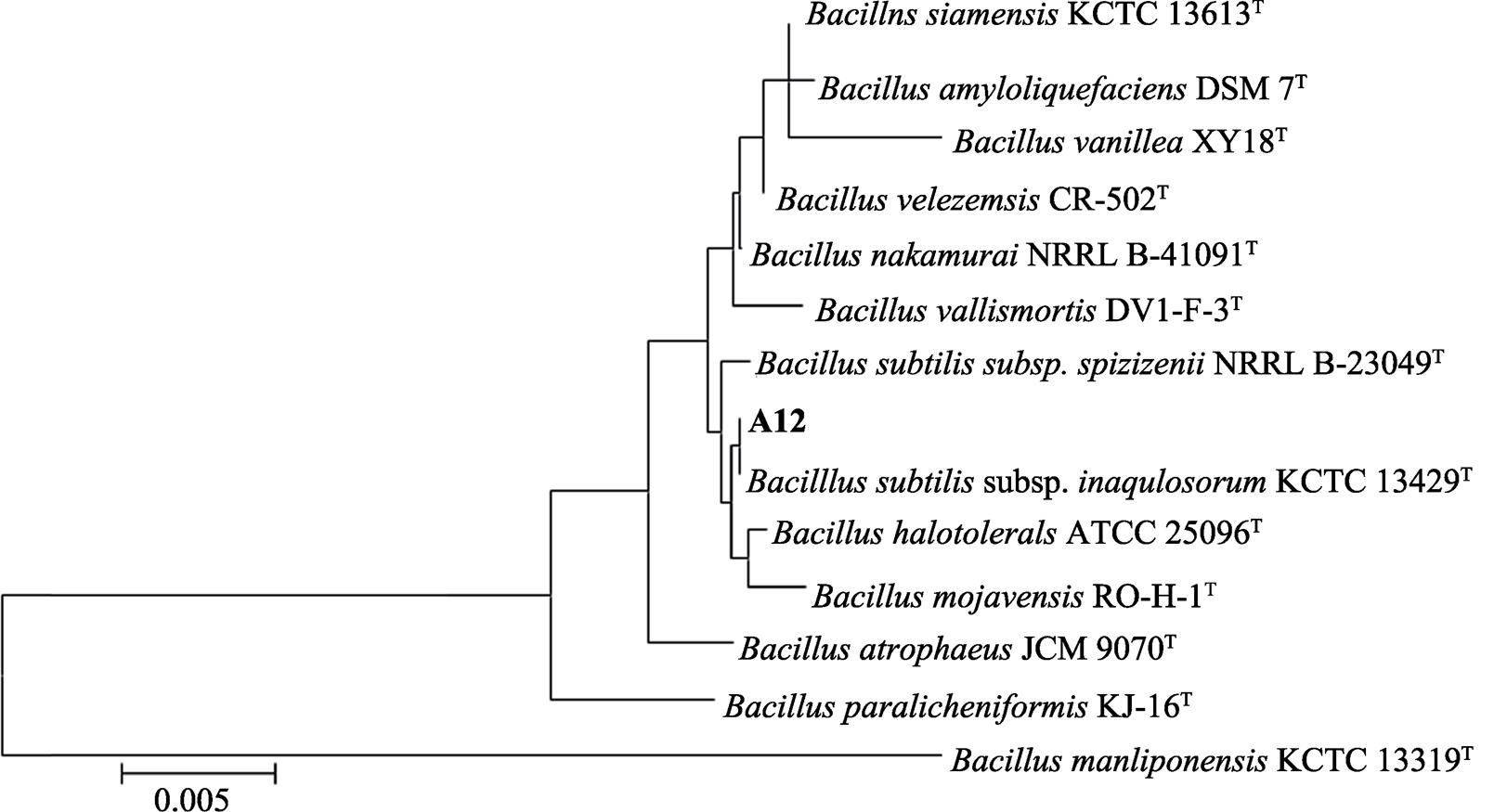
图4 菌株A12的系统发育树
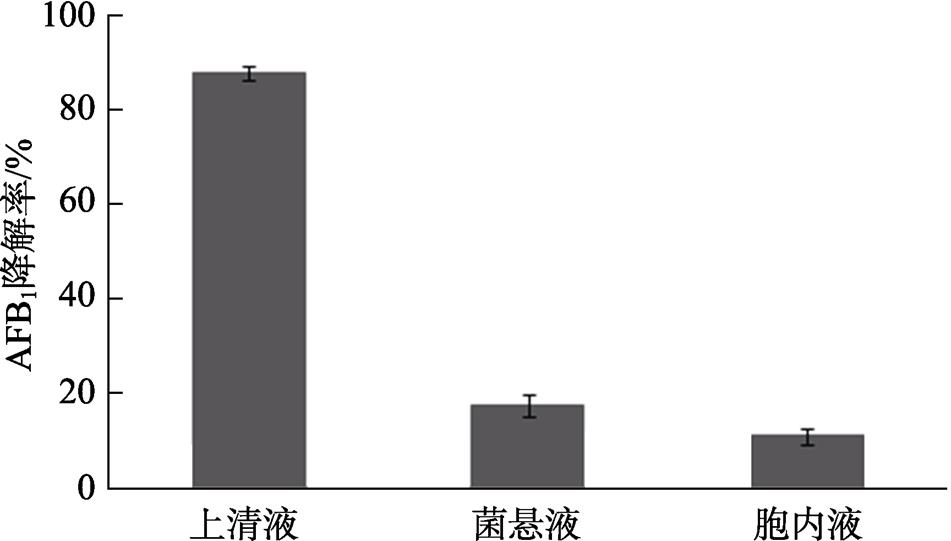
图5 菌株A12各组分降解AFB 1
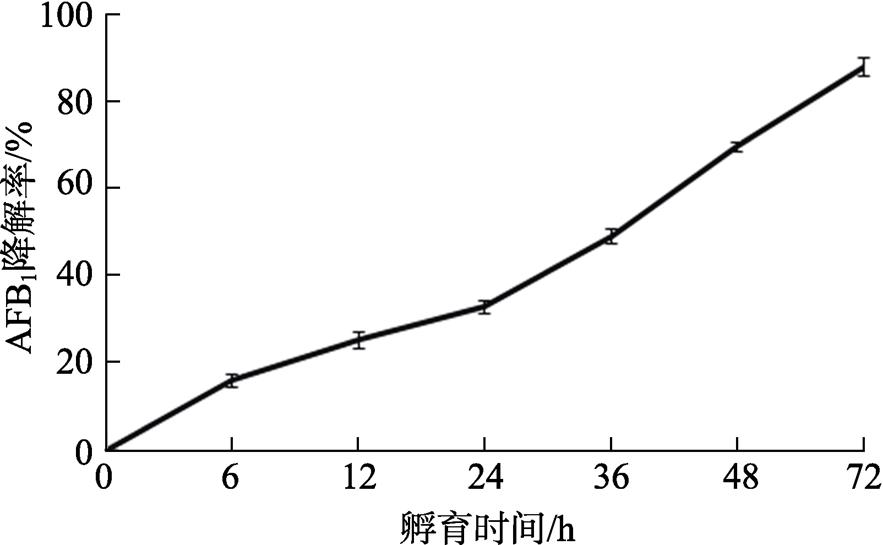
图6 不同时间菌株A12上清液降解AFB 1 的结果
2.3.3 温度对菌株A12上清液降解AFB 1 的影响
分别研究20、30、37、40 ℃四个温度下菌株A12上清液降解AFB 1 的情况(图7)。结果表明,在20~37 ℃条件下,菌株A12上清液降解AFB 1 的能力在增加,在37~40 ℃条件下,降解率明显降低,表明37 ℃是该菌上清液的最佳降解温度。
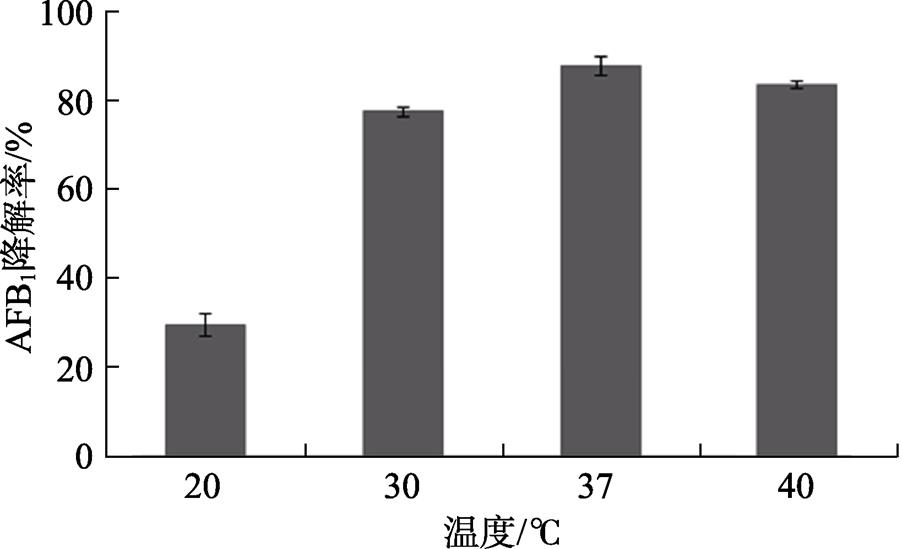
图7 不同温度下菌株A12上清液降解AFB 1 的结果
2.3.4 pH对菌株A12上清液降解AFB 1 的影响
研究发现菌株A12上清液对AFB 1 的降解随着pH的变化而不同。图8可以看出,当pH为5时降解率为33.3%,在pH从5到7时,降解率逐渐增加,pH为8时,降解率降低。研究表明当pH为7时,菌株A12上清液对AFB 1 的降解率最高。
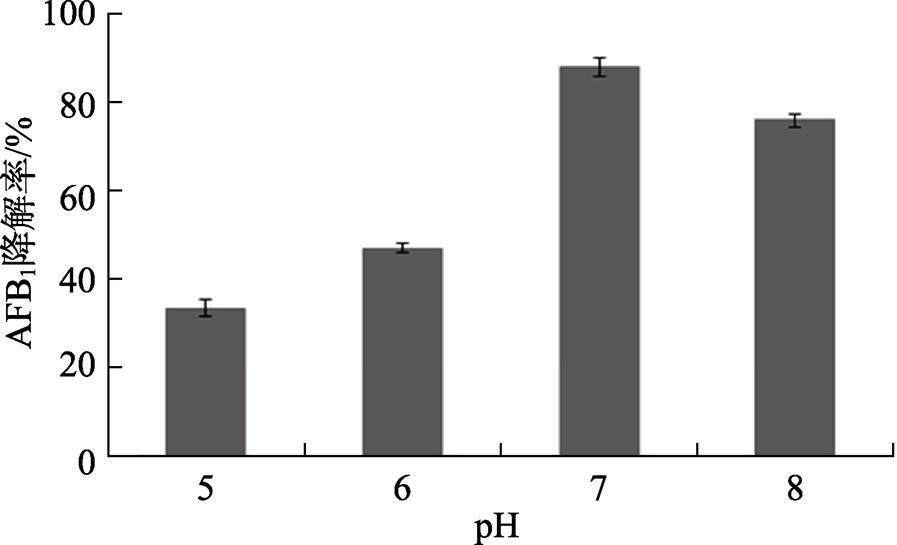
图8 不同pH条件下菌株A12上清液降解AFB 1 的结果
以黄曲霉毒素超标的花生样品为研究对象,分析表明未处理样品S1的AFB 1 含量为135.1 μg/kg。样品S2为黄曲霉毒素超标的花生样品经过灭菌处理,样品S3为加入菌株A12菌液处理。图9表明,样品S2的AFB 1 的含量为133.3 μg/kg,与样品S1未处理组差别不大,而加入菌株A12菌液处理的样品S3经72 h后,AFB 1 的含量明显降低,为25.6 μg/kg。说明菌株A12能显著降解黄曲霉毒素超标的花生样品中AFB 1 。
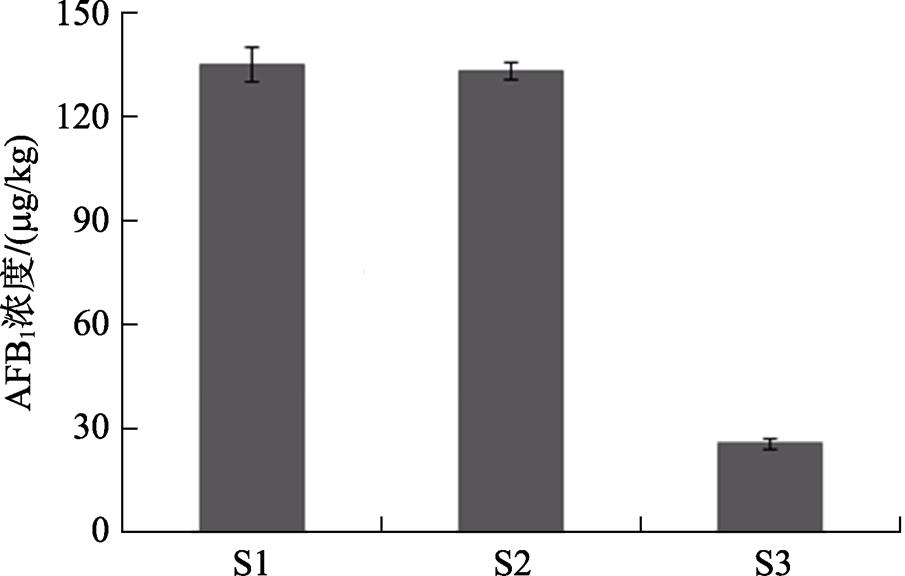
图9 菌株A12对花生样品中AFB 1 的降解结果
上述研究结果表明,从青岛土壤中筛选分离到的菌株A12具有较强的降解AFB 1 的能力,进一步研究表明菌株A12是一株枯草芽孢杆菌,该菌对AFB 1 降解的活性组分存在于胞外上清液中,菌悬液和胞内液对AFB 1 降解率很低。菌株A12上清液对AFB 1 降解能力受到培养时间、温度、pH等因素的影响,当温度为37 ℃、pH 7.0、培养时间为72 h时降解效率最高。目前报道有些细菌能降解AFB 1 ,如嗜麦芽窄食单胞菌( Stenotrophomonas maltophilia ) [17] 、铜绿假单胞菌( Pseudomonas aeruginosa ) [18] 、施氏假单胞菌( Pseudomonas stutzeri ) [19] 、红平红球菌( Rhodococcus erythropolis ) [20] 、橙红色粘球菌( Myxococcus fulvus ) [21] 、厚壁菌( Firmicutes bacterium ) [22] 等菌株,这些菌株如果应用到动物饲料中,还需要对它们安全性进行评价。枯草芽孢杆菌是革兰氏阳性菌,该菌株对人和动物无毒、无害,是农业部准许的可添加到动物饲料中的有益微生物,同时也是国际公认的可直接喂食动物的微生物制品 [23] ,在本研究中菌株A12对污染的花生样品中AFB 1 的降解实验表明该菌能显著降低花生中的AFB 1 。因此,本研究筛选到的高效降解AFB 1 的枯草芽孢杆菌A12具有很大的应用潜力。
目前只有少数研究报道了生物降解AFB 1 的产物成分及其安全性,并且不同微生物降解AFB 1 的产物也不同 [9] 。曹郁生等发现施氏假单胞菌F4能将AFB 1 降解成两种产物,分析发现降解产物无毒性 [24] ;刘大岭等发现假蜜环菌的胞内酶能使AFB 1 的双呋喃环断裂从而降低毒性 [25] 。本研究发现菌株A12能显著降解AFB 1 ,而对其降解产物的组成及产物毒性还未知。因此,后续实验将进行菌株A12降解AFB 1 的产物种类及安全性的研究,为应用该菌降解AFB 1 的安全性提供重要依据。
从青岛土壤中筛选分离到的枯草芽孢杆菌A12具有较强的降解AFB 1 的能力,进一步发现该菌分泌至胞外的活性物质起主导的生物降解作用,而不是细菌细胞壁的吸附作用,菌株A12上清液降解AFB 1 的最适反应温度为37 ℃,最适pH是7.0。枯草芽孢杆菌A12适合添加到动物饲料中,具有很大的应用价值和前景。
参考文献:
[1] MAO J, HE B, ZHANG L X, et al. A structure identification and toxicity assessment of the degradation products of aflatoxin B 1 in peanut oil under UV irradiation[J]. Toxins, 2016, 8: 332-341.
[2] 刘然, 庞广昌. 黄曲霉毒素与食品污染[J]. 食品科技, 2005(9): 34-36.
[3] 李成成, 冯永兵, 王文龙, 等. 黄曲霉毒素对蛋鸡产业潜在的生态和健康风险[J]. 家禽生态学报, 2015(2): 87-90.
[4] 刘畅, 刘阳, 邢福国. 黄曲霉毒素生物学脱毒方法研究进展[J]. 食品科技, 2010, 35: 290-293.
[5] 刘真, 王世清, 肖军霞, 等. 等离子体降解花生中黄曲霉毒素的影响因素[J]. 粮油食品科技, 2016, 24: 44-48.
[6] 李培武, 张道宏, 杨扬, 等. 粮油制品中黄曲霉毒素脱毒研究进展[J]. 中国粮油作物学报, 2010, 32: 315-319.
[7] 李玉鹏, 王世清, 肖军霞, 等. 低温射频等离子体降解农产品中黄曲霉毒素B 1 效果的研究. 粮油食品科技, 2014(5): 54-57.
[8] WOMACK E D, BROWN A E, SPARKS D L. A recent review of non-biological remediation of aflatoxin-contaminated crops [J]. Society of Chemical Industry, 2014, 94: 1706-1714.
[9] 蔡俊, 田尔诺, 邵帅, 等. 黄曲霉毒素B 1 生物脱毒的研究进展[J]. 微生物学通报, 2017, 44: 726-731.
[10] 孙丰芹, 金青哲, 王兴国, 等. 黄曲霉毒素B 1 生物脱毒的研究进展[J]. 粮油食品科技, 2011, 49: 39-41.
[11] 计成, 赵丽红. 黄曲霉毒素生物降解的研究及前景展望[J]. 动物营养学报, 2010, 22: 241-245.
[12] HORMISCH D, BROST I, KOHRING G W, et al. Mycobacterium fluoranthenivorans sp. nov., a fluoranthene and aflatoxin B1 degrading bacterium from contaminated soil of a former coal gas plant[J]. Systematic and Applied Microbiology, 2004, 27: 653-660.
[13] 关心, 何建斌, 董双, 等. 黄曲霉毒素B 1 高效降解菌株的筛选鉴定及其降解[J]. 华中农业大学学报, 2016, 35(2): 90-96.
[14] FRANK J A, REICH C I, SHARMA S, et al. Critical evaluation of two primers commonly used for amplification of bacterial 16S rRNA genes[J]. Applied and Environmental Microbiology, 2008, 74: 2461-2470.
[15] RUIZ-GARÍA C, BÉJAR V, MARTÍNEZ-CHECA F, et al. Bacillus velezensis sp. nov., a surfactant-production bacterium isolated from the river Vélez in Málaga, southern Spain[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55: 191–195.
[16] ROONEY A P, PRICE N P, EHRHARDT C, et al. Phylogeny and molecular taxonomy of the Bacillus subtilis species complex and description of Bacillus subtilis subtilis subsp . Inaquosorum subsp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 2429-2436.
[17] GUAN S, JI C, ZHOU T, et al. Aflatoxin B 1 degradation by Stenotrophomonas maltophilia and other microbes selected using coumarin medium[J]. International Journal of Molecular Sciences, 2008(9): 1489-1503.
[18] SANGARE L, ZHAO Y J, FOLLY Y M E, et al. Aflatoxin B 1 degradation by a Pseudomonas strain[J]. Toxin, 2014(6): 3028- 3040.
[19] 杨文华, 李海星, 刘晓华, 等. 黄曲霉毒素B 1 降解酶的分离纯化及其酶学特征[J]. 食品科学, 2014, 35: 164-168.
[20] KONG Q, ZHAI CP, GUAN B, et al. Mathematic modeling for optimum conditions on aflatoxin B1 degradation by the aerobic bacterium Rhodococcus erythropolis [J]. Toxin, 2012(4): 1181- 1195.
[21] ZHAO L, GUAN S, GAO X, et al. Preparation, purification and characteristics of an aflatoxin degradation enzyme from Myxococcus fulvus ANSM068[J]. Jouranal of Applied Microbiology, 2011, 110: 147-155.
[22] 陈晓飞, 周伏忠, 孙玉飞, 等. 黄曲霉毒素B 1 (AFB 1 )降解菌的筛选鉴定[J]. 河南科学, 2011, 29: 1447-1450.
[23] 孙玲玉, 李超, 郝海玉, 等. 泰山枯草芽孢杆菌的分离鉴定及其对黄曲霉毒素B 1 的降解研究[J]. 中国畜牧兽医, 2014, 41: 246-250.
[24] 李文明. 黄曲霉毒素B 1 生物降解产物的分离鉴定及其致突变性研究[D]. 南昌: 南昌大学, 2013.
[25] CAO H, LIU D L, MO X M, et al. A fungal enzyme with the ability of aflatoxin B 1 conversion: purification and ESI-MS/MS identification[J]. 2011, Microbiological Research, 166: 475-483. 
Screening and identification of aflatoxin B 1 degrading strains
WANG Ming-qing 1 , YU Li-na 1 , ZHANG Chu-shu 1 , BI Jie 1 , SUN Jie 1,2 , Liu Bin 3
(1. Shandong Peanut Research Institute, Qingdao Shandong 266100; 2. Management Committee of West Coast Modern Agricultural Demonstration Area, Qingdao Shandong 266000; 3. Agricultural Quality Standards and Testing Technology Institute, Shandong Academy of Agricultural Sciences, Jinan Shandong 250000)
Abstract: Aflatoxin B 1 (AFB 1 ) is highly toxic and carcinogenic, which seriously endangers human and animal health. The aflatoxin degradation strains were screened from the soil through enrichment culture, initial screening and rescreening, and the efficient degradation strain was identified and the degradation characteristics were studied. The results showed that the selected strains could degrade AFB 1 , and the strain A12 was the most efficient one, which was identified as bacillus subtilis, named as Bacillus subtilis subsp. Inaquosorum A12, by morphological, physiological and biochemical analyses and the evolution of 16S rRNA gene system. The degradation rate of supernatant, bacterial suspension, and intracellular fluid of A12 were 87.6%, 17.3% and 10.8% AFB 1 , respectively. The results indicated that degradation activity of strain A12 was located in extracellular fluid, and the optimal reaction temperature and pH value for degradation of AFB 1 by supernatant were 37 ℃ and 7.0, respectively. The AFB 1 content could be significantly reduced by inoculating strain A12 to peanut sample contaminated by AFB 1 . This study laid a foundation for the biological detoxification of AFB 1 by strain A12.
Key words: aflatoxin B 1 ; screen; strain; degradation; identification
DOI: 10.16210/j.cnki.1007-7561.2018.05.012
中图分类号: TS 207.4; Q 939.11 + 2
文献标识码: A
文章编号: 1007-7561(2018)05-0063-07
收稿日期: 2018-04-25
基金项目: 山东省自然科学基金(ZR2016CM43、ZR2017MC060、ZR2016YL021、ZR2017MC062);山东省农业科学院重大科技成果培育计划(2016CGPY10);山东省农业科学院农业科技创新工程(CXGC2016B17,CXGC2018E21);山东省2018年度农业重大应用技术创新项目
作者简介: 王明清,1981年出生,男,博士,助理研究员.
通讯作者: 孙杰,1981年出生,博士,副研究员.