表1 雨生红球藻氨基酸组分 [3] g/100 g
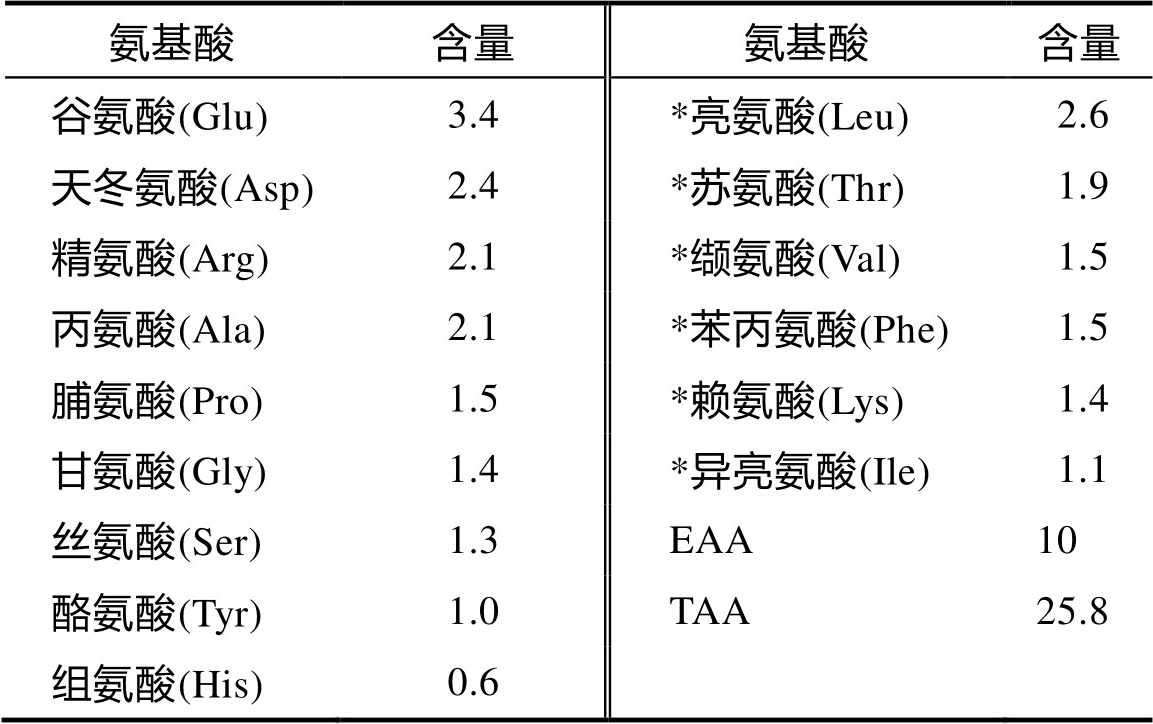
氨基酸含量氨基酸含量 谷氨酸(Glu)3.4*亮氨酸(Leu)2.6 天冬氨酸(Asp)2.4*苏氨酸(Thr)1.9 精氨酸(Arg)2.1*缬氨酸(Val)1.5 丙氨酸(Ala)2.1*苯丙氨酸(Phe)1.5 脯氨酸(Pro)1.5*赖氨酸(Lys)1.4 甘氨酸(Gly)1.4*异亮氨酸(Ile)1.1 丝氨酸(Ser)1.3EAA10 酪氨酸(Tyr)1.0TAA25.8 组氨酸(His)0.6
邱 月,赵晓燕,刘红开,张桂香,张晓伟,朱海涛
(济南大学 烹饪学院,山东 济南 250022)
摘 要: 雨生红球藻作为新资源食品,不仅是天然虾青素的“浓缩品”,还是一种潜在的蛋白资源。藻蛋白具有抗氧化、降血压、抗肿瘤、抗血栓、免疫调节活性等作用,将在食品、保健品、医药学、染料等领域有广阔的发展前景。目前,雨生红球藻多用于虾青素的研究,蛋白资源开发利用较少。综述了雨生红球藻中蛋白质的分类、组成、制备方法、生物活性以及应用,旨在为雨生红球藻蛋白相关产品的开发提供参考。
关键词: 雨生红球藻蛋白;制备;组成;活性;应用
雨生红球藻是一种淡水单细胞绿藻,于2010年被我国批准为新资源食品,是科学界目前发现的继螺旋藻、小球藻之后,又一富含营养价值和药用价值的经济微藻。藻类是蛋白质的一个重要来源。有研究表明,蓝藻中蛋白质含量能达到71%,绿海藻或红海藻次之,为10%~47%,棕海藻的蛋白质含量略低,为干物质的3%~15% [1-2] 。在欧洲,藻类已被开发成一种新型的功能性食品,藻蛋白所具备的抗氧化、降血压、抗肿瘤、抗血栓等一系列营养保健功能,推动其成为食品、保健品、医药等领域的研究热点。
迄今为止,国内外学者对雨生红球藻成分的研究大多集中在虾青素以及多糖,而忽略了藻蛋白的研究。雨生红球藻中粗蛋白含量约为26% [3] ,必需氨基酸模式与联合国粮农组织(FAO)和世界卫生组织(WHO)提出的理想模式相接近,是一种潜在的蛋白质来源。红球藻中的藻蛋白可从提取完虾青素后废弃的藻渣中提取,提高其附加价值和综合利用程度。本文就目前雨生红球藻中藻蛋白的分类、组成、制备方法、生物活性及藻蛋白的应用现状进行综述,以期为雨生红球藻蛋白相关产品的研发提供有力支持。
根据吸收波长,将藻蛋白分为四类:藻红蛋白(PE, λ max 490~570 nm)、藻红蓝蛋白(PEC, λ max 560~600 nm)、藻蓝蛋白(PC, λ max 610~ 625 nm)和别藻蓝蛋白(APC, λ max 650~660 nm),统称为藻胆蛋白(PBP)。藻胆蛋白是一种水溶性色素蛋白,由脱辅基蛋白和藻胆素(PB,发色团)通过硫醚键连接而成,其作为主要的捕光复合物,可吸收470~660 nm的可见光,能有效地将能量转移到叶绿素A [4-5] 。PBP的种类因藻种不同而表现出一定的差异性,红藻、蓝藻中主要存在PE、PC及APC,隐藻中只含有PE和PC。国外已有学者对雨生红球藻中的可溶性蛋白质进行了初步研究,该可溶性蛋白具体含有何种藻胆蛋白仍需要进一步研究。
目前为止,雨生红球藻中藻胆蛋白的相关报道极少,尤其是关于藻胆蛋白结构的研究仍处于空白阶段,但已有大量实验成果证明藻胆蛋白的三维结构均具有高度相似性。藻胆蛋白属于多亚基蛋白质,基本结构单位是α和β两个亚基,α亚基(12~20 kDa)通常小于β亚基(15~22 kDa) [6] ,此外,藻红蛋白中还存在一种特殊的γ亚基(30 kDa)。每个亚基由1个脱辅基蛋白和1~5个色素基团构成。α和β亚基组成结构单体αβ,在红藻和蓝藻中一般以稳固的三聚体(αβ) 3 或六聚体(αβ) 6 的形式存在。γ亚基作为连接多肽可连接两个三聚体,以(αβ) 3- γ-(αβ) 3 的聚集状态存在。色素基团的分子结构,与脱辅基蛋白的连接位置、连接方式,亚基的组成及聚集状态等使得藻胆蛋白的结构各异。
由表1可知,雨生红球藻中共检测出15种氨基酸,其中必需氨基酸6种,达到氨基酸总含量的近39%,与FAO/WHO提出的EAA/TAA为40%极为相近。谷氨酸含量最多,其次是亮氨酸和天冬氨酸。谷氨酸和天冬氨酸是两种鲜味物质,可赋予食物浓郁的风味。有研究表明,藻类中除含有一般的氨基酸外,还含有褐藻氨酸、软骨藻酸、牛磺酸等具有特殊功能的氨基酸 [7] 。
表1 雨生红球藻氨基酸组分 [3] g/100 g

注:*指必需氨基酸;EAA指必需氨基酸总含量;TAA指总氨基酸含量。必需氨基酸与总氨基酸含量的百分比为38.76%。
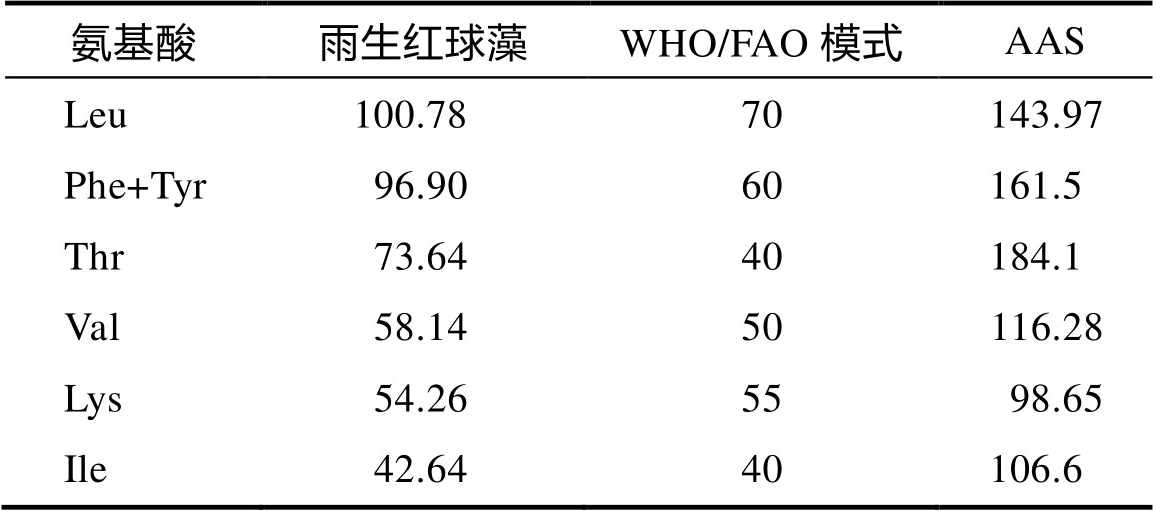
蛋白质的优劣取决于蛋白含量、氨基酸组成和必需氨基酸的平衡状态。氨基酸评分(AAS)是鉴定蛋白质品质的重要指标,评分值越接近100,说明待测模式与参考模式越相似,越符合人体需求,营养价值越高。由表2数据分析可知,Val、Lys、Ile的评分接近100,与WHO/FAO提出的建议模式相似,易于被人体吸收利用,Leu、Thr、Phe+Tyr均高于理想模式。因此,雨生红球藻是一种良好的蛋白质来源,可与缺乏Leu、Thr、Phe+Tyr的食物合理搭配,提高蛋白质的生物价。
表2 雨生红球藻中蛋白质的氨基酸评分
由于雨生红球藻细胞壁表现出一定的刚性,必须先破碎藻细胞,在保持蛋白活性的前提下获得粗提液,因此细胞破壁技术的选择尤为重要,将为后期获得高纯度藻蛋白奠定基础。藻细胞破壁技术主要有珠磨法、低温高压法、溶胀法、超声波法、反复冻融法、高压匀浆法等 [8-12] ,各破壁工艺、特点及所得蛋白溶出率见表3。
表3 雨生红球藻的破壁方法

藻蛋白相关产品若要实现工业化生产,势必要进行藻细胞的大量处理。然而上述破壁技术都存在一定的局限性,通常将多种方法混合使用以弥补单一方法的不足。由表3可看出,高压匀浆法蛋白质提取量大,能满足工业化需求。该法与酶解技术结合能降解藻细胞壁的部分纤维素,有效改善破壁过程中存在的问题,进一步提高蛋白质提取率 [13] 。
细胞破壁后,藻蛋白及其它物质一起溶出,此时蛋白纯度略低,仍需要进一步分离纯化,才能达到商品级应用标准,实现应用价值。藻蛋白提纯中常用的方法有盐析法、超滤法、壳聚糖亲和沉淀、羟基磷灰石柱层析法、离子交换层析法、反胶束法、双水相萃取法等。
3.2.1 盐析法
向藻蛋白粗提液中加入一定浓度的盐溶液使其溶解度降低而析出,现多采用硫酸铵沉淀。姚兴存等 [14] 向紫菜藻胆蛋白粗提溶液中加入(NH 4 ) 2 SO 4 粉末进行提纯,所得蛋白纯度较低。王巍杰等 [15] 研究证明六步最佳盐(硫酸铵)析比一步硫酸铵沉淀所得藻蛋白纯度要高。该法成本低,操作简单,不破坏蛋白质的构象,但蛋白纯度不高,只适用于蛋白的初步分离纯化。
3.2.2 超滤法
超滤技术的关键是超滤膜。无机盐、小分子蛋白质以及小分子藻毒素等杂质可通过膜的筛分作用被除去,从而提高藻蛋白纯度和安全性。有学者研究得出聚醚砜30 kDa是最适合的膜,可回收100%的R-藻红蛋白 [16] 。将超滤和低温静置离心法结合能进一步提高蛋白纯度,且纯化后的蛋白为无毒级 [17] 。该方法具有能耗低、成本低、提取率高的优点,且所提藻蛋白安全无毒,但同样只适用于蛋白质的预纯化。
3.2.3 壳聚糖亲和沉淀
壳聚糖由于末端氨基质子化,对pH比较敏感,当pH大于6.5时,壳聚糖能与带负电的蛋白质产生较强的吸附作用而沉淀。剡吴霞 [18] 向藻蓝蛋白粗提液中加入壳聚糖溶液,将pH调至6.9,使壳聚糖与杂蛋白亲和沉淀达到提纯的目的。该法在藻蛋白提取过程中常与盐析法、活性炭吸附和DEAE Sephadex A-25柱层析法共同使用,加入少量的壳聚糖溶液就能显著提高蛋白纯度 [19] 。壳聚糖价廉易得、无污染、具有可生物降解性,能提高产品得率,反应条件温和,蛋白不易变性。
3.2.4 羟基磷灰石柱层析法
于光等 [20] 用价格低廉的羟基磷灰石(HA)作为色谱填充料提纯出具有光敏作用的C - 藻蓝蛋白。该技术具有良好的分离性能,可作为制备色谱,易于放大,但由于HA吸附容量有限,所以洗脱出的目标蛋白含量不多,且耗时较长,易造成蛋白质的变性。此外,离子交换层析技术不断发展,逐渐取代了HA柱层析,加快了藻蛋白提取进程。
3.2.5 离子交换层析法
离子交换层析法(IEC)是在一定pH条件下,使用离子交换剂作为吸附剂,将溶液中的待分离组分依据电荷差异进行分离的方法。Liu等 [21] 根据藻红蛋白的等电点进行pH梯度洗脱,仅用 DEAE-Sepharose Fast flow一步层析,就将藻红蛋白纯度从1.402提高至5.6。离子交换层析法优点在于适用性强、处理量大、纯化时间较短、易于操作等,已逐渐成为蛋白质分离纯化的常用技术之一。
3.2.6 反胶束法
反胶束萃取法是一项有潜能的生物物质分离技术,为蛋白质产品实现工业化生产开辟了新途径。丁皓等 [22] 构建了十六烷基三甲基溴化铵(CTAB)/正辛烷—正戊醇反胶束体系,采用反胶束法和水合物生成相结合的分离技术提取藻蓝蛋白,提取率明显提高。反胶束法成本较低,处理量大,且萃取率高,溶剂能反复利用,在蛋白提取方面有着良好的发展前景。
3.2.7 双水相萃取法
双水相萃取法(ATPE)能在一定条件下将水溶性蛋白质等生物活性物质由一个水相转移至另一水相中。最常用的双水相体系为聚乙二醇/磷酸盐,藻蛋白富集在顶部相被回收,相分离可采用重力沉降和离心沉降法。双水相体系的选择、两相的质量分数、系线长度等都将影响双水相体系的性能 [23] 。双水相体系操作简单、分相时间短、回收率高,且反应条件温和,蛋白活性高,易于放大。
藻蛋白的构象与生理功能有着密切的联系,由于藻类中藻胆蛋白的结构都具有相似性,因此可以推测雨生红球藻藻蛋白具有与其它藻类蛋白相似的生物活性。表4列出了藻蛋白生物活性相关研究进展。
表4 藻蛋白的生物活性

雨生红球藻中蛋白资源丰富,氨基酸种类多样,是潜在的优质蛋白质来源。藻蛋白具有抗氧化、降血压、抗血栓等多种生理活性,对于延缓衰老和疾病防控方面具有较好的效果,在营养保健方面用途广泛。藻胆蛋白中的藻胆素是纯天然的植物色素,在食物中不仅起到着色和营养功能,还能引起流变性质的变化 [37] 。藻胆蛋白有着独特的特征激发光谱,可制成荧光探针,其中藻红蛋白探针具有消光系数大、量子产率高等优点,在免疫荧光检测中表现出较好的特异性和灵敏性,对于动物疫病的预防和控制作用显著 [38] 。藻胆蛋白还是一种新型光敏剂,与传统光敏剂相比,藻蓝蛋白具有更强的组织穿透性,光动力毒杀效果更好 [39] ,聚乙二醇(PEG)脂质体能增强藻蓝蛋白亚基在肿瘤细胞聚集的靶向性,提高光动力疗效 [40] 。
藻蛋白作为具备多种生物活性的天然色素蛋白,已经引起了科研人员的重视,被应用于食品、保健品、医学、染料等众多行业,但研究对象多集中于螺旋藻、小球藻等。我国对于雨生红球藻的研究基础比较薄弱,竞争环境相对宽松,具有较广阔的发展前景。20世纪90年代,国内外科研人员已致力于雨生红球藻的大规模养殖,并主要用于虾青素的研究,但对藻蛋白开发利用的力度和深度极其有限。本文对雨生红球藻中蛋白质的组成、制备、生物活性等进行了综述,为后期雨生红球藻中蛋白质产品的开发奠定一定基础。
参考文献:
[1] Becker W. Handbook of microalgal culture: biotechnology and applied phycology[M]. New York: Wiley, 2004: 312-351.
[2] 陶冉, 位正鹏, 崔蓉, 等. 藻类色素蛋白的资源开发和应用研究[J]. 食品科技, 2010, 31(9): 377-380.
[3] Ba F, Ursu A V, Laroche C, et al. Haematococcus pluvialis soluble proteins: Extraction, characterization, concentration/ fractionation and emulsifying properties[J]. Bioresource Technology, 2016, 200:147-152.
[4] Viskari P J, Colyer C L. Rapid extraction of phycobiliproteins from cultured cyanobacteria samples[J]. Analytical Biochemistry, 2003, 319(2): 263-271.
[5] Viskari P J, Kinkade C S, Colyer C L. Determination of phycobiliproteins by capillary electrophoresis with laser induced fluorescence detection[J]. Electrophoresis, 2001(22): 2327-2335.
[6] Sinha R P, Lebert M, Kumar A, et al. Spectroscopic and biochemical analyses of UV effect on phycobiliprotein of Anabena sp. and Nostoc carmium[J]. Bot Acta, 1995, 108: 87-92.
[7] 闫秋丽, 郭兴凤. 海藻蛋白研究及应用进展[J]. 食品研究与开发, 2008, 29(1): 179-182.
[8] Schwenzfeier A, Wierenga P A, Gruppen H. Isolation and characterization of soluble protein from the green microalgae Tetraselmis sp[J]. Bioresource Technology, 2011, 102 (19): 9121-9127.
[9] Wang X, Zhang X. Optimal extraction and hydrolysis of Chlorella pyrenoidosa proteins[J]. Bioresource Technology, 2012, 126: 307-313.
[10] 张少斌, 依晓楠, 林英, 等. 螺旋藻藻胆蛋白不同提取方法的比较[J]. 吉林农业大学学报, 2007, 29(4): 381-383.
[11] 刘立闯, 胡志和, 贾静, 等. 螺旋藻蛋白提取方法比较研究[J]. 食品科学, 2008, 29(11): 228-233.
[12] 吴蕾, 庞广昌, 陈庆森. 高压匀浆破碎螺旋藻细胞释放藻蛋白的研究[J]. 食品科学, 2008, 29(3): 43-45.
[13] 余绍蕾, 杜伟春, 鸭乔. 酶解结合物理法对雨生红球藻破壁处理的工艺研究[J]. 食品工程, 2016, 30(4): 38-40.
[14] 姚兴存, 舒留泉, 贾维宝, 等. 紫菜藻胆蛋白的制备及其体外模拟消化研究[J]. 食品与生物技术学报, 2014, 33(4): 403-408.
[15] 王巍杰, 徐长波, 程红燕. 盐析法分离藻蓝蛋白的研究[J]. 食品科技, 2010, 35(5): 238-241.
[16] Denis C, Mass A, Fleurence J, et al. Concentration and pre-purification with ultrafiltration of a R-phycoerythrin solution extracted from macro-algae Grateloupia turuturu:Process definition and up-scaling[J]. Separation and Purification Technology, 2009, 69(1): 37-42.
[17] 沈强, 沈银武, 刘永定, 等. 滇池水华蓝藻藻蓝蛋白的分离纯化与毒性研究[J]. 环境化学, 2009, 28(4): 497-501.
[18] 剡吴霞. 螺旋藻蛋白的分离方法研究[D]. 重庆: 重庆工商大学, 2012.
[19] 廖晓霞, 张学武. 高效分离纯化藻蓝蛋白新法[J]. 食品工业科技, 2011, 32(6): 273-275, 280.
[20] 于光, 马宇翔, 张成武, 等. 盐泽螺旋藻藻蓝蛋白的分离纯化[J]. 食品与生物技术学报, 2009, 28(4): 521-524.
[21] Liu L N, Chen X L, Zhang X Y, et al. One-stepchroma to graphyneth-odfor efficient separation and purification of R-phycoery thrin from Poly siphoniaur ceolata[J]. Journal of Biotechnology, 2005, 116(1): 91-100.
[22] 丁皓, 裘俊红. 反胶束水合萃取藻蓝蛋白研究[J]. 浙江工业大学学报, 2011, 39(4): 372-375.
[23] Benavides J, Rito-Palomares M. Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum[J]. Journal of Chromatography B, 2006, 844(1): 39-44.
[24] Romay C, Armesto J, Remirez D, et al. Antioxidant and anti-inflammatory properties of C-phycocyanin from blue-green algae[J]. Inflammation research, 1998, 47(1): 36-41.
[25] Fernández-Rojas B, Hernández-Juárez J, Pedraza- Chaverri J. Nutraceutical properties of phycocyanin[J]. Journal of Functional Foods, 2014, 11: 375-392.
[26] Dejsungkranont M, Chen H H, Sirisansaneeyakul S. Enhancement of antioxidant activity of C-phycocyanin of Spirulina powder treated with supercritical fluid carbon dioxide[J]. Agriculture and Natural Resources, 2017: 1-8.
[27] Pleonsil P, Soogarun S, Suwanwong Y, et al. Anti-oxidant activity of holo-and apo-c-phycocyanin and their protective effects on human erythrocytes[J]. International Journal of Biological Macromolecules, 2013, 60: 393-398.
[28] 刘立闯, 胡志和, 张艳. 螺旋藻蛋白及其水解产物对原发性高血压大鼠血压的影响[J]. 食品科学, 2009, 30(19): 276-278.
[29] 姚兴存, 蒋栋磊, 盘赛昆, 等. 条斑紫菜蛋白酶解物降血压活性[J]. 食品与发酵工业, 2011, 37(2): 62-64, 69.
[30] Ichimura M, Kato S, Tsuneyama K, et al. Phycocyanin prevents hypertension and low serum adiponectin level in a rat model of metabolic syndrome[J]. Nutrition Research, 2013, 33(5): 397-405.
[31] 伍强. 藻红蛋白生物活性肽的分离纯化及其性质分析[D]. 厦门: 集美大学, 2015.
[32] 杨帆. 藻蓝蛋白联合全反式维甲酸抗肿瘤分子机制研究[D]. 青岛: 青岛大学, 2014.
[33] 李小花. 螺旋藻激酶抗凝和溶栓作用的实验研究[D]. 南宁: 广西医科大学, 2009.
[34] 赵杰, 庞辉, 李想, 等. 螺旋藻激酶对内皮损伤大鼠纤溶酶原和抗凝血酶Ⅲ的影响[J]. 中国老年学杂志, 2017, 37(12): 2880-2881.
[35] Hsiao-Wei C, Tsung-Shi Y, Mao-Jing C, et al. Purification and immunomodulating activity of C-phycocyanin from Spirulinaplatensiscultured using power plant flue gas[J]. Process Biochemistry, 2014, 49: 1337-1344.
[36] Cheng C, Xu H, Li W, et al. Nostoc sphaeroides phycobiliprotein enhances immune functions in mice[J]. Food Science, 2016, 37(5): 167-174.
[37] Christaki E, Bonos E, Panagiota F P. Innovative Microalgae Pigments as Functional Ingredients in Nutrition[M]. Elsevier Inc, 2015: 233-243.
[38] 吴昌义. 藻胆蛋白荧光探针在动物疫病检测中的应用展望[J]. 当代畜牧, 2017(14): 50-51.
[39] 彭慕华. 微囊藻藻胆蛋白对微生物的光敏杀伤研究[D]. 合肥: 安徽大学, 2015.
[40] 周桃, 黄蓓, 左漫漫, 等. PEG脂质体增强藻蓝蛋白亚基对乳腺癌细胞光毒性的研究(英文)[J]. 中国科学技术大学学报, 2011, 41(1): 35-44. 
Research progress and application of haematococcus pluvialis protein
QIU Yue, ZHAO Xiao-yan, LIU Hong-kai, ZHANG Gui-xiang, ZHANG Xiao-wei, ZHU Hai-tao
(Culinary School, Jinan University, Jinan Shandong 250022)
Abstract: Haematococcus pluvialis ,as an important new resource food, not only is a " concentrated product " of natural astaxanthin, but also a potential protein source. Algae proteins have a variety of biological activities, such as anti-oxidation, reducing blood pressure, anti-tumor, antithrombosis and immune regulation. It will have broad prospects for development in the fields of food, health care products, medicine and dyes. At present, the haematococcus pluvialis is chiefly used for astaxanthin, which results in less application of protein source. The classification, composition, preparation method, biological activity, and application of haematococcus pluvialis proteinwere described in order to provide a scientific basis for the development of protein products in haematococcus pluvialis .
Key words: haematococcus pluvialis protein; preparation; composition; active; application
DOI: 10.16210/j.cnki.1007-7561.2018.05.008
中图分类号: TS 201.2 + 1; S 985.4
文献标识码: A
文章编号: 1007-7561(2018)05-0042-06
收稿日期: 2018-03-27
基金项目: 国家自然科学基金(21406133);国家科技支撑计划(2015BAD29B04)
作者简介: 邱月,1994年出生,女,硕士研究生.
通讯作者: 赵晓燕,女,博士,硕士生导师.