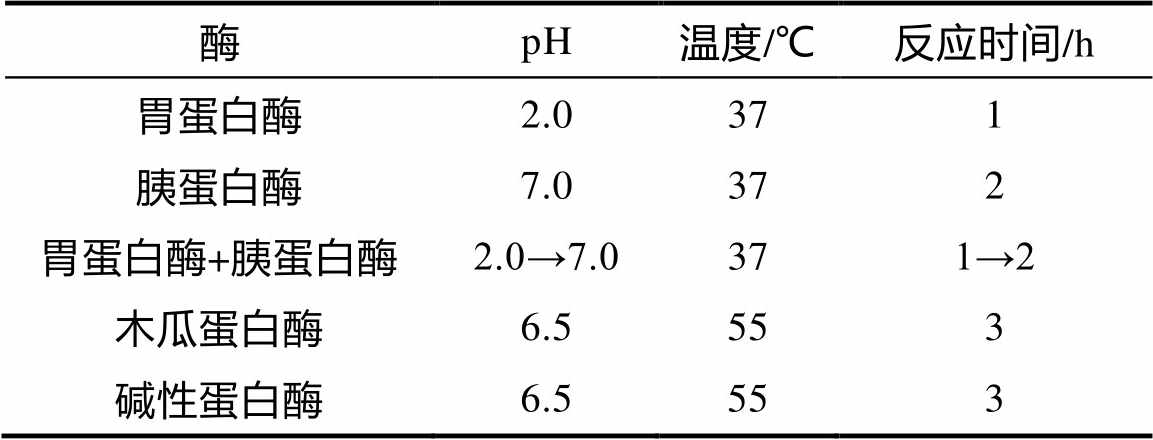
表1 不同蛋白酶酶解苦荞蛋白条件
吴伟菁 1,2 ,纪美茹 1 ,李再贵 2
(1. 厦门医学院,福建 厦门 361023;2. 中国农业大学,北京 100083)
摘 要: 以苦荞蛋白作为底物,采用碱性蛋白酶Alcalase 2.4 L、木瓜蛋白酶、胃蛋白酶、胰蛋白酶以及胃蛋白酶加胰蛋白酶模拟体内蛋白消化,制备苦荞麦蛋白水解物。采用DPPH及ABTS + ·法比较不同的蛋白水解物与水解前苦荞蛋白的体外抗氧化活性。结果表明:不同蛋白酶水解产物水解度由高到低的顺序为:碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>木瓜蛋白酶>胰蛋白酶,其中碱性蛋白酶水解苦荞蛋白水解度达29.95%。苦荞蛋白本身具有一定的抗氧化能力,其中DPPH清除率及ABTS + ·清除率最高分别达71.91%及11.25%,但均显著低于阳性对照Vc。随着水解程度的增加,苦荞蛋白水解产物抗氧化能力逐渐增强。其中,以碱性蛋白酶酶解产物抗氧化活性最高,其DPPH清除率及ABTS + ·清除率最高分别为91.65%(0.5 mg/mL)及16.67% (1 mg/mL),均显著高于原苦荞蛋白。其中,碱性蛋白酶水解产物的DPPH自由基清除率在高浓度(>0.5 mg/mL)条件下,与阳性对照Vc持平。同时碱性蛋白酶酶解产物抗氧化性(DPPH清除率及ABTS + ·清除率)显著优于其他蛋白酶解产物。因此,苦荞麦蛋白采用碱性蛋白酶解制备苦荞水解产物可作为天然的抗氧化剂。
关键词: 苦荞蛋白;水解;蛋白酶;抗氧化
苦荞( FagopyrumtataricumL.Gaertn ),又称鞑靼荞麦(Tartary buckwheat),是一种药食两用的植物,具有较高的营养价值和保健功能 [1] 。其中,荞麦蛋白作为苦荞中重要活性物质,具有降胆固醇 [2] 、抗菌 [3] 、抗癌 [4] 、抗氧化 [5] 、抗高血压 [6] 等作用。研究表明,水解能够改善蛋白的功能特 性 [5-9] ,因而苦荞蛋白水解物有较大的应用价值和开发潜力。不同的蛋白酶水解蛋白质的位点不同,因此其水解程度也不同。人体摄入蛋白时以寡肽形式为主经过消化道吸收。一些寡肽能够以完整地被肌体吸收,进入血液循环,被组织所利用 [10] 。对于苦荞蛋白多肽的制备,已经报道的研究有采用碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、枯草杆菌蛋白酶(Alcalase 2.4 L)、protamex酶、flavourzyme蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶,以及模拟体内蛋白酶水解等进行蛋白水解,并进行一定的优化获得最佳水解工艺 [11-14] 。但是,现有的研究主要集中在单一酶解条件优化,对于不同蛋白酶水解及模拟体内消化后的蛋白水解产物抗氧化性质的研究比较少。为了明确苦荞蛋白及不同苦荞蛋白酶解产物的抗氧化活性的区别,本研究以体外抗氧化能力(DPPH及ABTS + ·自由基清除能力)为评价指标,评价不同蛋白酶水解的苦荞蛋白产物的抗氧化活性,为苦荞蛋白多肽的应用提供依据。
苦荞粉:西荞2号,四川凉山;碱性蛋白酶( Alcalase 2.4 L 2.4 L, ≥2.4 AU/g):Sigma公司;胰蛋白酶(250 U/mg):Amresco公司;胃蛋白酶(1 200 U/g):国药化学试剂;木瓜蛋白酶 (800 U/mg):上海源叶公司;1,1二苯基-2-苦基肼(DPPH):日本TCI公司;总抗氧化能力检测试剂盒(ABTS快速法):上海碧云天公司;Bradford 蛋白定量试剂盒:索莱宝公司;其他试剂均为分析纯。
IKA EUROSTAR 20顶置搅拌器:德国艾卡公司;EYELA PS-1000磁力水浴锅:日本东京理化器械株式会所;Thermo Orion Star pH计:美国赛默飞世尔科技公司;Beckman JXN30/26大型离心机:美国贝克曼库尔特公司;Chirst Alpha 2-4冷冻干燥机:德国Chirst公司;Tecan Infinite M1000 Pro酶标仪:瑞士帝肯公司;Bio-rad电泳仪:美国伯乐公司。
1.3.1 苦荞蛋白的制备及纯度测定
苦荞全粉按料液比(1∶5, w/w)加入石油醚,常温搅拌24 h进行脱脂,过滤后,再进行一次脱脂处理。脱脂后苦荞全粉置于通风橱内,过夜干燥。脱脂后的苦荞全粉按照料液比(1∶10, w/w)加入去离子水,用4 NNaOH将pH调节为8.0,搅拌2 h。将苦荞全粉悬浊液离心 (5 500 r/min) 20 min,收集上清液,沉淀按上述方法用pH 8.0 的去离子水复提一次。合并二次上清后,将上清液pH调整为蛋白等电点pH 4.5。离心(5 500 r/min)20 min,收集沉淀,即为苦荞蛋白提取物。苦荞蛋白提取物加水复溶,pH 调节为7.0,冷冻干燥,获得苦荞蛋白。
苦荞蛋白纯度采用Bradford蛋白试剂盒进行测定。将一定质量的苦荞蛋白定容于0.05N NaOH溶液。取一定量样品液,按蛋白测定试剂盒说明书操作,测定样品液蛋白浓度,计算苦荞冻干粉蛋白纯度。
1.3.2 蛋白水解物的制备
精确配制苦荞蛋白悬浊液(2%,w/v),常温搅拌1h充分溶解蛋白。将悬浊液调整为不同pH,置于恒温磁力搅拌水浴锅内,按酶与底物比5%(w/w)加入对应蛋白酶。如表1所示,在不同的温度及时间条件下对苦荞蛋白进行酶解。反应结束后,于90 ℃下加热15 min灭酶。酶解产物冷却后离心(5 500 r/min, 10 min),收集上清液。
表1 不同蛋白酶酶解苦荞蛋白条件

1.3.3 蛋白水解度测定及凝胶电泳分析
1.3.3.1 蛋白水解度 蛋白水解度测定方法采用甲醛滴定法 [15] 。
1.3.3.2 凝胶电泳(SDS-PAGE)为了了解苦荞蛋白酶解后蛋白质量变化,采用12%丙烯酰胺分离胶的SDS-PAGE进行蛋白及水解产物的分析,辅助了解蛋白酶解过程。将酶解前的苦荞蛋白及不同蛋白水解物溶液调整为相同蛋白浓度。蛋白溶液与电泳上样缓冲混合,95 ℃加热5 min。蛋白上样量20 μg。分离后的蛋白条带采用考马斯亮蓝R-250进行染色。
1.3.4 苦荞蛋白酶解产物体外抗氧化特性
1.3.4.1 苦荞蛋白酶解产物对DPPH 自由基清除能力 新鲜配制1 mM的DPPH无水乙醇溶液,避光冷藏放置。使用前用无水乙醇稀释至 0.2 mM。将样品分别稀释成不同浓度,以抗坏血酸V C 作为阳性对照。将100 μL样品溶液和等体积 0.2 mM DPPH溶液混合,在30 ℃条件下避光反应30 min,于517 nm处测定吸光值。
DPPH自由基清除能力/%=( A 对照 - A 样品 )/ A 对照
1.3.4.2 苦荞蛋白酶解产物总抗氧化能力(ABTS快速法) 根据试剂盒方法,取ABTS + ·溶液,过氧化氢溶液及检测缓冲液配制ABTS + ·工作液。取20 μL过氧化物酶工作液加入10 μL样品,混匀,加入170 μL ABTS + ·工作液,轻轻混匀,室温孵育6 min,在414 nm下测定吸光值,以V C 作为阳性对照,计算ABTS + ·自由基清除率。
ABTS + ·自由基清除能力/%=( A 对照 - A 样品 )/ A 对照
1.3.5 统计分析
统计分析采用SPSS 24.0 统计软件进行。实验数据用均数±标准差 (Mean±SD)表示。多组之间的比较采用单因素方差分析(One-Way ANOVA),事后比较采用图基分析。以 p <0.05为具有统计学显著性差异。
苦荞蛋白经过石油醚脱脂除去脂类,黄酮类等小分子物质。采用碱提等电点沉淀方法获取灰绿色苦荞蛋白提取物,提取量约为7.4%。经过测定,提取的苦荞蛋白纯度达84.37%±1.28%。
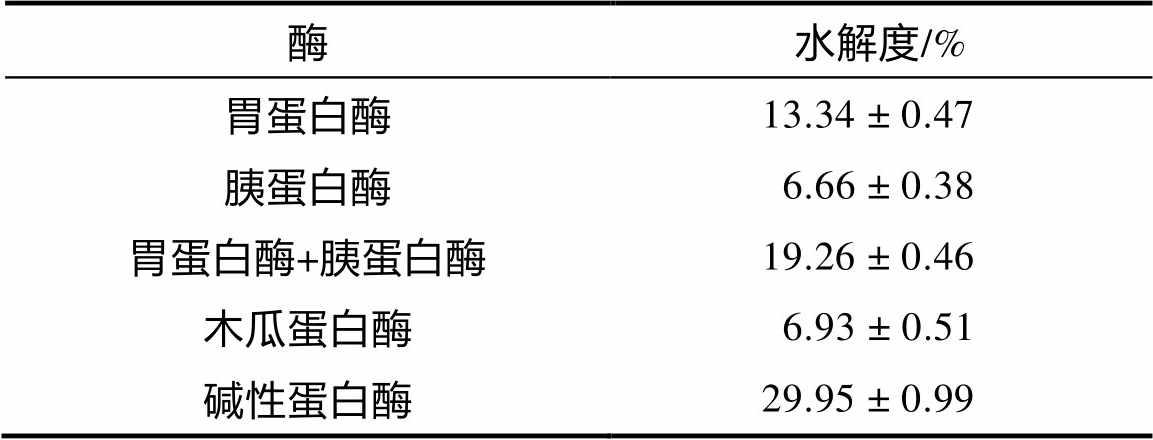
不同蛋白酶对苦荞蛋白进行水解,结果的水解度如表2所示。不同蛋白酶水解产物水解度由高到低为:碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>木瓜蛋白酶>胰蛋白酶。而碱性蛋白酶对于苦荞蛋白的水解程度较高,结果与之前报道相似 [17] 。苦荞蛋白模拟体内消化采用胃蛋白酶+胰蛋白酶,而二者对苦荞蛋白酶解程度有限。有研究指出,苦荞蛋白体外消化率偏低,主要是由于蛋白质结构本身造成 [16] 。
表2 不同蛋白酶对苦荞蛋白水解度的影响
进一步通过SDS-PAGE图谱分析脱脂苦荞蛋白及水解产物的分子量变化。如图1所示,苦荞蛋白于66.2~14.4 kDa之间有5个主要蛋白条带,与之前报道相似 [18] 。经过水解后,碱性蛋白酶(Alcalase 2.4 L)水解产物在66.2~14.4 kDa之间无条带,表明苦荞蛋白已经被酶解。酶解后的苦荞蛋白质降解为小分子肽段,分子量均在14.4 kDa以下。胃蛋白酶联合胰蛋白酶模拟体内消化水解程度次之,在14.4 kDa之间仅存1个主要条带。胃蛋白酶水解程度较胰蛋白酶水解程度较大,因此,在模拟体内消化条件下,胃蛋白酶起主要的蛋白水解作用。胰蛋白酶及木瓜蛋白酶水解程度较低,水解的蛋白条带也略有不同。研究结果与已有研究报告相似 [17,19] ,碱性蛋白酶对于苦荞蛋白水解能力比其他蛋白酶强,木瓜蛋白酶及胰蛋白酶对苦荞蛋白的水解能力较低。根据水解程度,抗氧化能力的测定选择水解度较高的碱性蛋白酶,胃蛋白酶,及胃蛋白酶联合胰蛋白酶水解产物。
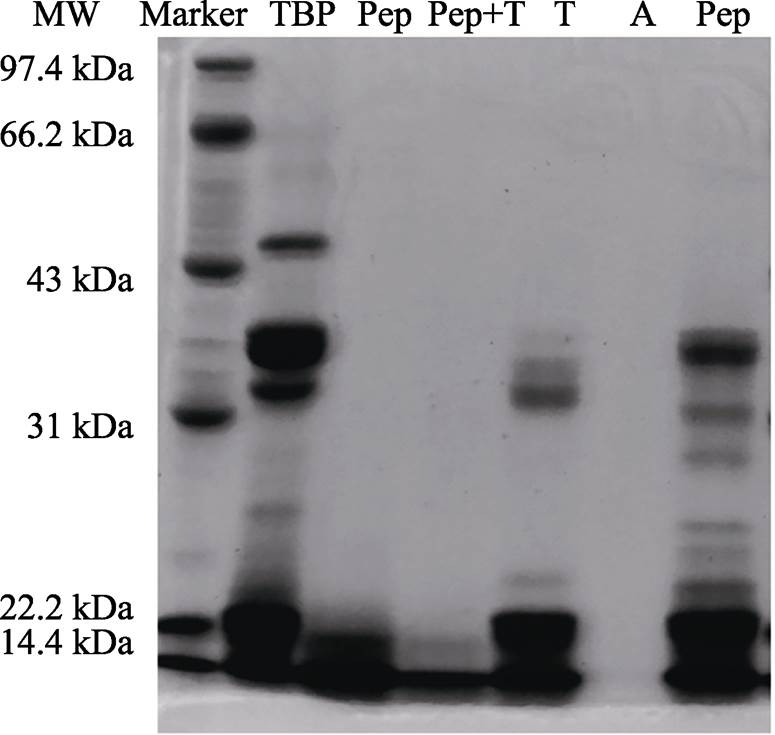
TBP 苦荞蛋白提取物;Pep胃蛋白酶水解产物;Pep+T胃蛋白酶及胰蛋白酶联合水解产物;T胰蛋白酶水解产物;A碱性蛋白酶(Alcalase 2.4 L)水解产物;Pap木瓜蛋白酶水解产物
图1 苦荞蛋白及水解产物SDS-PAGE图谱
如图2 所示,水解前苦荞蛋白具有一定的清除DPPH能力,水解前苦荞蛋白的DPPH清除率最高达71.91%±2.23%(1 mg/mL),但清除DPPH能力显著低于阳性对照Vc。在低浓度条件下 (0.1 mg/mL),苦荞蛋白水解产物抗氧化能力均显著弱于水解前的苦荞蛋白,并且显著弱于阳性对照Vc。而不同蛋白酶水解产物的清除DPPH能力随着浓度的增加有所提高。在高浓度条件下(>0.5 mg/mL),碱性蛋白酶及胃蛋白酶联合胰蛋白酶水解产物的清除DPPH自由基的能力显著大于水解前苦荞蛋白。其中碱性蛋白酶水解产物的DPPH清除率最高达91.65%±4.49%(0.5 mg/mL)。在0.5 mg/mL及1 mg/mL的浓度下,碱性蛋白水解产物DPPH清除率与阳性对照Vc间无显著性差异。胃蛋白酶联合胰蛋白酶水解产物清除DPPH能力虽显著高于水解前的苦荞蛋白,但显著弱于阳性对照Vc。胃蛋白酶水解物的清除DPPH能力与水解前苦荞蛋白无显著性差异。因此,随着水解度的增加,在高浓度情况下,苦荞蛋白水解物抗氧化能力增加,结果与已有研究相似 [5] 。酶解后的蛋白通常表现出较高的抗氧化性,例如荞麦蛋白水解物 [5] 、大米蛋白水解物 [7-8] 及鹰嘴豆水解物 [9] 等。荞麦蛋白水解物(1.25 mg/mL) [5] 及鹰嘴豆水解物(1 mg/mL) [9] 在各自浓度下,DPPH自由基清除水平在40%~50%之间。相比之下,苦荞蛋白碱性蛋白酶水解物(1 mg/mL)具有相对较高的清除DPPH自由基能力。
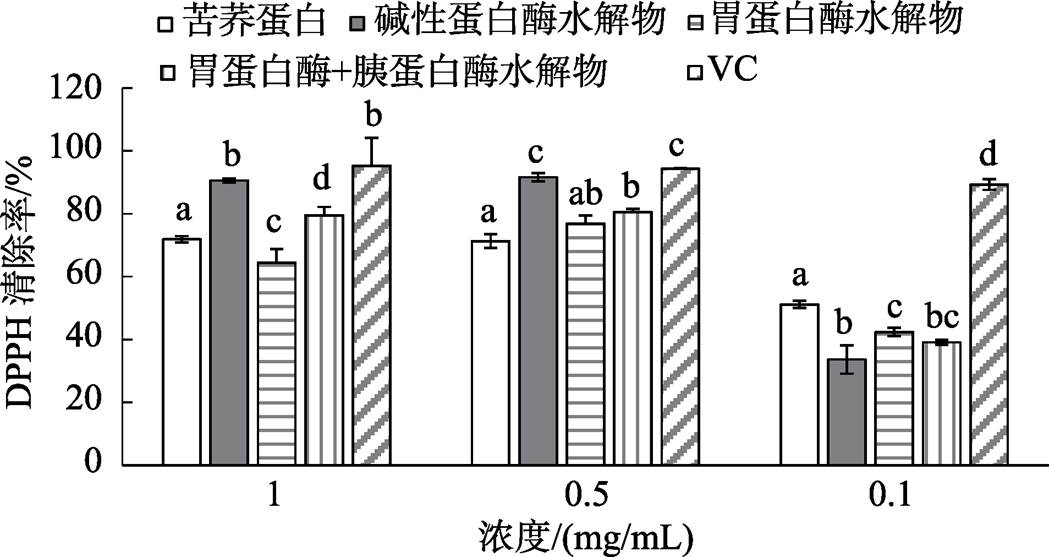
图2 不同苦荞蛋白水解物对DPPH自由基清除能力
注:同一浓度组内,不同字母代表组内比较具有显著性差异( P <0.05)
如图3所示,高浓度的苦荞蛋白具有一定的清除ABTS + ·的能力,因而具有一定抗氧化能力,但显著低于阳性对照Vc。苦荞原蛋白的ABTS+·清除率最高达11.25%±1.30%(1 mg/mL)。在低浓度条件下,蛋白水解物不能提高显著提高清除ABTS + ·自由基能力。在高浓度条件下(1 mg/mL),碱性蛋白酶水解能够显著提高苦荞蛋白的清除ABTS + ·自由基能力,最高清除率达16.67%±0.44% (1 mg/mL),但是还是显著低于阳性对照Vc。而胃蛋白酶及胃蛋白酶联合胰蛋白酶的清除ABTS + ·自由基能力与水解前苦荞蛋白没有显著差异。
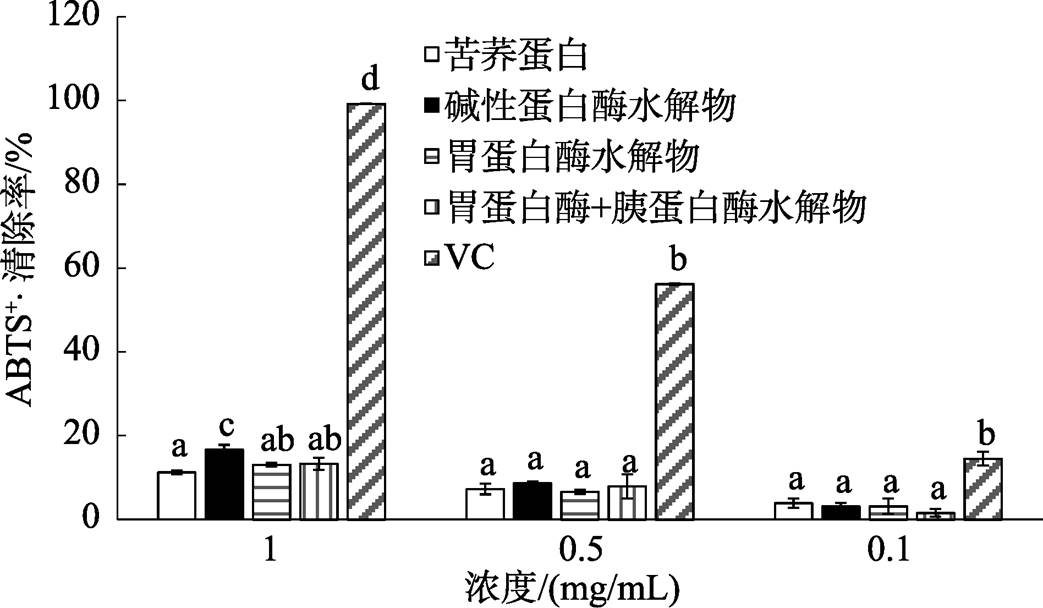
图3 不同苦荞蛋白水解物对ABTS + ·自由基清除能力
注:同一浓度内,不同字母代表组内比较具有显著性差异( p <0.05)
以苦荞蛋白为底物,采用碱性蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶等进行酶法水解,结果发现,不同蛋白酶水解产物水解度由高到低顺序为:碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>木瓜蛋白酶>胰蛋白酶。碱性蛋白酶对于苦荞蛋白的水解度及降解的苦荞蛋白分子量情况,均优于其他蛋白酶,其中碱性蛋白酶水解苦荞蛋白水解度达29.95%±0.99%。苦荞蛋白本身具有一定的抗氧化活性,其中DPPH清除率及ABTS + ·清除率最高分别为71.91%±2.23%及11.25%±1.30%(1 mg/mL),但均显著低于阳性对照Vc。经过蛋白酶水解后,在高浓度条件下,苦荞水解蛋白抗氧化活性增加。碱性蛋白酶水解苦荞蛋白能够显著提高苦荞蛋白抗氧化能力,并且优于其他蛋白酶,其DPPH及ABTS + ·清除率最高达91.65%± 4.49% (0.5 mg/mL)及16.67%±0.44%(1 mg/mL),均显著高于原苦荞蛋白。并且DPPH清除能力在高浓度下(>0.5 mg/mL),与阳性对照Vc持平。因此,蛋白酶水解有助于提高苦荞蛋白抗氧化能力。碱性蛋白酶水解的苦荞蛋白产物可作为天然的抗氧化剂。
参考文献:
[1] ZHU F. Chemical composition and health effects of Tartary buckwheat[J]. Food Chemistry, 2016, 203: 231-245.
[2] 周小理, 黄琳. 荞麦蛋白的组成与功能成分研究进展[J]. 应用技术学报, 2010, 10(3): 196-199.
[3] ZHANG C, RUI Z, LI Y M, et al. Cholesterol-Lowering Activity of Tartary Buckwheat Protein[J]. Journal of Agricultural & Food Chemistry, 2017, 65(9): 1900.
[4] 陈英娇. 苦荞蛋白酶解物的制备及抗菌活性的研究[D]. 上海师范大学, 2015.
XIAONA G, KEXUE Z, HUI Z, et al. Purification and Characterization of the Antitumor Protein from Chinese Tartary Buckwheat (Fagopyrumtataricum Gaertn.) Water-Soluble Extracts[J]. Journal of Agricultural & Food Chemistry, 2007, 55(17): 6958-61.
[5] MA Y, XIONG Y L, ZHAI J, et al. Fractionation and evaluation of radical-scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry, 2010, 118(3): 582-588.
[6] LI C H, MATSUI T, MATSUMOTO K, et al. Latent production of angiotensin I-converting enzyme inhibitors from buckwheat protein[J]. Journal of Peptide Science, 2002, 8(6): 267–274.
[7] PHONGTHAI S, LIM S T, RAWDKUEN S. Optimization of microwave-assisted extraction of rice bran protein and its hydrolysates properties[J]. Journal of Cereal Science, 2016, 70: 146-154.
[8] WATTANASIRITHAM L, THEERAKULKAIT C, WICKRAMASEKARA S, et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J]. Food Chemistry, 2016, 192: 156-162.
[9] LI Y H, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2): 444-450.
[10] CLEMENTE A. Enzymatic protein hydrolysates in human nutrition[J]. Trends Food Sci Technol, 2000, 11: 254-262.
[11] 李侠, 张利宽, 春萌,等. 响应面法优化荞麦蛋白酶解工艺[J]. 食品科学, 2012, 33(22): 145-148.
[12] 郭晓娜, 崔颖, 张晖, 等. 苦荞麦蛋白质的酶法水解研究[J]. 食品工业科技, 2009(7): 81-84.
[13] 何晓兰, 许庆忠, 王筑婷, 等. 消化道酶连续水解制备苦荞球蛋白多肽及其抗氧化活性研究[J]. 食品科技, 2016(8): 70-75.
[14] 龚倩, 唐传核, 杨晓泉. 胰蛋白酶水解对荞麦蛋白功能特性的影响[J]. 食品科学, 2010, 31(5): 244-247.
[15] 姚玉静, 崔春, 邱礼平, 等. pH-stat法和甲醛滴定法测定大豆蛋白水解度准性比较[J]. 食品工业科技, 2008(9): 268-270.
[16] 郭晓娜. 苦荞麦蛋白质的分离纯化及功能特性研究[D]. 江南大学, 2006.
[17] 丰凡. 荞麦多肽制备及生物活性研究[D]. 西北农林科技大学, 2007.
[18] GUO X, YAO H. Fractionation and characterization of tartary buckwheat flour proteins[J]. Food Chemistry, 2006, 98(1): 90-94.
[19] 李红敏, 周小理. 荞麦多肽的制备及其抗氧化活性的研究[J]. 食品科学, 2006, 27(10): 302-306. 
Antioxidant activity of different protein hydrolysates from tartary buckwheat
WU Wei-jing 1,2 , JI Mei-ru 1 , LI Zai-gui 2
(1. Xiamen Medical College, Xiamen Fujian 361023; 2. China Agricultural University, Beijing 100083)
Abstract: Tartary buckwheat protein hydrolysate was prepared with tartary buckwheat protein as substrate, hydrolyzed by Alcalase 2.4 L, papain, pepsin, trypsin, and combination of pepsin and trypsin to simulate i n vitro digestion.The antioxidant properties of different protein hydrolysates were tested by DPPH and ABTS + ·scavenging ability. The result showed that the order of the degree of hydrolysis of different proteases hydrolysates was: Alcalase 2.4 L > pepsin+trypsin >pepsin> papain>trypsin. The tartary buckwheat protein hydrolysate by Alacalase 2.4 L had highest degree of hydrolysis of 29.95%. The original tartary buckwheat had antioxidant ability. The highest scavenging ability of DPPH and ABTS + ·of original tartary buckwheat protein was 71.91% and 11.25%, but both of them were significantly lower than positive control group of Vc. With the increase of hydrolysis degree, the antioxidant ability of protein hydrolysate increased. The protein hydrolysates from Alcalase 2.4 L showed the highest antioxidant ability, which was significantly higher than original tartary buckwheat protein. The highest scavenging ability of DPPH and ABTS + ·of protein hydrolysates from Alcalase 2.4 L were 91.65% (0.5 mg/mL) and 16.67% (1 mg/mL), respectively. At high concentration (>0.5 mg/mL), protein hydrolysates from Alcalase 2.4 L showed no significant difference compared with positive control of Vc. Besides, protein hydrolysates from Alcalase 2.4 L showed significantly higher antioxidant properties than other protein hydrolysates. Therefore, the tartary buckwheat protein hydrolysate by Alcalase 2.4 L could be used as an antioxidant.
Key words: tartary buckwheat protein; hydrolysis; protease; antioxidant
DOI: 10.16210/j.cnki.1007-7561.2018.05.002
中图分类号: TS 210.1
文献标识码: A
文章编号: 1007-7561(2018)05-0006-05
收稿日期: 2018-07-04
基金项目: 国家现代农业产业燕麦荞麦产业技术体系(CARS-07-D-03);厦门医学院自然科学研究项目(K2015-05)
作者简介: 吴伟菁,1989年出生,女,助理实验师,博士生.
通讯作者: 李再贵,1964年出生,男,教授.