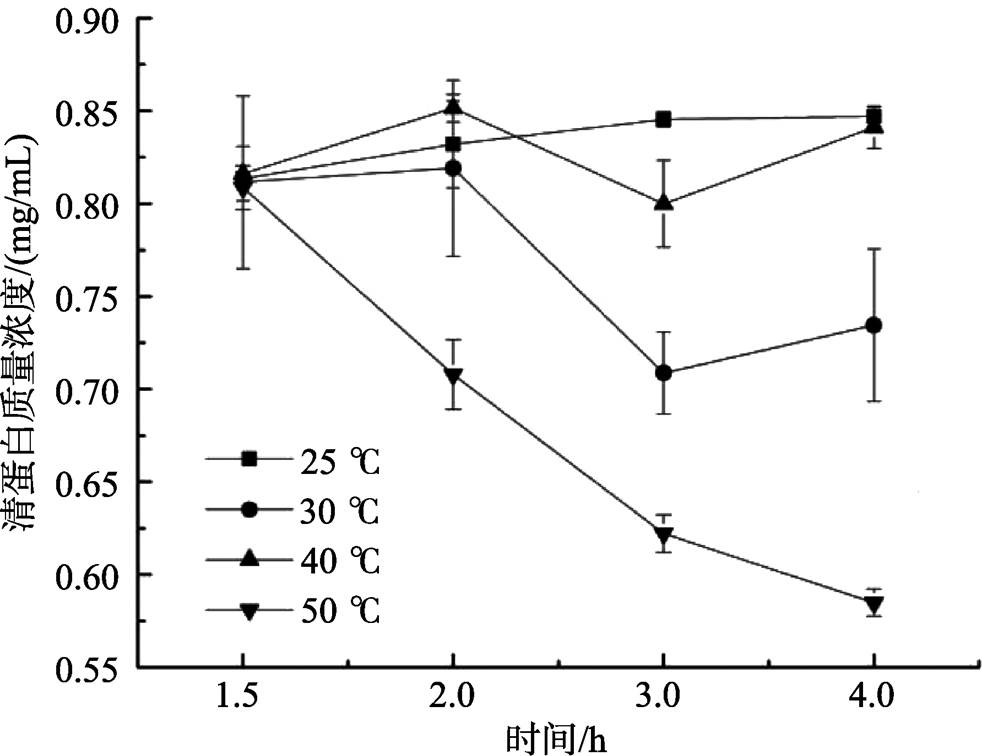
图1 温度对燕麦清蛋白质量浓度的影响
王美玉 1 ,粱亚萍 2 ,王 愈 1 ,陈振家 1
(1. 山西农业大学 食品科学与工程学院,山西 太谷 030801;2. 山西农业大学校医院,山西 太谷 030801)
摘 要: 通过单因素实验对燕麦蛋白组分的分离提取工艺进行了优化,并通过SDS-PAGE电泳对燕麦蛋白组分进行亚基分析。结果表明:燕麦清蛋白提取的最佳温度为40 ℃,球蛋白提取最佳盐浓度为7%,醇溶蛋白提取的最佳乙醇浓度为75%,谷蛋白提取的最佳碱浓度为0.05 mol/L,蛋白质提取率为83.1%。SDS-PAGE实验结果显示:燕麦清蛋白在10~100 kD范围内均有分布,燕麦球蛋白由2个亚基组成,分子量分别在97.4~100 kD和43~66.2 kD范围内,燕麦醇溶蛋白亚基大部分集中在18.39~40.72 kD之间,燕麦谷蛋白部分亚基分布在20.67~26.66 kD与43.29~50.80 kD之间。
关键词: 燕麦蛋白;分离提取;SDS-PAGE;亚基
燕麦属禾本科燕麦属,生长特性与其他谷物相似,是一年生草本植物 [1] ,适于生长在北纬40.8度到71度之间的地区 [2-3] 。燕麦产量约占世界粗粮产量的57%,在世界谷物生产中排名第六,仅次于小麦、玉米、大米、大麦和高粱 [4] 。我国燕麦播种面积约80万hm 2 ,产量85万t,居世界第八位 [5] 。燕麦中的蛋白质含量(12.4%~24.5%)在谷类食品中是最高的,其中清蛋白7%~11%、球蛋白52%、醇溶蛋白15%、谷蛋白19%~22% [6] ,氨基酸平衡性好,蛋白质功效比超过2.0,生物价为72~75 [7] ,而且清蛋白和球蛋白所占比重大,赖氨酸和天冬氨酸含量高,而脯氨酸和谷氨酰胺含量较低 [1] ,必需氨基酸比例合理,利用率高,是低成本高营养价值蛋白质的潜在来源 [8] 。目前对燕麦麸蛋白质的Osborne分类法已有报道 [9-11] ,但对于燕麦蛋白质的研究报道还较少。本研究旨在优化Osborne法分离提取燕麦蛋白组分工艺的基础上,通过SDS-PAGE电泳,确定燕麦蛋白各组分提取的最佳条件和亚基组成,为燕麦蛋白质的进一步研究和应用提供理论基础。
1.1.1 实验材料
市售燕麦。
1.1.2 主要试剂
石油醚、无水乙醇、氢氧化钠、氯化钠、三氯乙酸、盐酸、浓硫酸(均为分析纯):天津市凯通化学试剂有限公司;考马斯亮蓝G250、SDS、β-巯基乙醇、溴酚蓝、甲叉双丙烯酰胺、四甲基乙二胺、过硫酸铵、氢氧化钾、甘油、低分子量蛋白质Marker:北京索莱宝科技有限公司。
1.1.3 实验仪器
DYY-7C型电泳仪:北京市六一仪器厂;723可见分光光度计:上海菁华科技有限仪器公司;HH系列数显恒温水浴锅:金坛市科析仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;SHZ-III循环水真空泵:上海亚荣生化仪器厂;TS-2000 ADecoloring Shaker:Kylin-Bell Lab Instrument公司;HC-2064高速离心机:安徽中科中佳科学仪器有限公司。
1.2.1 脱脂燕麦粉制备
燕麦籽粒经挑选去杂后,磨制成粉,按料液比1∶5加入石油醚,磁力搅拌脱脂4 h,抽滤除去油脂石油醚混合溶液,沉淀置于空气中待石油醚挥发完全后,收集备用。
1.2.2 Osborne法分离提取燕麦蛋白组分
1.2.2.1 燕麦清蛋白提取 称取一定量脱脂燕麦粉,按料液比1∶10加入蒸馏水,分别在水浴锅中恒温(25、40、50 ℃)搅拌1.5、2、3、4 h,取一定量溶液,以10 000 r/min速度离心5 min,测定上清液中蛋白质量浓度。
1.2.2.2 燕麦球蛋白提取 称取一定量脱脂燕麦粉,按照上述步骤除去清蛋白,所得沉淀分别加入NaCl溶液(2%、3%、4%、5%、6%、7%、8%、9%),磁力搅拌0.5、1、2、3 h,取定量溶液,以10 000 r/min速度离心5 min,测定上清液中蛋白质量浓度。
1.2.2.3 燕麦醇溶蛋白提取 称取一定量脱脂燕麦粉,按照上述步骤除去燕麦清蛋白、球蛋白后,所得沉淀中分别加入乙醇溶液(65%、70%、75%、80%、85%、90%),磁力搅拌0.5、1、2、3 h,取一定量溶液,以10 000 r/min速度离心5 min,测定上清液中蛋白质量浓度。
1.2.2.4 燕麦谷蛋白提取 称取一定量脱脂燕麦粉,依次提取,除去燕麦清蛋白、球蛋白、醇溶蛋白后,所得沉淀中分别加入NaOH溶液(0.01、0.03、0.05、0.07、0.09、0.10 mol/L),磁力搅拌0.5、1、2、3 h,取一定量溶液,以10 000 r/min速度离心5 min,测定上清液中蛋白质量浓度。
1.2.3 燕麦蛋白质量浓度测定
用考马斯亮蓝法 [12] 进行测定。
1.2.4 SDS-PAGE电泳
依照Laemmli等人 [13] 的方法。浓缩胶浓度为5%,分离胶浓度为12%,样品上样量为5 μL。恒压电泳,电流为16 mA,浓缩胶电压为100 V,分离胶电压为150 V。电泳结束后,电泳胶片先固定3 h后,再染色,脱色结束后,用成像仪进行成像。
热是使蛋白质变性最常见的物理因素,大多数蛋白质在45~50 ℃时已可觉察到变性,到55 ℃时变性进行得很快。70 ℃以下时蛋白质变性仅涉及非共价键的变化,但在70~80 ℃以上,将会破坏蛋白质的二硫键,产生不可逆变性 [14] 。因此本实验选取了30、40、50 ℃三梯度进行实验,并与室温(25 ℃)条件下进行了比较。由图1可知,除25 ℃外,随提取时间的延长,蛋白质浓度曲线整体呈下降趋势,50 ℃时下降明显,说明此时燕麦清蛋白已经开始变性,造成部分沉淀,使得溶解度降低。在30 ℃和40 ℃下,清蛋白浓度都是在2 h时有所提高,之后随时间延长蛋白浓度有所波动,但总体呈下降趋势。说明随着提取时间的延长,也会造成部分清蛋白的变性沉淀。40 ℃提取2 h时,清蛋白浓度最高,所以确定清蛋白提取温度为40 ℃,时间为2 h。

图1 温度对燕麦清蛋白质量浓度的影响
盐以两种不同的方式影响蛋白质的稳定性,低浓度时,离子通过非特异性的静电相互作用与蛋白质作用,稳定了蛋白质的结构;高浓度时,盐具有影响蛋白质结构稳定性的离子特异效应 [15] ,且在相同离子强度下燕麦球蛋白在NaCl溶液中的溶解度大于在一些二价盐溶液中的溶解度 [16] ,由图2可以看出,当盐浓度为7%和8%时,随时间变化,蛋白质量浓度曲线基本重合且最高,说明此时盐离子与燕麦球蛋白相互作用,很好地稳定了蛋白质的结构,使燕麦球蛋白的溶解性达到最大,9%时蛋白质量浓度开始下降,说明此时的盐离子浓度已经破坏了燕麦球蛋白的稳定性,溶解度降低。所以确定盐浓度为7%时最佳。
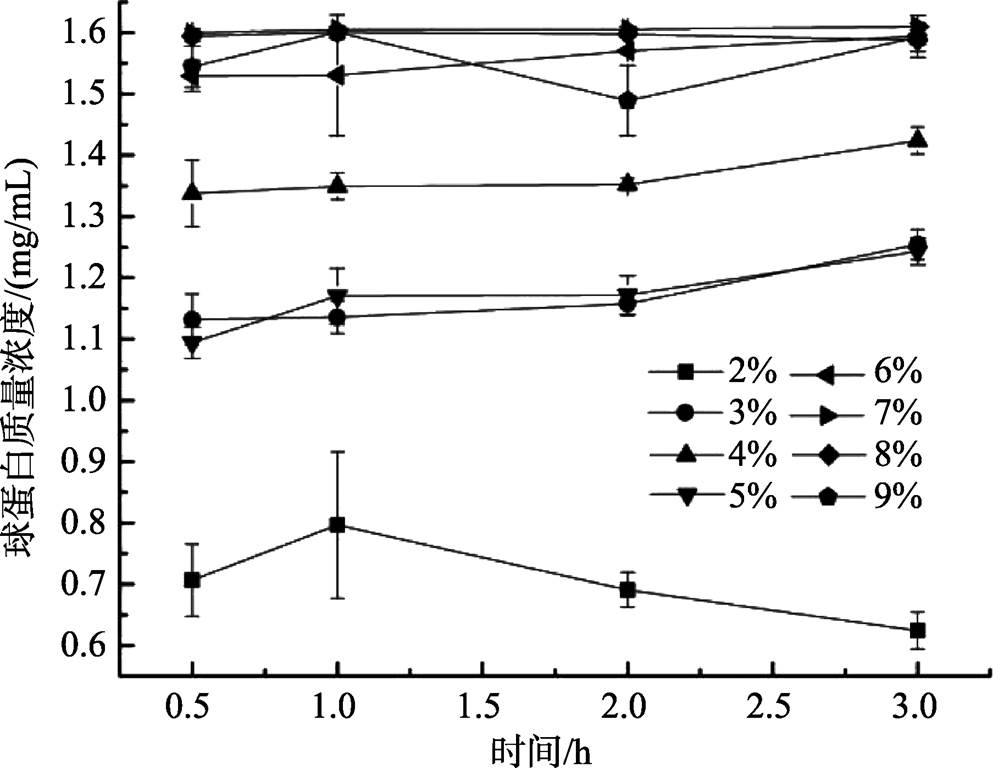
图2 NaCl溶液浓度对球蛋白质量浓度的影响
有机溶剂以不同方式影响蛋白质的疏水相互作用、氢键和静电相互作用的稳定性。在低浓度时,一些有机溶剂能提高几种酶对变性的稳定性 [17] 。然而在高浓度时,有机溶剂将导致蛋白质变性。由图3可以看出,乙醇溶液体积分数为75%时,提取的醇溶蛋白质量浓度最高,说明此时燕麦醇溶蛋白与乙醇溶液相互作用,稳定了蛋白质结构,溶解度提高,当乙醇溶液体积分数大于75%时,导致了蛋白质变性沉淀,溶解度降低。
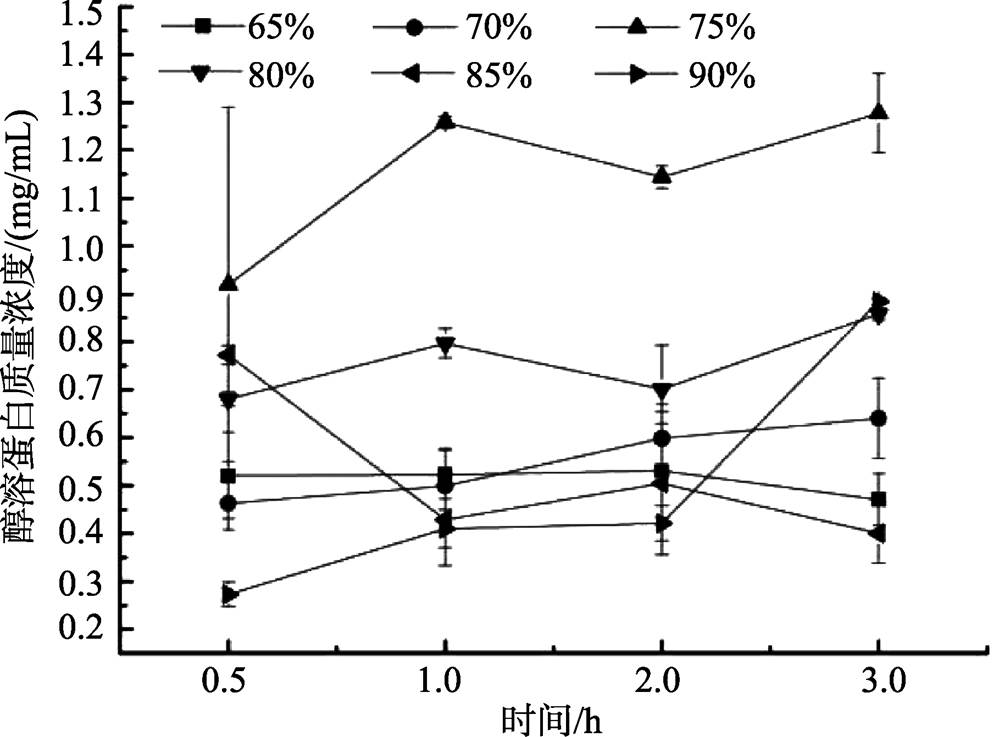
图3 醇溶液浓度对燕麦醇溶蛋白质量浓度的影响
由图4可知,氢氧化钠浓度为0.03 mol/L和0.05 mol/L时,随时间延长,蛋白质量浓度曲线开始呈显著上升趋势,2 h之后则上升较缓,且在2 h之后,0.05 mol/L的碱浓度提取的谷蛋白质量浓度最高,故碱溶液浓度确定为0.05 mol/L。添加NaOH会加速淀粉的糊化速度 [18] ,实验结果表明,当碱溶液浓度高于1.0 mol/L后,由于在提取过程中造成燕麦淀粉的糊化,溶液会成胶状,无法离心分离,在下一步研究中可以考虑先将淀粉除去,再进一步研究。
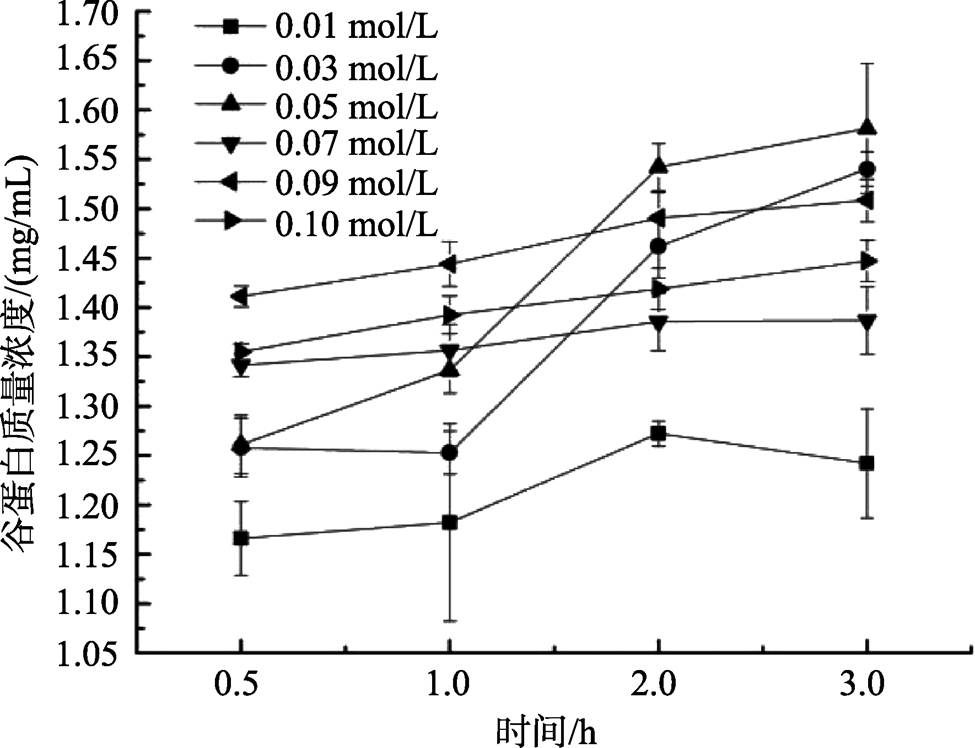
图4 NaOH溶液浓度对燕麦谷蛋白质量浓度的影响
由图5和图6可知,不同提取条件对蛋白亚基组成有较大影响。燕麦清蛋白亚基在10~100 kD范围内均有分布,25 ℃提取所得燕麦清蛋白亚基条带较少,可见25 ℃条件下未能提取清蛋白有效组分,50 ℃提取所得清蛋白亚基分布与40 ℃有较大不同,结合提取率数据,推测50 ℃的提取条件下,部分蛋白变性导致亚基组分分布发生变化,此外,添加β-ME后,清蛋白的部分亚基条带消失,说明清蛋白中的部分亚基含有二硫键。不同提取条件对燕麦球蛋白的亚基组成影响较小,3个盐浓度提取所得燕麦球蛋白在电泳图谱中均呈现相同的亚基条带,分子量在43~66.2 kD之间,含有二硫键,二硫键断裂后形成的低分子量亚基分别在31~43 kD和14.4~22 kD范围内;燕麦醇溶蛋白亚基分布范围较广,但大部分亚基集中在18.39~40.72 kD之间,与Kim等人 [19] 描述的20~40 kD基本相符,不同醇浓度对燕麦醇溶蛋白亚基组成影响较大,其中乙醇浓度为75%时提取所得的蛋白亚基条带最多,这可能正是造成乙醇浓度为75%时蛋白质量浓度最高的原因,当乙醇浓度为80%时,只提取出了少量的18.39~ 40.72 kD之间的亚基,当乙醇溶液浓度为70%时,还提取出了相对分子质量较小的亚基(9.78~ 18.39 kD),而低分子质量的亚基氨基酸组成不同于典型的醇溶蛋白,它们可能像小麦和大麦一样,主要包含蛋白酶和α-淀粉酶抑制剂 [20] ,燕麦醇溶蛋白大部分亚基不含二硫键。燕麦谷蛋白亚基主要有两条,分别分布在20.67~26.66 kD与43.29~ 50.80 kD之间,随着NaOH浓度的增加,分离胶顶端颜色加深,而20.67~26.66 kD与43.29~ 50.80 kD之间两个亚基组分则逐渐减少,所以推测低浓度的NaOH溶液有利于提取出低分子量的燕麦谷蛋白亚基,而高浓度的NaOH溶液有利于提取出大分子量的亚基,当NaOH浓度为0.5 mol/L时,既可以提取出部分小分子量亚基也可提取出部分大分子量亚基,这可能正是此时燕麦谷蛋白质量浓度最大的原因。
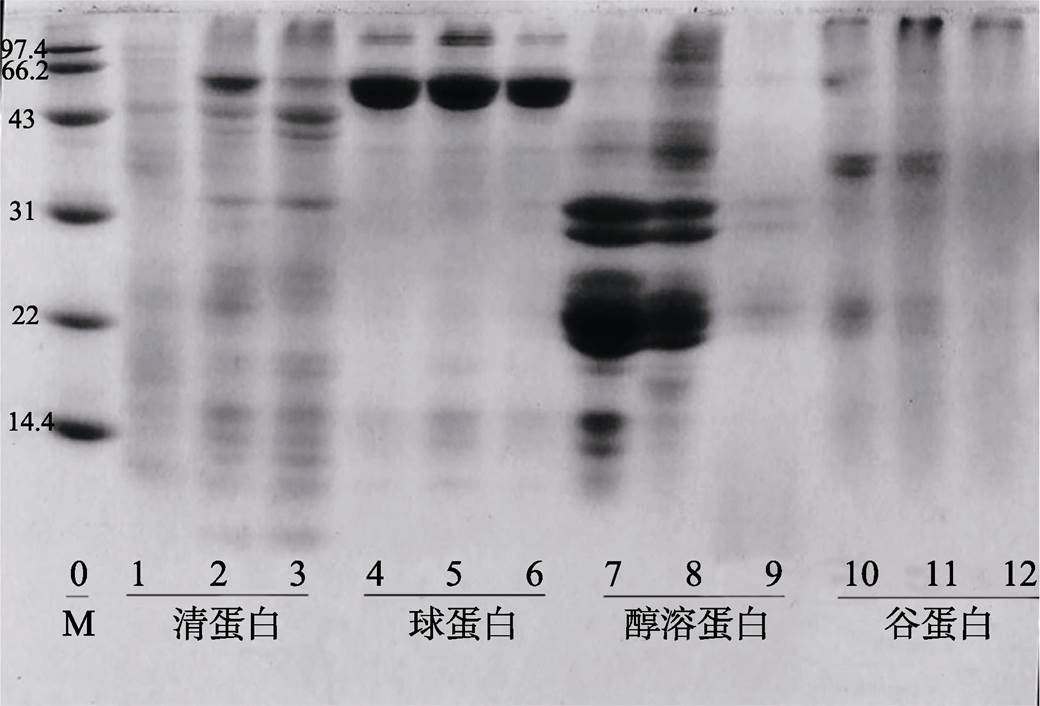
从左到右,泳道0:蛋白标样;泳道1、2、3:清蛋白(25、40、50 ℃);泳道4、5、6:球蛋白(5%、7%、9%);泳道7、8、9:醇溶蛋白(70%、75%、80%)、泳道10、11、12:谷蛋白(0.01、0.05、0.1 mol/L)
图5 燕麦蛋白组分电泳图谱(未加 b -ME)
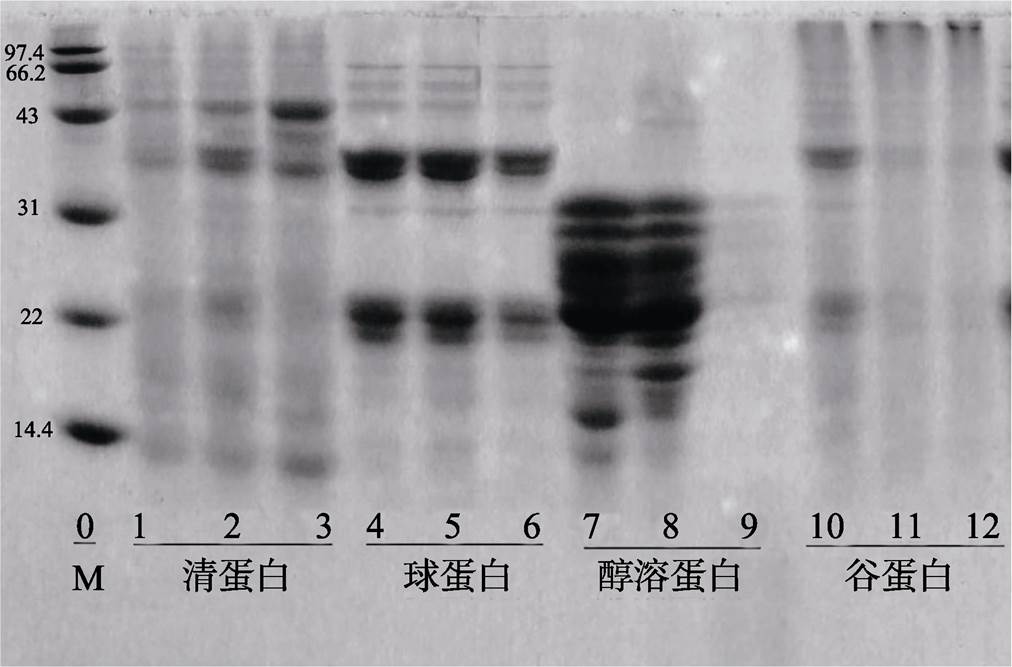
从左到右,泳道0:蛋白标样;泳道1、2、3:清蛋白(25、40、50 ℃);泳道4、5、6:球蛋白(5%、7%、9%);泳道7、8、9:醇溶蛋白(70%、75%、80%)、泳道10、11、12:谷蛋白(0.01、0.05、0.1 mol/L)
图6 燕麦蛋白组分电泳图(加 b -ME)
燕麦清蛋白提取的最佳温度为40 ℃,球蛋白提取的最佳盐浓度为7%,醇溶蛋白提取的最佳乙醇浓度为75%,谷蛋白提取的最佳碱溶度为0.05 mol/L。提取的蛋白含量(占粗蛋白)依次为:清蛋白19.40%、球蛋白36.42%、醇溶蛋白10.29%、谷蛋白17.02%,蛋白质提取率可高达83.1%。SDS-PAGE结果表明:不同提取条件对燕麦清蛋白、醇溶蛋白和谷蛋白的亚基组成有较大影响。燕麦清蛋白亚基在10~100 kD范围内均有分布,燕麦球蛋白由2个亚基组成,分子量分别在97.4~100 kD和43~66.2 kD范围内,燕麦醇溶蛋白亚基大部分亚基集中在18.39~40.72 kD之间,燕麦谷蛋白部分亚基分布在20.67~26.66 kD与43.29~50.80 kD之间,其中燕麦清蛋白和球蛋白含有二硫键。
参考文献:
[1] KULP K, PONTE J G. Handbook of cereal science and technology[M]. 2nd ed. New York: Marcel Dekker Inc, 2000: 131-376.
[2] SCHRICKEL D J. World Oats Use and Marketing[M]. Proceedings of the Second International Oats Conference. Springer Netherlands, 1986: 197-199.
[3] SCHRICKEL D J, WEBSTER F H. Oats production, value, and use[M]. 1986: 111.
[4] HOFFMAN L A. The U. S. oats industry[M]. U. S. dept. of Agriculture Economic Research Service, 1987.
[5] 胡新中, 李小平. 燕麦荞麦产品加工现状与思考[J]. 农业工程技术: 农产品加工业, 2013(12): 24-27.
[6] 皇甫红芳, 苏占明, 李刚. 燕麦的营养成分与保健功效[J]. 现代农业科技, 2016(19): 275-276.
[7] MOHAMED A, BIRESAW G, XU J Y, et al. Oats protein isolate: thermal, rheological, surface and functional properties[J]. Food Research International, 2009, 42(1): 107-114.
[8] GUAN X, YAO H. Optimization of Viscozyme L-assisted extraction of oat bran protein using response surface methodology[J]. Food Chemistry, 2008, 106(1): 345-351.
[9] 管骁, 姚惠源. 燕麦麸蛋白的组成及功能性质研究[J]. 食品科学, 2006, 27(7): 72-76.
[10] 王婵. 燕麦麸皮蛋白的提取条件及其理化性质研究[D]. 天津科技大学, 2013.
[11] XIAO G, YAO H Y. Composition and Functional Properties of Oat Bran Protein[J]. Food Science, 2006, 27(7): 72-76.
[12] 周跃男, 王湛, 赵小川, 等. 浅谈蛋白质含量的定量检测方法[J]. 食品研究与开发, 2014(7): 127-130.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[14] 管斌, 林洪, 王广策. 食品蛋白质化学[M]. 化学工业出版社, 2005.
[15] FENNEMA O R. Food Chemistry, Third Edition[M]. Crc Press, 1996.
[16] PETERSON D M. Subunit structure and composition of oat seed globulin[J]. Plant Physiology, 1978, 62(4): 506-509.
[17] ASKURA T K. ADACHI, SCHWARTZ E. Stablizing effect of various organic solvents on protein[J]. Biol. Chem, 1978, 253: 6423-6425.
[18] 王琳, 许杨杨, 朱轶群, 等. 碱液处理对荞麦淀粉物理性能和结构的影响[J]. 食品工业科技, 2017, 38(6): 79-83.
[19] KIM, CHARBONNIER, MOSSE. Heterogeneity of avenin, the oat prolamin. Fractionation, molecular weight and amino acid composition[J]. Biochimicaet Biophysica Acta, 1978, 537: 22-30.
[20] DAUSSANT J, MOSSE J, VAUGHAN J. Seed proteins[M]. Annual Proceedings of the Phytochemical Society of Europe, 1983.
[21] WALBURG G, LARKINS B A. Oat seed globulin: subunit characterization and demonstration of its synthesis as a precursor[J]. Plant Physiology, 1983, 72: 161-65. 
Separation and extraction of oat protein components and analysis by SDS-PAGE
WANG Mei-yu 1 , LIANG Ya-ping 2 , WANG Yu 1 , CHEN Zhen-jia 1
(1. School of food science and engineering, Shanxi Agricultural University, Taigu Shanxi 030801; 2. Hospital of Shanxi Agricultural University, Taigu Shanxi 030801)
Abstract: The separation and extraction process of protein components in oat were optimized by single factor experiments and the protein subunit components of oat were analyzed by SDS-PAGE. The results showed that the optimal temperature for extraction of oat albumin was 40 ℃, the optimal salt concentration for globulin was 7%, the optimalethanol concentration for prolamin was 75%, the optimal alkaliconcentration for glutenin was 0.05 mol/L, the extraction rate of oat protein 83.1%. The results of SDS-PAGE showed that the oat albumin distributed in the range of 10~100 kD; the oat globulin was composed of two subunits with molecular weight in the range of 97.4~100 kD and 43~ 66.2 kD respectively; the distribution range of most oat prolamin subunits was 18.39~40.72 kD; and the distribution range of some oat glutenin subunits was between 20.67~26.66 kD and 43.29~50.80 kD.
Key words: oat protein; separation and extraction; SDS-PAGE; subunit
DOI: 10.16210/j.cnki.1007-7561.2018.05.001
中图分类号: TS 210.1
文献标识码: A
文章编号: 1007-7561(2018)05-0001-05
收稿日期: 2018-03-20
基金项目: “十三五”国家重点研发计划重点专项(2017YFD0400200);山西农业大学博士科研启动专项(2016ZZ06)
作者简介: 王美玉,1994年出生,女,硕士研究生.
通讯作者: 陈振家,1981年出生,男,博士,副教授.