表1不同培养基产芽孢能力
编号产芽孢时间/h芽孢率芽孢量/(CFU/mL)150>90%1.0×107221>90%7.0×108350>90%1.0×106448>90%1.0×107550>90%1.0×107650>90%1.0×107726>90%7.0×108850<10%4.0×108950<10%2.0×1081050<10%1.8×109
刘虎军,常晓娇,王楠希,赵一凡,杜 稳,孙长坡
(国家粮食局科学研究院,北京 100037)
摘 要:通过培养基筛选、单因素实验、正交实验获得芽孢率和芽孢量较高的培养基,优化发酵pH和温度,获得最优产芽孢培养条件,在20 L发酵罐中对发酵培养基和发酵条件进行验证,并对发酵pH的控制和补料发酵进行初步探索。获得的最佳培养基为:麸皮5 g/L、玉米粉3 g/L、NaCl 5 g/L、KH2PO41 g/L、MnSO4·H2O 0.2 g/L、K2HPO41.5 g/L,在pH 6.0、37 ℃、200 r/min条件下震荡培养21 h,芽孢率达到91%,芽孢量达到5.2×1010CFU/mL。在20 L发酵罐放大实验中通过恒定pH和批次补料发酵,芽孢率达到95%,芽孢量达到1.38×1011CFU/mL。获得了玉米赤霉烯酮降解菌ASAGW-10菌剂的生产工艺,为后续开展降解菌性能和应用研究提供数据支撑。
关键词:玉米赤霉烯酮;枯草芽孢杆菌;芽孢;培养条件
真菌毒素是真菌生长产生的次级代谢物,对小麦、玉米、花生等主要作物造成了严重污染,威胁着人类的财产和生命安全,全球每年因真菌毒素污染造成的经济损失高达数百亿美元。玉米赤霉烯酮(ZEN)是一种雌性激素类似物,同时也是分布最为广泛的真菌毒素之一[1]。国内外学者针对真菌毒素进行了多年研究,开发了吸附、热处理、化学试剂处理、酶处理等多种理化和生物降解方法,其中生物降解具有安全、有效、没有二次污染等优点,成为目前真菌毒素降解研究的热点[2]。钟凤等[3]克隆表达了能够降解真菌毒素的A4-Prx酶,并研究了该酶的酶学性质,La Xiang[4]等在毕赤酵母中高效表达了ZEN降解酶,降解酶活性能够达到150 U/mL,骆翼[5]通过筛选获得了4株能够降解ZEN的菌株,并对各菌株的降解能力进行了评估,孙志轩[6]等从发酵食品材料中筛选获得了能够降解ZEN的枯草芽孢杆菌,ZEN降解率能够达到62.48%。
枯草芽孢杆菌因具有较广泛的酶系,能够产生抗菌肽、抗生素等多种益生物质而被广泛应用于饲料、肥料、环境等领域[7]。在前期工作中我们筛选获得了一株能够高效降解ZEN的枯草芽孢杆菌ASAGW-10,能够在快速降解物料中ZEN的同时,提升其营养价值。芽孢作为枯草芽孢杆菌的休眠体,便于长期保存和运输,具有广泛的实用性。营养贫瘠是芽孢产生的条件之一[7],因此如何在寡营养培养条件下获得较高的芽孢生物量成为当前亟待解决的问题。本文在前期工作基础上,开展了ZEN降解菌株ASAGW-10产芽孢条件的优化研究,为后续该菌株在粮食副产物和饲料原料脱毒中的应用研究提供数据支持。
ZEN降解菌ASAGW-10由本实验室筛选保存。
种子培养基:LB培养基。
发酵培养基:(1)麸皮3%、大豆蛋白胨3%、氯化钙0.1%,pH 7.5[8];(2)麸皮0.5%、玉米粉1%、氯化钠0.5%、KH2PO40.1%、MnSO4·H2O 0.04%,pH 7.5[9];(3)玉米粉0.317%、大豆粉0.58%、蛋白胨0.362%、MnSO4·H2O 0.106%、葡萄糖0.5%、尿素0.3%、MgSO4·7H2O 0.15%、KH2PO40.3%,pH 7.5[10];(4)麦芽浸粉1.5%、玉米浆1.5%、CaCO30.5 %、MgCl2·6H2O 0.05 %,pH 7.5[11];(5)甘油1%、酵母浸粉0.5%、蛋白胨0.5%、氯化钠1%、Arg 0.4%,pH 7.5;(6)玉米粉1%、玉米浆1%、豆粕1%,pH 7.5;(7)葡萄糖1.0%、豆粕1.0%、氯化钠0.5%、硫酸锰0.06%,pH 7.5[12];(8)麦芽糖0.25%、玉米粉0.5%、黄豆粉0.5%、胰蛋白胨0.5%、CaCl2·2H2O 0.05%、MnSO4·H2O 0.05%、K2HPO40.1%,pH 7.5[13];(9)麸皮2.0%、酵母膏0.5%、豆粕粉1.0%、氯化钠0.5%、K2HPO40.3%、硫酸锰0.03%,pH 7.5[14];(10)蔗糖1%、K2HPO40.05%、氯化钠0.02%、二氧化硅0.1%、硫酸镁0.02%、碳酸钙0.1%、酵母膏0.04% ,pH 7.5。
补料培养基:蔗糖10%、K2HPO40.5%、氯化钠0.2%、二氧化硅1%、硫酸镁0.2%、碳酸钙1%、酵母膏0.4%、pH 7~7.2。
1.3.1 种子液培养
挑取单菌落接种LB培养基,在37 ℃、200 r/min下培养16 h作为种子液。
1.3.2 培养基和培养条件优化
在摇瓶条件下对文献报道的10种培养基的生物量、产芽孢时间(芽孢率达到90%的发酵时间)和芽孢率进行评估,筛选出能够获得较高生物量和芽孢率的培养基。进一步对所选培养基进行单因素、Plackett-Burman(PB)和正交实验优化,在获得最佳培养基基础上,对发酵pH和发酵温度进行优化,以提高芽孢生产能力。摇瓶初始发酵条件:250 mL摇瓶装液量50 mL,在37 ℃、200 r/min下震荡培养,定时取样,稀释涂布,检测芽孢量和芽孢率。芽孢率为芽孢浓度占菌体浓度的百分比。
1.3.3 20 L发酵罐放大发酵
接种单菌落至摇瓶中,在37 ℃、240 r/min条件下培养16 h作为一级种子,将一级种子以5%接种量接入到二级种子培养基中,37 ℃、240 r/min培养14 h作为二级种子。20 L全自动发酵罐装液量10 L,发酵罐接种量10%。初始发酵条件:pH 7.0,温度37 ℃,搅拌转速500 r/min,通气0.5 vvm,罐压维持在0.04~0.05 Mpa。调节通气量和转速控制溶氧在20%以上,发酵后期每2 h取样镜检,确定芽孢形成情况,芽孢率达到90%以上发酵结束,测定芽孢率和生物量。
1.3.4 菌体浓度测定
10倍梯度稀释平板培养计数法,发酵液适当稀释,涂布平板进行活菌计数,每个样品涂布3个梯度并设计3个平行。
1.3.5 芽孢浓度和芽孢率测定
取适量发酵液,85 ℃水浴 10 min后稀释平板计数,测定芽孢浓度和芽孢率,每个样品涂布3个梯度并设计3个平行。
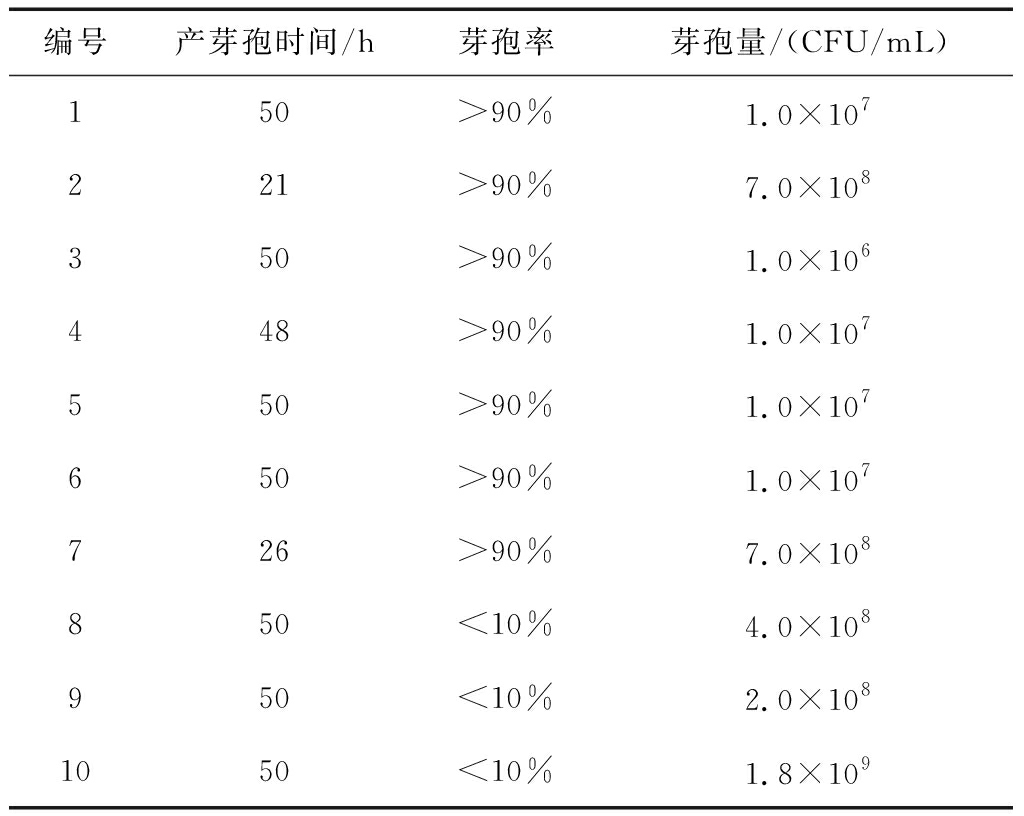
对文献报道的10种培养基的产芽孢时间、芽孢率和芽孢量进行评估,结果见表1。
表1不同培养基产芽孢能力

由表1可以看出,10种培养基所获得的菌体浓度、产芽孢时间和产芽孢率区别较大,2号、7号、8号、9号和10号培养基能够获得较高的芽孢量,芽孢量大于1×108CFU/mL。其中7号、8号、9号和10号培养基的产芽孢时间较长,2号培养基在21 h内能够获得7×108CFU/mL的芽孢量,芽孢率达到90%以上,因此以2号培养基为基础进行优化。
2.2.1 单因素实验
以2号培养基为基础对培养基中碳源和氮源进行单因素优化,由图1a可以看出,随着麸皮含量的增加芽孢量不断增加,麸皮含量在5 g/L时,芽孢量为2.6×109CFU/mL,麸皮含量超过5 g/L时,产芽孢时间推迟,芽孢量没有明显增加,因此选择5 g/L的麸皮添加量进行后续实验。由图1b可以看出,玉米粉的添加量为2 g/L时芽孢量最高,芽孢量为4.0×109CFU/mL,玉米粉含量增加对产芽孢不利;由图1c可以看出,调整麸皮和玉米粉的比例为5∶2,在一定范围内增加两种物料的含量能够增加总生物量,但是芽孢量呈下降趋势;为了提高芽孢含量,尝试添加一定比例的葡萄糖作为速效碳源(图1d),葡萄糖的加入会使产芽孢时间延长且芽孢量下降,不利于芽孢生产,因此在后续实验中不添加葡萄糖。
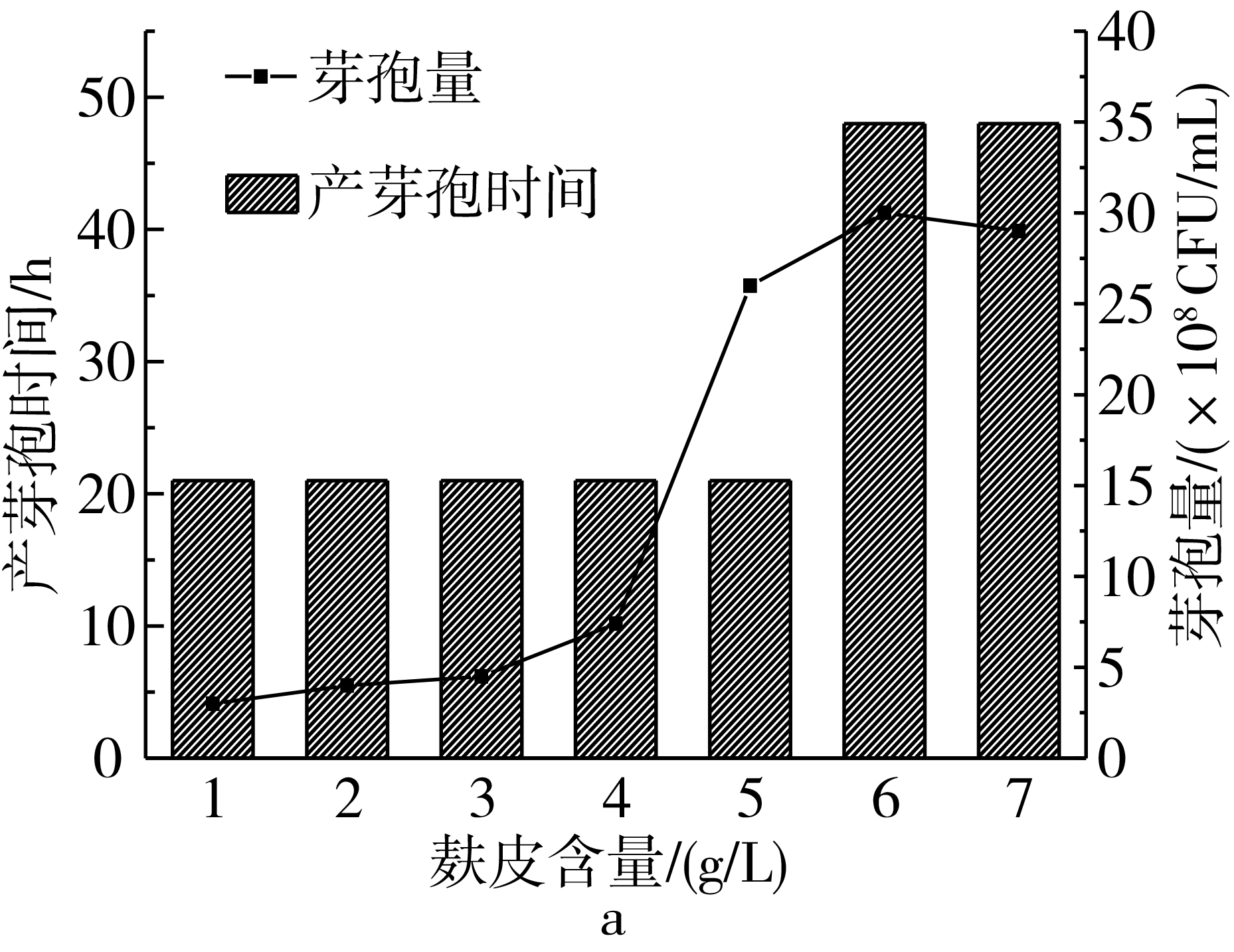
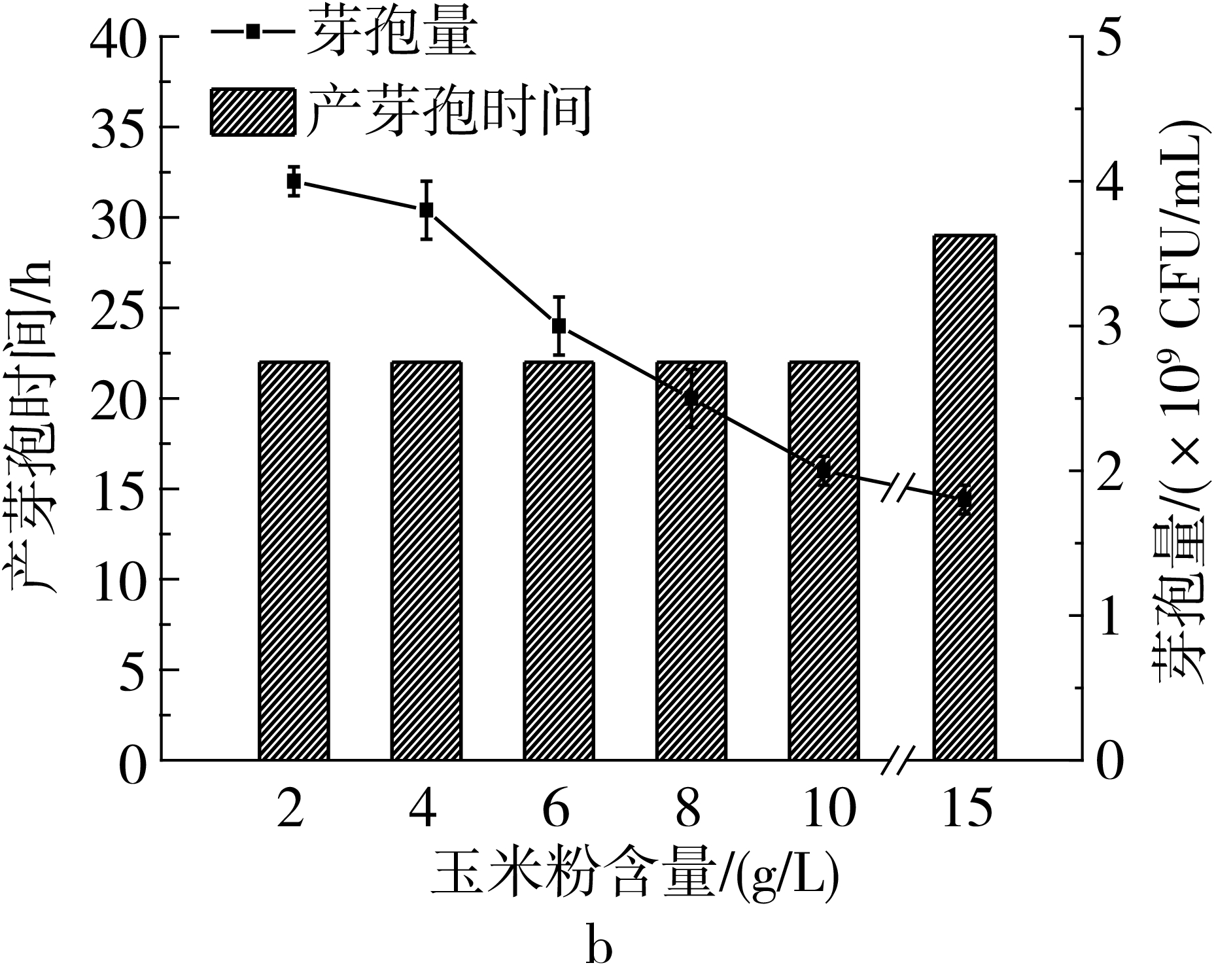

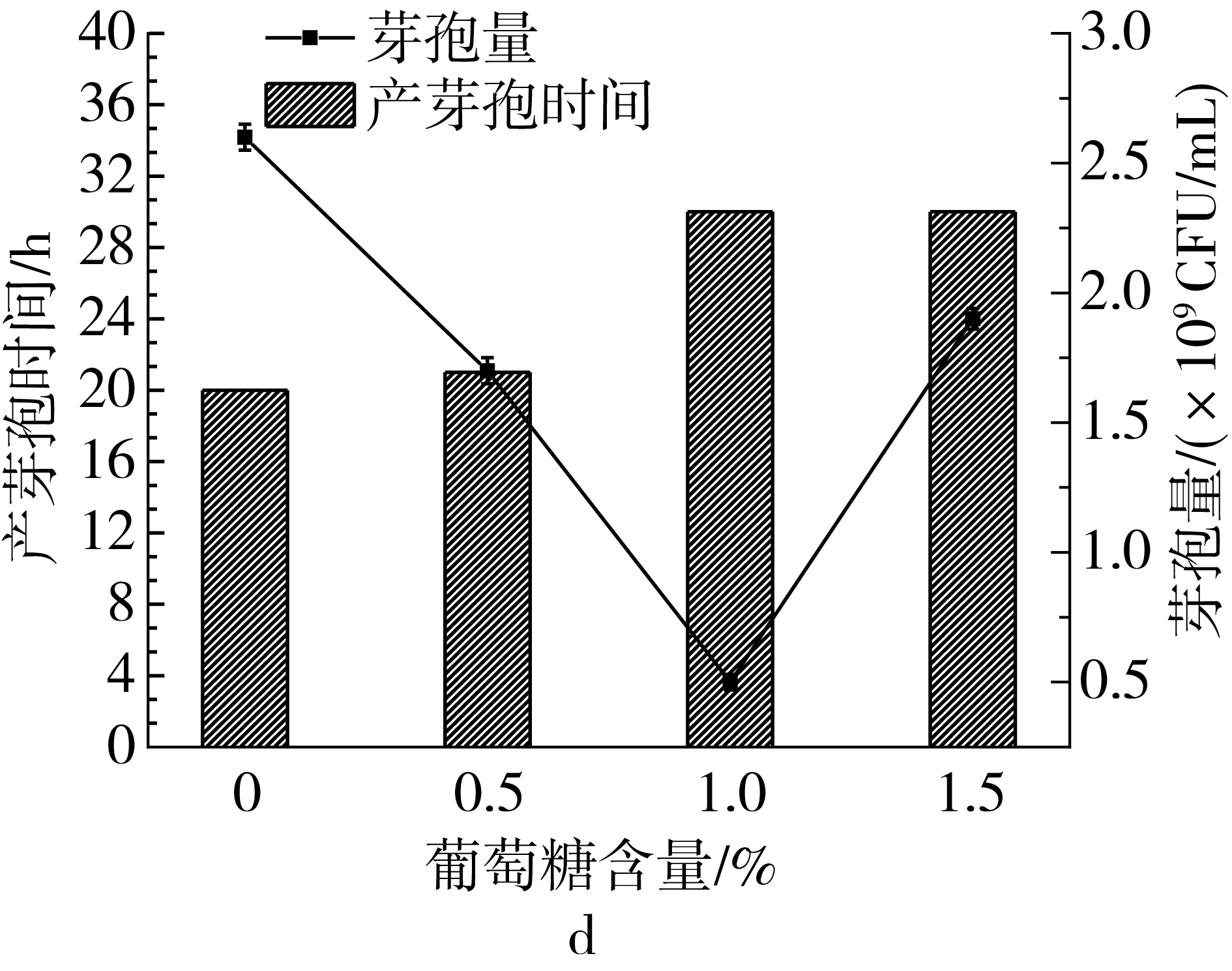
a-麸皮添加量对产芽孢的影响;b-玉米粉添加量对产芽孢的影响;c-等比例增加营养含量对产芽孢的影响;d-葡萄糖含量对产芽孢的影响图1 培养基成分优化
2.2.2 无机盐离子筛选
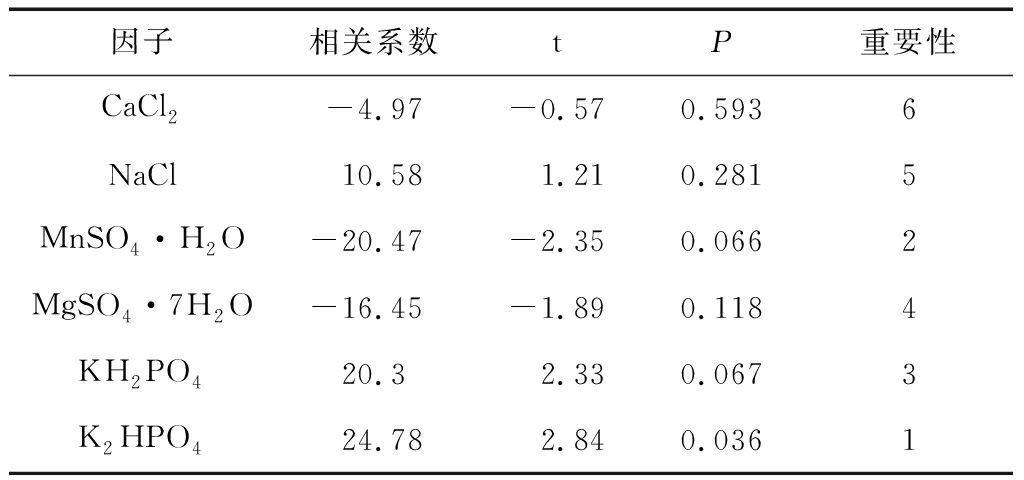
通过Plackett-Burman(PB)实验研究6种无机盐对芽孢量的影响,培养基其他成分:麸皮5 g/L,玉米粉2 g/L。由结果(表2)可以看出,K2HPO4对芽孢含量影响显著(P<0.05);MnSO4·H2O和KH2PO4对芽孢含量有一定影响(P<0.1);CaCl2、MgSO4·7H2O和NaCl对芽孢量影响不显著(P>0.1)。由于CaCl2和MgSO4·7H2O影响不显著且为负效应,培养基中不再添加此两种无机盐。
表2 PB实验显著性分析
2.2.3 正交实验
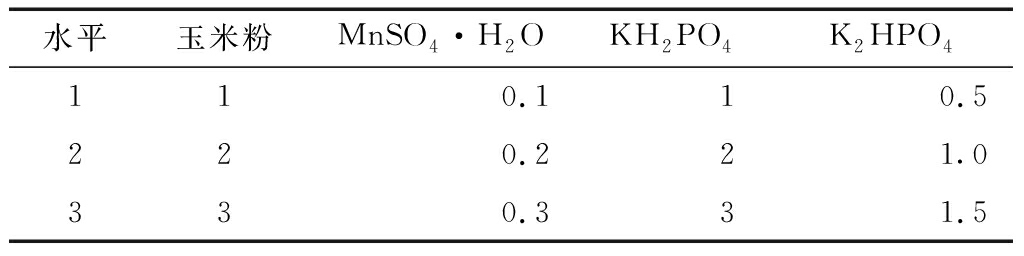
根据单因素实验和PB实验,设计4因素3水平正交实验(表3),培养基中其他成分含量:麸皮5 g/L,NaCl 5 g/L。
表3正交实验设计因素水平g/L
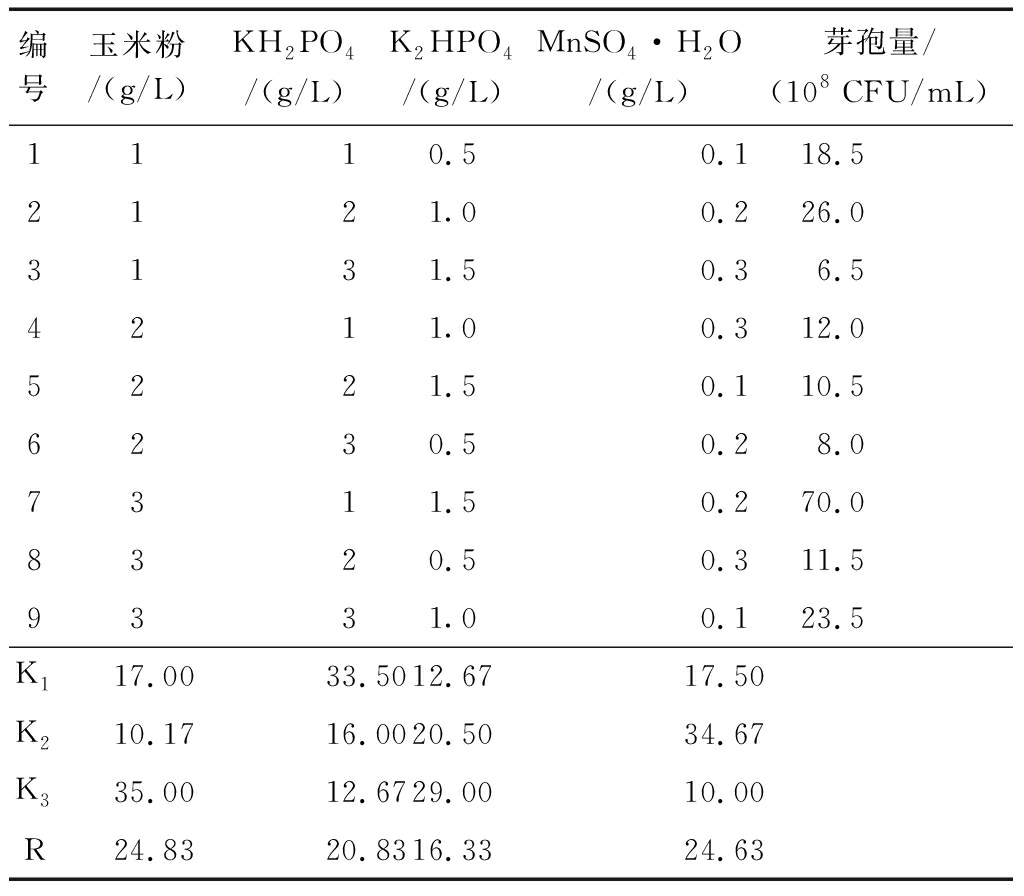
正交实验结果(表4)显示,4种因素对芽孢量的影响主次顺序为:玉米粉>MnSO4·H2O>KH2PO4>K2HPO4,所得最优组合为:玉米粉3 g/L,KH2PO41 g/L,K2HPO41.5 g/L,MnSO4·H2O 0.2 g/L。经过培养基筛选、单因素实验和正交实验最终确定培养基为:麸皮 5 g/L、玉米粉3 g/L、NaCl 5 g/L、KH2PO41 g/L、MnSO4·H2O 0.2 g/L、K2HPO41.5 g/L,芽孢含量可以达到7.0×109CFU/mL。
表4正交实验结果
2.2.4 发酵条件优化
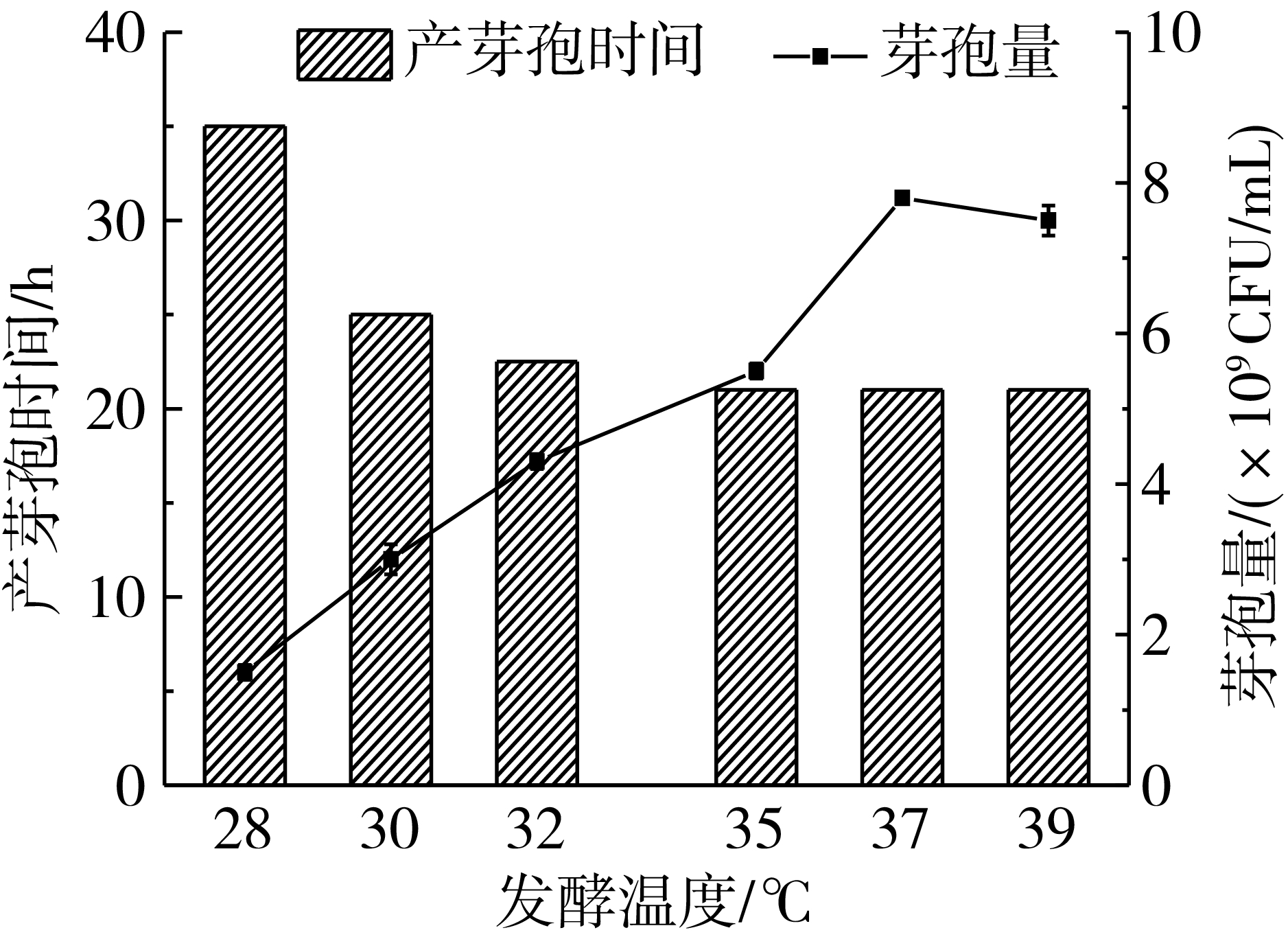
图2 培养温度对产芽孢的影响
温度和pH影响菌体的增殖速度和芽孢的形成,因此以优化获得的培养基作为发酵培养基,研究不同温度和pH对菌体产芽孢的影响。由实验结果可以看出,随着温度的升高,所获得芽孢量不断增加,产芽孢时间不断缩短,在37 ℃下经过21 h发酵,芽孢量达到最大值,芽孢量达到7.6×109CFU/mL,芽孢率达到90%以上(图2),因此选择37 ℃进行后续实验。控制发酵温度为37 ℃,发酵时间为21 h,研究不同pH对菌体增殖和芽孢生成的影响,结果见图3,由结果可以看出随着pH的升高,生物量和芽孢量呈下降趋势,在pH 6.0条件下,能够获得5.7 ×1010CFU/mL的总生物量,芽孢量为5.2 ×1010CFU/mL,芽孢率达到91%。摇瓶中不能对发酵后期的pH进行监控,因此需要在发酵罐中对发酵pH控制策略开展进一步研究。
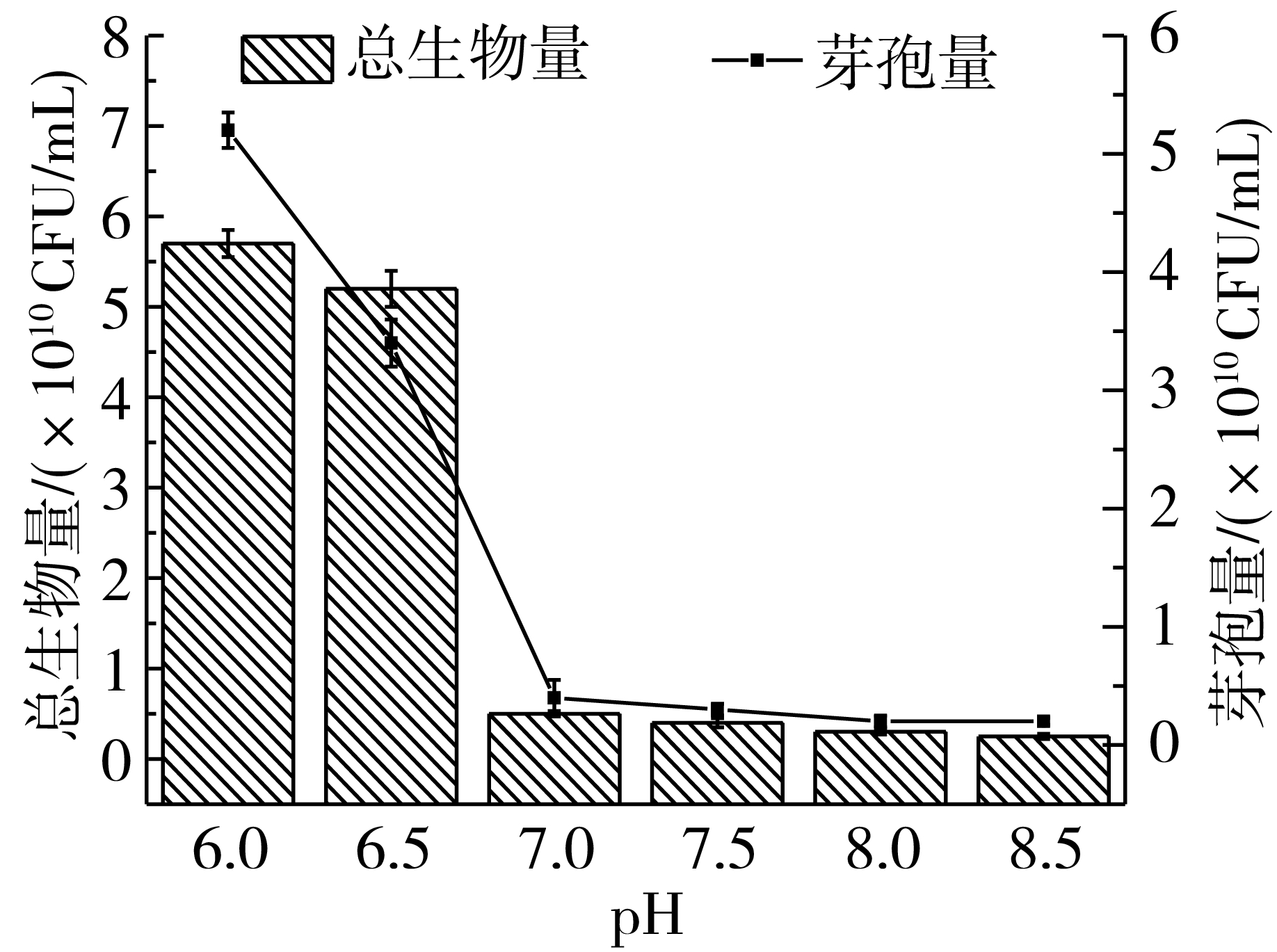
图3 初始pH对产芽孢的影响
2.3.1 pH不调控对产芽孢的影响
调节初始pH为6.0,发酵过程中不控制pH,其他条件为1.3.3所述发酵罐初始发酵条件,发酵过程变化见图4。由结果可以看出,随着发酵时间的延长,发酵pH和溶氧开始下降,经过10 h发酵,溶氧和pH达到最低值,分别为74%和4.75,然后开始反弹,发酵液最高pH可以达到8.5。经过20 h发酵,生物量达到最大,OD600=5.3,此时芽孢率达到90%,芽孢量达到2×109CFU/mL。

图4 不调节pH时发酵过程曲线
2.3.2 恒定pH对产芽孢的影响
过低的pH不利于菌体生长,导致生物量较低,通过氨水控制发酵前中期pH在6.0(图5),发酵后期由于产芽孢,细胞裂解导致pH上升,最终pH达到7.3。经过18 h发酵生物量达到最高值OD600=6.7,此时芽孢量达到3.9×1010CFU/mL,芽孢率大于95%,芽孢量和芽孢率较不控制pH值情况下有明显提高。实验证明发酵前期维持稳定的pH有利于枯草芽孢杆菌的生长,同时用于调控pH的氨水可以为菌体提供氮源,促进菌体增殖。
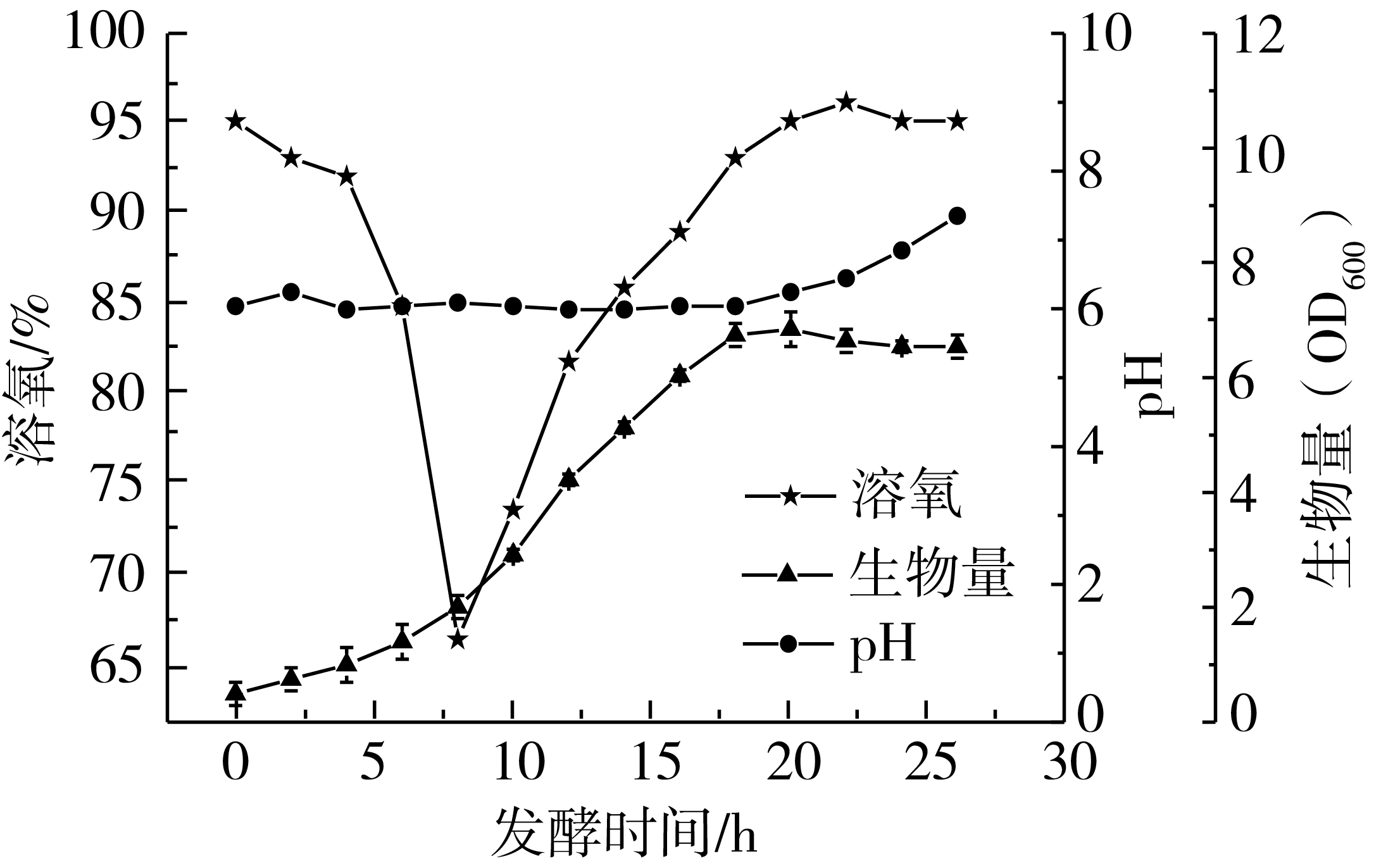
图5 控制发酵前中期pH 6.0时发酵过程曲线
2.3.3 批次补料对产芽孢的影响
调节初始pH为6.0,通过流加氨水控制发酵前中期pH在6.0,并在8 h时一次性加入补料培养基1 L,每2 h取样测定OD600,并通过镜检和稀释涂布确定芽孢率,芽孢率达到90%以上发酵结束,实验结果见图6。从图中可以看出,通过补料能够有效增加菌体含量,菌体耗氧量相应增加,控制通气和转速维持溶氧在20%以上。发酵34 h,溶氧和pH开始反弹,菌体生物量达到最大值OD600=10.0,发酵48 h溶氧反弹到65%,芽孢率达到95%,芽孢量达到最大值1.38×1011CFU/mL。

图6 批次补料发酵过程曲线
影响枯草芽孢杆菌产芽孢的三个重要因素是:遗传性状,营养水平和菌体浓度[7],通过培养基优化能够对营养水平和菌体浓度两个因素进行调节,从而影响芽孢产率和芽孢量。本文通过培养基筛选和培养基组分优化,获得了能够高效率产芽孢的培养基:麸皮5 g/L、玉米粉3 g/L、NaCl 5 g/L、KH2PO41 g/L、MnSO4·H2O 0.2 g/L、K2HPO41.5 g/L。葡萄糖含量的增加会导致芽孢量的降低。Mn2+和 Ca2+二价阳离子是芽孢中重要组成成分,添加这2种金属离子能够较大程度提高芽孢生物量和芽孢率,磷酸根能够直接影响能量代谢和Sp0A的磷酸化水平,因此对芽孢的形成具有重要作用[15]。发酵罐能够对pH和溶氧进行实时控制,流加氨水控制前中期pH=6.0,芽孢量达到3.9×1010CFU/mL。产芽孢培养基一般较贫瘠,通过补料能够弥补营养缺乏的缺点,Monteiro M.[16]、钱风光[17]等通过指数补料使得芽孢产量有了明显提高。本文通过批次补料,使得最终芽孢量达到1.38×1011CFU/mL,较批次恒定pH发酵提高了2.5倍。
发酵过程中通过补料策略能够普遍增加枯草芽孢杆菌的生物量,但在本研究中添加葡萄糖会降低ZEN降解菌的芽孢量,因此需要对补料培养基和补料策略进行持续优化,在下一步的工作中将探索不同的补料培养基和补料策略对芽孢量和芽孢率的影响。
参考文献:
[1]熊凯华, 程波财, 胡威,等. 玉米赤霉烯酮降解的研究进展[J]. 中国粮油学报, 2010, 25(1):138-142.
[2]孙建和, 陆苹, 顾红香. 真菌毒素的微生物脱毒技术[J]. 微生物学通报, 2003, 30(1):60-63.
[3]钟凤, 吴晖, 刘思利,等. 可降解玉米赤霉烯酮的重组过氧化物酶A4-Prx的纯化与活性研究[J]. 现代食品科技, 2015(8):65-70.
[4]XIANG L, WANG Q, ZHOU Y, et al. High-level expression of a ZEN-detoxifying gene by codon optimization and biobrick inpichia pastoris[J]. Microbiological Research, 2016, 193:48-56.
[5]骆翼. 玉米赤霉烯酮的微生物脱毒研究[D]. 上海:上海交通大学, 2014.
[6]孙志轩, 冼钰茵, 孙纬华,等. 分解玉米赤霉烯酮菌株的分离、鉴定及其产酶特征[J]. 微生物学通报, 2014, 41(5): 909-915.
[7]徐世荣, 陈骧, 吴云鹏. 细菌芽孢形成机制在微生态制剂生产中的应用[J]. 食品与生物技术学报, 2007, 26(4):121-126.
[8]甄静, 郭直岳, 谢宝恩,等. 枯草芽孢杆菌XK-1产芽孢条件的优化[J]. 中国农学通报, 2012, 28(27):146-151.
[9]郭夏丽,狄源宁,王岩. 枯草芽孢杆菌产芽孢条件的优化 [J]. 中国土壤与肥料, 2012(3): 99-103.
[10]郭小华, 陆文清, 邓萍,等. 益生枯草芽孢杆菌MA139增殖培养基的优化[J]. 中国农业大学学报, 2006, 11(3):41-46.
[11]王美英, 王芳, 韩金志,等.Paenibacillus polymyxaJSa-9发酵培养基优化及其在黄瓜枯萎病中的应用研究[J]. 南京农业大学学报, 2016, 39(4):673-680.
[12]宋卡魏, 王星云, 张荣意. 培养条件对枯草芽孢杆菌B68芽孢产量的影响[J]. 中国生物防治学报, 2007, 23(3):255-259.
[13]张文芝, 王云鹏, 刘红霞,等. 蜡质芽孢杆菌AR156发酵培养基及发酵条件的优化[J]. 微生物学通报, 2010, 37(6):803-810.
[14]陈秋红, 孙梅, 匡群,等. 培养条件对凝结芽孢杆菌芽孢形成的影响[J]. 生物技术, 2009, 19(1):77-81.
[15]郭学军. 细菌芽孢形成过程中的基因调控[C]//中国畜牧兽医学会家畜传染病学分会第六届全国会员代表大会暨第11次学术研讨会, 2005.
[16]MONTEIRO S M,CLEMENTE J J, HENRIQUES A O, et al. A Procedure for high-yield spore production bybacillus subtilis[J]. Biotechnology Progress, 2005, 21(4): 1026-1031.
[17]钱风光,陈守文,蔡皓. 生防菌枯草芽孢杆菌BS-5在3L发酵罐中的发酵工艺优化[J]. 中国生物防治, 2009, 25(1): 74-78.
LIU Hu-jun,CHANG Xiao-jiao,WANG Nan-xi,ZHAO Yi-fan,DU Wen,SUN Chang-po
(Academy of State Administration of Grain,Beijing 100037)
Abstract:The medium with high sporulation rate and quantity was obtained by selecting medium component, single factor experiment and orthogonal experiment, and the pH and temperature was optimized for the optimal culture condition. The medium and condition were verified in 20 L fermenter and the controlling of pH and fed-batch fermentation was explored. The optimal culture medium was: wheat bran 5 g/L, corn flour 3 g/L, NaCl 5 g/L, KH2PO41 g/L, MnSO4·H2O 0.2 g/L and K2HPO41.5 g/L. Cultured in shake flask with pH 6, 200 r/min, at 37 ℃ for 21 h, the sporulation rate reached to 91% and sporulation quantity 5.2×1010CFU/mL. In larger experiment, cultured in 20 L fermenter with constant pH and fed-batch fermentation, the sporulation rate reached to 95% and sporulation quantity 1.38×1011CFU/mL. The production process of the ZEN-degrading strain ASAGW-10 was obtained, which provided the guarantee for the subsequent study on the degrading bacteria and application.
Key words:zearalenone;bacillus subtilis; spore; cultivation condition
收稿日期:2017-12-13
中图分类号:TS 201.3
文献标识码:A
文章编号:1007-7561(2018)04-0050-05
基金项目:“十二五”国家科技支撑计划 (2015BAK43B03)
作者简介:刘虎军,1986年出生,男,硕士.
通讯作者:孙长坡,1975 年出生,男,研究员.