陈 成
(河南工大设计研究院,河南 郑州 450001)
摘 要:调质的目的是改变小麦中水分的含量,提高粮食的加工品质。以三种具有代表性的国产小麦(软、中、硬)为实验材料,设置梯度温度,采用低场核磁共振技术研究不同条件下水分状态变化;用核磁共振成像技术(NMRI)研究不同条件下的水分迁移规律。结果表明:在不同调质温度条件下,各样品T21、A21均呈显著上升趋势;T22、A22呈先下降后上升趋势;T23与温度为正相关性,A23调质初期达到峰值之后逐渐下降。NMRI表明水分在小麦籽粒内传导有两个主要路径和一个辅助路径,一是水分通过珠心层进入胚部向茸毛端扩散,二是透过糊粉层细胞壁由外向内渗透;辅助路径为水分从茸毛端逐步向胚乳中心扩散。
关键词:小麦;调质;核磁共振;水分
水分是小麦中重要组分之一,对小麦物理化学性质的影响具有关键作用[1]。比如在小麦中发生的蛋白质变性、脂肪酸水解、酶活性大小、面团的形成、淀粉凝胶化等反应均与水分有着密切关系[2]。研究小麦调质过程水分状态变化和水分迁移对于优化小麦加工工艺和提高小麦粉品质有积极作用。本研究利用核磁共振技术探究常规调质过程水分状态的分布情况,对于深层次揭示小麦调质中不同因素对水分影响的机理及在生产实践中通过选择性配置润麦条件实现润麦时间调控均有一定意义。
国麦301(GM301),豫农982(YN982),郑麦366(ZM366)。
VTMR2010V-T核磁共振食品成像分析仪,磁体强度0.52 T;JE3002精密电子称量天平;微型恒温箱。
1.2.1 小麦样品处理
先将小麦过筛,清除杂质,再取适量小麦籽粒于托盘中,用镊子捡出虫蚀粒、病斑粒、破损粒及瘪麦粒。
1.2.2 小麦调质方法
称取150 g小麦样品于自封袋中,根据小麦籽粒含水量指标,精确计算调质至15%的加水量,设置温度梯度为20、25、30 ℃。在恒温条件下静置调质。封口混合充分摇匀3 min,置于调质箱中进行调质,设定总调质时间为24 h。加水量计算公式为:
加水量![]()
式中:W为调质样品重,g;M1为目标水分,%;M0为原始水分,%。
通过恒温箱进行控温。调质准备阶段调节恒温箱使温度恒定达到实验要求,调质进行中随时监测温度变化,及时调控温度恒定,确保实验过程具有可重现性。
1.2.3 弛豫时间的测定
每次取大约1 g小麦置于核磁测试管中,高度控制在2.2~2.5 cm。鉴于调质过程前期水分变化较快,后期放缓,设置不同的间隔时间测定,时间梯度为:0、1/6、1/3、2/3、1、1.5、2、3、4、6、8、12、16、24 h,总调质时间为24 h。
1.2.4 核磁参数设置
采用CPMG ( Carr-Purcell-Meiboom-Gill)脉冲序列测量自由诱导指数衰减曲线,对曲线进行反演操作,利用T2_FitFrm 软件调用CPMG 序列拟合得到T2,获得水的不同组态、弛豫时间、相对含量等信息。核磁共振软件采集自旋回波串峰值并自动生成.pea 文件保存,重复采集4次。测试条件:序列参数设置: 采样点数TD = 249 612,主频SW = 200 kHz,累加次数NS = 4,回波时间(Echo Time) = 100 μs,回波数(Echo Count) = 5 000。运算参数: 反演点数200,弛豫时间点数100,迭代次数1 000 000。运用Excel,SPSS和Origin软件处理分析数据。
1.2.5 质子信号幅度
采用多组分模型拟和质子弛豫过程,如下方程:
式中A1、A2、A3分别代表T21、T22、T23的质子信号幅度。
1.2.6 小麦调质过程成像
小麦核磁共振成像技术(MRI)实验参数设置:重复时间TR=200 ms,回波时间TE=5.42 ms,矩阵200×128,视野FOV X=FOV Y=40 mm,D0=178 ms,相位编码时间D1=0.1 ms,累加次数NS=256,梯度幅度GxAmp/%=77.8,GyAmp/%=41.6,GzAmp/%=25.3。利用O-siris处理质子密度,图像以BMP格式保存。成像时间梯度分别为:0、4、12、24 h。成像位置:上:ZM366,中:YN982,下:GM301。
2.1.1 调质温度对T21和A21的影响
由图1可知,不同温度梯度的小麦T21均呈上升趋势,前期变化剧烈,后期趋于平缓;不同小麦品种趋于平缓的时间不同,GM301与YN982在调质时间6 h时各温度梯度基本趋于稳定状态,而ZM366在调质时间为8 h时趋于稳定,品种差异性显著。随调质温度的上升,各品种小麦T21值均呈先下降后上升的趋势,总体呈升高趋势,说明各品种小麦结合水的流动性增强,质子移动性加快,结合水的弛豫特性与温度呈正相关关系。温度为25 ℃时各小麦的T21值均低于其他两个梯度,过程值和终值均符合此规律,推测原因25 ℃是促进水分与蛋白质、多糖等大分子结合的酶类最大活性的最适温度[3],造成此温度下水分子与水分子之间、水分子与大分子之间的结合强度最大,键力最强[4]。
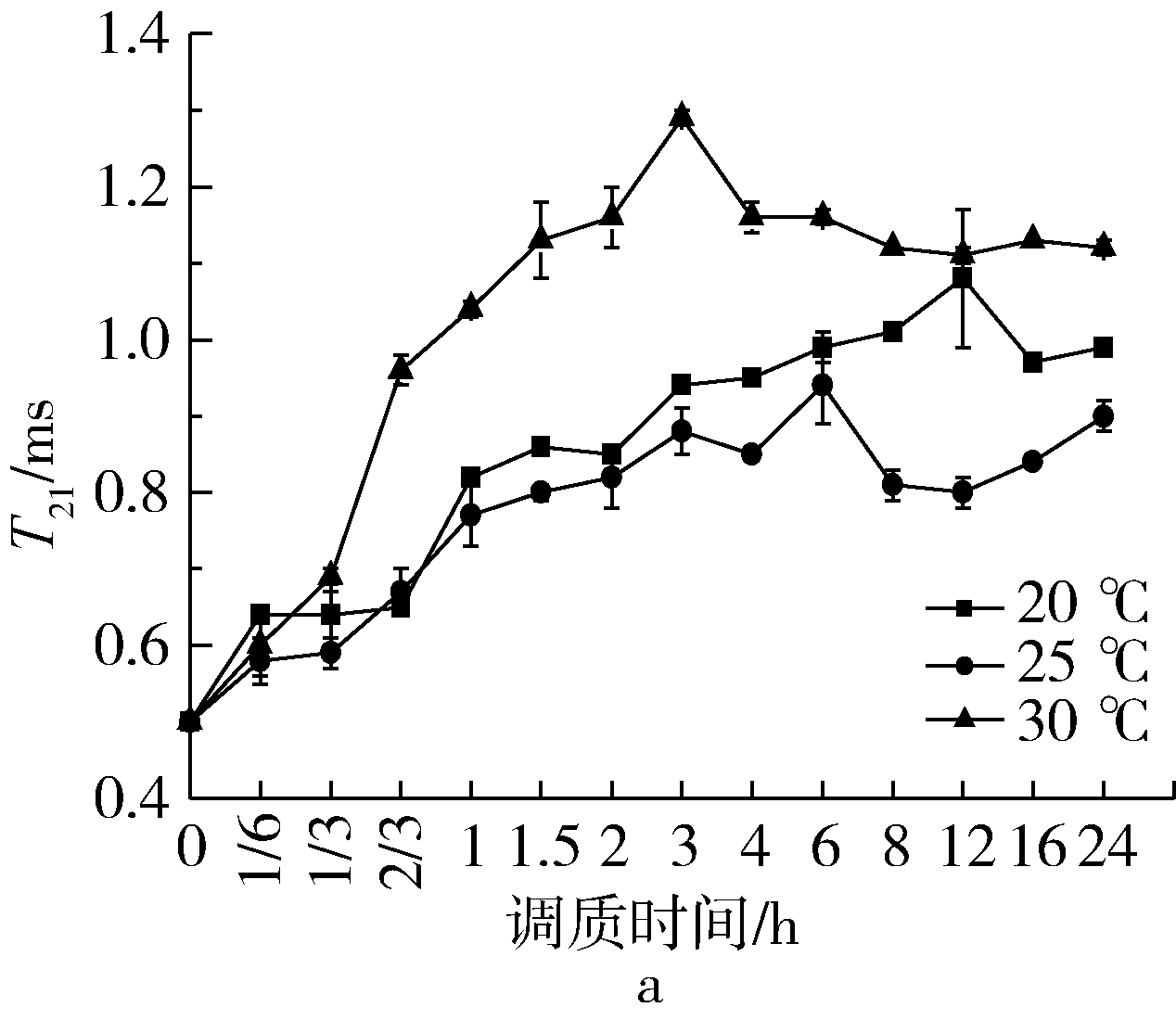


图1 温度对调质过程T21的影响
注:a:GM301;b:YN982;c:ZM366,下同。
图2是温度对调质过程中A21的影响。随温度的上升,各品种水质子信号幅度A21在各温度梯度均曲折上升,说明温度的增加可以提高结合水的相对含量,蛋白质和多糖、脂类能够加强与水分子的作用,大分子物质与水分子的结合机会随温度的升高而增加,麦粒内部的大分子可以锁住更多的水分子,促进水分子与其键合的能力[5]。整个调质过程,T21基本处于迁入状态,表明中间状态水与自由水有向结合水不断转化的趋势,调质后期A21略有起伏逐渐趋于稳定状态。调质前期质子信号幅度A21变化率与小麦硬度呈负相关性,与温度呈正相关性,提高调质温度可以增加结合水的相对含量。由实验结果可知温度的提升可以缩短A21所需达到稳定状态的时间,为实际工业生产中缩短润麦时间提供科学参考。三种小麦样品的A21终值与品种的相关性差异显著,表明小麦籽粒硬度对于A21终值影响显著;调质温度较低时终值与小麦硬度呈负相关性(P<0.05),温度较高时三种样品的A21终值差异不显著,原因可能是温度提高时,水分子的活动更加剧烈,逐步减小由于小麦籽粒硬度造成水分迁移的影响,由此使软、中、硬三种小麦的差异性不显著。


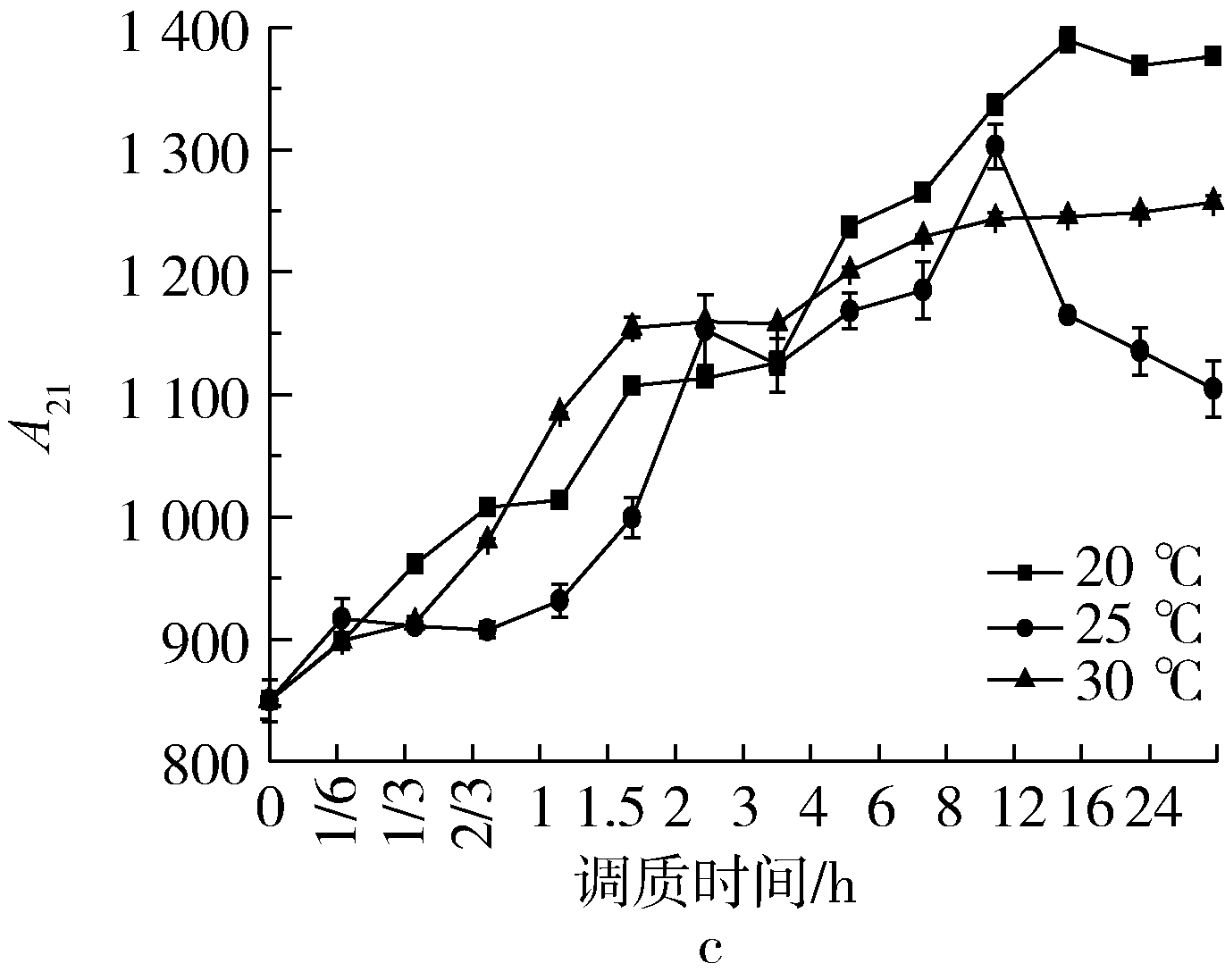
图2 温度对调质过程A21的影响
2.1.2 调质温度对T22和A22的影响
图3是温度对调质过程中T22的影响。在温度和时间的双重作用下,T22呈现曲折态势。不同品种小麦弛豫时间T22有较大的差异性,GM301T22值集中在3.19~5.76 ms范围内,YN982和ZM366T22值集中在3.27~7.26 ms之间,即中间状态水T22值变化幅度与小麦籽粒硬度为显著正相关性(P<0.05),原因可能是软质小麦胚乳细胞内含物淀粉和蛋白质结合松散,结合强度较硬质麦粒较低,且细胞内含物之间结合不牢固[6]。软质小麦表面粘附有较多的分子量为15 000原子质量单位的蛋白质,硬质小麦淀粉粒表面该蛋白质含量较少或为零,此类蛋白质通过各类基团与水分结合,束缚水分子的运动性,降低其流动性。调质初期,各温度梯度T22均显著增大,且增长速率与温度呈负相关性,硬麦的变化速率显著大于软麦的速率。调质中期各温度梯度和各样品小麦T22值均过渡到平缓期,各个时间点T22值差异性不显著,原因可能是在此阶段水分由小麦表皮进入糊粉层和籽粒内部,水分从细胞间隙逐步渗透至细胞内部与其他大分子结合,渗透速率与结合速率大致达到一种平衡状态;调质后期各温度梯度和调质时间点T22值出现波动态势,出现先降低和后升高的趋势且各温度间差异性显著。


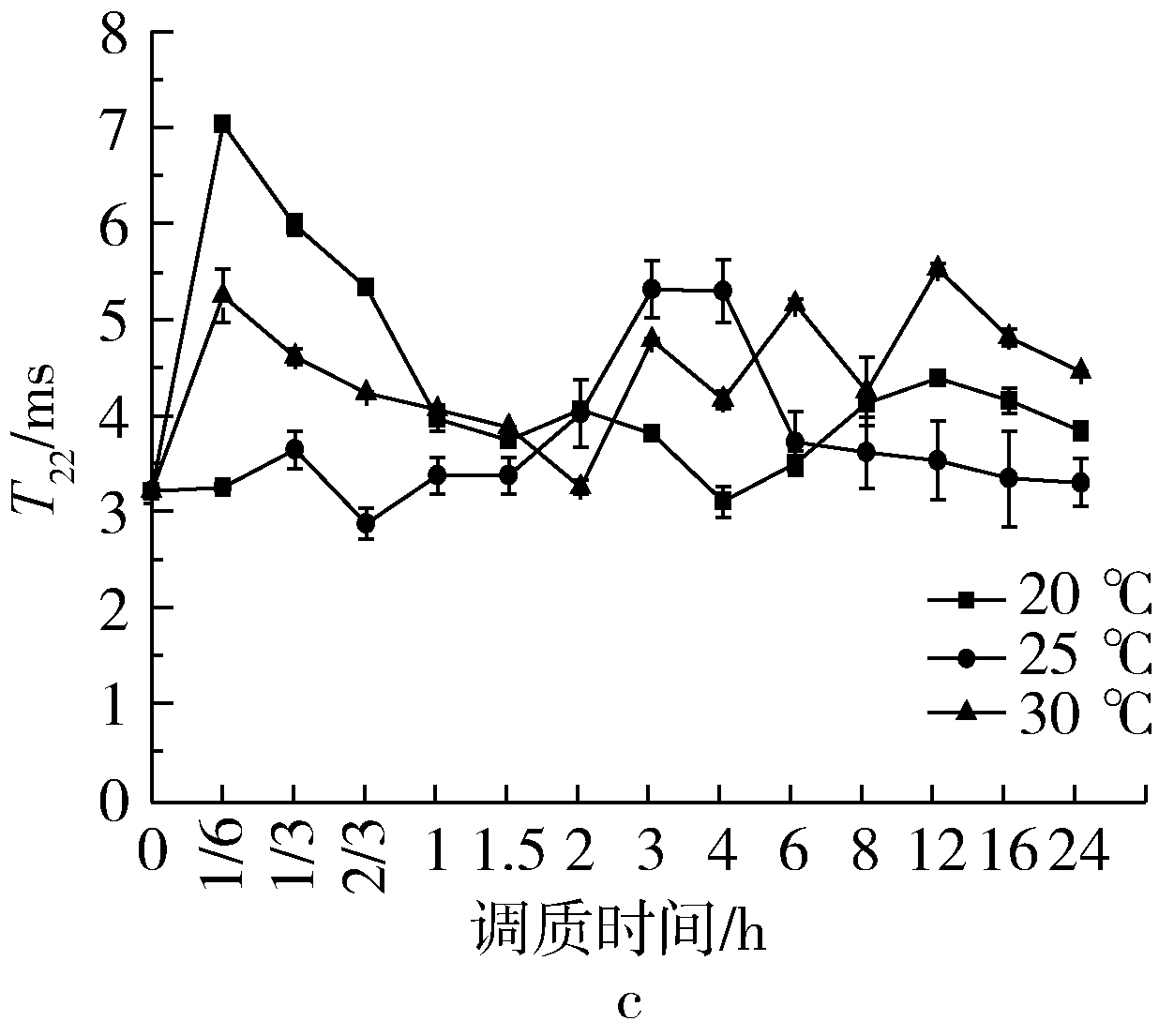
图3 温度对调质过程T22的影响
图4是温度对调质过程中A22的影响。由图可知,加水调质20 min后软麦GM301和硬麦ZM366质子幅度A22值极速升高至最大值,YN982在调质40 min后A22值为最高值,且与温度梯度A22至最大值时间基本一致,即中间状态水分相对含量在调质初期即到最高值,温度对质子幅度A22最大值所需时间影响不显著,小麦内部分布着纵横贯通的多孔性毛细管,有效表面积总和超过小麦本身外部表面积的20倍,水分通过有效面积与麦粒组分迅速结合成为中间状态水[7]。实验结果与Banaszek研究谷物的水分吸附速率,发现谷物的水分吸附速率会随相对湿度和温度的增加而加快、随时间的增长而逐渐放缓的结果一致[8]。随小麦籽粒硬度的增加A22峰值与硬度呈极显著正相关性(P<0.01),硬麦ZM366A22最大值为455.01,中等硬度麦YN982最大值为373.54,二者差异率为21.81%,软质麦GM301A22最大值为308.94,与硬麦差异率为47.28%,原因可能是软麦籽粒中含有更多的小分子量蛋白通过羟基、氨基、羰基、酰基和亚氨基等具有氢键键合能力的中性基团,相互作用形成氢键,在大分子内或大分子间形成水桥,反之水桥阻挡滞留更多的水分子形成网状结构,造成硬麦籽粒A22最大值大于其他样品。



图4 温度对调质过程A22的影响
2.1.3 调质温度对T23和A23的影响
图5是温度对调质过程中T23的影响。由图可知,调质初期自由水流动性迅速升高,呈直线上升趋势,各个温度梯度与样品均符合此规律。原因可能是小麦内部分布多孔性毛细管,具有吸附气体及水蒸汽的能力。当水分或气体充满小麦的间隙,一部分水分或气体被吸附在麦粒表面,另一部分水分或气体分子通过籽粒内部的毛细管向细胞间隙中扩散,被毛细管的内壁所吸收,造成自由水增多和T23值增大[9]。不同品种T23的增长速率有明显差异,GM301与YN982增长速率明显高于ZM366,调质进程为1.5 h有所放缓,由此T23增长速率与小麦籽粒硬度有负相关性,原因可能是不同硬度小麦籽粒内蛋白质基质和淀粉颗粒之间的结合程度不同,外露的亲水性和疏水性基团的种类不同,如亲水性基团中的羧基、羰基、羟基和疏水性基团中的烃基、硝基等基团,造成与自由水的结合程度和结合速度不同[10]。
随调质时间的增加,T23值达到峰值后逐渐下降至稳定平衡的状态。各温度梯度间T23值在调质过程有明显区别,当调质温度为20 ℃与25 ℃时,T23值在软麦和中等硬度麦内部差异性不显著,硬麦ZM366中差异较显著,在调质时间内呈交叉曲折上升之势;调质温度为30 ℃时,各个样品T23值均表现显著高于其他温度梯度的T23值,此规律与温度梯度下T21值变化规律保持一致。原因是小麦籽粒具有导热性,水分子的运动是随热量的流动方向而转移,利用热的因素小麦内水分子内移或外导产生迁移现象[11],水分子的运动能力与温度呈正相关性,由此造成30 ℃下自由水活动加剧。



图5 温度对调质过程T23的影响
图6是温度对调质过程中A23的影响。A23指的是小麦籽粒内流动性最高的这部分水的相对含量,这类水分又可分为滞化水、毛细管水、自由流动水,可结冰和溶解溶质,小麦被干燥时最易被除去一部分的水分[12]。由图6可知,各样品温度梯度调质初期A23值迅速升高,调质时间为10 min时达到峰值,然后逐步下降至平稳范围,此规律与Babbit 研究小麦籽粒水分吸附的定性结果一致[10]。原因可能是小麦具有吸附性和导热性,水分通过麦粒表面的多孔性毛细管逐步进入籽粒内部,水分以液体的形式在毛细管内扩散,通过密集孔道在细胞间隙传导[13],传导过程一部分水分子渗透至细胞内部与胶体微粒结合,形成中间状态水,完成由自由水向中间状态水转化的过程;另一原因是小麦皮层主要成分是碳水化合物,碳水化合物中膳食纤维(包括纤维素、半纤维素和木质素)较多,而这些膳食纤维含较多葡萄糖残基有大量亲水性基团,具备很强的吸水膨胀性,对水分的扩散和传导有较强的积极作用[14]。不同硬度小麦A23值的表现规律有所不同,结果显示:A23值在达到最高值后各样品温度梯度均回复到稳定的范围内波动,在调质时间分别为4 h和6 h时,GM301、YN982和ZM366达到相对较低的水平,即小麦籽粒的硬度越低,所需调质时间越短。另外笔者发现硬度较低的小麦皮层外部水分较快的渗透至内部,通过直观观察的角度也可说明水分迁移和转化的速率,软质小麦明显快于硬质小麦;当调质时间为8 h时,各样品和各调质条件A23值均基本确定,说明自由水含量在不同因素和水平的影响下均已稳定;调质后期,软麦和中等硬度麦A23值反弹,出现略微升高的趋势,类似吐水现象;各样品温度梯度A23终值与初始值差异性不显著(P<0.05),表明小麦调质过程自由水含量的变化较小,其他两种水分的变化较为明显。自由水向中间状态水和结合水的转化和迁移的过程结束。

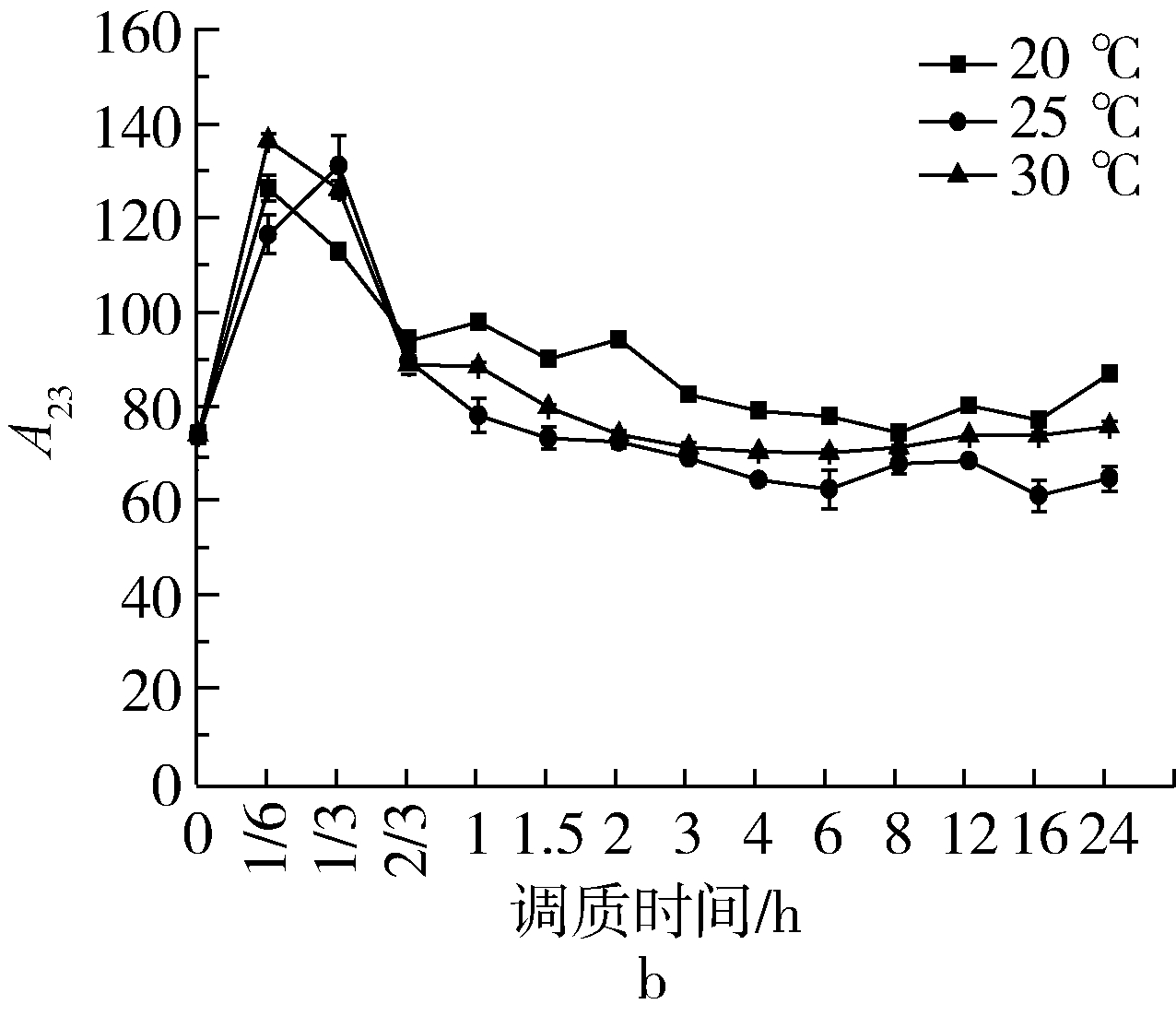
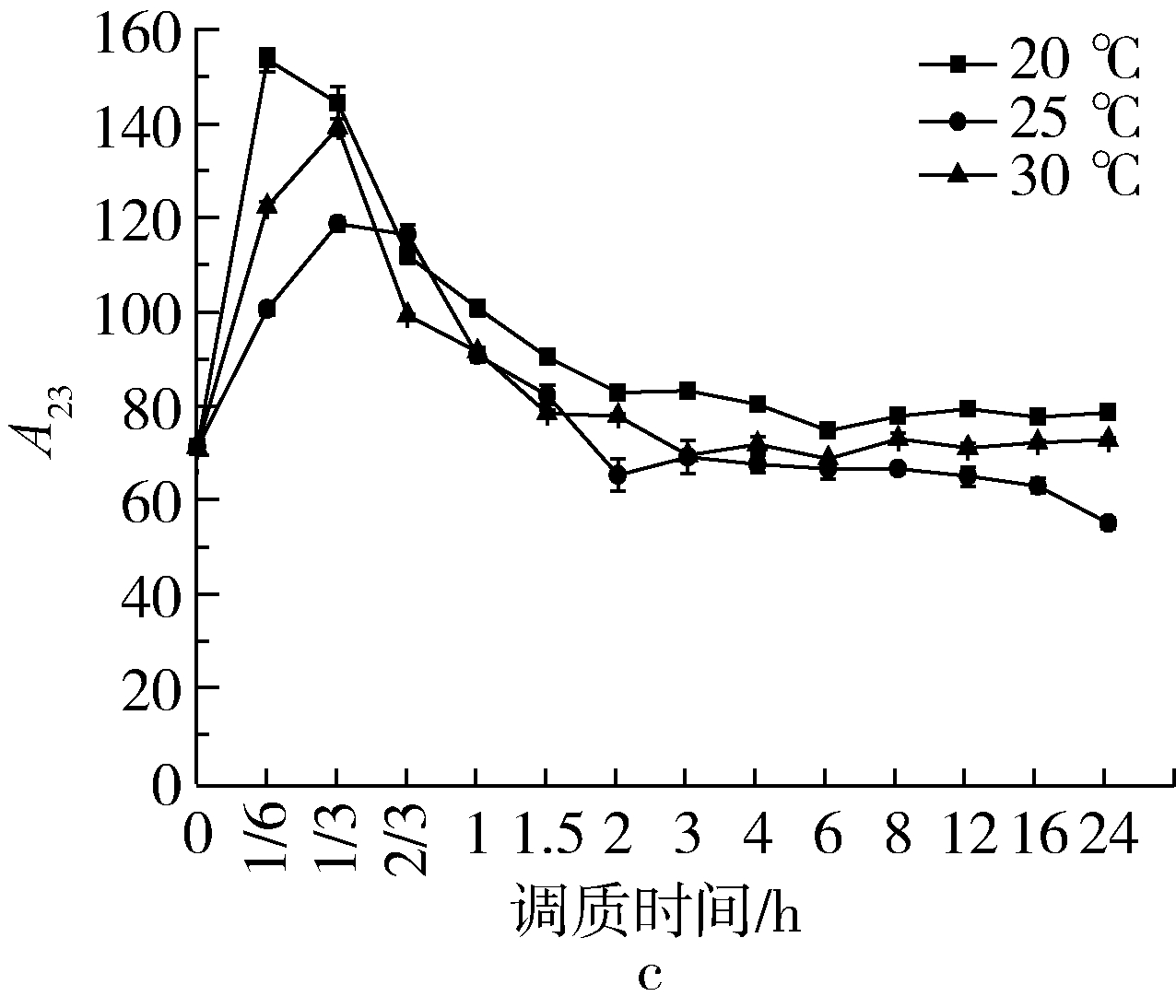
图6 温度对调质过程A23的影响
图7、图8分别是调质时间与浸泡时间对小麦NMRI的影响,成像时间依次为0、4、12、24 h。核磁共振成像原理与传统显微镜相似,样品本身中的氢原子作为造影剂,且这种造影剂无需染色或定影。成像核心技术是取得样品质子的空间分布信息,样品单位体积组分化学特性和物理结构对信号有一定影响,组织成分中水分含量是影响成像清晰度的主要因素,原因是水分含量是信号强度(S)、信噪比(S/N)和成像分辨率的决定性因素[15]。由图7可知,原粮水分主要集中在小麦胚部,胚乳中心区域水分含量较外层高,调质初期水分通过胚部进入糊粉层和胚乳,与Seckinger利用碘色法和Stenvert通过辐射法研究水分渗透的路径一致。水分进入小麦籽粒后重新分布在内部组织,表层区域水分含量较低,原因是小麦皮层是一种选择透过性生物膜,保持水分在籽粒内部。调质末期及完成时胚部水分含量仍远高于其他组织[16]。从图8可知,小麦浸泡过程水分传导有两种主要路径和一种次要路径,一是水分通过珠心层进入胚部向茸毛端扩散。二是透过糊粉层细胞壁由外向内渗透,传导速度与皮层距离呈反比,原因是内部组织细胞壁较薄,水分传导路径较小和传导阻力升高。辅助路径为水分从茸毛端逐步向胚乳中心扩散。另外,水分传导速率与小麦籽粒的粒径、小麦硬度、淀粉细胞形态和细胞壁宽窄有关,造成YN982的NMRI图像色彩阈较低。浸泡完成时胚乳中心水分梯度较高,且从胚部至茸毛端水分含量依次降低,再次证明胚部是水分传导主要路径之一。
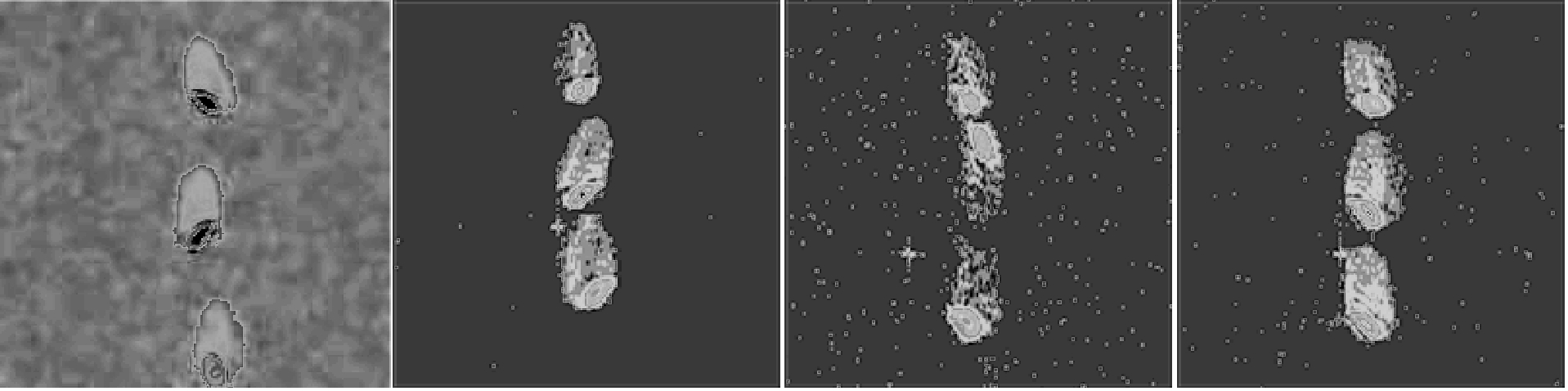
图7 调质时间对小麦MRI的影响
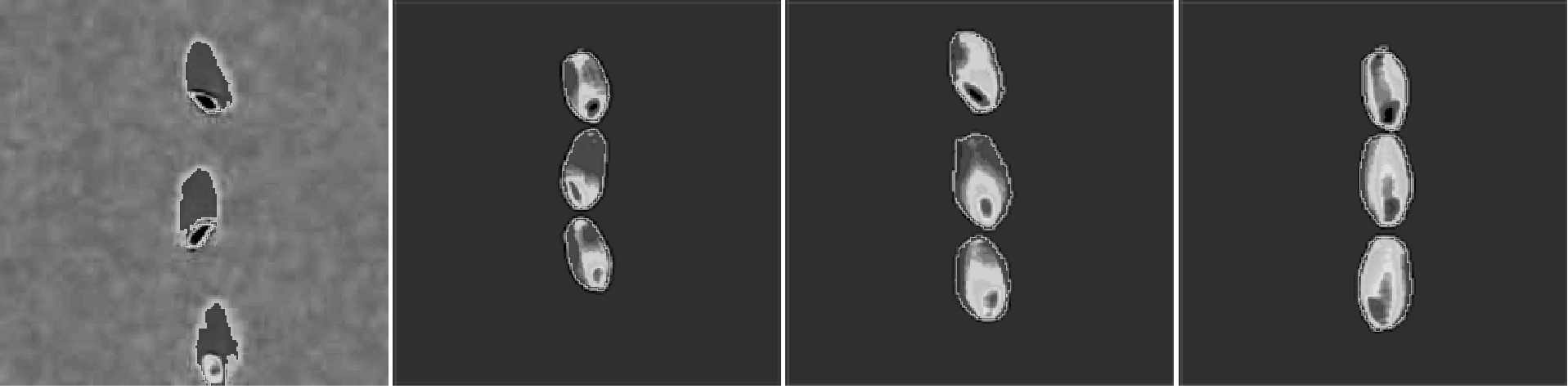
图8 浸泡时间对小麦MRI的影响
在不同调质温度条件下,各样品T21、A21均呈显著上升趋势,调质初期变化速率较快,调质后期趋于平缓稳定,T21值与调质温度呈显著正相关,A21值、稳定时间与小麦硬度呈正相关性;T22、A22呈现先下降后上升趋势,T22变化率与小麦硬度呈显著正相关性,与温度呈负相关性,A22值与调质温度呈极显著正相关性,随调质时间的增加变化率降低;T23与调质时间、温度呈正相关性,与小麦硬度呈负相关性,A23调质初期达到峰值后逐渐下降,与小麦硬度无显著相关性。
小麦调质过程NMRI表明水分在小麦籽粒内传导两种主要路径和一种辅助路径,一是水分通过珠心层进入胚部向茸毛端扩散,二是透过糊粉层细胞壁由外向内渗透,辅助路径为水分从茸毛端逐步向胚乳中心扩散。浸泡完成时胚乳中心水分梯度较高,且从胚部至茸毛端水分含量依次降低,再次证明胚部是水分传导主要路径之一。
参考文献:
[1]赵学敬. 论小麦水分调节的力学效应与潜伏功能[J]. 粮食加工, 2009 (1):13-15.
[2]Krishnan P, Joshi D K, Nagarajan S, et al. Characterisation of germinating and non-germinating wheat seeds by nuclear magnetic resonance (NMR) spectroscopy[J]. European Biophysics Journal, 2004, 33(1):76-82.
[3]Krishnan P, Joshi D K, Maheswari M, et al. Characterisation of soybean and wheat seeds by nuclear magnetic resonance spectroscopy[J]. Biologia Plantarum, 2004, 48(1):117-120.
[4]Horigane A K, Takahashi H, Maruyama S, et al. Water penetration into rice grains during soaking observed by gradient echo magnetic resonance
imaging[J]. Journal of Cereal Science, 2006, 44(3): 307-316.
[5]王晓曦, 王绍文. 润麦水分对中筋小麦品质特性的影响[J]. 河南工业大学学报:自然科学版, 2012, 33(1):11-16.
[6]Horigane A K, Takahashi H, Maruyama S, et al. Water penetration into rice grains during soaking observed by gradient echo magnetic resonance imaging[J]. Journal of Cereal Science, 2006, 44(3): 307-316.
[7]Mcentyre E, Ruan R, Fulcher R G. Comparison of water absorption patterns in two barley cultivars, using magnetic resonance imaging[J]. Cereal Chemistry, 1998, 75(6):792-795.
[8]BanaszekL,Banaszek M M, Siebenmorgen T J. Adsorption equilibrium moisture content of long-grain rough rice[J]. Trans of the Asae, 1990, 33(1):247-252.
[9]李资玲,刘成梅,万婕,等.核磁共振研究膳食纤维面包制作过程的水分迁移行为[J]. 食品科学, 2007, 28(10): 127-130.
[10]Babbit J D.Observation on the adsorption of water vapor by wheat[J]. Canadian J Research,1949,27:55-72.
[11]Horigane A K, Takahashi H, Maruyama S, et al. Water penetration into rice grains during soaking observed by gradient echo magnetic resonance imaging[J]. Journal of Cereal Science, 2006, 44:307-316.
[12] Lzydorczyk M S, Chornick T L, Paulley F G, et al. Physicochemical properties of hull-less barley fibre-rich fractions varying in particle size and their potential as functional ingredients in two-layer flat bread[J]. Food Chemistry, 2008, 108(2): 561-570.
[13]Kweon M, Slade L, Levine H. Solvent retention capacity (src) testing of wheat flour: Principles and value in predicting flour functionality in different wheat-based food processes and in wheat breeding-A review[J]. Cereal Chemistry, 2011, 88(6): 537-552.
[14]Ghosh P K, Jayas D S, Smith E A, et al. Mathematical modelling of wheat kernel drying with input from moisture movement studies using magnetic resonance imaging (MRI), Part I: Model development and comparison with MRI observations[J]. Biosystems Engineering, 2008, 100(3): 389-400.
[15]丁正耀. 高水分小麦热风干燥特性及工艺研究[D]. 安徽农业大学, 2012.
[16]Saulnier L, Guillon F, Chateigner-Boutin A L. Cell wall deposition and metabolism in wheat grain[J]. Journal of Cereal Science, 2012, 56(56):91-108.
CHEN Cheng
(Design and Research Institute, Henan University of Technology, Zhengzhou Henan 450001)
Abstract:The purpose of tempering is to change the moisture content of wheat and improve the processing quality of grain. Three kinds of representative domestic wheat (soft, medium and hard) were used as experimental materials, and the temperature gradient was set, and the water state change under different conditions was studied by using low-field nuclear magnetic resonance (NMR) technology; the water migration patterns under different conditions were studied by nuclear magnetic resonance imaging (NMRI).The results showed that:T21andA21of the samples showed a significant upward trend under different tempering temperature;T22,A22first decreased and then increased;T23was positively correlated with temperature, andA23reached the peak at the preliminary stage of tempering then decreased gradually. NMRI showed that there were two major pathways of moisture and one ancillary path in wheat kernel. One was moisture diffused through the nucellar layer into the germ line, the other was moisture infiltrated through the cell wall of the aleurone layer; the auxiliary path was moisture diffused from the fuzzy end to the endosperm center.
Key words:wheat; tempering; nuclear magnetic resonance (NMR); moisture
收稿日期:2018-01-04
中图分类号:TS 210.1
文献标识码:A
文章编号:1007-7561(2018)04-0006-07
基金项目:国家自然科学基金项目(31271815,31301594);现代农业产业技术体系建设专项(CARS-14);“十二五”国家科技支撑计划课题(2012BAD34B01)
作者简介:陈成,1990年出生,男,硕士.