一种转基因马铃薯PCR鉴别方法的建立
周延培,孙海新,赵美丽,崔玲君
(山东世通检测评价技术服务有限公司,山东 青岛 266000)
摘 要:为建立一种鉴别转基因马铃薯的PCR方法,设计转基因马铃薯常用调控元件的特异性引物,以4种转基因马铃薯标准品系EH92-527-1、AV43-6-G7、AM04-1020、PH05-026-0048为模板进行单基因PCR和多重PCR扩增工艺方法研究。经琼脂糖凝胶电泳结果分析后,从中筛选出一组引物特异性较强,且无交叉污染或非特异性扩增现象的引物组合对。对9种已知转基因马铃薯样品进行多重PCR验证,均得到条带清晰且区分明显的目的条带。成功建立了能够快速、准确鉴别转基因马铃薯中多种调控元件的多重PCR与单基因PCR相结合的检测方法。
关键词:转基因马铃薯;PCR方法;鉴别
随着转基因技术的不断发展,转基因作物的种植面积也在不断扩大。马铃薯是世界上仅次于小麦、水稻和玉米的第四大食用作物,也是目前种植最多的转基因作物之一[1-2]。目前国外已获批的转基因马铃薯有40多种,主要涉及抗马铃薯甲虫、抗病毒、品种改良三大类,但是中国还未有获批的转基因马铃薯[3]。转基因技术在给社会带来巨大利益的同时,食品安全问题也令广大消费者担忧。因此,如何快速、准确、灵敏地检测转基因马铃薯是当前面临的十分重要的问题。
目前,对于转基因食品的检测主要包括蛋白检测技术和核酸检测技术两大类[4]。其中,蛋白检测技术主要包括酶联免疫吸附法(Enzyme Linked Immunosorbent Assay, ELISA)和免疫试纸条法(Lateral Flow Strips),有研究报道通过ELISA定量检测方法对大豆外源蛋白CP4 EPSPS进行检测,其灵敏度可达0.007 5%[5]。核酸检测技术主要包括定性PCR检测技术和荧光定量PCR检测技术等[6-7]。PCR技术被广泛应用于多种转基因作物检测中,不仅可以检测出是否含有转基因成分,还可以鉴别出所转入的目标基因。Shirai等利用PCR技术成功检测抗草甘膦大豆Round-up-ready的CaMV35S启动子和NOS终止子[8]。此外,巢式PCR和多重PCR是在普通PCR基础上建立起来的技术,也被用于转基因作物检测[9-11]。董立明等人利用多重PCR方法快速检测5个转基因大豆品系,其检测灵敏度达到0.1%[12]。在转基因马铃薯检测方面,白月等人利用多重PCR-HPLC方法快速检测转基因马铃薯EH92-527-1品系,可以同时对转基因马铃薯内4个内、外源基因进行同步筛选检测[13]。但该方法操作较繁琐,只能针对已知功能基因的样品进行检测,对于鉴别未知基因成分样品的检测有一定局限性,尤其是作为第三方检测机构行业更加困难。对于如何快速、准确鉴别转基因马铃薯的方法的研究还未见报道。
本研究以转基因马铃薯标准品为研究对象,通过引物组合筛选,多重PCR反应体系优化,建立一种能同时检测转基因马铃薯调控元件的引物组合的方法,为快速、准确鉴别转基因农产品奠定一定基础。
1 材料与方法
1.1 材料与试剂
转基因马铃薯标准品:均购自深圳卓越生物科技有限公司;待测马铃薯样品:市场购买;DNA提取试剂盒:上海生物工程有限公司;Taq PCR Master Mix(2×,red dye):上海生物工程有限公司。
1.2 仪器与设备
基因扩增PCR仪(K960C):青岛戎月生物技术有限公司;凝胶成像仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 样品DNA提取
采用商品化的DNA提取试剂盒,使用核酸蛋白仪测定模板DNA的纯度和浓度,纯度在1.8~2.0 之间,浓度稀释至25 ng/μL。
1.3.2 引物设计
研究设计转基因马铃薯中4种常用筛选引物,其引物序列见表1。
表1 PCR引物序列信息
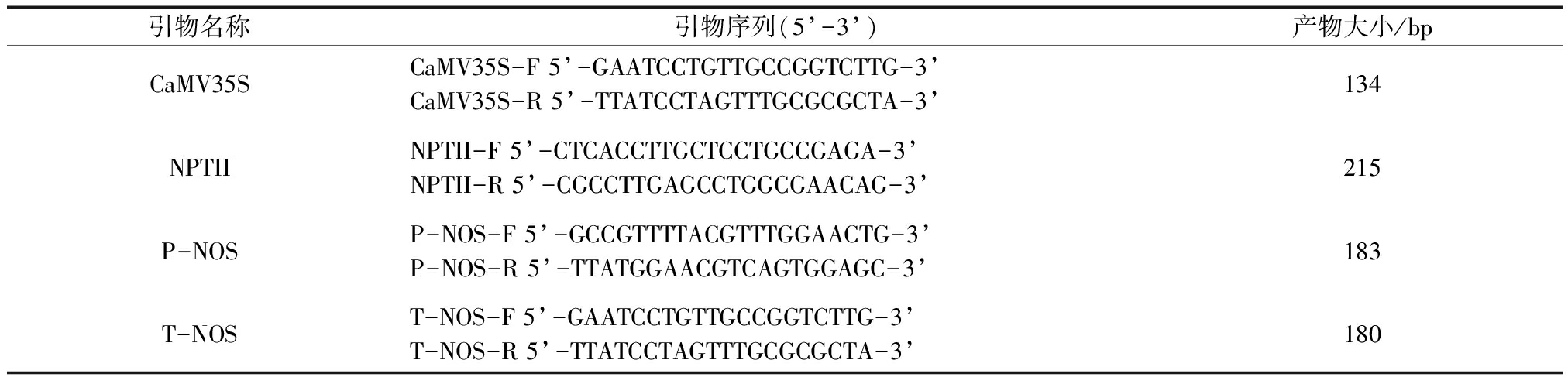
引物名称引物序列(5’-3’)产物大小/bpCaMV35SCaMV35S-F 5’-GAATCCTGTTGCCGGTCTTG-3’CaMV35S-R 5’-TTATCCTAGTTTGCGCGCTA-3’134NPTIINPTII-F 5’-CTCACCTTGCTCCTGCCGAGA-3’NPTII-R 5’-CGCCTTGAGCCTGGCGAACAG-3’215P-NOSP-NOS-F 5’-GCCGTTTTACGTTTGGAACTG-3’P-NOS-R 5’-TTATGGAACGTCAGTGGAGC-3’183T-NOST-NOS-F 5’-GAATCCTGTTGCCGGTCTTG-3’T-NOS-R 5’-TTATCCTAGTTTGCGCGCTA-3’180
1.3.3 单基因PCR反应体系及扩增程序
PCR反应体系为:Tap PCR Master Mix 终浓度为1 μM,上下游引物终浓度为0.4 μM,模板DNA 2.0 μL,补充ddH2O体积至25 μL。在定性PCR仪上反应扩增程序为:94 ℃预变性4 min;进入35个循环,变性30 s,56 ℃(P-NOS)或58 ℃(T-NOS)退火30 s,72 ℃延伸50 s;72 ℃延伸10 min。
1.3.4 多重PCR反应体系及扩增程序
组合引物PCR反应体系:Tap PCR Master Mix终浓度为1 μM,经筛选后确定CaMV35S和NPTII、CaMV35S和P-NOS、NPTII和P-NOS、NPTII和T-NOS、P-NOS和T-NOS组合引物终浓度(μM)的最佳配比为0.3∶0.3,待测DNA模板1.0 μL,补充ddH2O 体积至25 μL。在定性PCR仪上反应扩增程序为:94 ℃预变性4 min;进入35个循环,变性30 s,58 ℃退火30 s,72 ℃延伸50 s;72 ℃延伸10 min。
2 结果与分析
2.1 单基因PCR验证结果
以转基因马铃薯EH92-527-1、AV43-6-G7、AM04- 1020、PH05-026-0048标准品,非转基因马铃薯样品(对照)及ddH2O(空白对照)为模板,根据所设计引物进行单基因PCR检测,最终筛选出4对含有特异条带的引物,分别为CaMV35S、NPTⅡ、P-NOS、T-NOS,扩增结果如图1所示,P-NOS、T-NOS、CaMV35S 3个基因在4种转基因标准品的扩增结果中除样品AV43-6-G7外,其它三个均有特异性条带被扩增,NPTⅡ基因则是在4个样品中都扩增出特异性条带,且与已知目标基因条带一致,说明引物特异性较好。此外,这四个基因在待测马铃薯样品中均未被扩增,说明该样品未有目标基因出现。
2.2 多重PCR验证结果
为建立一种快速、准确检测转基因马铃薯的方法,根据2.1所筛选出的4对引物,将其两两组合进行多重PCR检测,经过引物浓度(μM)配比梯度筛选后,将两对引物按照0.3∶0.3的比例最终配成25 uL的体系,根据琼脂糖凝胶电泳结果分析(图2),E图引物组合方式扩增结果条带清晰且区分明显,且与单基因PCR检测结果一致,F~I图引物组合方式虽有条带被扩增,但出现条带不清晰或缺失现象。因此,图中分析结果表明E图中引物组合(CaMV 35S和NPTⅡ)可适用于转基因马铃薯的检测,并能同时检测转基因马铃薯中的多个调控元件。
A,CaMV35S;B,NPTⅡ;C,P-NOS;D,T-NOS
图1 单基因PCR检测结果
注:M,Maker;1,模板EH92-527-1;2,模板AV43-6-G7;3,模板AM04-1020;4,模板PH05-026-0048;5,非转基因马铃薯样品;6,ddH2O。
E,引物组合CaMV 35S和NPTⅡ;F,引物组合CaMV 35S和P-NOS;G,引物组合NPTII和P-NOS;H,引物组合NPTII和T-NOS;I,引物组合P-NOS和T-NOS
图2 多重PCR检测结果
注:M,Maker;1,模板EH92-527-1;2,AV43-6-G7;3,AM04-1020;4,PH05-026-0048;5,ddH2O。
2.3 已知样品验证实验
为进一步确定2.2所筛选引物组合的可行性,以9种转基因马铃薯样品和1种非转基因样品为测试样品,进行PCR验证实验。结果如图3所示,9种转基因马铃薯样品中均扩增出特异性条带,而非转基因样品中未有阳性条带出现,说明该引物组合特异性较好,能够用于转基因马铃薯样品的检测。
图3 已知样品多重PCR验证
注:M,size maker;1,转基因EH92-527-1;2,AM04-1020;3,PH05-026-0048;4,ATBT04-27;5,ATBT04-30;6, ATBT04-36;7, AV43-6-G7;8, BT06;9, BT12;10, 非转基因马铃薯样品; 11,ddH2O。
3 结论
采用单基因PCR方法从常用的调控元件中筛选出适用于EH92-527-1、AV43-6-G7、AM04- 1020、PH05-026-0048标准品系的4对调控元件(CaMV35S、P-NOS、T-NOS、NPTⅡ),再以其中两两引物组合的方法进行多重PCR验证,最终筛选出条带较清晰且区分明显的引物组合对(CaMV35S和 NPTⅡ)。通过对已知转基因样品的验证实验结果表明,该引物组合特异性较好,能够广泛应用于大多数转基因马铃薯的检测。
由于转基因调控元件的多样性,导致一对或多对引物无法对未知样品做出准确鉴别,行业标准(SN/T 1198--2013)中关于常见转基因马铃薯转入外源基因显示,大多数都含有CaMV35S、NPTⅡ或NOS,本研究在检测过程中首先利用所筛选出的引物组合对待测样品进行检测,若出现阳性条带则判定该样品为转基因样品,否则再进一步通过单基因PCR方法进行检测验证。此外通过琼脂糖凝胶电泳对PCR产物进行分析,操作简单且节约成本。不仅为转基因马铃薯的检测的研究奠定一定的理论基础,同时也为现在的检测行业提供一种准确可靠的检测方法。
参考文献:
[1]Clive James. 2015年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2016,36(04):1-11.
[2]胡虎.欧盟批准转基因马铃薯种植[J].基因组学与应用生物学,2010,29( 2) : 389.
[3]安娜,董美,宛煜嵩,等.转基因马铃薯的研究现状[J].中国农业科技导报,2016,18(4):38-43.
[4]邓汉超,尹长城,刘国振,等.转基因植物核酸成分检测技术研究进展[J].中国生物工程杂志,2011,31(1):86-95.
[5]白卫滨,孙建霞,姜桂传,等. ELISA方法定量检测转基因大豆及其产品的研究[J].食品与发酵工业,2007,33(11):103-106.
[6] CHAOUACHI M, MALKI R, BERARD A, et al. Development of a realtime PCR method for the differential detection and quantification of four solanaceae in GMO analysis: potato (Solanum tuberosum), tomato (Solanum lycopersicum), eggplant (Solanum melongena), and pepper (Capsicum annuum)[J]. J Agric Food Chem. 2008, 56 (6): 1818-1828.
[7]邵碧英,陈文炳,杨婕.马铃薯及其制品中转基因成分的多重PCR检测[J].食品科学,2006, 27(1): 178-181.
[8] NOBUAKI S, KEIKO M, SACHIKO O, et al. Safety Assessment of Genetically Engineered Food: Detection and Monitoring of Glyphosate-Tolerant Soybeans[J]. Bioscience, Biotechnology, and Biochemistry,1998,62(7):1461-1464.
[9]AHMED F E. Detection of genetically modified organisms in foods[J]. Trends Biotechnology,2002,20(5) : 215-223.
[10]MATSUOKA T, KURIBARA H, AKIYAMA H, et al. A multiplex PCR method of detecting recombinant DNAs from five lines of genetically modified maize[J]. Shokuhin Eiseigaku Zasshi, 2001, 42(1): 24-32.
[11]JAMES D, SCHMIDT A M, WALL E, et al. Reliable detection and identi-fication of genetically modified maize, soybean, and canola by multi-plex PCR analysis[J]. J Agric Food Chem,2003, 51(20): 5829-5834.
[12]董立明,李葱葱,邢珍娟,等.利用多重PCR技术快速检测五个转基因大豆品系[J].大豆科学,2016,35(06):1002-1007.
[13]白月,栾凤侠,高宏伟.应用多重PCR-DHPLC方法快速检测转基因马铃薯及EH92-527-1品系鉴定[J].中国马铃薯,2011,25(3):129-134. ●
Establishment of a PCR method to identify transgenic potato
ZHOU Yan-pei,SUN Hai-xin,ZHAO Mei-li,CUI Ling-jun
(Shandong Seatone Detection Evaluation Technical Services Co., Ltd., Qingdao Shandong 266000)
Abstract:A PCR method to identify transgenic potato was established by designing specific primers of regulatory elements in genetically modified organism (GMO) potato, then four kinds of transgenic potato standard lines EH92-527-1, AV43-6-G7, AM04-1020 and PH05-026-0048 were used as templates for single gene PCR and multiplex PCR amplification. After analysis by agarose gel electrophoresis, the primer combinations with strong primer specificity and no cross-contamination or non-specific amplification were screened out. And nine kinds of known transgenic potato samples were verified by multiplex PCR, and the bands were clear and distinct. The detection method of combining multiplex PCR with single PCR that can rapidly and accurately identify a variety of regulatory elements of transgenic potatoes has been established.
Key words:transgenic potato; PCR method; identification
收稿日期:2018-01-18
基金项目:山东省泰山产业领军人才工程支持项目(鲁政办字[2016]190 号);青岛市“人才特区”工程支持项目(2016);山东半岛国家自主创新示范区发展建设资金项目(鲁科字[2017]41 号)
作者简介:周延培,1991年出生,女,硕士研究生.
通讯作者:孙海新,1978年出生,男,博士,工程技术应用研究员.
中图分类号:S 532
文献标识码:A
文章编号:1007-7561(2018)03-0067-04



