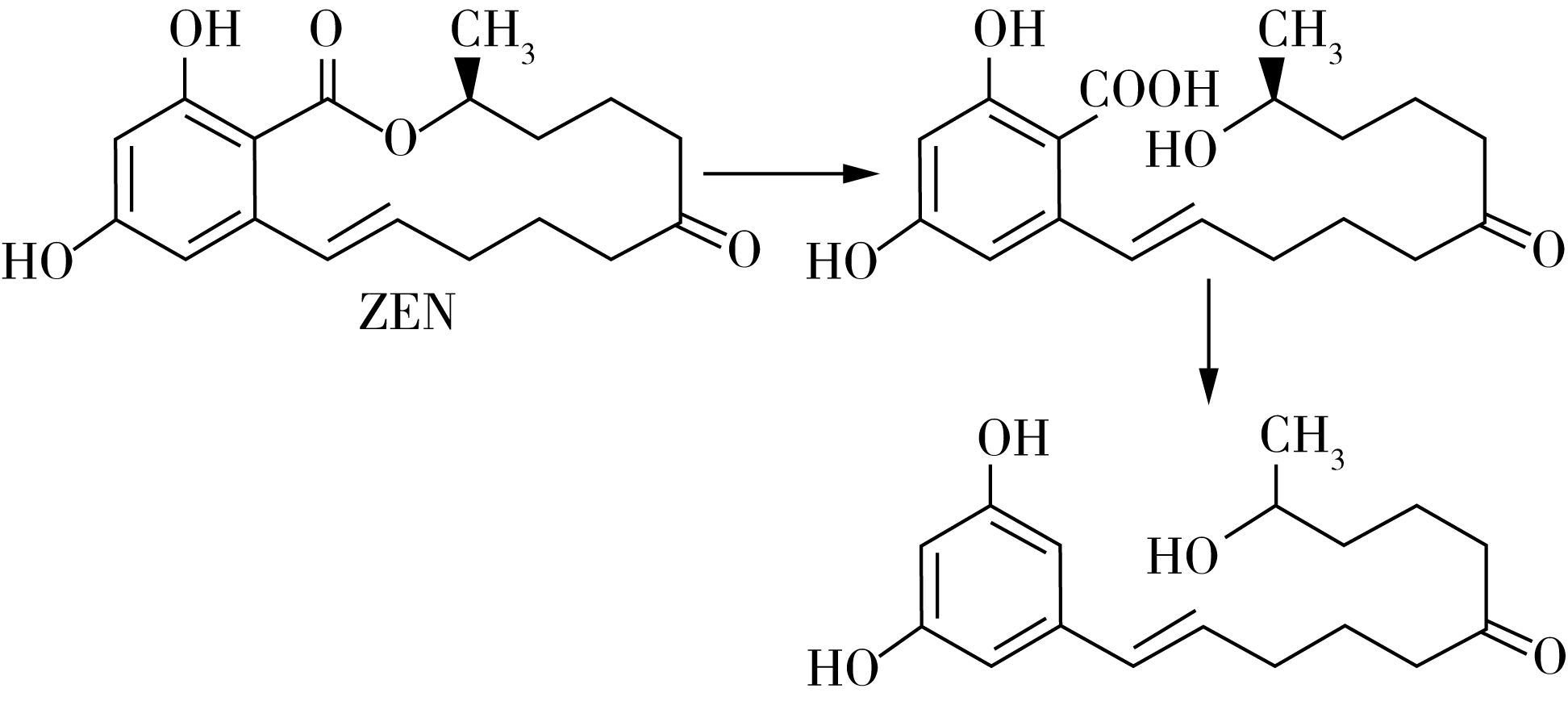
图1 玉米赤霉烯酮的降解过程
杜 稳,刘虎军,王 峻,王浩宇,孙长坡
(国家粮食局科学研究院,北京 100037)
摘 要:以采集的粮油加工副产物及污泥等作为分离降解菌株的样品,筛选分离出两株具有耐酸且高效降解玉米赤霉烯酮(Zearalenone,简称为ZEN)的微生物菌株,分别命名为FS-3和FS-7。初步鉴定FS-3菌株为解淀粉芽孢杆菌,FS-7菌株为黑曲霉菌。FS-3菌株活性物质可外分泌到培养基中,而FS-7菌株活性物质主要在菌体内。在pH 5的条件下,FS-3菌株和FS-7菌株对ZEN的降解率分别为84.1%和95.7%。对两株降解菌的ZEN降解产物进行质谱分析,得出FS-3菌株可将ZEN降解为质荷比为397的新物质,FS-7菌株将ZEN降解为质荷比为213和243两种新物质。将FS-3和FS-7菌株应用于玉米副产物发酵脱毒,发酵3 d后,FS-3和FS-7菌株可分别将ZEN初始含量由4 345.8 μg/kg降解至176.3 μg/kg和431.83 μg/kg。
关键词:玉米赤霉烯酮;筛选;应用;玉米副产物
玉米赤霉烯酮(zearalenone,简称ZEN)又称F-2毒素,由Stob等人第一次从霉变的玉米中分离出来[1]。1966年,Urry采用经典化学[2]、核磁共振和质谱技术确定了ZEN的化学结构,并正式确定其学术名称为6-(10-羟基-6-氧代-反式-1-10-碳烯)-β-雷锁酸-内酯,分子式为C18H22O5。它是由大多数镰刀菌如禾谷镰刀菌、大豆镰刀菌、粉红镰刀菌等[3]产生的非类固醇雌激素的次级代谢产物[4]。ZEN对家畜特别是对雌猪体现出强雌激素效应,极易引起严重的生殖障碍[5-6];ZEN对人体内分泌系统也具有干扰作用,Fizzell等研究表明,当ZEN浓度为100 μmol/L时,雌二醇、睾酮、皮质激素的水平显著下降,ZEN和其代谢产物通过影响受体信号,改变激素的产生,是潜在的内分泌干扰物[7]。
ZEN有很高的热稳定性,传统的蒸煮加热法对其破坏效果甚微[8],近些年应用的物理法(辐射、吸附),化学法(氧化法、碱液浸泡等)[9]都对ZEN去除效果不理想且营养物质损失很大。利用微生物将ZEN降解为无毒的小分子物质是一种安全高效、无二次污染的毒素消减方法,而且能保持甚至改善粮食和饲料中的营养组分[10-11],Naoko等[12]指出,粉红粘帚霉菌分泌的内酯酶可通过断裂ZEN中的内酯键,使其毒性降低(图1)。粮食加工副产物以及动物肠胃中的pH均呈酸性,史競等人指出,目前筛选出的可降解ZEN的微生物以及ZEN降解酶反应条件均在pH 7以上[13],因此,耐酸性降解菌及功能基因的筛选亟待解决。本研究旨在筛选能够在酸性条件下高效降解ZEN的菌株,以期应用于玉米加工副产物ZEN的去除,从而消除ZEN的危害。

图1 玉米赤霉烯酮的降解过程
1.1.1 样品
样品来源见表1。
表1样品来源

1.1.2 试剂与培养基
色谱级甲醇、乙腈:Thermal公司;ZEN标准品:Sigma公司。
无机盐培养基(MSM):(NH4)2SO40.5 g,MgSO4·7H2O 0.2 g,CaCl20.05 g,Na2HPO42.44 g,KH2PO41.52 g,加水至1 L,调pH至6.8,121 ℃灭菌20 min,固体培养基加1.5%的琼脂。
LB培养基:10 g蛋白胨,10 g NaCl,5 g酵母提取物,加水溶解至1 L,121 ℃灭菌20 min。
PDA培养基:葡萄糖20 g加水定容到200 mL,121 ℃灭菌20 min。200 g马铃薯切丁后加水煮烂,用8层纱布过滤后,加水至800 mL,115 ℃灭菌20 min后加入灭菌的葡萄糖溶液。
玉米物料培养基(干基含量15%):玉米皮27 g,蛋白粉53 g,玉米胚53 g,粉碎后过20目筛,玉米稀浆175 mL,加水定容到1 L,调节pH到5,121 ℃灭菌20 min。
玉米单物料培养基(干基含量15%):玉米单物料(ZEN含量1 500±10 μg/kg)粉碎后过20目筛,取150 g,加水定容到1 L,调节pH到5,121 ℃灭菌20 min。
高效液相色谱(e2695)、荧光检测器(2475):美国WATERS公司;PCR仪:美国BIO-RAD公司;凝胶成像仪:美国BIO-RAD公司;Agilent 1200-6510Q-Tof LC/MS液相色谱—质谱联用仪:美国安捷伦公司;粉碎机:天津泰斯特仪器有限公司;气控操作架:北京华安麦科生物技术有限公司。
1.3.1 ZEN测定方法
ZEN含量测定方法参照国标法GB 5009. 209--2016[14],高效液相色谱条件中色谱柱:C18(259 mm×4.6 mm,5 μm,xbridge);流动相:V(水)∶V(乙腈)∶V(甲醇)=46∶46∶8;流速1.0 mL/min;柱温25 ℃;进样量10 μL;荧光检测器:激发波长(Ex)=274 nm,发射波长(EM)=440 nm。
ZEN降解率=降解后培养基中ZEN含量/原培养基中ZEN的含量×100%。
1.3.2 降解菌的分离和纯化[15]
富集和初筛:取5 g样品于50 mL MSM培养基中,ZEN浓度为20 mg/L,30 ℃、220 r/min培养10 d,以10%的接种量转接3次,高效液相色谱检测ZEN残留,选择具有ZEN降解效果的样品进行下一步实验。
复筛:将初筛获得的具有降解效果的样品经过适当稀释涂布于MSM平板上,挑取不同形态的单菌落接到含有10 μg ZEN的1 mL MSM培养基中,在30 ℃、220 r/min条件下培养6 d,检测ZEN残留,挑取具有降解效果的菌株进行下一步实验。
1.3.3 ZEN降解菌活性物质分泌特性的研究
挑取各菌株单菌落接种到50 mL MSM培养基中,在30 ℃、220 r/min条件下培养48 h。发酵液在1 000 r/min、4 ℃下离心5 min获得发酵上清液;发酵液经过超声破碎,1 000 r/min、4 ℃下离心5 min,获得发酵液破碎上清液。分别取离心上清液和发酵液破碎上清液500 μL加入到含有10 μg ZEN的1 mL离心管中,在30 ℃、220 r/min条件下反应12 h,蒸干,加入1 mL甲醇,超声溶解30 min,0.22 μm滤膜过滤,高效液相色谱检测ZEN残留,筛选降解效果较好的菌株。
1.3.4 耐酸性ZEN降解菌的筛选
调节MSM培养基的初始pH为4、5和7,以pH 7为对照,以pH 4和pH 5进行实验,将1.3.3筛选得到的菌株接种到不同pH且含有10 μg ZEN的1 mL MSM培养基中,30 ℃、220 r/min培养10 d,蒸干,加入1 mL甲醇,超声溶解30 min,0.22 μm滤膜过滤,高效液相色谱检测,研究不同菌株在酸性环境下对ZEN的降解效果,挑取酸性环境中降解效果较好的菌株进行下一步实验。
1.3.5 降解菌的鉴定
形态鉴定:将获得的菌株在MSM平板上划线,30 ℃培养24~48 h,观察菌落形态、大小、边缘、表面隆起形状、透明度等。对菌株进行革兰氏染色。
分子鉴定:对获得的降解菌进行16SrDNA或18SrDNA鉴定,以培养20 h的菌液作为模板,反应体系:模板1 μL,TaqMix 12.5 μL,16S/18S上下游引物各1 μL,双蒸水10.5 μL。反应程序:98 ℃预变性10 min,94 ℃变性50 s,55 ℃退火45 s,72 ℃延伸1.5 min,30个循环,72 ℃延伸10 min,4 ℃保存。PCR产物经核酸电泳检测后送到Invitrogen公司测序,将测序得到的序列在NCBI上进行比对。
细菌通用引物:16SF(5’-ATTGAACGCTGGCGGCAGGCCT-3’),16SR(5’-TAACAAGGTAACCGTAGGGGA-3’)。
真菌通用引物:18SF(5’-GTAGTCATATGCTTGTCTC-3’),18SR(5’-ATTCCCCGTTACCCGTTG-3’)。
1.3.6 ZEN降解菌降解机理质谱解析
分别将FS-3菌株和FS-7菌株接入含有10 μg ZEN的1 mL MSM培养基中,30 ℃、220 r/min条件下培养6 d,每24 h取样,高效液相色谱检测ZEN残留,分别取三种不同降解率的样品进行质谱分析,质谱条件参考梁颖[16]的方法。
1.3.7 降解菌在玉米副产物ZEN降解中的初步应用
分别将FS-3菌株和FS-7菌株接种到LB和PDA培养基中,在30 ℃、220 r/min下培养至对数期作为种子液。以5%的接种量接入各玉米副产物培养基中,在30 ℃、220 r/min下培养2~3 d,取样检测物料中ZEN残留,分析降解效果,物料中ZEN提取方法参见国标法GB 5009. 209--2016[17]。
根据1.3.2的方法对18个工厂样品进行筛选,得到8株对ZEN有降解效果的菌株,分别命名为FS-1~FS-8。
分别取8种菌株发酵液上清液和发酵液破碎上清液各500 μL,加入到含有10 μg ZEN的1 mL离心管中,在30 ℃、220 r/min条件下反应12 h,以灭活的菌株发酵液破碎上清液作为对照,高效液相色谱测定ZEN残留量并计算降解率,结果见表2。FS-3和FS-8发酵液上清液降解率达到70%以上,活性物质主要分泌到胞外,FS-4、FS-6和FS-7发酵液破碎上清液降解率达到70%以上,活性物质主要分布在胞内。选择FS-3、FS-4、FS-6、FS-7、FS-8菌株进行下一步研究。
表2不同菌株活性物质对ZEN的降解率%
根据1.3.4的方法,以培养基pH 7作为对照,分别调节培养基pH为4和5进行实验,对2.2筛选得到的5株ZEN降解菌进行耐酸性筛选,菌株降解效果如图2所示。当培养基pH为7时,5种菌株ZEN降解率均在75%以上,FS-3和FS-7菌株ZEN降解率达到90%以上;培养基pH为5时,FS-4、FS-6和FS-8对ZEN的降解率低于60%,FS-3和FS-7菌株对ZEN仍保持较高的降解率,分别为84.1%和95.7%。培养基pH为4时,5株菌株对ZEN降解效果较差,降解率均低于30%。玉米加工副产物pH在4~5之间,当pH为4时,ZEN降解效果较低,pH为5时,FS-3和FS-7对ZEN保持较高的降解效果,因此选取FS-3和FS-7进行研究。
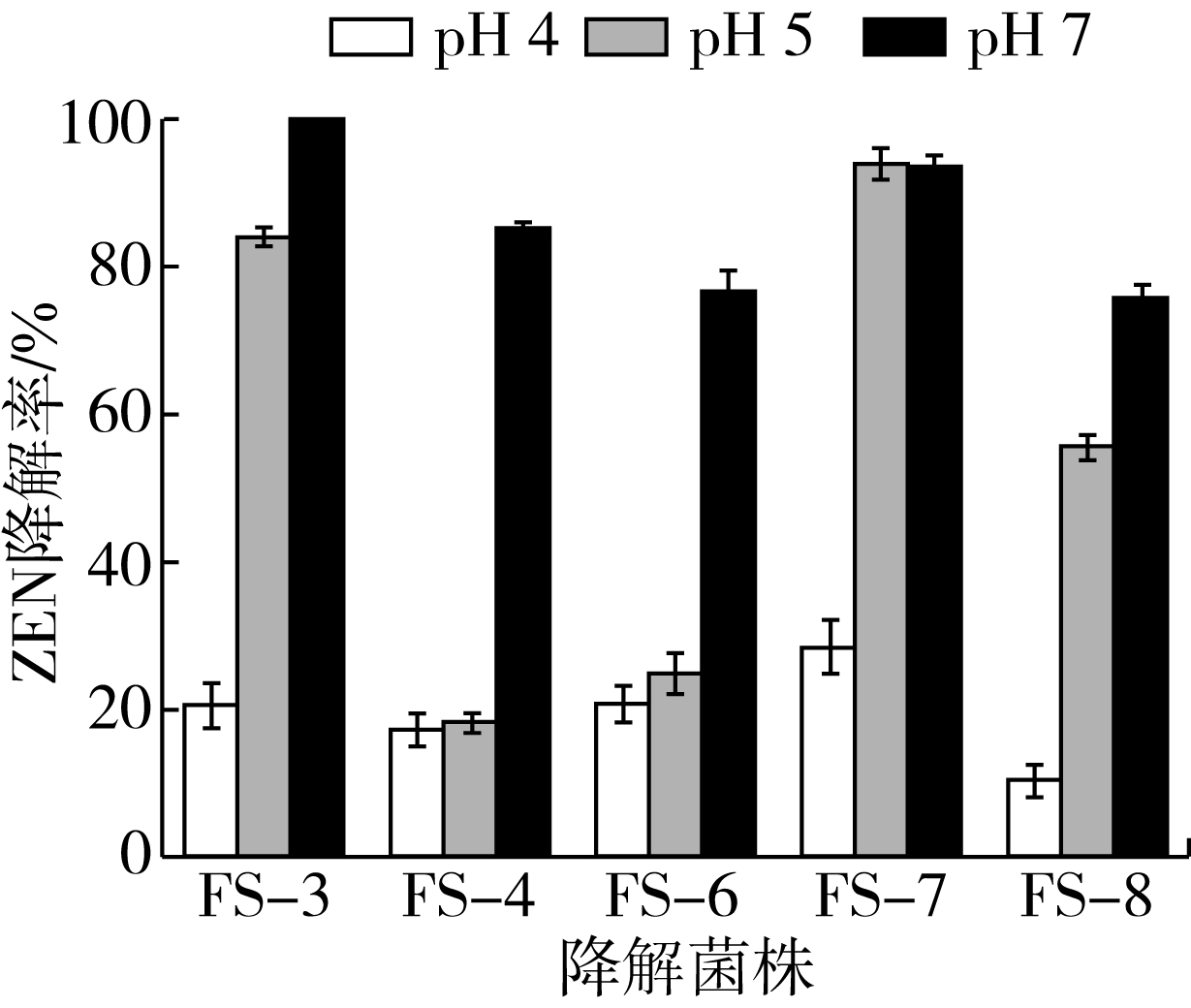
图2 耐酸性ZEN降解菌株的筛选
2.4.1 形态鉴定
菌株FS-3特征为:菌落成囊泡化,扁平状,边缘光滑,表面有裂纹状(图3a)。革兰氏染色成阳性。
菌株FS-7特征为:菌丝发达呈厚绒状,且布满整个平皿,表面附有黑色孢子,菌落不易挑取(图3b)。

图3 菌株FS-3(a)和菌株FS-7(b)的菌落特征
2.4.2 分子鉴定
以菌液为模板,用16S通用引物进行基因扩增,将PCR产物进行测序,测序结果在GeneBank数据库中进行比对。结果表明,菌株FS-3和Bacillus amyloliquefaciens strain md1-51同源性高达99%。利用MEGA-5.0软件通过N-J法对FS-3菌株构建系统进化树,结果见图4。根据菌株16S rDNA的相似性、系统发育树和菌落形态,初步鉴定FS-3菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
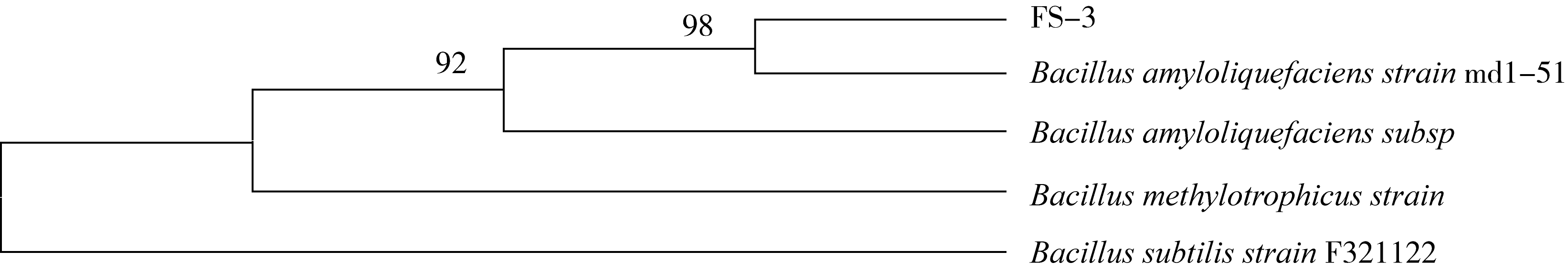
图4 基于16S rDNA部分基因序列构建的FS-3菌株进化树
以菌液为模板,用18S通用引物进行基因扩增,将PCR产物进行测序,测序结果在GeneBank数据库中进行比对。结果表明,FS-7菌株和Aspergillus niger同源性高达99%。利用MEGA-5.0软件通过N-J法对FS-7菌株构建系统进化树,结果见图5。根据菌株18S rDNA的相似性、系统发育树和菌落形态,初步鉴定FS-7菌株为黑曲霉菌(Aspergillus niger)。
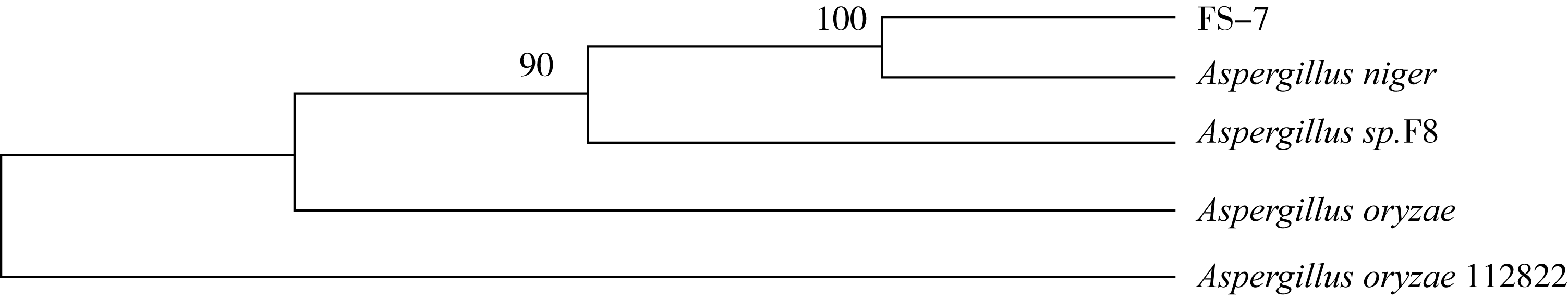
图5 基于18S rDNA部分基因序列构建的FS-7菌株进化树
对FS-3菌株转化ZEN产物进行质谱分析,降解过程基峰提取离子流图如图6a所示,随着发酵降解天数的增加,ZEN峰值降低,物质1峰值逐渐增加,发酵3 d后,ZEN全部转化为物质1。对转化产物进行质荷比鉴定(图6b),物质1质荷比为397,而ZEN质荷比为317,说明FS-3菌株分泌的活性物质促进ZEN进行了加成反应,使其变为分子量更高的397物质,而加成反应产物不稳定,在一定条件下容易恢复成ZEN,相关机理有待进一步研究。
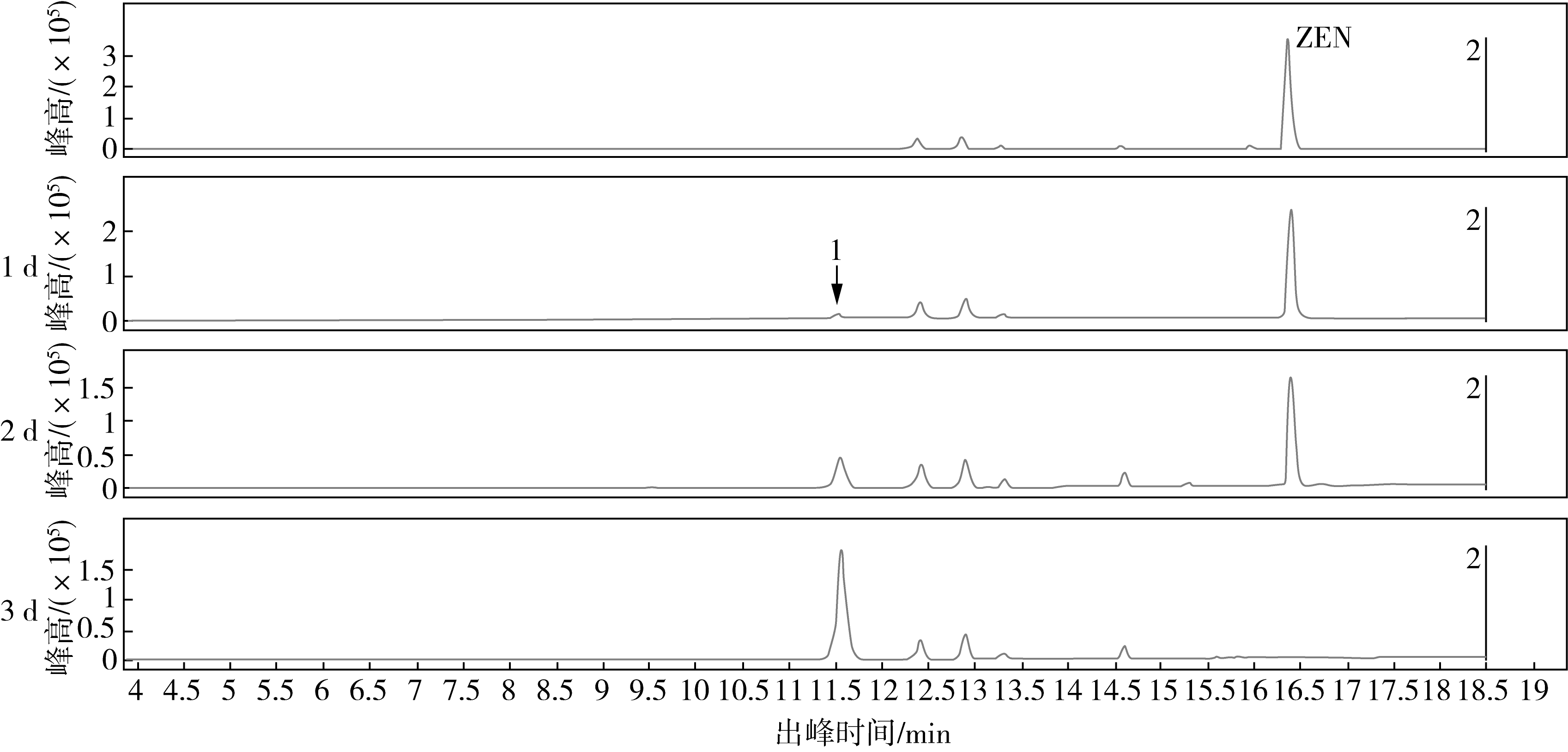
a

b
a,FS-3降解ZEN产物基峰提取离子流图;b,FS-3降解ZEN产物质荷比分析
图6 FS-3菌株ZEN降解产物质谱分析
注:1为质荷比397的物质。
通过对FS-7菌株降解ZEN产物进行质谱分析,降解过程基峰提取离子流图如图7a所示,FS-7菌株在发酵2 d后,ZEN峰值降低,物质1和2的峰高增加,发酵3 d后,物质1的峰值最高,物质2消失,物质3的峰值增加。经过对物质1、2、3质荷比鉴定,物质1质荷比为213,物质2质荷比为397,物质3质荷比为243,其中物质1丰度较高(图7b)。由质谱分析结果可以看出,FS-7菌株能够将ZEN转化成物质1(213)和物质3(243)两种小分子物质,表明FS-7菌株分泌的活性物质能够将ZEN分子破坏,具有较高的研究价值,相关机理有待进一步研究。
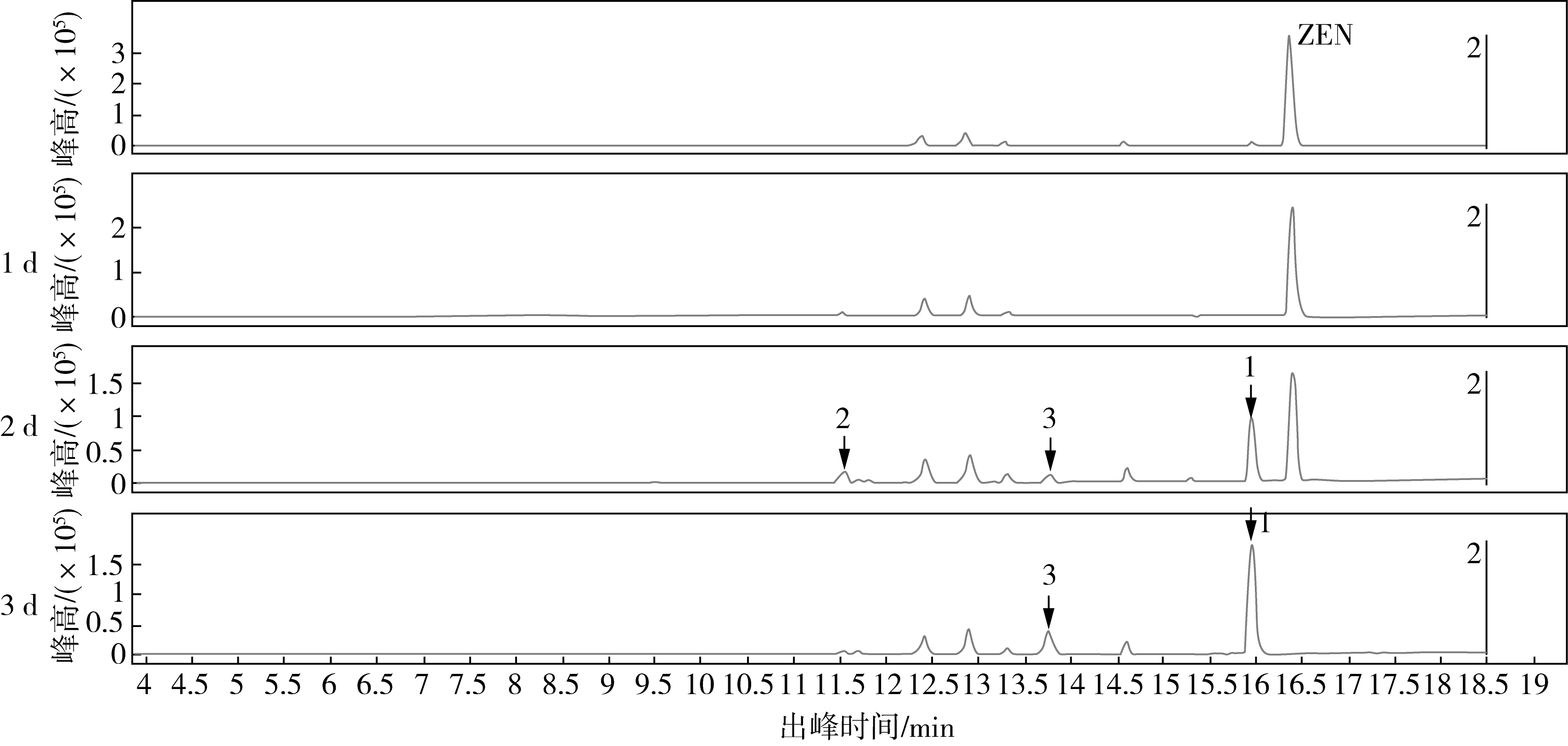
a

b
a,FS-7降解ZEN产物基峰提取离子流图;b,FS-7降解ZEN产物质荷比分析
图7 FS-7菌株ZEN降解产物质谱分析
注:1为质荷比213的物质,2为质荷比397的物质,3为质荷比243的物质。
2.6.1 发酵时间对菌株降解玉米副产物中ZEN的影响
分别将FS-3和FS-7菌株以5%的接种量接种到玉米物料培养基中,在30 ℃、220 r/min条件下培养5 d,取样测定ZEN残留量,结果如图8所示,经过FS-3菌株发酵1 d,玉米物料中的ZEN含量由初始的4 345.8 μg/kg降解到2 258.83 μg/kg,3 d后ZEN降解到176.3 μg/kg,此后逐渐降为0 μg/kg。FS-7菌株发酵1 d后,ZEN含量由初始的4 345.8 μg/kg降解到2 490.27 μg/kg,发酵3 d后ZEN降解到431.83 μg/kg,此后ZEN含量不再变化。结果表明,经FS-3和FS-7菌株发酵3 d后,玉米物料中的ZEN含量均降到国家饲料标准[16]以下。分析其原因为,随着发酵时间的增加,降解菌的生物量逐渐增大,生物活性物质逐渐增加,降解能力也随之增强。
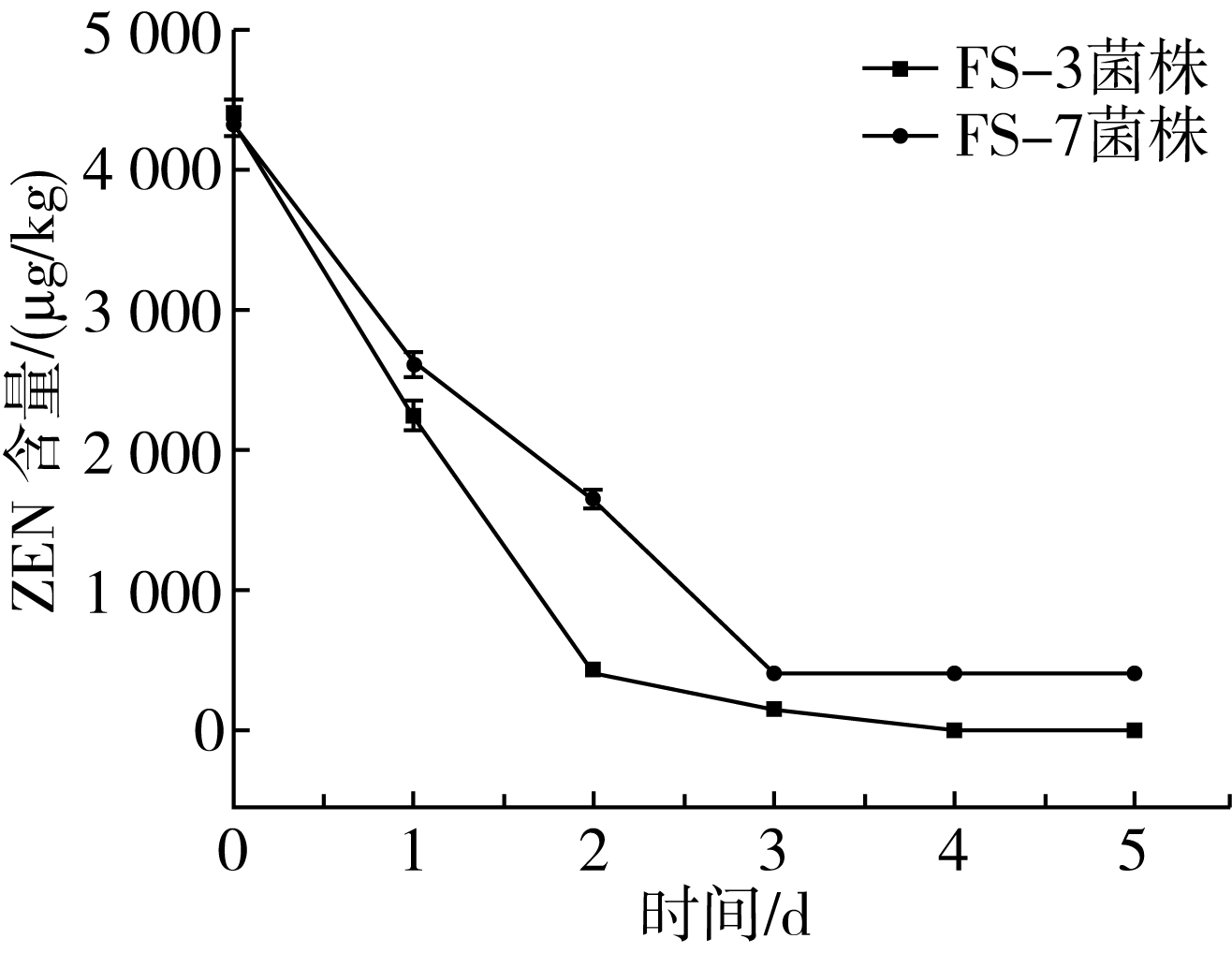
图8发酵时间对菌株降解玉米副产物混合物料ZEN的影响
2.6.2 不同物料对菌株降解玉米副产物ZEN的影响
FS-3和FS-7菌株在不同物料中对ZEN的降解效果见图9,结果表明,FS-3菌株在不同物料中的降解能力为玉米蛋白>玉米混合物料>玉米皮>玉米胚芽>玉米浆,在玉米蛋白和玉米混合物料中ZEN降解效率在85%以上,而在玉米浆中ZEN降解效果较差,降解率为50%。分析其原因可能是各物料中的蛋白含量不同,高蛋白含量的玉米物料有助于降解菌的生长,而玉米浆中营养物质低于其他物料且无机盐含量较高,不利于FS-3菌株的生长。FS-7菌株在不同物料中的降解能力为玉米蛋白>玉米混合物料>玉米皮>玉米浆>玉米胚芽,在所有物料中ZEN降解率均能达到70%以上。与FS-3菌株相比,FS-7菌株在玉米浆中的ZEN降解率不是最低的,且与其他物料的降解效果相差不大,表明FS-7菌株适应性较强,具有较好的应用前景。
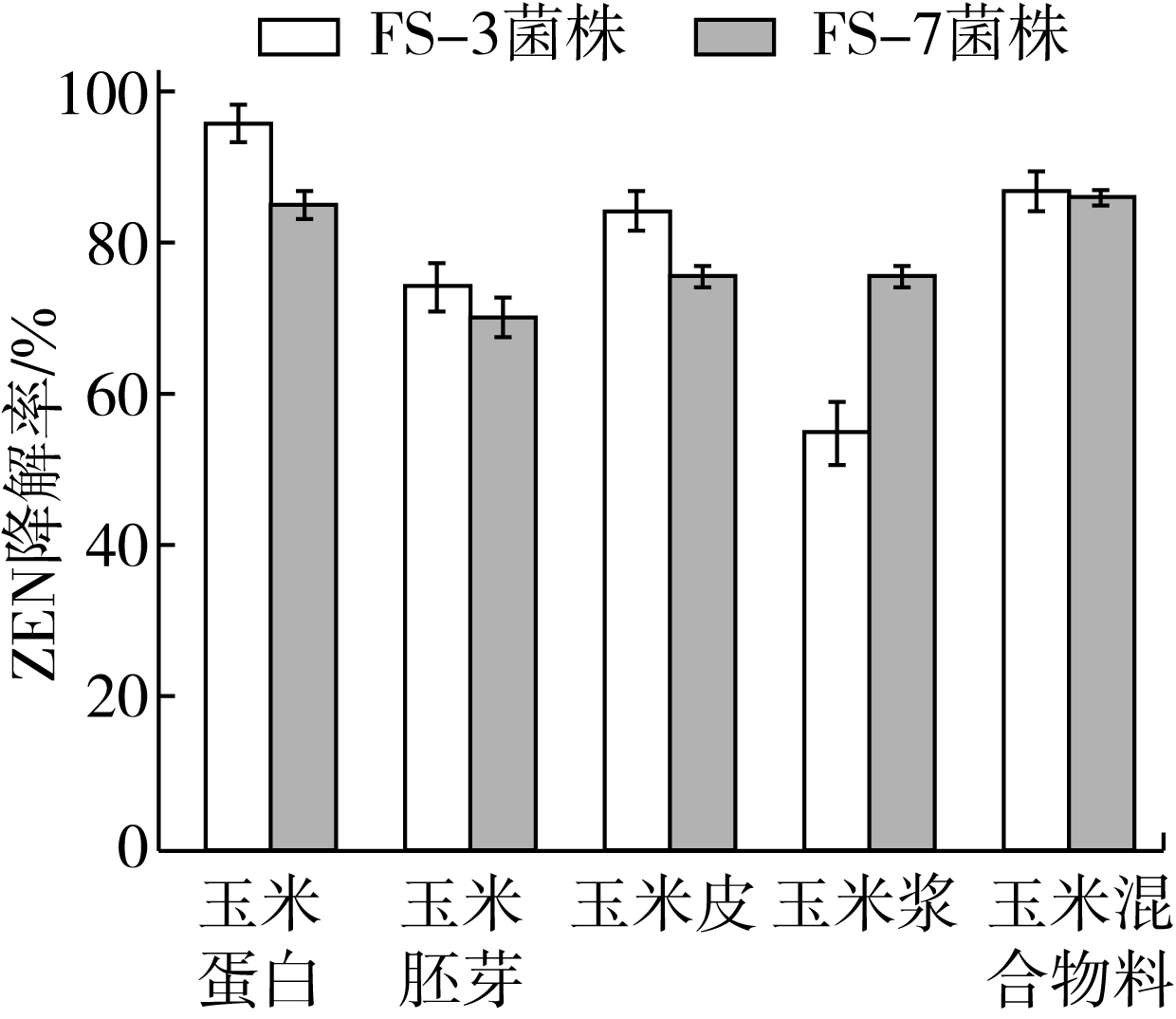
图9降ZEN菌株对不同玉米副产物中ZEN的降解效果
Xiang La等人[18]研究表明ZEN降解酶在碱性环境下降解效果更为明显,而玉米加工副产物及动物肠胃环境多呈酸性,因此耐酸性的ZEN降解菌具有更大的实际应用潜力。本研究中,FS-3菌株和FS-7菌株在pH 5的条件下均具有较好的ZEN降解效果。通过对FS-3菌株和FS-7菌株的形态鉴定、16S或18S rDNA的分子鉴定以及系统发育树的分析,初步鉴定FS-3菌株为解淀粉芽孢杆菌,FS-7菌株为黑曲霉菌。以分离的FS-3菌株和FS-7菌株作为菌种,在发酵消减玉米副产物中高含量的ZEN初步实验中,表现出了很好的毒素降解效果。
解淀粉芽孢杆菌FS-3菌株降解ZEN后降解物质经质谱分析结果表明ZEN被降解为质荷比为397的物质,其比ZEN的分子量大,推断降解过程中对ZEN进行了加成,有可能会被还原成ZEN。黑曲霉FS-7菌株降解ZEN后的降解产物质谱分析结果表明,FS-7可将ZEN降解转化为质荷比分别为213和243的物质,213和243为新物质且213丰度较高,小分子物质的存在证明FS-7菌株破坏了ZEN的分子结构,因此该菌株具有较高的研究价值,其深层次降解机理和降解产物安全性有待进一步研究。
解淀粉芽孢杆菌和黑曲霉菌均属于饲料添加剂目录(农业部2016年)允许添加微生物,能够直接在饲料原料中应用,本文将解淀粉芽孢杆菌和黑曲霉菌初步应用于不同玉米副产物ZEN的降解,结果表明这两株菌对玉米物料中ZEN的降解率都能达到50%以上,最高降解效果达到90%。其中解淀粉芽孢杆菌FS-3在营养较为丰富的物料中降解效果更好,而黑曲霉菌FS-7和其产生的活性物质具有较强的适应能力。我们将进一步对这两株菌在粮食加工副产物ZEN降解中的应用进行研究,为其应用于粮食副产物中真菌毒素降解规模化生产提供更有力的依据。
参考文献:
[1]STOB M, BALDWIN R S, TUITE J, et al. Isolation of an anabolic, uterotrophic compound from corn infected with Gibberellazeae[J]. Natrue, 1962, 196:1318.
[2]URRY W H,WEHRMEISTER J L, HODGE E B, et al. The structure of zearalenone[J]. Tetrahedron Letters, 1966,27:3109-3114.
[3]何学军,齐德生.玉米赤霉醇的毒性研究进展[J].中国饲料, 2006, 10: 2-5.
[4]BOSCH U, MICOCHA C J. Toxin production by Fusarium species fromsugar beets and natural occurrence of zearalenone in beets and beet fibers[J]. Applied and Environmental Microbiology, 1992, 58(10): 3233-3239.
[5]ETIENNE M, JEMMALI M. Effects of zearalenone (F2) on estrous activity and reproduction in gilts[J]. Journal of Animal Science, 1982, 55(1): 1-10.
[6]KABAK B, DOBSON A D, VAR I. Strategies to prevent Mycotoxin contamination of food and animal feed: a review[J]. Critical Reviews in Food Science and Nutrition,2006, 46 (8): 593-619.
[7]FRIZZELL C, NDOSSI D, VERHAEGEN S, et al. Endocrine disrupting effects of zearalenone, alpha- and beta-zearalenol at the level of nuclear receptor binding and steroidogenesis[J]. Toxicology Letters, 2011, 206(2): 210-217.
[8]熊凯华, 程波财, 胡威, 等.玉米赤霉烯酮降解的研究进展[J].中国粮油学报, 2009, 24(11):97-101.
[9]徐新慧, 晏猛, 符峰, 等. 郑州某粮库小麦中玉米赤霉烯酮含量的检测[J].动物医学进展, 2012, 33(4):59-62.
[10]雷元培, 马秋刚, 谢实勇, 等. 抽样调查北京地区猪场饲料及饲料原料玉米赤霉烯酮污染状况[J]. 动物营养学报, 2012, 24(5): 905-910.
[11]孙长坡, 代岩石, 王松雪, 等.利用生物技术防控、消减粮食及其制品中的真菌毒素[J].中国粮油学报, 2009, 24(11): 97-101.
[12]NAOKO T, MAKOTO K, HIDEAKI K, et al. A novel lactonohydrolase responsible for the detoxification of zearalenone:enzyme purification and gene cloning[J]. Biochemical Journal, 2002,365:1-6.
[13]史竸, 汪洋, 鞠星, 等. 玉米赤霉烯酮生物降解研究进展[J].中国粮油学报, 2014, 28(6):111-114.
[14]GB 5009.209-2016,食品中玉米赤霉烯酮的测定[S].
[15]王国兵, 伍松陵, 林爱军,等. 玉米赤霉烯酮降解菌的分离及降解性研究[J].中国粮油学报, 2016, 31(1):84-89.
[16]梁颖, 刘邻渭, 张春晖. 联用同时检测小麦中三种镰刀菌素[J].中国粮油学报, 2006, 21(6): 160-162.
[17]GB 13078.2-2006,饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量[S].
[18]XIANG L, WANG Q H, ZHOU Y L, et al. High-level expression of a ZEN-detoxifying gene by codon optimization and biobrick in Pichia pastoris[J]. Microbiological Research, 2016(193):48-56.●![]()
DU Wen, LIU Hu-jun, WANG Jun, WANG Hao-yu, SUN Chang-po
(Academy of State Administration of Grain,Beijing 100037)
Abstract:FS-3 and FS-7, Zearalenone (ZEN) degradation and acid tolerance strains, were isolated from grain and oil processing by-products and sewage sludge. FS-3 strain was identified asBacillus Amyloliquefaciensand FS-7 strain was identified asAspergillus niger. The bioactive substances of FS-3 strain could be secreted to medium, while FS-7 strain was intracellular. Under condition of pH 5, the degradation rates of FS-3 and FS-7 strains were 84.1% and 95.7%, respectively. Mass spectrometric for ZEN degradation products was performed and demonstrated that a new substance (M/Z=397) was appeared by FS-3 strain as well as two new substances (M/Z=213, 243) were appeared by FS-7 strain. The FS-3 and FS-7 strains were applied in the corn by-product fermentation process for ZEN detoxication, the result proved that ZEN content can be degraded from 4 345.8 μg/kg to 176.3 μg/kg and 431.83 μg/kg after fermentation for 3 days.
Key words:zearalenone; screening; application; corn by-products
收稿日期:2017-11-02
基金项目:“十二五”国家科技支撑计划(2015BAK43B02)
作者简介:杜稳, 1989年出生,男,研究实习员.
通讯作者:孙长坡, 1975年出生,男,研究员.
中图分类号:TS 201.3
文献标识码:A
文章编号:1007-7561(2018)03-0060-07