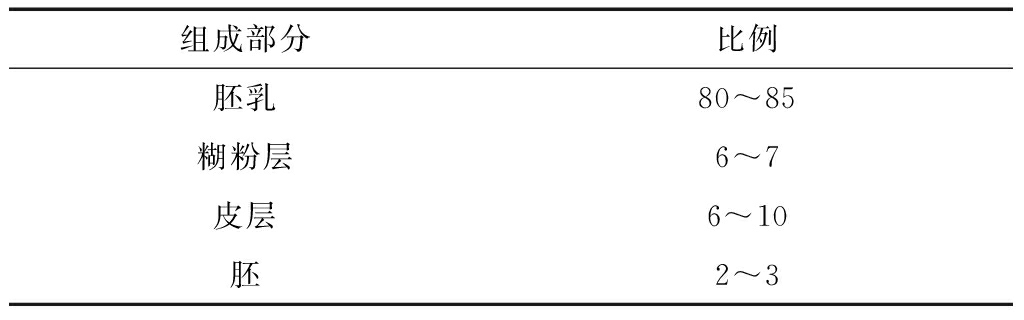
表1小麦各组成部分比例%
孙 含,赵晓燕
(济南大学 食品科学与营养系,山东 济南 250022)
摘 要:综述了从小麦麦麸、麦胚、面筋中提取的不同小麦蛋白肽的生物活性功能的研究,对现有的活性肽制备方法进行比较,特别是对各种酶水解小麦蛋白得到小分子量肽的方法比较,发现几种酶的综合使用更有利于提高小麦肽的得率。提出了目前活性肽研究存在的一些问题,并对未来发展进行了展望。
关键词:小麦蛋白;活性肽;功能;制备;应用
近年来,随着人们对蛋白质在消化道内消化、吸收以及代谢规律研究的不断深入,蛋白质营养学研究已从大分子蛋白进入了小分子肽营养学研究的新阶段。肽作为蛋白质降解的中间产物,不但可以继续降解成氨基酸被肠道吸收利用以合成机体蛋白,也可以直接以小肽的形式被机体吸收利用以发挥更重要的生理功能。研究发现蛋白酶在水解蛋白质的过程中会产生许多分子量较小的活性成分,这些小片段肽可能在机体内具有特殊生理调节功能[1]。随着人们对于生活质量要求越来越高,对饮食营养健康更加关注,活性分子肽已成为当代食品及营养学探究的一大热点,活性肽作为一种功能因子具有极其广阔的发展和应用前景[1]。
小麦是我国重要的粮食作物,小麦栽培遍及全国,在全国粮食总产值中小麦所占比重仅次于稻谷和玉米,居于第三位,产量和出口量都居世界前列。在众多的禾谷类作物中,小麦中的蛋白质含量十分丰富,约占小麦总质量的13%,高于其他粮种。因此,小麦是人们在日常生活中摄取蛋白质的主要来源之一。小麦蛋白主要由清蛋白、球蛋白、谷蛋白、醇溶蛋白组成[2]。将小麦粉深加工以后能提取一种天然谷物蛋白,即面筋蛋白,主要由麦胶蛋白和麦谷蛋白组成,干燥粉碎后为淡黄色的粉末(谷朊粉),蛋白质所占的比重达75%~85%。因此谷朊粉是一种营养丰富的植物蛋白产品,具有粘性、弹性、延伸性、成膜性和吸脂性。谷朊粉经酶解后可得到具有生理功能的小肽分子,从而极大地提高了小麦产品及蛋白产品的附加值[2]。
小麦蛋白肽是以小麦粉中提取的蛋白质为底物,利用多种蛋白水解酶,首先将蛋白进行特定的酶切水解步骤,然后利用小肽特殊性质结合特定的分离技术,从而分离得到小分子多肽物质。分离得到的小麦肽分子有些片段较大,有些只有2~3个氨基酸,分子量基本在200~300道尔顿,具有水溶性分散好,溶液状态稳定,易于被人体吸收,生物活性强等特点[3]。小分子肽由于分子量小,因此不需要再经过进一步的消化,且肽的吸收具有低耗能、不饱和、转运无竞争性等特点,在足够多的蛋白质和活性肽同时进入消化道的情况下,一部分活性肽就能以完整的小肽形式在体内直接被小肠吸收,进入血液循环。研究发现活性肽的抗氧化、抗菌等活性与其分子量大小呈一定的关系,一般分子量越小,活性越强[3]。
目前很多活性肽的研究主要集中在大豆上,对小麦蛋白肽的研究不够深入。通过综述从小麦不同结构提取的小麦蛋白肽的生物活性功能研究以及对现有的活性肽制备方法进行比较,特别是对各种酶解法的比较,以及现有的产品市场,提出了目前活性肽研究存在的一些问题,并对未来的发展进行了展望,以期为相关的研究提供理论依据。
小麦肽具有多种生理活性功能,研究发现小麦功能肽主要有神经活性肽(阿片功能)、酶调节及抑制肽、激素及激素调节肽、抗氧化肽、抗菌肽、免疫活性肽、凝集与抗凝集活性肽[4]。小麦的不同部位所含蛋白肽的种类和含量有很大的差异,研究者一般会单独从麸皮、麦胚或者整个麦粒中提取小麦肽进行功能研究。
从结构表1和表2中可以看出,胚乳占了整个小麦的大部分,胚乳中主要是淀粉,虽然蛋白在胚乳中所占的比重只有12.91%,但因基数大,所以小麦中蛋白也集中在胚乳中。在胚、糊粉层中蛋白质含量很高。日常生活中,一方面一般只留下胚乳生产小麦粉,这势必导致高蛋白的胚、糊粉层、果皮种皮得不到有效的利用,造成蛋白资源的浪费。另一方面,小麦蛋白在水中的溶解度低,很难被有效利用。因此,将小麦中的蛋白提取出来,并进一步降解成溶解度高、易吸收的生物活性肽,是提高小麦附加值及资源有效利用的好途径。
表1小麦各组成部分比例%

表2小麦各部分的化学成分比例%(干基)

麸皮作为小麦加工的主要副产物,含有丰富蛋白质。麦麸酶解后得到的麦麸多肽含有17种氨基酸,其中有7种必需氨基酸,具有抗氧化、提高免疫力和抗疲劳功能。
刘长江等[5]对麦麸多肽的抗氧化性进行了研究,利用碱性蛋白酶Alcalase制备麦麸抗氧化肽,最佳酶解条件为[E]/[S]=5%、pH 8.0、温度50 ℃、时间3 h。采用硝基四氮唑蓝(NBT)还原法和脱氧核糖法分别对麦麸抗氧化肽超氧阴离子自由基![]() 和羟自由基(·OH)的清除率进行检测,得到清除率分别为69.16%和82.23%。曹向宇等[6]对麦麸多肽进行Sephadex G-25柱层析和DEAE-32纤维素柱层析纯化,而后加入到小鼠红细胞悬液中,用适当浓度的H2O2处理红细胞悬液37 ℃、1 h,测A415 nm发现麦麸多肽能明显抑制H2O2对红细胞膜氧化损害后溶血反应的发生,有效保护红细胞结构的完整性。同时向小鼠肝脏线粒体悬浮液中加入麦麸多肽后,用适当浓度的FeSO4和VC激发线粒体膨胀1 h,然后测定A520 nm发现麦麸多肽能抑制·OH诱导的线粒体肿胀。刘长江[5]等又在此基础之上构建小鼠D-半乳糖衰老模型,用不同浓度的麦麸多肽灌胃处理一段时间后,对小鼠骨髓细胞DNA氧化情况、脾、胸腺指标及血清丙二醛(MDA)含量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性进行检测,发现麦麸多肽具有抗DNA氧化的功能,能够提高机体内源性抗氧化酶活性,清除自由基,抑制脂质过氧化损伤作用。BABINI等[7]采用酶与微生物水解小麦蛋白,发现得到的肽具有新的抗氧化功能和增强免疫力。
和羟自由基(·OH)的清除率进行检测,得到清除率分别为69.16%和82.23%。曹向宇等[6]对麦麸多肽进行Sephadex G-25柱层析和DEAE-32纤维素柱层析纯化,而后加入到小鼠红细胞悬液中,用适当浓度的H2O2处理红细胞悬液37 ℃、1 h,测A415 nm发现麦麸多肽能明显抑制H2O2对红细胞膜氧化损害后溶血反应的发生,有效保护红细胞结构的完整性。同时向小鼠肝脏线粒体悬浮液中加入麦麸多肽后,用适当浓度的FeSO4和VC激发线粒体膨胀1 h,然后测定A520 nm发现麦麸多肽能抑制·OH诱导的线粒体肿胀。刘长江[5]等又在此基础之上构建小鼠D-半乳糖衰老模型,用不同浓度的麦麸多肽灌胃处理一段时间后,对小鼠骨髓细胞DNA氧化情况、脾、胸腺指标及血清丙二醛(MDA)含量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性进行检测,发现麦麸多肽具有抗DNA氧化的功能,能够提高机体内源性抗氧化酶活性,清除自由基,抑制脂质过氧化损伤作用。BABINI等[7]采用酶与微生物水解小麦蛋白,发现得到的肽具有新的抗氧化功能和增强免疫力。
麦麸多肽的抗氧化活性主要是靠清除超氧阴离子自由基和羟自由基、提高超氧化物歧化酶等抗氧化酶活性来实现的,保护红细胞结构的完整性,抑制线粒体肿胀,保护DNA,都与其抗氧化性有着密切的关系[7]。其免疫活性也大多是通过增强溶菌酶、吞噬细胞、免疫球蛋白活性或含量来实现的[7]。
麦胚中蛋白质含量丰富,约占37.6%,且蛋白种类丰富,是一种完全蛋白,同时含有多种人体必需氨基酸和多种生物活性物质,被称为“人类天然的营养宝库”[8]。利用特异性蛋白酶水解小麦胚芽蛋白可以制备具有抗氧化活性的抗氧化肽。
郭红英等[9]对麦胚蛋白水解物进行抗氧化研究,用纤维素平板膜对麦胚蛋白酶解物进行超滤分级,用阴阳离子交换树脂脱盐法进行纯化,研究不同分子量肽的抗氧化活性,发现大于5 kDa的肽对DPPH清除能力极其微弱,随着分子量的减小,麦胚肽对DPPH清除率显著提高,反映了麦胚肽提供氢供体的能力,说明麦胚肽的抗氧化活性与其分子量大小密切相关。同时,郭红英等[9]考察了麦胚肽对Fe2+的螯合能力,发现随着麦胚肽浓度的增大,对金属离子的螯合能力呈线性关系。在抑制亚油酸自氧化能力测定中,麦胚肽能够阻断链式反应,抑制过氧化脂质生成,从而抑制亚油酸的自氧化。一系列研究证明麦胚肽具有很强的抗氧化性[10-11]。
小麦面筋蛋白(谷朊粉)水解可以得到多种功能短肽。
1.4.1 谷氨酰胺肽
小麦面筋蛋白中谷氨酰胺的含量高达30%,所以用面筋蛋白经生物酶(如谷氨酰胺酶)酶解后得到谷氨酰胺肽。这种肽的主要功能是提供谷氨酰胺。谷氨酰胺是核苷酸合成的前体物质,谷氨酰胺可以通过酸碱平衡反应维持内环境的平衡,氨在机体内的转化运输主要是通过谷氨酰胺来实现[12-14]。研究表明谷氨酰胺是机体肠中的主要能量来源物质,可以作为肠营养物质,增强肠免疫功能。谷氨酰胺还是还原型谷胱甘肽的前体物质,后者是体内极其重要的抗氧化剂[12-14]。
张海华[15]采用体内实验研究谷氨酰胺肽对游水大鼠补充谷氨酰胺,观察其抗疲惫作用,结果发现谷氨酰胺肽能够延长大鼠游泳力竭时间,降低血液和肌肉中乳酸水平,减少肝糖原的损耗,具有抗疲劳功能。通过体外细胞实验研究谷氨酰胺肽对癌细胞和正常细胞生长的影响,发现谷氨酰胺肽具有促进老鼠脾细胞增殖作用,也说明其具有潜在增强机体免疫能力的作用。用一定浓度的谷氨酰胺肽处理胃癌细胞和小鼠淋巴瘤细胞,出现细胞凋亡现象,说明有一定的抑癌作用。
谷氨酰胺肽能够发挥增强免疫力、抗癌等作用主要是通过分解成谷氨酰胺来实现的。谷氨酰胺在水中的溶解度很低,并且稳定性差,易受pH、温度变化的影响[13-14]。而谷氨酰胺肽能够克服这些缺点,使其临床应用成为可能。在日本市场上已销售的谷氨酰胺名为“麦粒胺”的二肽商品。美国大力投资开发的用来改善免疫系统及运动后能源补充的新型特殊营养补充剂之一,生物活性谷氨酰胺补剂,在高温及低pH值的环境中,可以保持功能稳定。
1.4.2 神经活性肽
研究发现小麦面筋蛋白水解后会产生阿片活性的短肽。孔祥珍等[16-17]测定由3种酶酶解面筋蛋白制备短肽的阿片活性,利用豚鼠回肠离体检定法。结果表明,由碱性蛋白酶、胃酶和胰酶复合水解制备的3种面筋蛋白短肽的阿片活性较强。孔祥珍[16-17]等接着对这3种小麦面筋蛋白短肽的镇痛活性进行体内实验,利用小鼠热板法和醋酸扭体法,发现小鼠痛阈有所提高及扭体得到抑制。Kong等[18]人用碱性蛋白酶Alcalase对小麦谷蛋白进行酶解,酶解6 h后,获得了富含低分子量的短肽水解物,具有很强的阿片活性,活性高于用胃蛋白酶酶解的产物。
神经活性肽对人体有非常重要的作用,可以作为激素或神经递质和受体结合,具有调节情绪、体温、脉搏、呼吸和阵痛等功能,与普通镇痛剂不同的是没有副作用。食物来源的阿片肽活性比内源性的阿片肽弱,主要在中枢神经系统发挥作用,不会产生依赖性、耐受性和成瘾性,可以作为机体内源性阿片肽的补充,共同参与到生理活动的调节中[19]。
1.4.3 抗氧化及ACE抑制活性
吴茜等[20]对复合蛋白酶酶解谷朊粉产物进行抗氧化活性研究,最优酶解条件为酶解时间3 h,底物浓度25%,加酶量0.8%,酶解温度35 ℃。分离后发现分子质量Mr<1 kDa组分的抗氧化活性较高,经提纯后抗氧化成分的活性可达76.34%,结构鉴定表明,高抗氧化活性肽的分子量为730.83 Da,其氨基酸序列为Gln-Gln-Gln-Pro-Arg。蛋白肽对ACE的抑制作用主要是通过抑制血管紧张素Ⅰ转化为血管紧张素Ⅱ,从而抑制血管收缩,增加前列腺素,扩张血管,起到降压的作用。临床上用于治疗高血压症[21]。
蛋白原料(麦麸、麦胚、谷朊粉)→预处理(脱脂、粉碎、烘干、浸出、碱溶、酸沉、煮沸、冷却)→酶解→灭酶(脱苦、脱色、脱盐)→精制(分离、真空干燥)→成品小肽。
酶法水解小麦蛋白制备小麦活性肽的方法有较多研究,目前有的已经应用到工业化生产中。王辛等[22-23]对复合风味蛋白酶水解小麦蛋白进行研究,得出水解小麦蛋白的最佳反应条件为底物浓度5%,酶用量50 LAPU/g,水解时间6 h,水解温度50 ℃,pH值6.0。张锐昌等[24]选用Alcalase碱性蛋白酶和Protamex复合蛋白酶对小麦蛋白进行酶解,制得2种不同的抗菌肽,分离提纯后对大肠杆菌的抑制率分别达到53.8%、51.6%,对金黄色葡萄球菌的抑制率分别达到51.8%、49.1%。小麦各部分酶解物主要活性见表3。蛋白水解酶水解情况比较见表4。
表3小麦各部分酶解物主要生物活性

表4蛋白水解酶水解情况比较

经过大量的研究,目前生物活性肽的制备方法主要有生物提取法、蛋白酶水解法、微生物发酵法、酸碱水解法、酶促合成法、重组DNA合成法及化学合成法等[20-23,31-33]。每种方法的优缺点如表5所示。
表5活性肽制备方法比较

小麦肽具有十分广阔的应用前景,比如在饮品、食品、化妆品、饲料、医疗保健品等行业中应用。小麦肽具有良好的乳化性能,可用于生产蛋白类饮品、调配型乳酸饮料、运动型功能饮料、各种果汁饮料等液体饮料,也可用于中老年奶粉、功能蛋白粉、婴儿配方奶粉等固体饮料的生产调配。如河南鼎天及郑州安安康食品化工有限公司等都生产食品级低聚小麦肽作为食品原料。小麦肽具有优良的乳化及持水能力,可用作烘焙、乳制、面制、调味食品的改良剂,也可作为功能添加剂改进肉制品的持水性。在化妆品行业,可添加到洗面奶、面膜、美容霜、洗发水、化妆水等中,可以改善产品质地,起到保湿补水、营养细胞、刺激细胞生长修复皮肤等作用。如雨花旗下开发出一款闪柔小麦蛋白肽轻盈修护霜,用于修复烫染受损、干枯毛糙的头发,醉青丝旗下也有一款小麦多肽修护护发素。在饲料生产中,小麦肽与血浆蛋白并用有很好的协调作用,可用于生产宠物罐头、动物功能饲料、水产饲料、维生素饲料、兽药产品等,可用于家畜仔断奶一期及二期料,也可用于家畜泌乳料。在医疗保健行业,可用于提高免疫、降三高、镇痛、抗疲劳、医用稠状流食、特殊人群口服营养液等。如广东中食营科生物技术有限公司开发的倍乐肽奶粉固体饮料作为中老年食品营养补充剂,同时有改善肠道、增强心肌功能的作用;日本协和发酵公司针对小肠黏膜绒毛萎缩症患者,利用含大量谷氨酰胺的小麦肽开发稠厚流食以弥补患者体内谷氨酰胺供应不足;武汉乔元生物科技中心开发的糖悦小麦多肽颗粒(淀粉酶抑制剂)用于糖尿病人平衡体内多糖分子。虽然小麦肽的应用前景十分可观,但其产品种类及市场还待进一步的开发。
特殊生理功能的活性肽是近年来食品营养学领域研究极受关注的方向。大豆肽研究已经积累了大量数据,但对小麦肽的研究比较少,特别是对小麦功能性短肽的研究不够充分。对于酶法水解小麦蛋白制备小麦肽的研究有一些报道,在其他方法制备小麦活性肽研究较少,比如发酵法、重组DNA合成法、酶促合成法等。对于一些有功能的活性肽的机制研究结果还不明确。目前大多数研究只是停留在分离纯化活性肽或者做体外功能性研究,缺少体内的研究,对于活性肽进入人体消化道后,特别是强酸性的胃,能否保持其活性,能否以完整的活性肽形式进入人体发挥作用还需进一步研究。因此,应加大对小麦活性肽的研发力度,提高小麦的附加值。加强对功能活性肽机理的研究,开发完善的新活性肽制备技术,着力研究功能性短肽活性保持和在人体内发挥其功能活性。
参考文献:
[1]殷雪婷.生物活性肽的制备方法及其功能[J].河南科技,2011(4):57-58.
[2]PRANDI B,TEDESCHI T,FOLLONI S,et al.Peptides from gluten digestion:A comparison between old and modern wheat varieties[J].Food Research International,2017,91:92-102.
[3]KATO M,NAKANISHI T,TANI T,et al.Low-molecular fraction of wheat protein hydrolysate stimulates glucagon-like peptide-1 secretion in an enteroendocrine L cell line and improves glucose tolerance in rats[J].Nutrition Research,2017(7):37-45.
[4]TSOU M J,LIN W T,LU H C,et al.The effect of limited hydrolysis with neutrase and ultrafiltration on the anti-adipogenic activity of soy protein[J].Process Biochem,2010,45(2):217-222.
[5]刘长江,曹向宇,刘剑利,等.麦麸多肽的酶法制备及其特性研究[J].食品工业,2009(1):34-36.
[6]曹向宇.麦麸多肽的制备及生物活性的研究[D].沈阳农业大学,2009.
[7]BABINI E,TAGLIAZUCCHI D,MARTINI S,et al.LC-ESI-QTOF-MS identification of novel antioxidant peptides obtained by enzymatic and microbial hydrolysis of vegetable proteins[J].Food Chemistry,2017,228:186-196.
[8]ZHU K X,WANG X P,GUO X N.Isolation and characterization of zinc-chelating peptides from wheat germ protein hydrolysates[J].Journal of Functional Foods,2015(12):23-32.
[9]郭红英.麦胚蛋白酶解物的制备及其抗氧化功能研究[D].江苏大学,2009.
[10]LEE D F,SHIN G R,LEE S M.Metabolomics reveal that amino acids are the main contributors to antioxidant activity in wheat and rice gochujangs(Korean fermented red pepper paste)[J].Food Research International,2016,87:10-17.
[11]Zhu K X,Zhou H M,Qian H F.Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochemistry,2006,6(41):1296-1302.
[12]王建中,冯冲,李领川.谷氨酰胺酶水解小麦蛋白工艺研究[J].食品工业,2016(6):153-156.
[13]吕艳.酶解小麦蛋白制取谷氨酰胺活性肽的研究[D].浙江大学,2005.
[14]马洪龙,韩飞,李爱科,等.碱性蛋白酶水解小麦面筋蛋白制取谷氨酰胺肽的研究[J].粮油食品科技,2014(1):54-57.
[15]张海华.小麦面筋蛋白源谷氨酰胺肽的酶解制备、结构分析与生理活性研究[D].江南大学,2011.
[16]孔祥珍,周惠明,钱海峰.小麦面筋蛋白功能短肽的阿片活性及其相对分子质量分布的研究[J].中国粮油学报,2007(4):24-27.
[17]孔祥珍,周惠明,钱海峰.小麦面筋蛋白短肽的镇痛作用研究[J].食品与生物技术学报,2007(2):26-29.
[18]KONG X,ZHOU H,HUA Y,et al.Preparation of wheat gluten hydrolysates with high opioid activity[J].Eur Food Res Technol,2008,227:514-517.
[19]ANNA J,JAKUB F,TOMASZ J.Opioid receptors and their ligands[J].Curr Top Med Chem,2004(4):1-17.
[20]吴茜.酶解小麦蛋白提高功能特性以及制备血管紧张素转化酶抑制肽的研究[D].北京化工大学,2011.
[21]QU W J,MA H L,WEIRUI ZHAO W R,et al.ACE-inhibitory peptides production from defatted wheat germ protein by continuous coupling of enzymatic hydrolysis and membrane separation:Modeling and experimental studies[J].Chemical Engineering Journal,2013,226:139-145
[22]王辛,苏从毅,王猛,等.酶法水解小麦蛋白技术的研究[J].现代小麦粉工业,2013(1):33-35.
[23]王辛,蒋蕴珍,周晔艳,等.酸水解小麦蛋白技术的研究[J].现代小麦粉工业,2009(3):42-44.
[24]张锐昌,徐志宏,刘邻渭.胃蛋白酶水解小麦蛋白工艺的研究[J].食品与机械,2006(1):59-61.
[25]赵泽龙.小麦低聚肽制备工艺的优化及性质与抗氧化能力测试[D].黑龙江八一农垦大学,2016.
[26]赵源,刘爱国,吴子健,等.碱性蛋白酶酶解谷朊粉制备谷朊粉蛋白多肽的研究[J].食品工业科技,2014,18:216-220.
[27]孔祥珍,周惠明,王洪燕.碱性蛋白酶水解小麦面筋蛋白的研究[J].食品工业科技,2006(9):104-105.
[28]阙斐,赵粼,陈锡威.胰酶提升小麦蛋白酶解产物乳化活性工艺及其功能特性研究[J].食品工业科技,2014(10):303-307.
[29]黄婵媛,崔春,赵谋明.小麦面筋蛋白的米曲霉蛋白酶系酶解特性研究[J].食品与发酵工业,2010(9):38-41.
[30]丁志刚,高红梅,潘冬梅.复合酶法水解小麦面筋蛋白的研究[J].食品工业科技,2014,20:191-195.
[31]SUN J,YIN G Y.Composite enzymatic preparation of wheat gluten protein peptide and its antioxidant activity[J].Foodstuffs Technology,2014,22(2):95-99.
[32]ASHOK N R,APARNA H S.Empirical and bioinformatic characterization of buffalo(Bubalus bubalis)colostrum whey peptides & their angiotensin I-converting enzyme inhibition[J].Food Chemistry,2017,228:582-594.
[33]PIHLANTO A,KORHONEN H.Bioactive peptides and proteins[J].Advances in Food and Nutrition Research,2003,47:275-276.
SUN Han,ZHAO Xiao-yan
(Food Science and Nutrition,University of Jinan,Jinan Shandong 250022)
Abstract:The bioactivities of wheat peptides from wheat bran,wheat germ and gluten were reviewed.The preparation methods of the active peptides were compared.Especially,small molecular weight peptides obtained through hydrolyzing wheat protein with various enzymes were compared.It was found that the compound enzymes were more favorable to improve the yield of wheat peptide.Finally,some problems and the prospect in the research of active peptides were put forward.
Key words:wheat;peptide;bioactivity enzymatic hydrolysis;application
收稿日期:2017-07-24
基金项目:国家科技支撑计划(2015BAD29B04);国家自然科学基金(21406133)
作者简介:孙含,1992年出生,女,硕士研究生.
通讯作者:赵晓燕,1975年出生,女,博士,硕士生导师.
中图分类号:TS 210.9
文献标识码:A
文章编号:1007-7561(2018)02-0011-06