表1正交实验因素水平

刘 栋1,王 萍2,周智伟1,3,周选围1
(1.上海交通大学 农业与生物学院,上海 200240;2.天津理工大学 化学化工学院,天津 300384;3.上海大学 生命科学学院,上海 200444)
摘 要:在红曲霉发酵青稞产γ-氨基丁酸(γ-aminobutyric acid,GABA)单因素实验基础上,根据L9(33)设计3因素3水平正交实验,探讨不同辅料及其添加量对GABA产量的影响,筛选出最佳辅料并确定辅料的最佳添加量,从而优化红曲霉发酵青稞产GABA条件。结果表明,添加辅料可进一步提高红曲霉发酵青稞产GABA的量,固体发酵的最优培养基配方为青稞48%、玉米粉10%、黑豆粉17%、米粉15%,依据此配方,在30 ℃的环境下培养8 d,GABA产量约为24.62±0.18 mg/100 g。
关键词:红曲霉;青稞;γ-氨基丁酸;发酵;优化
γ-氨基丁酸(γ-aminobutyric acid,简称GABA)是一种非蛋白氨基酸,不溶于冷乙醇和乙醚,微溶于热乙醇,易溶于水,其分子量为103.2[1]。在γ-氨基丁酸的生物合成过程中,谷氨酸脱羧酶(glutamate decarboxylase,简称GAD)是关键酶,可催化谷氨酸脱去α-羧基产生GABA[2-3]。在人和哺乳动物的中枢神经系统中,GABA是一种重要的抑制性神经递质[4],具有抗惊厥、抗癫痫、降血压、镇静安神、改善脑机能等功效[5]。在食品领域,早在1986年,日本就研发了一款名为Gabaron Tea的富含GABA的茶,并将此种茶作为具有降血压功效的功能食品推向市场进行销售[6]。中国卫生部2009年批准GABA为新资源食品。目前,GABA已经被用于软饮料、调味品、乳制品等食品中[7]。γ-氨基丁酸主要通过三种方法生成,即化学合成法、植物富集法以及微生物发酵法。其中微生物发酵法合成GABA安全、成本低,又不会对环境造成危害,因此具有广阔的发展前景。目前已经在乳酸菌、大肠杆菌、曲霉菌等多种细菌和真菌中发现有可催化谷氨酸脱羧生产GABA的谷氨酸脱羧酶存在[8]。因此,选择其中对人体有益的微生物进行发酵,生产富含GABA的产品,是开发利用GABA的一条途径。
红曲霉(Monascus purpureus)是亚洲一些国家常用的食品发酵微生物,红曲GABA[9-10]、洛伐他汀[11](Lovastatin)、天然色素[12-13]是红曲霉的次生代谢产物,也是目前人们在食品开发和研究中关注的焦点[14]。青稞(Hordeum vulgareL.var.nudum hook.f.)属于禾本科大麦属,在植物上属于栽培大麦的变种,主要种植于青藏高原地区,并且是唯一可在海拔4 200 m以上种植的作物[15]。青稞中含有丰富的蛋白质、β-葡聚糖、VE等营养和活性成分。青稞中含有8种人体必需氨基酸,且赖氨酸含量达0.36%,而赖氨酸正是其他谷物所缺乏的[16]。随着育种以及生产技术的进步,青稞产量大大增加,对青稞深加工的研究逐渐深入,在青稞酒[17]、青稞面包[18]、青稞饮料[19]等新食品的研发上都取得了一定进展。
在先前红曲霉发酵青稞的研究和开发中,大部分研究者把注意力集中在活性成分Monacolin K[20]和红曲色素[21]上,甚至从中分离新的化合物[22],而GABA在红曲发酵青稞发酵过程中的积累则很少有人关注。本研究利用青稞作为固体培养基,添加不同辅料,测定不同辅料及其添加量对红曲霉发酵产GABA的影响。通过单因素实验及正交实验,确定产GABA最高的辅料组合及添加量,为进一步开发红曲霉发酵青稞产品提供参考。
1.1.1 生物材料和试剂
红曲霉-3.5834,购自中国科学院微生物研究所;青稞,由西藏圣龙实业有限公司提供;黑豆粉、玉米粉、米粉,购自上海市沃尔玛超市。
葡萄糖、KH2PO4、MgSO4·7H2O、CaCO3、蛋白胨、酵母提取物、琼脂、硫酸、硼酸盐、次氯酸钠(分析纯),购自国药集团化学试剂有限公司;苯酚(重蒸酚),购自北京索莱宝科技有限公司;γ-氨基丁酸标准品,购自上海金穗生物科技有限公司。
1.1.2 培养基
菌种活化培养基:葡萄糖5 g,蛋白胨5 g,酵母提取物2.5 g,琼脂10 g,水500 mL,pH自然。
液体种子培养基:葡萄糖5 g,蛋白胨5 g,酵母提取物2.5 g,水500 mL,pH自然。
基础固体培养基:青稞100 g,葡萄糖2.4 g,KH2PO40.375 g、MgSO4·7H2O 0.25 g、CaCO31 g,pH自然。
HPX-9052MBE电热恒温培养箱,上海博讯实业有限公司;电热恒温水浴锅,上海齐欣科学仪器有限公司;台式冷冻离心机、Centrifuge 5415D小型台式高速离心机,德国Eppendorf公司;IKA旋转混匀器,德国IKA公司;Multiskan Spectrum酶标仪,美国Thermo Fisher公司;电动粉碎机,宁波新芝科器研究所。
1.3.1 培养基的制作
1.3.1.1 菌种活化培养基
按照配方配置菌种活化培养基,在121 ℃高温灭菌20 min,冷却至室温后倒入培养皿中,放置室温中自然冷却备用。
按照配方配置液体种子培养基,在121 ℃高温灭菌20 min,冷却至室温后倒入250 mL的锥形瓶中,每瓶50 mL,准备4瓶。
1.3.1.2 固体基础培养基
取适量青稞,用自来水清洗3~5次,置于沸水锅中,加入自来水煮1~2 h,至青稞粒捏开后无“白心”。在过滤后的青稞中按照培养基配方中的要求分别加入葡萄糖、KH2PO4、MgSO4·7H2O、CaCO3混合均匀,随后装入广口塑料瓶至瓶肩,封口后121 ℃高压灭菌60 min,自然冷却至室温待用。
1.3.2 接种
自保藏的母种斜面上取10 mm2大小的菌种接入盛有菌种活化培养基的培养皿中,放至25~30 ℃电热恒温培养箱中,约培养4~5 d,菌丝长满培养皿2/3面积后,停止培养,备用。
取25 mm2活化的菌丝,分别接入制作好的液体种子培养基锥形瓶中,每瓶接种2块,共接种3瓶,1瓶不接种作为空白对照,在28 ℃、220 r/min的摇床中培养约5 d。
按5%~10%(v/w)的接种量,在无菌操作台用移液管(枪)将上述制作好的种子液接入基础固体培养基,30 ℃的环境下培养8~10 d,待菌丝长满至瓶肩,用于进一步分析。
1.3.3 γ-氨基丁酸测定方法的建立
1.3.3.1 标准曲线的绘制
用超纯水将γ-氨基丁酸标准品配制成1.0 mg/mL的γ-氨基丁酸标准储备液,摇匀备用。分别取γ-氨基丁酸标准储备液0.05、0.10、0.15、0.20、0.25 mL于5个10 mL的容量瓶中,补加蒸馏水定容至1 mL,得到不同浓度的γ-氨基丁酸标准溶液,再依次加入0.6 mL 0.2 mol/L(pH 9.0)硼酸盐缓冲液、2 mL 5%苯酚溶液、1 mL 7%(w/w)次氯酸钠溶液,摇匀后沸水浴加热5 min,颜色变成蓝绿色后冰浴冷却至室温,在645 nm处测定溶液的吸光度,以GABA含量为横坐标,吸光度为纵坐标,绘制标准曲线,实验重复进行3次[23]。
1.3.3.2 待测样品溶液的制备
使用药物粉碎机将样品打成粉末并过100目筛,准确称取500±5 mg样品置于50 mL烧杯中,加15 mL蒸馏水,扎好瓶口后放入摇床,200 r/min震荡4 h。震荡处理后,取上清液于另一离心管,3 000 r/min离心5 min后取1 mL上清液于10 mL容量瓶中,待测。
1.3.3.3 γ-氨基丁酸样品含量测定
把1.3.3.2所得上清液按照1.3.3.1方法加入硼酸盐缓冲液、苯酚溶液、次氯酸钠溶液,摇匀后放入沸水浴加热5 min,颜色变成淡黄色后,冰浴冷却至室温,待溶液出现蓝绿色后,在波长645 nm处测定吸光度,根据标准曲线确定样品中γ-氨基丁酸含量。
1.3.3.4 γ-氨基丁酸测定的方法学考察
分别对稳定性、精密度、加样回收率进行考察。
稳定性实验:选取样品,按照γ-氨基丁酸含量的测定方法,在显色后的10、20、30、60、90 min分别测定其吸光度并记录数据。
精密度实验:选取样品,按照γ-氨基丁酸样品含量的测定方法平行操作5次,取经震荡、离心后的测定液1.0 mL,沸水浴加热5 min,直到颜色变成淡黄色,冰浴冷却至室温,待溶液出现蓝绿色后,在波长645 nm处测定溶液的吸光度,计算平均值与相对标准偏差(RSD)值。
加样回收实验:吸取1 mL γ-氨基丁酸标准储备液(1.0 mg/mL),置于5 mL容量瓶中,作为γ-氨基丁酸加样使用液。取5支比色管,分别吸取0.8 mL测定液,各加入0.02、0.04、0.06、0.08、0.10 mL γ-氨基丁酸加样使用液,准确补水至1 mL,沸水浴加热5 min,冷却至室温,在波长645 nm处测定各吸光度值。
1.3.4 实验设计
1.3.4.1 单因素实验
固定基本配方中的其他原料添加量,以青稞总量为基准,考察辅料黑豆粉用量(1%、5%、10%、15%、20%)、辅料玉米粉用量(1%、5%、10%、15%、20%)、辅料米粉用量(1%、5%、10%、15%、20%)三个因素对红曲霉发酵青稞产GABA的影响。
1.3.4.2 正交实验
在单因素实验基础上,选用辅料黑豆粉、玉米粉、米粉的添加量为因素,设计L9(33)三因素三水平正交实验,以GABA产量为指标,优化辅料添加条件。正交实验因素与水平设计见表1。
表1正交实验因素水平

1.3.4.3 结果验证
通过正交实验得出的最佳培养基配方,按上述实验程序进行验证,重复3次。
2.1.1 γ-氨基丁酸检测标准曲线
在室温下使用全波长Multiskan Spectrum酶标仪(德国)在645 nm处测定溶液的吸光度,以GABA浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,见图1。经过回归处理,得到回归方程为:y=0.917 7x+0.010 3,相关系数为R2=0.994(n=6),在0~0.25 mg/mL范围内线性关系良好。

图1 γ-氨基丁酸标准曲线
2.1.2 方法学考察结果
分别在显色后10、20、30、60、90 min测定吸光度,结果表明(表2),在90 min内显色反应稳定,平均值为0.020 96,RSD值为2.81%,说明利用该方法测试GABA含量的稳定性较好。
表2稳定性实验结果
精密度实验结果如表3所示。选取样品,按照γ-氨基丁酸样品含量的测定方法平行操作5次,吸光度平均值为0.021,RSD值为2.12%,重现性良好。
表3精密度实验
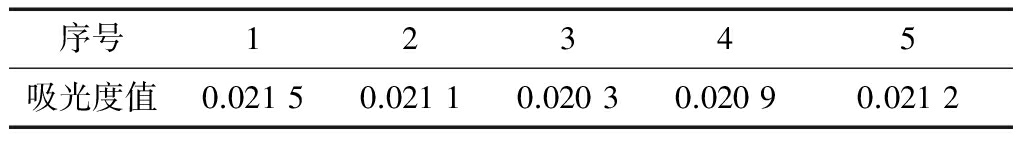
加样回收实验结果见表4,加样回收率的平均值为93.94%,RSD值为0.68%,表明使用该方法检测GABA准确性较高。
表4 γ-氨基丁酸加样回收率实验
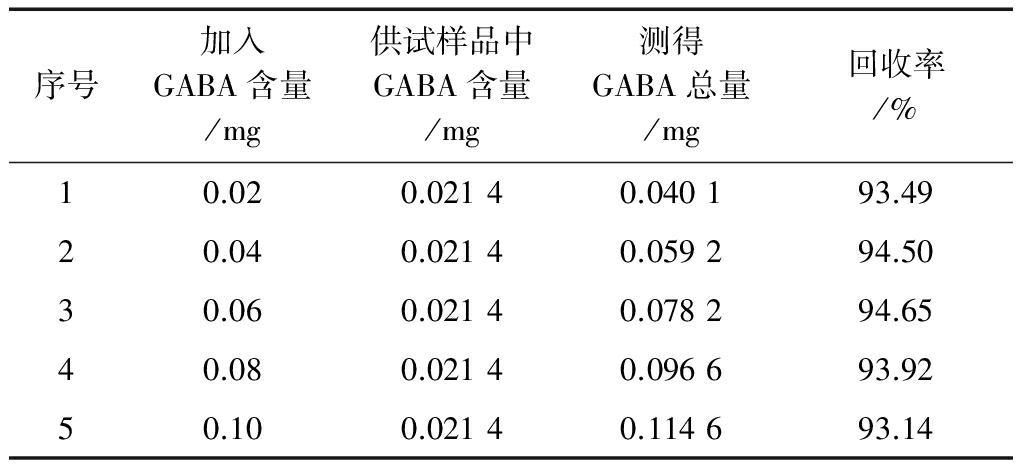
如图2所示,GABA的产量随辅料玉米粉添加量的增加先增加,当添加量达到10%时,GABA的产量最高,为19.62±0.23 mg/100 g,继续加量,GABA产量呈微微下降趋势。当黑豆粉添加量达到15%时,GABA的产量最高,为22.96±0.11 mg/100 g,继续加量,GABA产量呈微微下降趋势。当米粉添加量达到15%时,GABA产量最高,为19.15±0.04 mg/100 g,继续加量,GABA产量呈微微下降趋势。为了尽可能提高GABA产量,辅料玉米粉、黑豆粉、米粉的添加量分别为10%、15%、15%时较佳。

图2 各辅料添加量对青稞产GABA的影响
根据单因素实验结果,进行正交实验,确定红曲霉发酵青稞产GABA最佳辅料添加参数。正交实验设计和结果见表5。由极差分析可得出3个因素中影响青稞产GABA的主要因素是黑豆粉添加量,其次是玉米粉添加量、米粉添加量。由表6方差分析结果可得出添加玉米粉、黑豆粉、米粉3个因素对青稞产GABA的影响均达极显著水平:F(A)=149.41>F(Q=0.01),F(B)=294.13>F(Q=0.01),F(C)=9.58>F(Q=0.01)。
对实验结果分析发现,在所采用的3种辅料中,黑豆粉是主要因素,其次是玉米粉和米粉,以各因素不同水平下的GABA产量对各水平作图,如图3所示:因素A、C随着水平的提高,GABA产量均值先上升后下降,随着因素B水平的增加GABA产量呈直线上升,比较发现在每个因素的3个水平中A2、B3、C2对青稞产GABA的效果最好,由此确定最佳工艺组合为A2B3C2。
表5正交实验设计与结果
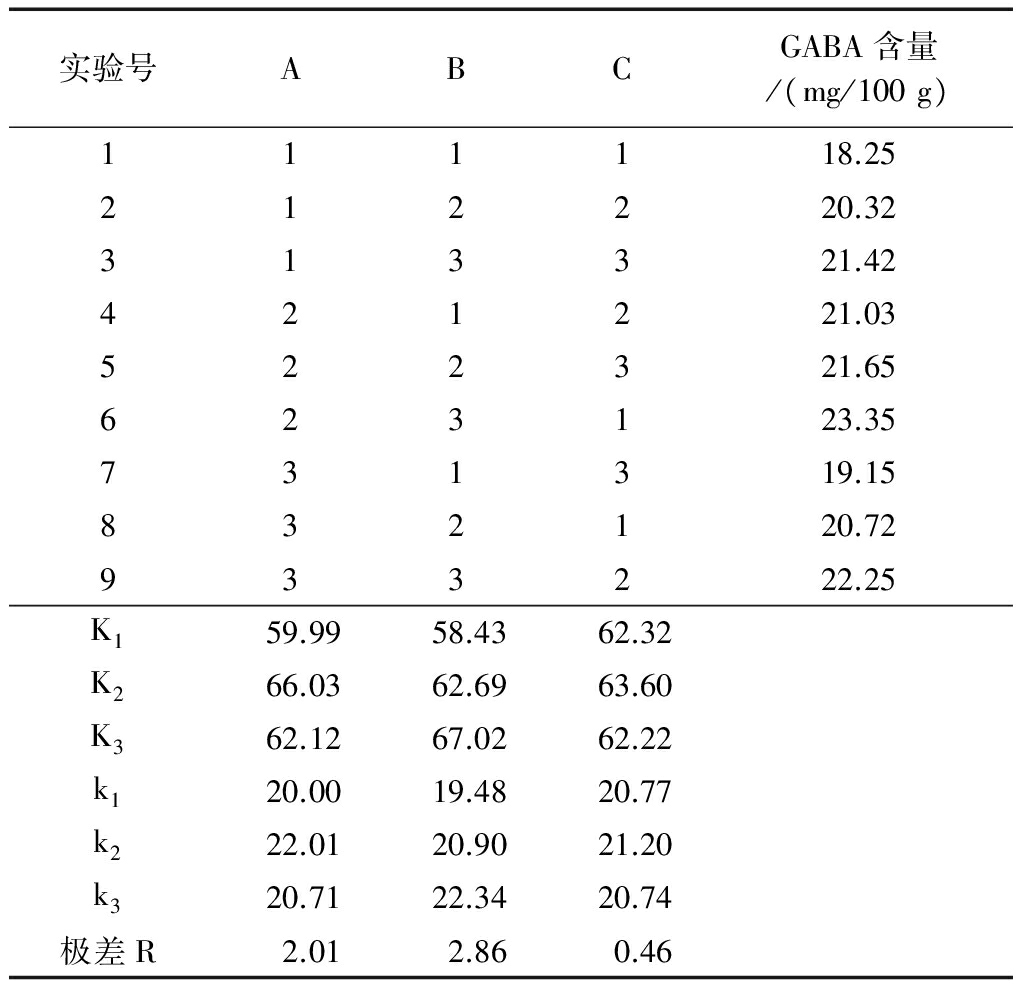
表6方差分析
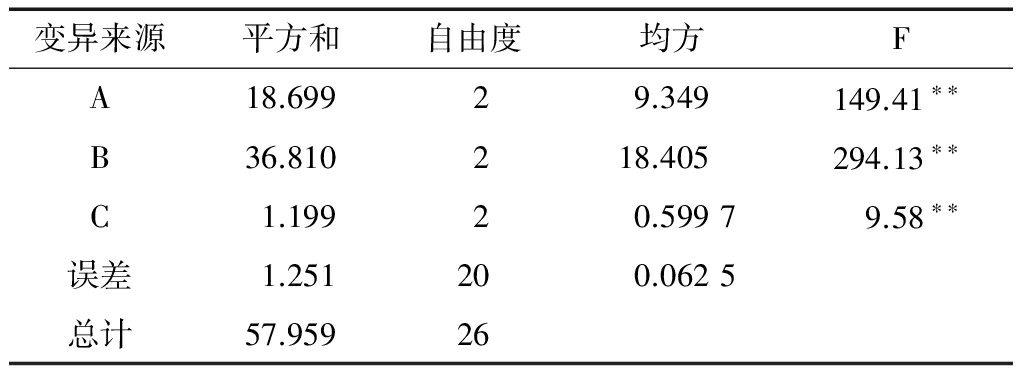
注:F(a=0.05)=3.49,F(a=0.01)=5.85;**表示极显著。

图3 在各因素不同水平下GABA的变化
正交实验得出的最优辅料配方为A2B3C2,即玉米粉添加10%,黑豆粉添加17%,米粉添加15%。按此配方,添加48%青稞,制成固体培养基,进行验证发酵实验,在30 ℃的环境下培养8 d,结果显示,GABA产量约为24.62±0.18 mg/100 g。
红曲霉(Monascus purpureus)发酵谷物是我国传统的药食两用食物,其发酵产物中,富含Monacolin K、红曲色素、γ-氨基丁酸、麦角固醇、天然植物激素等活性成分。在利用红曲霉发酵青稞的工艺研究中,国内外多数研究者均以Monacolin K、红曲色素等为评价指标研究其工艺过程[24-25],而以γ-氨基丁酸为评价指标的研究相对较少。据赵大伟[23]等人的测定,每100 g青稞大约含γ-氨基丁酸15.28±8.51 mg,而在我们的实验中,大约每48 g青稞(100 g培养基中)就可以产出大约24.62 mg的γ-氨基丁酸,由此可见,该方法大大提高了天然γ-氨基丁酸得率。蒋博文[26]等人筛选了发酵青稞的红曲酶菌株,优化了pH、料水比等发酵条件,虽然其在最优条件下发酵青稞得到的γ-氨基丁酸含量较高,但其条件较苛刻,很难在实际应用中得到推广。本方案发酵条件简便,易于操作,且对红曲菌株要求不高,几种辅料廉价易得,普通居民在家即可自行完成操作,因而是一种极具推广潜力的、能提高食品营养价值的、简便易行的操作方法。
本研究结果显示,在红曲霉发酵青稞的过程中,在青稞制作的固体培养基中添加适当辅料,会提高红曲霉发酵产GABA的产量。本实验所选取的玉米粉、黑豆粉、米粉三种辅料中,黑豆粉是影响GABA产量的主要因素;三种辅料添加量的最优组合为:玉米粉10%、黑豆粉17%、米粉15%,在红曲发酵青稞的过程中,按照该辅料组合,再添加48%青稞制成固体发酵培养基,在30 ℃的环境下培养8 d,GABA产量约为24.62±0.18 mg/100 g。
参考文献:
[1]杨叶,陈野,罗垠,等.挤压米糠发酵生产γ-氨基丁酸的工艺条件优化[J].食品科学,2011,32(9):246-250.
[2]徐林敏,张充,陆兆新,等.γ-氨基丁酸产生菌的筛选及培养基优化[J].食品科学,2014,35(23):238-244.
[3]Kinnersley A M,Turano F J.Gamma aminobutyric acid(GABA)and plant responses to stress[J].Critical Reviews in Plant Sciences,2000,19(6):479-509.
[4]Carmans S,Hendriks J J A,Slaets H,et al.Systemic treatment with the inhibitory neurotransmitter gamma-aminobutyric acid aggravates experimental autoimmune encephalomyelitis by affecting proinflammatory immune responses[J].Journal of Neuroimmunology,2013,255(1-2):45-53.
[5]Dhakal R,Bajpai V,Baek K H,Production of GABA(γ-aminobutyric acid)by microorganisms:a review[J].Brazilian Journal of Microbiology,2012,43(4):1230-1241.
[6]王辉,项丽丽,张锋华.γ-氨基丁酸(GABA)的功能性及在食品中的应用[J].食品工业,2013,34(6):186-189.
[7]梁恒宇,邓立康,林海龙,等,新资源食品——γ-氨基丁酸(GABA)的研究进展[J].食品研究与开发,2013,34(15):119-123.
[8]范杰,孙君社,张晓杰,等.高产γ-氨基丁酸乳酸菌的筛选及鉴定[J].中国酿造,2011,4:39-41.
[9]李丽,陈福生.红曲菌GABA高产菌株的筛选及培养基的研究[J].安徽农业科学,2012,40(30):14956-14957,14960.
[10]黄敏欣,洪泽淳,赵文红,等.红曲对广东客家黄酒发酵及产γ-氨基丁酸的影响[J].中国酿造,2016,35(10):46-50.
[11]李阔阔,王钰,万田,等.高产洛伐他汀红曲霉氮离子束诱变育种[J].食品与发酵工业,2016,42(4):98-102.
[12]张锐.红曲霉液态发酵生产红曲色素的工艺优化[J].生物技术通报,2015,31(2):187-195.
[13]张健明,何钢,刘嵬,等.水溶性红曲色素液态发酵培养基成分优化[J].食品科技,2015,40(9):252-257.
[14]Shi Y C,Pan T M.Beneficial effects of Monascus purpureus NTU 568-fermented products:a review[J].Applied Microbiology and Biotechnology,2011,90(4):1207-1217.
[15]高汪磊,龚凌霄,张英.青稞作为我国高原特色谷物资源在功能食品领域的开发潜力[J].粮食与油脂,2015,28(2):1-4.
[16]徐菲,党斌,杨希娟,等.不同青稞品种的营养品质评价[J].麦类作物学报,2016,36(9):1249-1257.
[17]张海涛,杨平平,王燕,等.全酶法酿制青稞清酒的工艺研究[J].酿酒科技,2015,6:54-57.
[18]沈娜,黄楠楠,周选围,等.发芽青稞面包加工工艺优化[J].粮油食品科技,2017,25(1):11-14.
[19]李玉斌,吴华昌,肖猛,等.一种青稞格瓦斯的制备及挥发性风味成分分析[J].食品与发酵工业,2017,43(1):96-103.
[20]谭友莉,马云桐,黄凤,等.响应面法对青稞红曲中两种Monacolin K的提取工艺优化[J].天然产物研究与开发,2015,27(11):1930-1937.
[21]周礼红,万强,刘敏,等.青稞红曲固态发酵工艺研究初探[J].中国酿造,2012,31(10):46-49.
[22]Ansari M P,Puri A,Ali M,et al.Five new secondary metabolites from Monascus purpureus-fermented Hordeum vulgare and Sorghum bicolor[J].Natural Product Research,2013,27(20):1848-1855.
[23]赵大伟,普晓英,曽亚文,等.大麦籽粒γ-氨基丁酸含量的测定分析[J].麦类作物学报,2009,29(1):69-72.
[24]蒲立柠,陈光静,阚建全.响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J].食品科学,2017,38(2):264-270.
[25]Huang Q.,Zhang H.,Xue D.,Enhancement of antioxidant activity of Radix Puerariae and red yeast rice by mixed fermentation with Monascus purpureus,Food Chemistry[J],2017,226:89-94.
[26]蒋博文,张玉红,丁予章,等,青稞γ-氨基丁酸发酵的初步研究,浙江农业科学[J],2011,1:93-95.●
LIU Dong1,WANG Ping2,ZHOU Zhi-wei1,3,ZHOU Xuan-wei1
(1.School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240;2.College of Chemistry and Chemical Engineering, Tianjin University of Technology, Tianjin 300384;3.School of Life Sciences, Shanghai University,Shanghai 200444)
Abstract:The influence of auxiliary ingredients and their amounts on the yield of γ-aminobutyric acid (GABA) was investigated based on the single factor test of producing GABA with highland barley fermentated by monascus, and the orthogonal test L9(33). The optimal varieties and amounts of auxiliary ingredients, were obtained. The production condition was optimized. The results showed that the yield of GABA could be increased by adding auxiliary ingredients. The optimal medium formula of solid fermentation were as follows: 48% highland barley, 10% corn flour, 17% black bean flour, and 15% rice flour; the yield of GABA was approximately 24.62±0.18 mg/100 g after 8 days′ fermentation at 30 ℃.
Key words:monascus; highland barley; γ-aminobutyric acid (GABA); fermentation; optimize
收稿日期:2017-05-03
基金项目:天津汇禾食品有限公司资助项目(16H100000413)
作者简介:刘栋,1989年出生,男,硕士研究生.
通讯作者:周选围,1962年出生,男,教授.
中图分类号:TS 202.3;TQ 920.6
文献标识码:A
文章编号:1007-7561(2018)01-0068-05