高向阳,杨梦柯
(郑州科技学院食品科学与工程学院,河南 郑州 450064)
摘 要:为建立一种快速简便、灵敏测定食品中铝的新方法,选用紫麦、贼小豆和油条等为样品,湿法消解后,用双标准夹心法与标准曲线法对照测定。结果表明:三价铝在质量浓度为0.10~50 μg/mL范围内与荧光强度呈线性关系,相关系数为0.999 0,回收率在96.0%~107.2%之间,相对标准偏差RSD<1%(n=11)。该法快速简便、成本低廉、样品用量少,无需绘制标准曲线和测定空白,为食品中铝的测定提供了一种全新的分析技术,具有推广应用价值。
关键词:铝;分子荧光;双标准夹心法;食品
铝是自然界含量较多的金属元素[1],广泛存在于食品中,在人体内能与多种蛋白质或酶发生化学反应,影响人体正常功能,使大脑骨骼受到损害,导致神经系统无法正常运转,甚至造成记忆力和智力下降[2],进而引发阿尔茨海默症、帕金森综合症、老年痴呆症[3]等神经系统疾病。世界卫生组织(WTO)已将铝确定为食品污染物之一,GB 2760—2014《食品添加剂使用标准》明确规定了面制品中含铝食品添加剂的用量、残留量和使用范围[4],我国已经进入老年社会,因此,建立快速、简便、准确测定食品中铝的新方法对维护人体健康有一定的现实意义。
目前,测定铝的方法主要有石墨炉原子吸收法[5]、高效液相色谱法[6]、电感耦合等离子体质谱法(ICP-MS)[7]、ICP-AES[8]、示波极谱法[9]等,这些方法仪器昂贵、成本高,操作麻烦、分析时间长,或需绘制标准曲线和测定空白溶液,计算较为繁琐复杂。荧光分析法灵敏度较高、线性范围广、选择性较好、操作简单快速,已得到实际应用[10],双标准夹心法也称双标准比较法或紧密内插法[11],该法利用浓度大(ρ1)、小(ρ2)的两个标准溶液,将待测试液(ρX)夹在其中,要求ρ1>ρX>ρ2。在相同体积的萃取液中,可简便的用质量代替浓度。在相同条件下,浓度或质量与发光信号呈正比,依此进行定量分析,该法已在环境监测中有所阐述[12],但双标准夹心法在发光分析领域尤其用分子荧光法测定食品中的铝至今未见文献报道。本实验根据8-羟基喹啉与三价铝在一定条件下定量形成强荧光配合物的特性,用双标准夹心法定量。该法试剂易购、样品用量少、无需绘制标准曲线和测定空白值、快速简便,为食品中铝的测定提供了一种全新的分析技术,具有一定的推广应用价值。
紫麦和贼小豆:采自郑州市郊;油条:购自郑州市早餐摊点。
1.2.1 主要试剂
硝酸、浓氨水:洛阳昊华化学试剂有限公司;高氯酸:天津市鑫源化工有限公司;氯仿:河南省新乡市中原有机化工有限责任公司;8-羟基喹啉:北京化工厂;冰醋酸:天津市致远化学试剂有限公公司。均为分析纯。1 000 μg/mL铝标准溶液:购自国家有色金属及电子材料分析测试中心;实验用水为怡宝纯净水,电导率为2.28 μS/cm。
100 μg/mL铝标准溶液储备液配制 准确移取1 000 μg/mL的铝标品5.00 mL于50 mL容量瓶中,用水定容至刻度。
铝标准使用液配制 采用逐级稀释法,将100 μg/mL的铝标准溶液储备液稀释为质量浓度为10、1、0.2 μg/mL等铝的标准使用液。
200 μg/mL 8-羟基喹啉溶液配制 准确称取0.100 0 g的8-羟基喹啉(分析纯)于小烧杯中,加入3 mL冰醋酸,转移至500 mL容量瓶中,用水定容。
6 mol/L氨水配制 取45 mL 25%的浓氨水加水稀释至100 mL。
1.2.2 主要仪器
FW-80型万能粉碎机:北京市永光明医疗仪器有限公司;pHS-3C型台式酸度计、970CRT型荧光分光光度计:上海仪电分析仪器有限公司;SW-TFG12型通风柜:郑州宏朗仪器设备有限公司;DZF-6050A型真空干燥箱:北京中兴伟业仪器有限公司。
所有玻璃仪器都要事先用30%硝酸浸泡过夜,用蒸馏水洗净后方可使用。
1.3.1 样品制备
紫麦、贼小豆分别用研钵研碎,油条剪碎,置于称量瓶中,在104 ℃烘箱内烘至恒重,于干燥器中保存。称取样品0.200 0 g(准确至0.000 1 g)于100 mL锥形瓶中,加入10 mL硝酸-高氯酸(4+1)混合酸,盖上小漏斗,在通风橱中消解冒白烟近干时取下,加2 mL水继续加热,待溶液澄清透明取下冷却后,全部移至25 mL容量瓶中,用水定容、摇匀,此为样品分析液。
1.3.2 双标准溶液配制
准确吸取1 μg/mL的铝标准使用液0.10 mL于100 mL烧杯中,加入20 mL水、200 μg/mL 8-羟基喹啉溶液5.00 mL,摇匀,用6 mol/L氨水调节pH 7.60后倒入分液漏斗中,取5 mL氯仿润洗烧杯后倒入漏斗中萃取,取下层液体于10 mL具塞比色管中,再取5 mL氯仿萃取1次,合并下层萃取液后用氯仿小心定容,摇匀后待测定,此为10 mL氯仿萃取液中含铝0.10 μg的稀标准溶液;同理,准确吸取1 μg/mL的铝标准使用液3.00 mL于100 mL烧杯中,按照以上操作配制10 mL氯仿萃取液中含铝3 μg的浓标准溶液,摇匀待测。
1.3.3 试液制备和测定
准确吸取样品分析液1.00 mL于100 mL烧杯中,加入20 mL水、200 μg/mL 8-羟基喹啉溶液5.00 mL,摇匀,以下操作和萃取同1.3.2双标准溶液,在仪器设定的相同条件下,完成双标准溶液和试液的测定。按(1)式计算10 mL样品氯仿萃取液中铝的质量mx。
(1)
式中,mx为样品氯仿萃取液中铝的质量,μg;Ix为样品mx的相对荧光强度;m1、m2分别为浓标准、稀标准氯仿萃取液中铝的质量,μg;I1、I2为浓标准、稀标准氯仿萃取液的相对荧光强度,I1>Ix>I2。
由(1)式可知,(m1-m2)/(I1-I2)为单位荧光发射强度所相当的氯仿萃取液中铝的质量。很显然,在相同条件下测定,此值乘以(IX-I2)即是样品氯仿萃取液比稀标准氯仿萃取液中多的铝的质量数值,依据此比例关系,可以简便的实现快速测定。同时,按(2)式计算样品中铝的质量分数:
w/(mg/kg)=mx×25/m
(2)
式中,w为样品中铝的质量分数,mg/kg;m为称样量,g;25为样品分析液定容的总体积,mL。
1.3.4 样品标准曲线法的测定
分别吸取1 μg/mL的铝标准使用液0.00、0.10、0.40、0.80、1.00、2.00、5.00、8.00、10.00、20.00、30.00、40.00、50.00 mL于100 mL烧杯中,各加20 mL水和200 μg/mL 8-羟基喹啉溶液5.00 mL,用6 mol/L氨水调节pH 7.60后,倒入分液漏斗中,以下按1.3.2萃取操作。以10 mL氯仿萃取液中Al3+的质量(μg)为横坐标,荧光相对强度为纵坐标绘制标准曲线,如图1。由图1可知,线性回归方程为y=3.845x+29.908,相关系数r=0.999 0。
在与标准曲线相同的条件下测定样品分析液,同时测定空白,由标准曲线或回归方程求出10 mL氯仿萃取液中Al3+的质量。
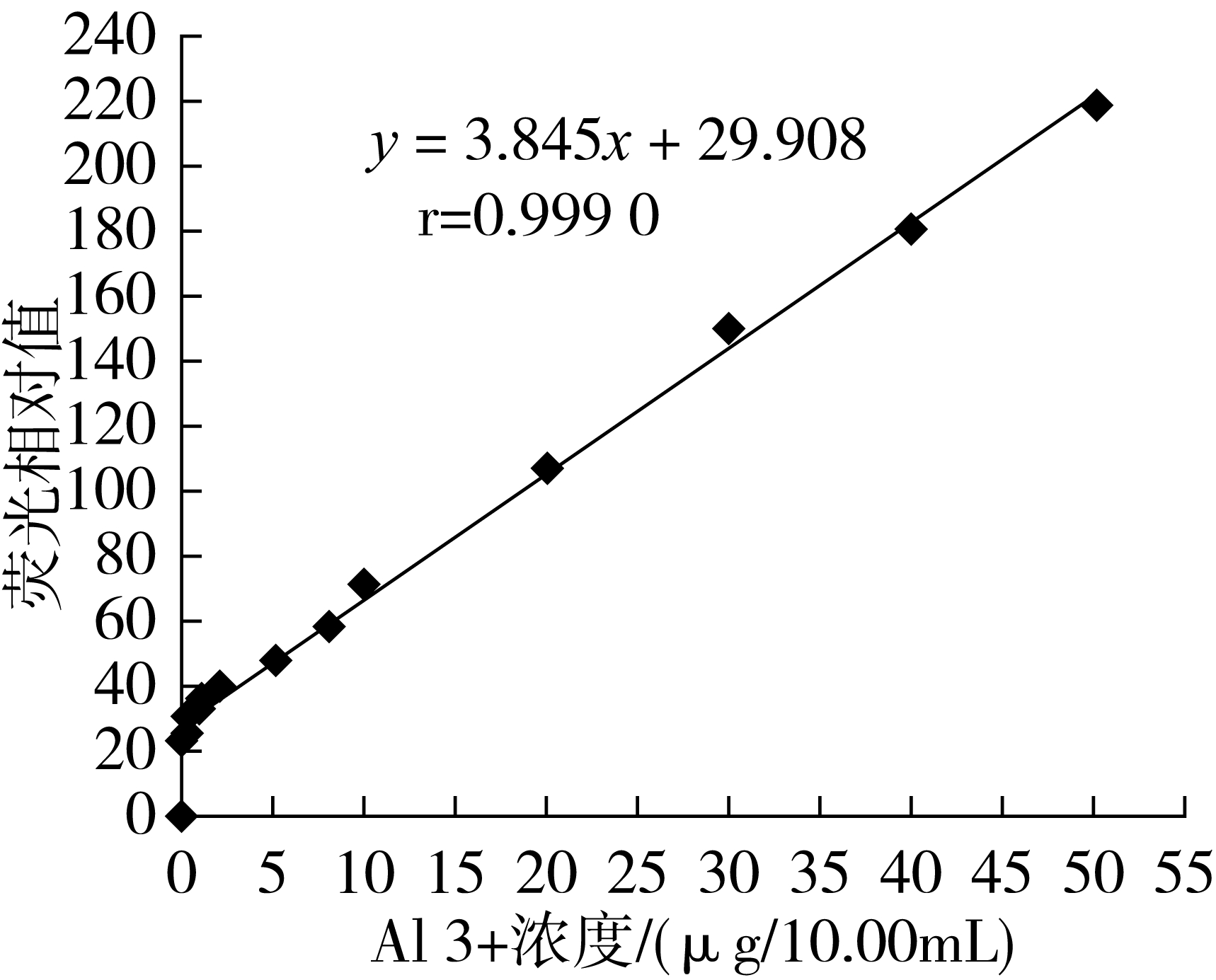
图1 8-羟基喹啉铝的标准曲线
最大激发波长EX为400 nm;最大发射波长EM为525 nm;扫描速度为低速;灵敏度为1;EX狭缝为10 nm;EM狭缝为10 nm。
取12个100 mL的烧杯,各加人20 mL水,0.2 μg/mL的铝标准使用液2.00 mL,200 μg/mL 8-羟基喹啉5.00 mL,用6 mol/L氨水调节pH分别调为4.00、5.00、6.00、7.00、7.30、7.60、7.90、8.00、8.20、8.50、8.80、9.00,分别倒入分液漏斗中,取5 mL氯仿润洗锥形瓶,以下按1.3进行操作、测定,结果见图2。由图2可知,pH为7.60时荧光相对值最大且基本稳定,与相关文献报道[12-14]结论一致。

图2 pH对铝—8-羟基喹啉络合物荧光强度的影响
吸取0.2 μg/mL的铝标准使用液1.00 mL,置于含有20 mL水的锥形瓶中,再加入5 mL 8-羟基喹啉溶液,调节pH为7.60,用10 mL氯仿萃取,以下操作同1.3.2。固定EM发射波长510 nm[12],设置EX为250~800 nm,在2.1其他条件下扫描,由图3可知,最大激发波长为400 nm;固定EX激发波长为400 nm,设置EM为250~800 nm扫描,由图4可知最大发射荧光波长为525 nm。最大波长各文献报道的均略有差异[10,13-14],本实验亦是如此,可能与仪器误差有关。

图3 铝—8-羟基喹啉络合物的激发光谱
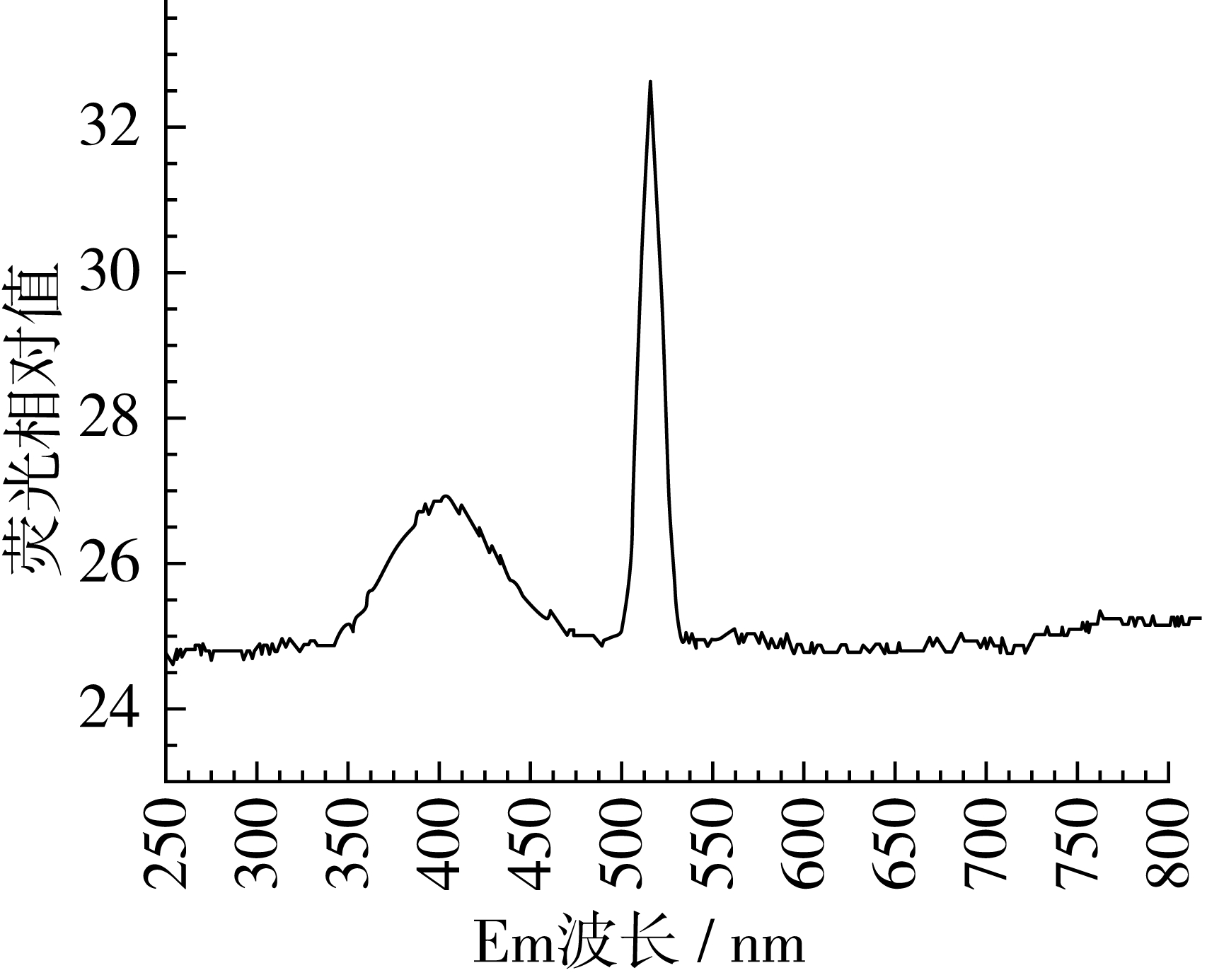
图4 铝—8-羟基喹啉络合物的荧光发射光谱
取5个100 mL烧杯,分别加20 mL水、0.2 μg/mL的铝标准使用液2.00 mL,8-羟基喹啉5.00 mL,用氨水调节pH 7.60后,1号溶液用10 mL氯仿萃取1次,2号溶液用10 mL氯仿分2次萃取,依次类推,每次萃取操作与步骤1.3.2相同,实验结果如图5。由图可知,10 mL氯仿萃取2次后测定的相对荧光值最大,效果最为理想。

图5 萃取次数对铝—8-羟基喹啉络合物荧光强度的影响
向7个烧杯中各加20 mL水,0.2 μg/mL的铝标准使用液2.00 mL,200 μg/mL 8-羟基喹啉5.00 mL,用6 mol/L氨水调节pH 7.60后,马上计时,设定反应时间分别为0.0、5.0、10、20、30、40、50 min,按1.3操作萃取后测定,实验结果如图6。
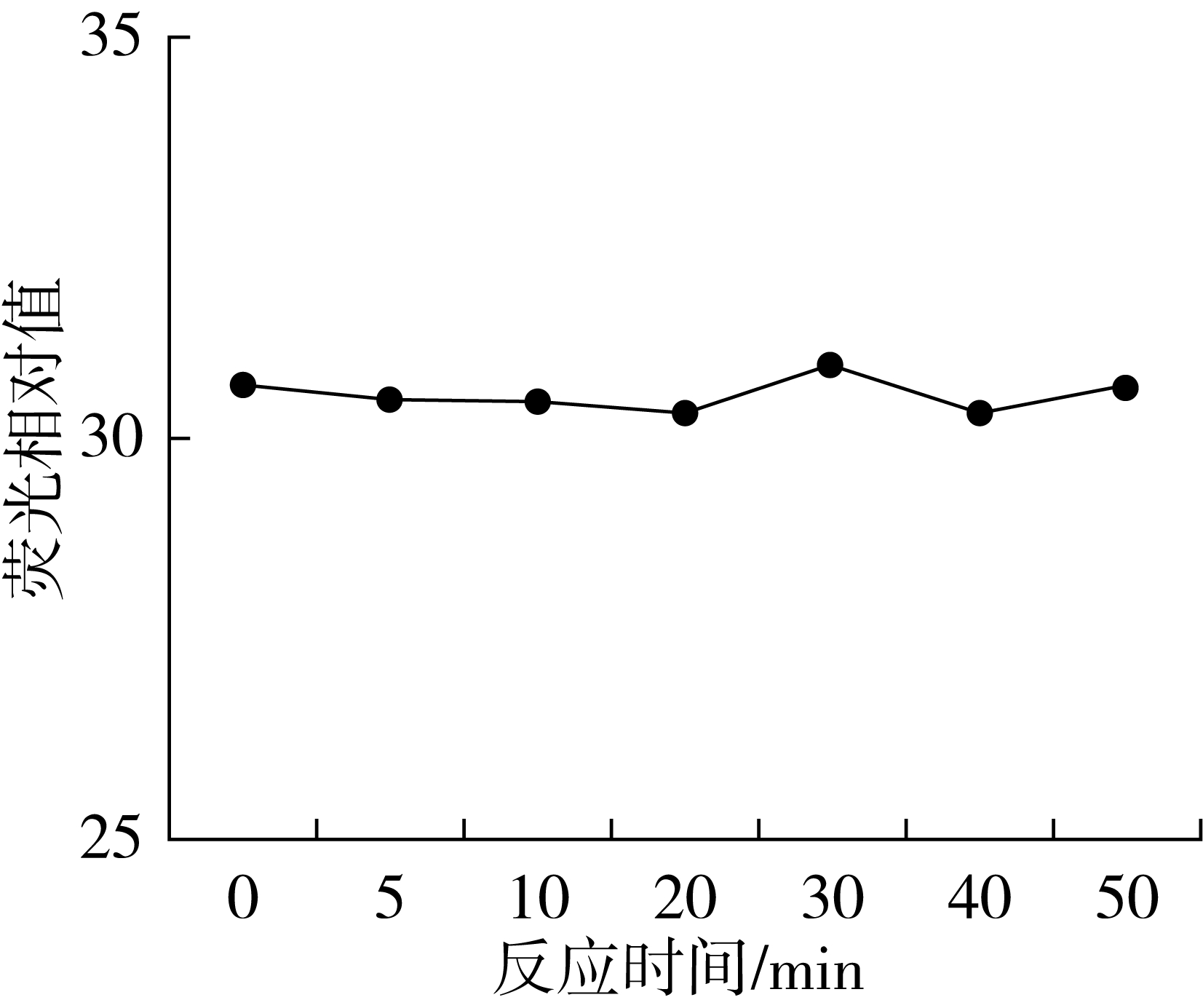
图6 反应时间对荧光强度的影响
由图6可知,络合反应时间对测定影响不大。
按实验方法,在仪器工作条件下,用双标准夹心法和标准曲线法对照测定,各样品分别进行5次平行测定,检验无可疑值后报告,测定结果和标准偏差S、相对标准偏差RSD见表1。
表1测定结果及精密度(n=5)
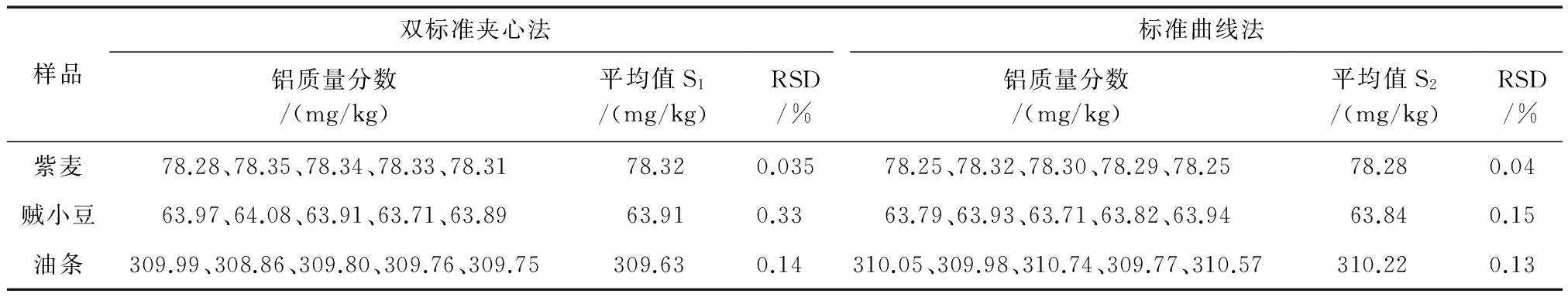
测定结果表明,油条铝含量最高,其次是紫麦和贼小豆。按照文献[15]对2种方法进行显著性检验,通过F检验和t可知,2种分析方法不存在显著的偶然误差和系统误差,结论的置信度为95%。
对0.1 μg/mL铝标准溶液,用实验方法和仪器条件进行11次平行测定,按3倍标准偏差计算的检出限0.030 μg/mL,按10倍标准偏差计算的定量限为0.10 μg/mL。
以紫麦和贼小豆为样品,分别加入0.50、2.00、10.00 μg的铝标准使用液,按实验方法进行操作,在仪器工作条件下进行加标回收率实验。结果见表2。
表2加标回收率结果
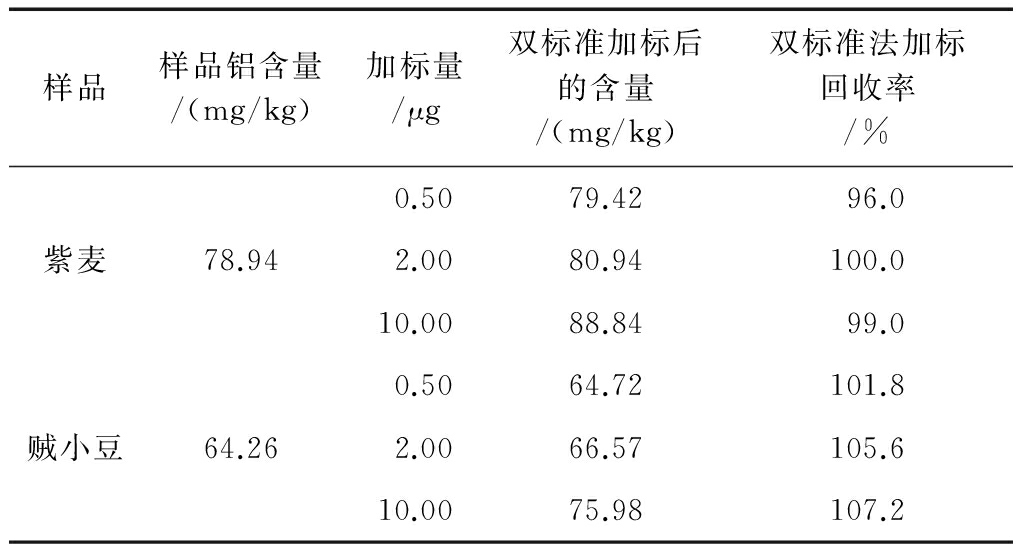
由表2可知,双标准夹心法的回收率在96.0%~107.2%之间。
用双标准夹心法定量测定食品中的铝,无需绘制标准曲线,避免了作图误差和时常校正标准曲线所带来的诸多不便。由计算公式(1)可知,所用标准溶液浓度处于试液的浓度左右,本法在完全相同的条件下,测定的是荧光信号差值所相当的浓度差值,8-羟基喹啉空白微弱的荧光信号在测定中已经予以扣除,无需再重复测定空白。该法简便、快速,结果计算简单,精密度和回收率较为理想。在仪器工作条件下,方法测得的检出限为0.030 μg/mL,定量限为0.10 μg/mL,回收率在96.0%~107.2%之间,相对标准偏差<1%。与工作曲线法对照测定样品,经F和t检验表明,2种方法间的测定结果不存在显著性差异,结论的置信度为95%,为食品中铝的快速测定提供了科学参考。
参考文献:
[1]祁嘉义.临床元素化学[M].北京:化学工业出版社,2003:158-165.
[2]孙晓仲,安思雨.ICP-OES法测定面制食品中铝含量[J].食品安全导刊,2017(3):81-82.
[3]Campbell A,Hamai D,Bondy S C.Differential toxicity of Aluminumsalts in human cell lines of neural origin:implications forneurodegeneration[J].NeuroToxicology,2001,22(1):63-71.
[4]GB 2760—2014,食品安全国家标准 食品添加剂使用标准[S].
[5]杨念东,陈少滨.石墨炉原子吸收光谱法测定面制食品中的铝[J].质量探索,2016(4):42-42.
[6]王硕,张向明,毛红霞,等.高效液相色谱法同时测定糖果中6种合成着色剂及其铝色淀[J].现代预防医学,2016,43(22):4174-4182.
[7]李媛,贾韶千,李思阳.微波消解/ICP-MS法测定乳制品纸铝塑包装中重金属[J].食品研究与开发,2017,38(4):154-157.
[8]吴莉,王玉.ICP-AES测定茶包中总铝及水溶性铝的含量[J].药物分析杂志,2017,37(5):869-874.
[9]梁朝河,王定国,陈大明,等.钙指示剂示波极谱法测定茶叶中铝[J].中华预防医学杂志,1998,32(1);1-4.
[10]张桂香.分子荧光光度法测定海水中的痕量铝[J].海湖盐与化工.2004,33(3):10-13.
[11]高向阳.新编仪器分析[M](第四版).北京:科学出版社,2013:83.
[12]吴云峰,史明昭.环境检测中四种定量手段的适用范围局限性及其选用原则[J].煤矿环境保护,1993,7(2):50-52.
[13]米培培,张丽霞.8-羟基喹啉荧光试剂法测定茶叶中铝含量[J].山东农业科学,2009(4):106-108.
[14]程代,朱春秋,许慧玲,等.8-羟基喹啉荧光分光光度法测定油炸食品中铝[J].中国食品卫生杂志,2011,23(4):317-319.
[15]华中师范大学,东北师范大学,陕西师范大学,等.分析化学,北京:高等教育出版社,2011:92-96.●
GAO Xiang-yang,YANG Meng-ke
(College of Food Science and Engineering,Zhengzhou Institute of Science and Technology,Zhengzhou Henan 450064)
Abstract:A rapid and sensitive method was established for the determination of aluminum in food.Purple wheat,vigna minima and the fried dough sticks was elected as samples,after wet digestion,the samples were determined by double-standard sandwich method and standard curve method.The results showed that there was a linear relationship between trivalent aluminium and fluorescence intensity as trivalent aluminum mass concentration within the range of 0.10~50 μg/mL-1,the correlation coefficient r=0.999 0,the recovery rate was 96.0%~107.2% and relative standard deviation RSD<1%(n=11).The method is rapid,simple,cheap with a small amount of sample,doesn’t need drawing the standard curve and determining blank simple,which provides a new analysis technique for the determination of aluminum in food and is worth being spread.
Key words:aluminum;molecular fluorescence;double standard sandwich method;food
收稿日期:2017-07-14
基金项目:郑州市科技局新兴产业研究与开发基金资助(153PXXCY186)
作者简介:高向阳,1949年出生,男,教授、研究生导师.
中图分类号:TS 207.3;TS 201.6
文献标识码:A
文章编号:1007-7561(2017)06-0056-05