
李 旭1,吴维吉2,刘 佳1,李凤旭1
(1.天津市粮油质量检测中心,天津 300171;2.中国天津粮油批发交易市场,天津 300171)
摘 要:研究谷物中16种邻苯二甲酸酯(PAEs)的测定方法。样品以乙腈-水提取,QuEChERS方法净化,气相色谱-串联质谱(GC-MS/MS)测定。结果表明,该法在20~2 000 μg/L质量浓度范围内线性关系良好,相对标准偏差(RSD)为4.6%~13.7%,在0.1 mg/kg和0.5 mg/kg加标水平下的回收率为84.1%~110.4%,检出限为1~100 μg/kg。对实际样品测定发现,18个谷物样品中均受到PAEs的污染。
关键词:气相色谱串联质谱;邻苯二甲酸酯;塑化剂;谷物
邻苯二甲酸酯类化合物(PAEs),又称酞酸酯,是工业生产中常用的一种增塑剂。含有PAEs的商品包括塑料薄膜、塑料瓶、保鲜盒、塑料玩具、医用材料等。PAEs具有难挥发、溶解度低、易生物富集的特点。由于它们与塑料基质之间没有形成共价键,会扩散到水、土壤等环境中或者迁移到与塑料接触的食品中。PAEs进入食物链后,会干扰血液中的激素水平,从而对生殖系统产生影响[1-7]。2011年6月,卫生部将邻苯二甲酸酯类物质列为食品中可能违法添加的非食用物质和易滥用食品添加剂[8]。
目前在各类食品PAEs检测的报道中,对谷物的关注相对较少。已有的文献主要参照GB/T 21911—2008[9]的方法进行测定[10-11]。谷物既是人们日常生活一种重要的主食,也是食品加工链条的源头之一。研究谷物中PAEs的污染情况,对保障食品安全和人民健康具有重要的意义。本实验采用乙腈-水混合溶剂振荡提取,QuEChERS方法净化,GC-MS/MS检测谷物中的16种PAEs类化合物。与国标相比,该法降低了PAEs的检出限,同时使定性更加准确。
1.1.1 仪器
TRACE 1310/TSQ QUANTUM XLS气相色谱-三重四极杆质谱联用仪:Thermo Fisher公司;XW-80A微型漩涡混合仪:上海沪西分析仪器厂;LD5-2B雷勃尔离心机:北京雷勃尔离心机有限公司;PSA玻璃固相萃取柱:迪马科技公司;EDAA-2300TH超声清洗器:上海安谱实验科技股份有限公司;3100旋风磨:瑞典Perten仪器公司;SY88-TH砻谷机:韩国双龙机械产业株式会社;XHF-D高速分散器:宁波新芝生物科技股份有限公司;SSL1回旋式振荡器:英国Stuart公司。
1.1.2 试剂
16种PAEs混和标准溶液:浓度为1 000 mg/L,分别含有邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)己酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二苯酯(Diphenyl phthalate)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二壬酯(DNP):美国O2si Smart Solutions公司;PSA粉(40~63 μm),C18粉(40~63 μm):上海安谱实验科技股份有限公司;色谱纯乙腈、色谱纯正己烷:赛默飞公司;优级纯乙腈、优级纯正己烷、色谱纯丙酮、优级纯丙酮、分析纯氯化钠,分析纯无水硫酸镁:天津市化学试剂批发公司。
1.2.1 色谱条件
色谱柱:TR-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;传输线温度280 ℃;不分流进样,进样量1 μL;载气:氦气,流速1 mL/min;升温程序:60 ℃保持1 min,以20 ℃/min升至220 ℃,保持1 min,以5 ℃/min升至300 ℃,保持4 min。
1.2.2 质谱条件
电子轰击离子源(EI),能量70 eV,离子源温度280 ℃,溶剂延迟时间5 min,采取选择反应监测模式(SRM)进行数据收集。
1.2.3 样品前处理方法
用旋风磨将样品粉碎成细颗粒(稻谷经砻谷机脱壳后粉碎)。称取粉碎的样品5 g,放入100 mL三角瓶中,加入10 mL去离子水,20 mL乙腈,振荡提取30 min。过滤至装有3 g氯化钠的25 mL比色管中,振摇1 min,静置15 min,取上层清液2 mL至装有150 mg无水MgSO4、50 mg C18、50 mg PSA的玻璃管中,在涡旋混合器上混匀1 min。在1 000 r/min下离心5 min,取上清液600 μL至样品瓶中待测。
PAEs沸点较高,极性较弱,因此应选择弱极性的色谱柱,并且在程序升温时采取较高的温度。图1为PAEs混合标准溶液的总离子流图。可以看出,16种化合物能够得到有效的分离。

图1 PAEs混合标准溶液的总离子流
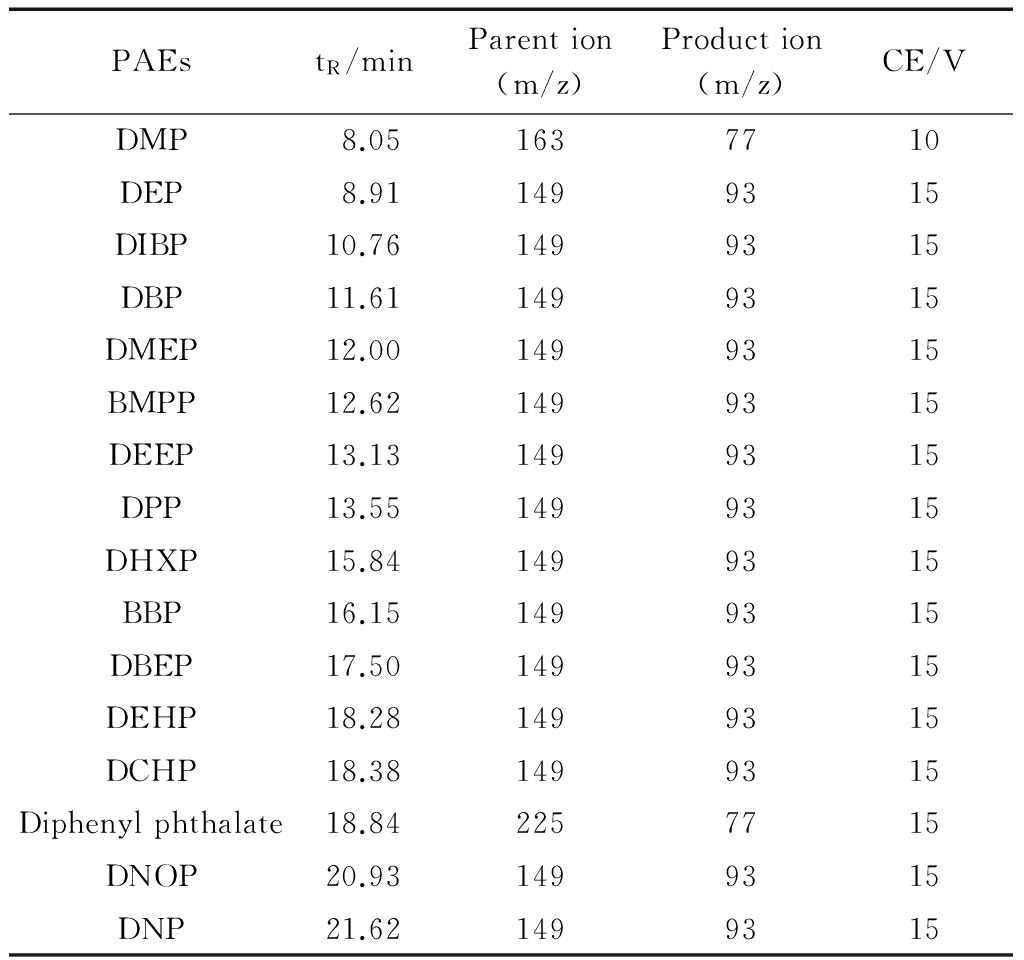
对标准溶液进行单极质谱全扫描,确定各化合物的最大丰度碎片,将其作为母离子(Parent ion)。再进行子离子扫描,在其产生的二级离子碎片中,选择丰度最大的作为子离子(Product ion)。最后改变电子碰撞能量,选择子离子强度最大的碰撞能量为最优碰撞能量。优化后的16种邻苯二甲酸酯保留时间、监测离子(m/z)以及碰撞电压(CE)见表1。
表1保留时间(tR)、监测离子(Parent ion、Product ion)及碰撞电压(CE)
2.3.1 提取溶剂及方式确定
分别考察乙腈、正己烷、丙酮、乙腈-水、丙酮-水混合溶液的提取效率,结果发现,乙腈-水和丙酮-水混合溶剂的提取效率最高。可能是PAEs虽然是极性偏弱的化合物,但是谷物中的含水量较低,纯有机试剂的渗透作用不强,提取效果不如混合溶剂。丙酮-水的提取液中的色素等杂质较多,给净化增加了困难。因此最终选择乙腈-水混合溶剂作为提取液。
选择某一PAEs含量较高的阳性样品,考察不同振荡时间对提取效果的影响。振荡时间分别设为15、20、25、30、35、40 min,将不同时间下的提取液净化,上机测定。结果表明,30 min以后的PAEs含量基本无变化。以DIBP为例,图2是不同提取时间DIBP的含量变化情况。另外,对同一样品分别采取了超声提取30 min和均质机提取2 min两种方式,几种PAEs中的含量与振荡提取的结果一致。最终采取振荡提取的方式。
实验曾尝试用离心方法促进分层。将提取液过滤至含3 g氯化钠的玻璃离心管中,剧烈振摇1 min,1 000 r/min离心10 min,乙腈和水层分层效果明显。然而在离心过程中,提取液会接触离心管的塑料塞。为了避免污染,最终采取静置分层方法。
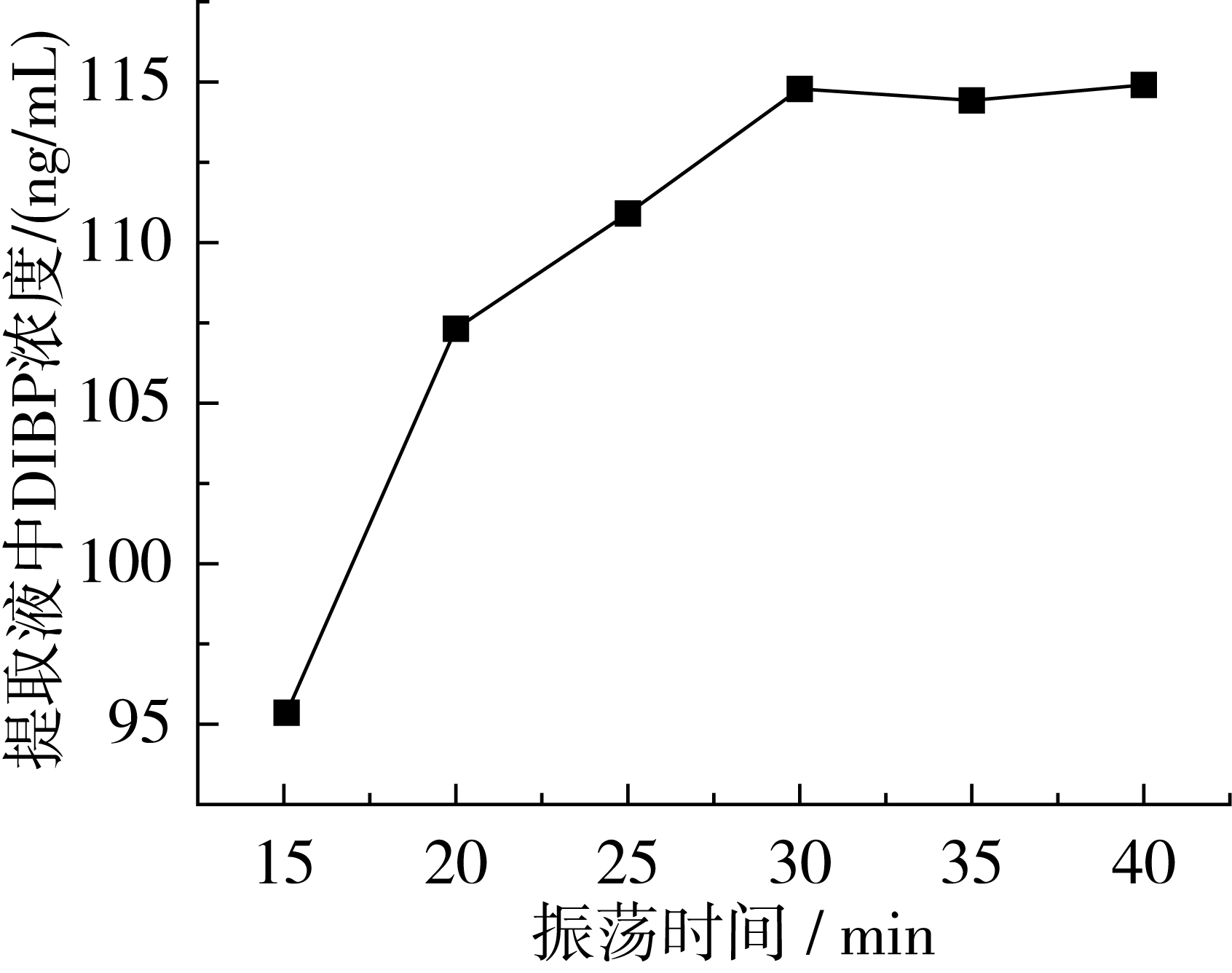
图2 不同振荡时间提取液中DIBP的浓度
2.3.2 净化方法确定
比较了PSA玻璃固相萃取柱和QuEChERS 2种净化方法。固相萃取柱法消耗的试剂较多,并且净化液需要浓缩才能进样,步骤较为繁琐。同时,浓缩后试剂中的PAEs含量也会增加,造成本底偏高。最终采用QuEChERS方式进行净化。
PSA能较好吸附游离脂肪酸等极性萃取物,同时能吸附少量色素。谷物中含有一定量的脂肪,通过加入C18粉能得到净化。乙腈提取液中的少量水分可以用无水MgSO4去除。石墨化炭黑粉能够有效吸附色素,但同时对PAEs也有一定的吸附。最终确定的净化材料为无水MgSO4、C18和PSA。实验发现,当吸取2 mL提取液时,加入150 mg无水MgSO4、50 mg C18、50 mg PSA即可取得理想的净化效果。
PAEs作为一种大量使用的塑化剂,在环境中几乎无处不在。因此实验过程中必须对仪器和试剂进行有效控制,保证样品不被污染。前处理中使用的器具全部为玻璃制品。使用前用铬酸洗液浸泡过夜,用蒸馏水冲洗干净后在超声清洗器中用水进行超声,最后用去离子水冲洗、晾干。实验所使用的有机试剂也可能含有PAEs[12]。对不同品牌的有机试剂的PAEs进行了测定,发现国产试剂中PAEs含量较高,最终选择本底含量最低的赛默飞色谱纯级试剂。
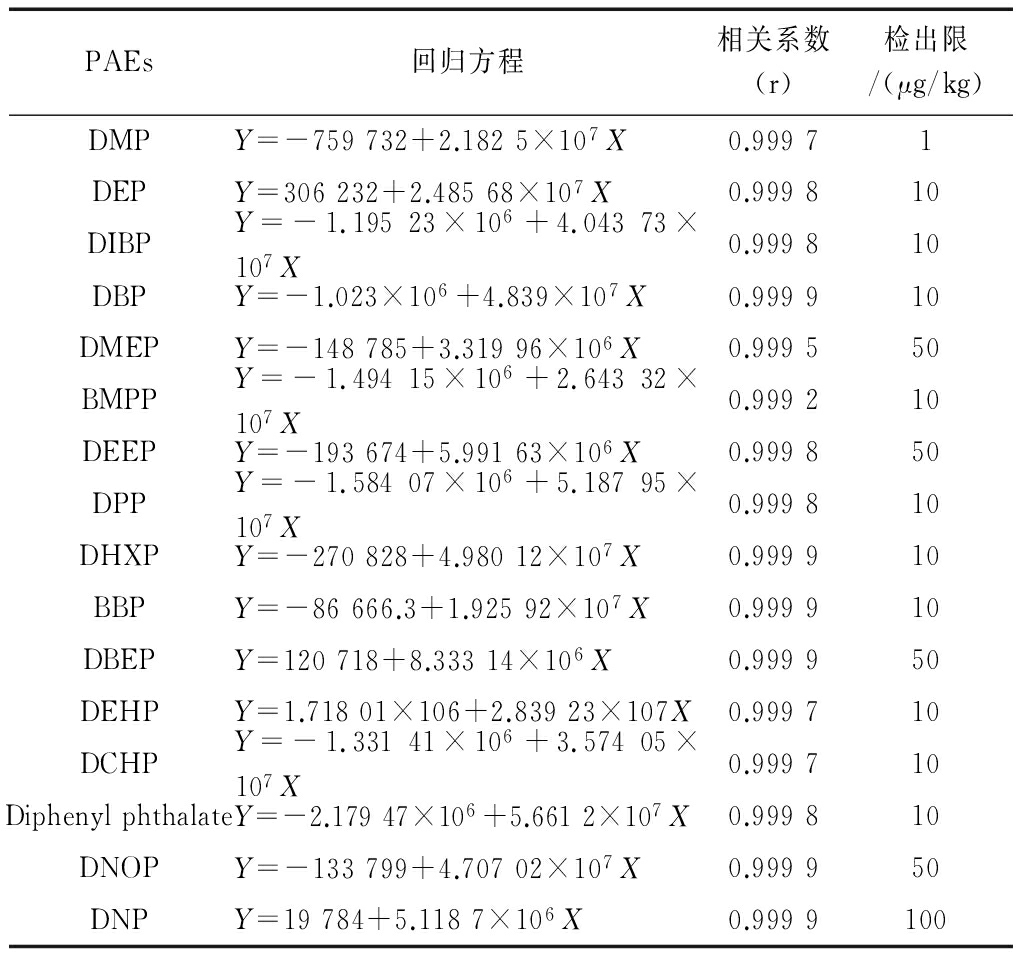
将PAEs混合标准溶液稀释成20~2 000 μg/L不同梯度的溶液,按照前述的GC-MS/MS条件上机测定。以峰面积为纵坐标,浓度为横坐标进行线性拟合,得到标准曲线的回归方程、相关系数。取空白样品制备不同梯度的加标样品,按前述方法进行前处理,上机测定。考察各种化合物的峰面积,当某一化合物的峰面积约等于3倍信噪比时,将其所对应的加标浓度作为方法的检出限。回归方程、相关系数、检出限见表2。
由表2可知,该方法在20~2 000 μg/L浓度范围内线性良好,检出限为1~100 μg/kg。其中DMEP、DEEP、DBEP、DNP由于响应信号小,所以检出限较其他化合物偏高。DNP出峰附近的噪声明显偏高,因此其检出限明显高于其他化合物。
表2回归方程、相关系数、检出限
分别制作含量为0.1 mg/kg和0.5 mg/kg的加标样品,按上述方法进行处理。做6个平行试样,同时测定空白样品中的PAEs含量,计算回收率的平均值,结果见表3。
表3回收率和相对标准偏差(RSD,n=6)

表3中的数据表明,16种加标化合物的回收率为84.1%~110.4%,相对标准偏差(RSD)为4.6%~13.7%,说明该方法对测定谷物中的PAEs有较强的可靠性。
采用上述方法对小麦(7个样品)、稻谷(5个样品)、玉米(6个样品)共18个样品进行检测。结果发现,样品中DIBP、DBP、DPP、DEHP含量较高,见表4。这与先前报道中水体、土壤中PAEs调查的结果基本一致[13]。本实验所有样品均来自粮库抽样,储存方式为散存无包装。这些谷物从收获、运输到存储过程中接触塑料制品的机会很少,因此其中的PAEs可能来自于作物生长过程中受到环境的污染。
表4实际样品检测结果
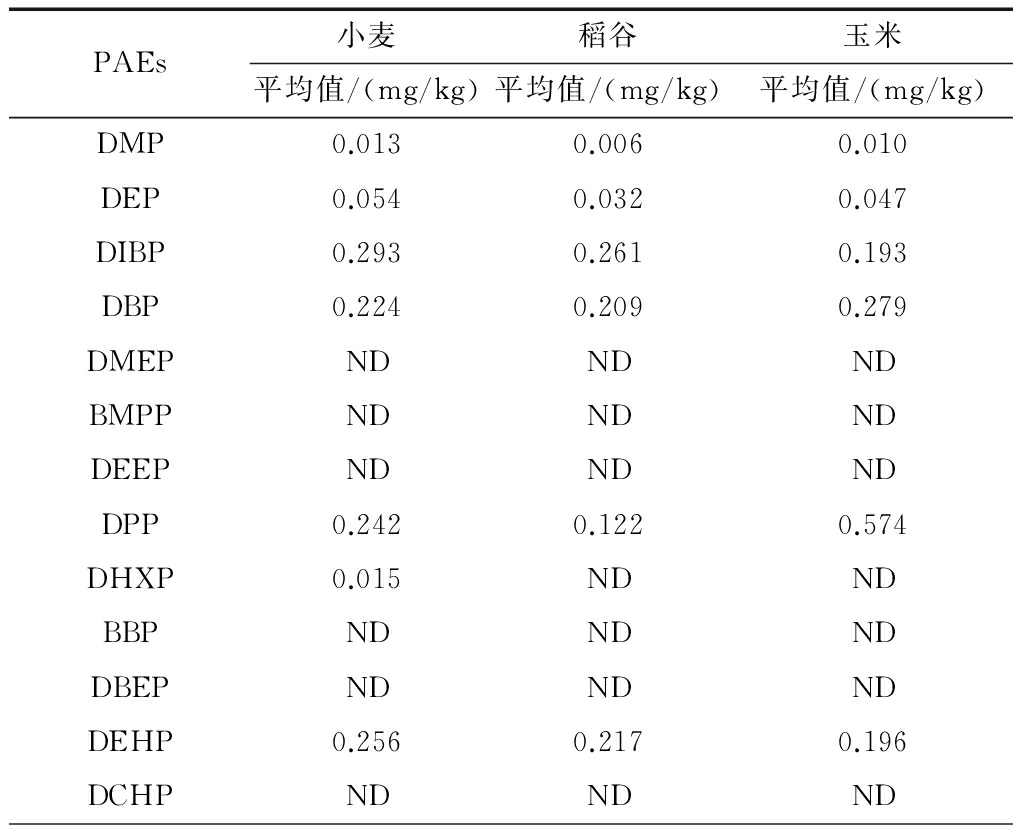
续表4
注:ND为未检出。
本实验研究了谷物中PAEs的测定方法。PAEs以乙腈-水提取,QuEChERS方法净化,GC-MS/MS测定。该方法在20~2 000 μg/L范围内呈良好线性关系,加标回收率为84.1%~110.4%,相对标准偏差(RSD)为4.6%~13.7%,方法检出限为1~100 μg/kg。前处理简便、快捷,定量准确。对实际样品的测定发现,DIBP、DBP、DPP、DEHP检出率较高。
参考文献:
[1]Stales C A,Peterson D R,Parkerton T F,et al.The environmental fate of phthalate esters: A literature review[J].Chemosphere,1997,35(4):667-749.
[2]Thompson C J,Ross S M,Gaido K W.Di(n-butyl) phthalate impairs cholesterol transport and steroidogenesis in the fetal rat testis through a rapid and reversible mechanism[J].Endocrinology,2004,145(3):1227-1237.
[3]Benson B.Hazard to the developing male reproductive system from cumulative exposure to phthalate esters-dibutyl phthalate,diisobutyl phthalate,butylbenzyl phthalate diethylhexyl phthalate,dipentyl phthalate,and diisononylphthalate[J].Regulatory Toxicology & Pharmacology,2009,53(2):90-101.
[4]胡雄星,韩中豪,刘必寅,等.邻苯二甲酸酯的毒性及其在环境中的分布[J].环境科学与管理,2007,32(1):37-40.
[5]刘慧杰,舒为群.邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J].第三军医大学学报,2004,26(19):1778-1781.
[6]靳秋梅,孙增荣.邻苯二甲酸酯类化合物的生殖发育毒性[J].天津医科大学学报,2004(s1):15-18.
[7]Engel S M,Miodovnik A,Canfield RL,et al.Prenatal phthalate exposure is associated with childhood behavior and executive functioning[J].Environmental Health Perspectives,2010,118(4):565-571.
[8]卫生部办公厅关于通报食品及食品添加剂中邻苯二甲酸酯类物质最大残留量的函:卫办监督函[2011]551号[EB/OL].http://www.nhfpc.gov.cn/sps/s3594/201211/2b4831f001a740a48086fad 152117286.shtml.2011-06-13/2017-04-14.
[9]GB/T 21911—2008,食品中邻苯二甲酸酯的测定[S].2008.
[10]郭浩楠,凌云,李玉玉,等.GC-MS法检测谷类、根茎类蔬菜中24种邻苯二甲酸酯[J].食品科学,2013,34(16):164-168.
[11]翟志雷,卢素格,张伟.粮食中邻苯二甲酸酯类物质含量的调查[J].中国卫生检验杂志,2014,24(2):270-272.
[12]陈永山,骆永明,章海波,等.环境样品酞酸酯分析中溶剂背景的影响[J].分析实验室,2010,29(10):33-36.
[13]崔学慧,李炳华,陈鸿汉,等.中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J].生态环境学报,2010,19(2):472-479.●
LI Xu1,WU Wei-ji2,LIU Jia1,LI Feng-xu1
(1.Tianjin Grain & Oil Quality Inspection Center,Tianjin 300171;2.China Tianjin Grain & Oil Wholesale Market,Tianjin 300171)
Abstract:A method based on gas chromatography-tandem mass spectrometry (GC-MS/MS) was developed for the determination of 16 kinds of phthalic acid esters (PAEs) in grains.The sample was extracted by acetonitrile-water and purified by QuEChERS method.The results showed that the liner range was 20~2 000 μg/L,the recovery rate on 0.1 mg/kg and 0.5 mg/kg were in the range of 84.1%~110.4% and the relative standard deviations (RSDs) were 4.6%~13.7%.The limits of detection were in the range of 1~100 μg/kg.A total of 18 grain samples were found to be contaminated with PAEs.
Key words:GC-MS/MS;phthalic acid esters (PAEs);plasticizer;grain
收稿日期:2017-04-07
作者简介:李旭,1963年出生,女,高级工程师.
通讯作者:刘佳,1982年出生,男,高级工程师.
中图分类号:TS 207.5
文献标识码:A
文章编号:1007-7561(2017)06-0046-04