彭星星1,乔茜华2,张红云1,高海军1,高敬铭1,戴冠苹1,秦祎芳1
(1.河南省粮油饲料产品质量监督检验中心,河南 郑州 450000;2.国家电网公司运行分公司郑州管理处,河南 郑州 450000)
摘 要:以核桃油为试验原料,研究了核桃油在氧化过程中的抗氧化活性的变化。结果表明:未曾氧化的核桃油抗氧化活性较好,核桃油对DPPH·自由基的抑制率随着核桃油样品浓度的增加而不断增强,147.0 mg/mL质量浓度的核桃油清除DPPH·自由基能力为50%;340.83mg/mL质量浓度的核桃油清除羟基自由基的能力为50%;1.0 mg/mL质量浓度的核桃油对超氧阴离子自由基的平均清除率与1.0 mg/mL质量浓度的 Vc相当。而经氧化后的核桃油清除DPPH·自由基和·OH自由基的能力明显降低,相同浓度不同氧化时间的核桃油样品对超氧阴离子自由基的清除能力,随着氧化时间的增长而逐渐下降,但氧化时间越短核桃油对![]() 的抑制率越好,当氧化时间为30天时,核桃油对
的抑制率越好,当氧化时间为30天时,核桃油对![]() 的平均抑制率从55.53%降到15.43%。总之,未曾氧化的核桃油的抗氧化物活性较好,随着氧化时间的增加核桃油对以上三种自由基的清除能力逐渐降低。
的平均抑制率从55.53%降到15.43%。总之,未曾氧化的核桃油的抗氧化物活性较好,随着氧化时间的增加核桃油对以上三种自由基的清除能力逐渐降低。
关键词:核桃油;贮藏;抗氧化能力
核桃为世界四大干果之一。我国也是核桃的原产地之一,栽培面积和产量均居世界之首。现今核桃已然成为了我国核桃主产区乡村经济的支柱产业之一,在推动农业结构调整、提高农民收入和保障我国食用油供给安全等方面起到了重要的作用。祖国医学指出,核桃性温、味甘、无毒,有健胃、补血、润肺、养神等成效[1]。核桃具有很高的营养价值[2-5],核桃含油量约为65%,被称为“树上的油库”,核桃油脂肪酸组成主要是亚油酸、油酸和亚麻酸等不饱和脂肪酸,含量高达约为90%[6-7],对于降低胆固醇防治冠心病、动脉硬化和心肌梗塞等疾病有很大作用[8-10]。核桃油中富含黄酮类物质[11-12],还含有神经酸、鳕油酸、EPA、DHA、角鲨烯、褪黑素、黄酮、胡萝卜素等微量营养成分[13],能够防治动脉粥样硬化[14]、具有抗氧化[15]等功效。
但正是由于核桃油含有较高的不饱和脂肪酸,特别容易氧化变质,降低了其固有的风味及营养价值,缩短了保质期,因此核桃油的氧化变质问题成为其在货架期的主要问题之一。目前,普遍采用的评价核桃油及其制品货架期的方法为Schaal烘箱法,即将样品置于(60+1)℃的烘箱中进行快速氧化[16]。孟阿会[17]的研究数据表明,核桃油随着氧化程度的加深,相同浓度水平的样品对DPPH自由基和超氧阴离子自由基的清除能力表现出降低的趋势,核桃油在氧化过程中产生的反应变化可以影响核桃油对自由基的清除能力;周凤娟等[18]使用 Schaal 烘箱法对不同种类抗氧化剂在核桃油贮藏期间的抗氧化能力进行了研究,确定出了最合适的抗氧化剂;张丽等[19]以新疆薄皮核桃油为原料,在不同水平的温度、光照、金属离子及抗氧化剂等条件下,以核桃油的过氧化值为评价指标,对核桃油的氧化稳定性进行评估,并采用 Schaal 耐热试验得出 20 ℃条件下核桃油的预期货架寿命。目前鲜有文献对核桃油在贮藏过程中抗氧化能力即清除DPPH·、·OH和![]() 能力的变化进行研究。
能力的变化进行研究。
为了对核桃油在贮藏过程中抗氧化能力的变化进行研究,本试验采用Schaal 烘箱法对核桃油的抗氧化能力进行了快速评价,研究了未氧化核桃油、60 ℃烘箱氧化10 d、20 d及30 d核桃油对DPPH·、·OH和![]() 清除能力的变化,以期为核桃油在贮藏过程中抗氧化能力的变化规律提供一定的理论依据。
清除能力的变化,以期为核桃油在贮藏过程中抗氧化能力的变化规律提供一定的理论依据。
1.1.1 材料
试验用核桃油(冷榨法,无任何添加剂)取自陕西海源生态农业有限公司,在试验前进行密封贮藏,防止其氧化变质。
1.1.2 试剂
1,1-二苯基-2-苦肼基DPPH,Sigma公司;维生素C,邻苯三酚,三羟甲基氨基甲浣(Tris),水杨酸,硫酸亚铁,氢氧化钠,98%浓硫酸,双氧水,盐酸,无水乙醇,试验用水为蒸馏水。
EL-204型电子天平,梅特勒-托利多仪器上海有限公司;720紫外分光光度计,上海美谱达仪器有限公司;TDL-5低速离心机,赛默飞世尔科技公司;恒温水浴锅,太仓市试验设备厂;pH计。
1.3.1 核桃油清除DPPH·自由基能力试验
DPPH·溶于乙酸乙酯中呈现出紫色,在波长515 nm处有最大吸收值,并且浓度和吸光度为线性关系,物质的抗氧化能力可以由物质对DPPH·的清除能力来表示。主要通过紫外分光光度法进行测定。
(1)称取0.000 39 g DPPH,用乙酸乙酯定容至100 mL,得到浓度为1×10-4mol/L的DPPH溶液,低温放置,待用;
(2)在10 mL的试管中分别加入含2 mL未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油、VC的乙酸乙酯溶液,浓度分别对应为0.03 g/mL、0.06 g/mL、0.09 g/mL、 0.12 g/mL、0.15 g/mL。之后再依次加入DPPH反应液4 mL,摇匀,放置暗处反应30 min,反应结束后,在515 nm波长处测定吸光度值;
(3)对照组为2 mL样品加入4 mL乙酸乙酯溶液;空白组为2 mL乙酸乙酯溶液加入4 mLDPPH反应液。以乙酸乙酯溶液作为参比,测定其吸光度,记录下吸光度值,由此计算DPPH.的清除率。
DPPH自由基清除率![]()
注:Ai—2 mL样品溶液+4mLDPPH溶液测定的吸光度值。
Ai0—2 mL样品溶液+4mL乙酸乙酯溶液测定的吸光度值。
A0—2 mL乙酸乙酯+4mLDPPH溶液测定的吸光度值。
1.3.2 核桃油清除羟基自由基能力试验
Fenton反应是用二价铁离子作为催化体系,用双氧水作为氧化剂的氧化反应体系,在化学反应过程中可以产生羟基自由基,依据对水杨酸-乙醇反应体系的氧化情况,确定待测样品能否对羟基自由基产生清除效果。在化学反应过程中,二价铁离子被其氧化成三价铁离子可能发生混凝反应从而生成沉淀。
(1)制备硫酸亚铁溶液(6 mmol/L):准确称取0.083 4 g七水合硫酸亚铁用少量蒸馏水溶解,然后转移至50 mL 容量瓶中精确定容,获得6 mmol/L的硫酸亚铁溶液;
(2)制备水杨酸-乙醇体系(6 mmol/L):准确称取0.041 4 g水杨酸溶于少量无水乙醇中,然后用无水乙醇溶液准确定容为50 mL(100 mL),得到6 mmol/L水杨酸-乙醇体系;
(3)制备0.1%的双氧水溶液:用微量移液器准确量取含30%浓度双氧水溶液166.7 μL转移至50 mL容量瓶中,用蒸馏水定容至刻度,得到0.1%的双氧水溶液。
在10 mL的试管中分别加入1 mL 6mmol/L的水杨酸-乙醇溶液和1 mL 6mmol/L硫酸亚铁溶液,之后分别加入1mL的样品溶液(用无水乙醇定容),浓度分别为0.03 、0.06、0.09、 0.12、0.15 g/mL,最后加入0.8 mL双氧水溶液,使反应开始,摇匀,将其放置于37 °C水浴锅中反应30 min,水浴反应完毕之后在3500 r/min速度下离心10 min,然后取上清液在510 nm波长处测定其吸光度值,以无水乙醇取代双氧水作为对照组,以无水乙醇取代样品溶液作为空白组。
羟基自由基清除率![]()
注:Ai—为样品的吸光度值。
Ai0—以无水乙醇代替双氧水对照组的吸光度值。
A0—以无水乙醇代替样品空白的吸光度值。
1.3.3 核桃油清除超氧阴离子自由基能力试验
邻苯三酚在弱碱性环境下(Tris-HCl溶液提供)能够使自身发生氧化分解反应,生成超氧阴离子自由基。在反应进行过程中,超氧阴离子自由基不断地增多,在这一过程中生成带有颜色的中间产物,从而使反应溶液在波长420 nm下吸光度值在一段时间内随时间变化而成线性增长关系。所以,在这一时间段内,吸光度的变化能够反应样品对超氧阴离子自由基的抑制能力。
(1)制备邻苯三酚溶液(30 mmol/L):准确称取0.189 2 g邻苯三酚,用10 mmol/L的盐酸溶液溶解,定容于50 mL容量瓶中,此溶液需临场配制;
(2)制备10 mmol/L HCl:加0.86 m L的浓盐酸至1 000 mL的水中。
(3)Tris-HCl溶液(pH=8.2):配制1L 0.05 M(50 mmol/L)Tris-HCl溶液,称量7.88 g Tris-HCl置于1 L烧杯中,加入约800 mL左右的去离子水,用玻璃棒充分搅拌溶解后加入浓盐酸调节至所需要的pH值,然后将溶液定容至1 L,经高温高压灭菌后,在室温下保存。
(4)制备样品溶液(1.0 mg/mL):分别称取0.025 g未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油、维生素C用无水乙醇定容至25 mL容量瓶中,得到1.0 mg/mL的样品乙醇溶液和维生素C溶液。
具体实验方法:分别称取样品未氧化核桃油、氧化10 d核桃油、氧化20 d核桃油、氧化30 d核桃油乙醇溶液、维生素C溶液(1.0 mg/mL)1.0mL,放置于10 mL试管中,之后加入pH为8.2的Tris-HCl溶液5.0 mL,邻苯三酚溶液50 μL,迅速混匀,以蒸馏水为空白每30 s测定波长420 nm处的吸光度值。
超氧阴离子自由基清除率![]()
注:Ai—(1 mL样品溶液+5 mLTris-HCl溶液+50 μL邻苯三酚溶液)的吸光值
A0—(1 mL蒸馏水+5 mLTris-HCl溶液+50 μL邻苯三酚溶液)的吸光值
不同氧化天数的核桃油(Walnut Oil,下表中简称WO)样品对DPPH·的清除能力如图1所示:

图1 不同氧化天数的核桃油对DPPH·的清除率
表1不同氧化天数核桃油对DPPH·抑制的回归曲线
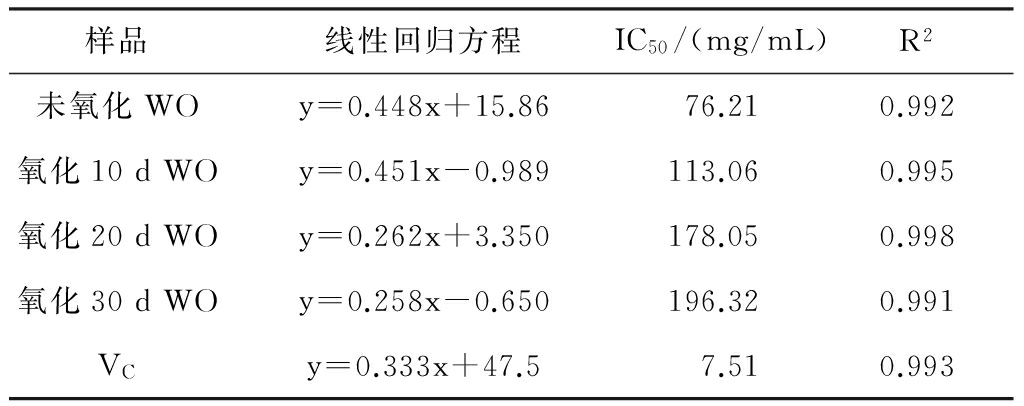
经比较发现,随着浓度水平的增加,不同氧化天数的核桃油对DPPH·的抑制率也随之增加,并且氧化时间越短,核桃油的清除效果越好,76.21mg/mL质量浓度未氧化核桃油清除DPPH·自由基的能力为50%,相当于7.51 mg/mL质量浓度 VC对DPPH·清除自由基的能力,相当于113.06 mg/mL质量浓度氧化10 d核桃油清除DPPH·的能力,相当于178.05 mg/mL质量浓度氧化20 d核桃油清除DPPH·的能力,相当于196.32 mg/mL质量浓度氧化30 d核桃油清除DPPH·的能力。此结论与孟阿会[17]的结果相一致,这可能是由于随着氧化时间的增长,核桃油中的天然抗氧化成分如黄酮、生育酚等的含量也急剧降低,核桃油的抗氧化能力也逐渐减弱,清除DPPH·的能力也逐渐减低[20]。
不同氧化天数的核桃油样品对·OH的清除能力如图2所示:

图2 氧化不同天数核桃油对·OH的清除率
表2不同氧化天数核桃油对·OH抑制的回归曲线

经比较发现,86.65 mg/mL质量浓度未氧化核桃油清除·OH自由基的能力为50%,相当于1.53 mg/mL质量浓度 VC对OH·清除自由基的能力,相当于121.60 mg/mL质量浓度氧化10 d核桃油对·OH清除自由基的能力,相当于169.60 mg/mL质量浓度氧化20 d核桃油清除·OH的能力,相当于190.84 mg/mL质量浓度氧化30 d核桃油清除·OH的能力。随着浓度水平的增加,不同氧化天数核桃油对·OH的抑制率增加,并且氧化时间越短,核桃油的清除效果越好。这可能是由于随着氧化时间的增长,核桃油中的天然抗氧化成分如植物甾醇等的含量也急剧降低,核桃油的抗氧化能力也逐渐减弱[21]。
不同氧化天数的核桃油样品及维生素C对超氧阴离子自由基的清除能力如图3所示:

图3 核桃油对超氧阴离子的清除率
表3不同氧化天数核桃油对![]() 抑制的回归曲线
抑制的回归曲线

由实验结果可知,相同浓度的不同氧化时间的核桃油样品对超氧阴离子自由基的清除能力随着时间的延长,抑制率逐渐下降,但氧化时间越短核桃油对![]() 的抑制率越好,当氧化时间达到30 d时,核桃油的最高抑制率由90.84%降到33.77%,下降幅度达62.82%;平均抑制率由55.53%降为15.43%,下降幅度达72.21%。这可能是核桃油在氧化过程中失去了一些具有清除自由基能力的活性物质,另外还有一些不饱和脂肪酸如油酸、亚油酸、亚麻酸等发生氧化生成小分子的醛酮类物质,而核桃油中的一些抗氧化物质如黄酮等结构发生破坏,无法起到保护核桃油的作用。此外,未氧化核桃油的清除率变化幅度较大,VC清除
的抑制率越好,当氧化时间达到30 d时,核桃油的最高抑制率由90.84%降到33.77%,下降幅度达62.82%;平均抑制率由55.53%降为15.43%,下降幅度达72.21%。这可能是核桃油在氧化过程中失去了一些具有清除自由基能力的活性物质,另外还有一些不饱和脂肪酸如油酸、亚油酸、亚麻酸等发生氧化生成小分子的醛酮类物质,而核桃油中的一些抗氧化物质如黄酮等结构发生破坏,无法起到保护核桃油的作用。此外,未氧化核桃油的清除率变化幅度较大,VC清除![]() 较迅速,1 min后即达到平缓趋势,但二者的平均清除率相差不大,这说明核桃油对
较迅速,1 min后即达到平缓趋势,但二者的平均清除率相差不大,这说明核桃油对![]() 的清除能力与VC相当。
的清除能力与VC相当。
试验结果表明,未氧化的核桃油对DPPH·自由基、OH·自由基和![]() 自由基的清除能力较强,随着氧化时间的增长,核桃油对以上三种自由基的清除能力逐渐减弱。总之,核桃油含有多种生物活性物质如黄酮、生育酚、甾醇等,具有较强的抗氧化能力,为核桃油的诸多生理活性提供了解释,但是随着氧化时间的增长核桃油中天然活性物质含量也急剧减少,因此对以上三种自由基的清除能力逐渐降低,抗氧化能力逐渐降低,这也解释了核桃油在氧化过程中营养价值降低的原因。
自由基的清除能力较强,随着氧化时间的增长,核桃油对以上三种自由基的清除能力逐渐减弱。总之,核桃油含有多种生物活性物质如黄酮、生育酚、甾醇等,具有较强的抗氧化能力,为核桃油的诸多生理活性提供了解释,但是随着氧化时间的增长核桃油中天然活性物质含量也急剧减少,因此对以上三种自由基的清除能力逐渐降低,抗氧化能力逐渐降低,这也解释了核桃油在氧化过程中营养价值降低的原因。
参考文献:
[1]李时珍(明).本草纲目(下册)[M].北京:人民卫生出版社,1982:1084.
[2]李敏,刘媛,孙翠,等.核桃营养价值研究进展[J].中国粮油学报,2009(6):166-170.
[3]王利华.核桃的营养保健功能及加工利用[J]. 中国食物与营养,2007(8):28-30.
[4]李仁敏.核桃营养及药用研究进展[J].农产品加工,2004(12):26-27.
[5]郗荣庭,张毅萍.中国果树志:核桃卷[M].北京:中国林业出版社,1996.
[6]陆浩,杨会芳,毕艳兰,等.山核桃油的理化性质及脂肪酸组成分析[J].中国油脂,2010,35(5):73-76.
[7]王顺民,郑丹,汤斌,等.山核桃油中的脂肪酸GC法分析[J].中国调味品,2009,34(1):106-108+117.
[8]Zibaeenezhad,M.J.,Rezaiezadeh,M.,Mowla,A.,Ayatollahi,S.M.T.,Panjehshahin,M.R.Antihypertriglyceridemic effect of walnut oil[J].Angiology,2003.54(4):411-414.
[9]Willis L. Dose-dependent effects of walnuts on motor and cognitive function in aged rats[J]. Brit J Nutr, 2009,101(8):1140-1144.
[10]Griel A. An increase in dietary n-3 fatty acids decreases a marker of bone resorption in humans[J]. J Nutr, 2007 (6):2.
[11]余旭亚,王洪钟,郑桂兰,等.核桃油总黄酮含量的测定[J].中国油脂,2002,27(1):59-60.
[12]余旭亚,陈朝银,王洪钟,等.核桃仁与核桃油总黄酮含量比较研究[J].食品研究与开发,2002,23(6):25-26.
[13]赵声兰,陈朝银,葛锋,等.核桃油功效成分研究进展[J].云南中医学院学报,2010,33(6):71-74.
[14]陈丹,赵声兰. 核桃油保健及药用功效研究[J].亚太传统医药,2009,5(1):27-29.
[15]张清安,李建科,李泽珍.核桃油对小鼠肝脏与脑组织的抗氧化作用[J].营养学报,2004,26(5):408-409.
[16]韩军歧,张有林,陈双平,等.葵花籽油的超声波提取及抗氧化研究[J].食品工业科技,2005,26(1):52-541.
[17]孟阿会.核桃油成分及抗氧化性质研究[D].北京林业大学,2012.
[18]周凤娟,苏朋,孔翠萍,等.核桃油体外清除自由基活性的研究[J].中国油脂,2007(7):32-33.
[19]张丽,宋丽军,曹静洁等.新疆薄皮核桃油氧化稳定性的研究[J].农业机械,2012(12):41-45.
[20]孙丽萍,王大仟,张智武.11种天然植物提取物对DPPH自由基的清除作用[J].食品科学,2009(1):45-47.
[21]赵红红,李波,李万林,等.微波辅助提取菜籽油中植物甾醇及其清除羟基自由基研究油脂加工[J].2014,22(5):20-24.●
PENG Xing-xing1, QIAO Qian-hua2, ZHANG Hong-yun1, GAO Hai-jun1, GAO Jing-ming1, DAI Guan-ping1, QIN Yi-fang1
(1.Henan Cereal, Oil and Feed Products Quality Supervision and Inspection Station, Zhengzhou Henan 450000; 2.Zhengzhou Office of Grid Operation Branch of State Grid Corporation of China, Zhengzhou Henan 450000)
Abstract:Taking walnut oil as the test material, its antioxidant activity in the storage process was studied. The results showed that unoxidized walnut oil showed good antioxidant ability. The inhibition rate of walnut oil on DPPH· radical increased with the increase of the concentration of walnut oil. The inhibition rate of walnut oil on DPPH· reached 50% when the concentration of walnut oil was 147.0 mg/mL; the inhibition rate of walnut oil on OH· reached 50% when the concentration of walnut oil was 340.83 mg/mL; the average inhibition rate of walnut oil and VC on O2![]() was almost in the same level when the concentration of walnut oil and VC was 1.0mg/mL. The inhibition rate of walnut oil on DPPH· and OH· decreased obviously after it was oxidized. The scavenging activity of walnut oil in the same concentration oxidized for different time on superoxide anion radical (O2
was almost in the same level when the concentration of walnut oil and VC was 1.0mg/mL. The inhibition rate of walnut oil on DPPH· and OH· decreased obviously after it was oxidized. The scavenging activity of walnut oil in the same concentration oxidized for different time on superoxide anion radical (O2![]() ) declined gradually with the increase of the time. The average inhibition rate of walnut on O2
) declined gradually with the increase of the time. The average inhibition rate of walnut on O2![]() dropped from 55.53% to 15.43% after 30 days being oxidized. In a word, the unoxidized walnut oil had good antioxidant ability. However, their antioxidant ability decreased as oxidation time increased.
dropped from 55.53% to 15.43% after 30 days being oxidized. In a word, the unoxidized walnut oil had good antioxidant ability. However, their antioxidant ability decreased as oxidation time increased.
Key words:walnut oil;storage ;antioxidant ability
收稿日期:2017-03-27
作者简介:彭星星,1989年出生,女,硕士研究生.
中图分类号:TS 227
文献标识码:A
文章编号:1007-7561(2017)05-0027-05