表1抗生素浓度梯度μg/mL

抗生素设计水平氯霉素(chloramphenicol)11.522.533.54庆大霉素(gentamicin)2468101214链霉素(streptomycin)10-510-410-310-210-10.51利福平(rifampicin)100200300400500600700
王海霞1,2,陈 园2,王 超2,黎 琪2,陈 新1,张晓琳2
(1.武汉轻工大学 生物与制药工程学院, 湖北 武汉 430023;2.国家粮食局科学研究院,北京 100037)
摘 要:通过2种途径向菌株ASAGF W2引入链霉素、庆大霉素、利福平和氯霉素抗性,研究抗生素抗性筛选技术对选育多杀菌素高产菌株的作用效果。途径一是将4种抗生素的抗性通过含有抗生素的平板逐级引入,标记为非GYM组;途径二是将分离得到的抗性突变菌进行纯培养后通过抗生素平板引入下一种抗性,标记为GYM组,利用摇瓶发酵进行多杀菌素高产菌株的选育。结果显示非GYM组的方法是进行抗生素抗性筛选的较适途径;通过对高产菌株连续转接5次,最终获得4株遗传稳定的高产突变菌,其中突变菌13-8-1来自非GYM组,具有Str0.5Gen10双重抗性,多杀菌素平均发酵产量较出发菌株ASAGF W2提高了23.87%。利用抗生素抗性筛选技术选育多杀菌素高产菌株,简单易行且效果显著。
关键词:刺糖多孢菌;多杀菌素;抗生素;抗性筛选
多杀菌素(spinosad),是由土壤放线菌刺糖多孢菌(saccharopolysporaspinosa)在有氧条件下发酵生成的胞内次级代谢产物,具有杀虫活性高、杀虫谱广、对非靶标动物安全等优点[1-2],是唯一由美国环保署(US Environmental Protection Agency)于1999、2008和2010年先后3次被授予“总统绿色化学品挑战奖”(The US-EPA Presidential Green Chemistry Challenge Award)的杀虫剂[3]。多杀菌素已在20多个国家的2百多种作物上完成登记注册,我国已经登记注册的多杀菌素产品有Success©(菜喜,多杀菌素含量为2.5%)和Tracer©(催杀,多杀菌素含量为48%)[4-5]。目前多杀菌素的生产被美国陶氏益农公司(Dow AgroSciences)独家垄断,国内适合多杀菌素生产的工业化菌种及发酵生产工艺尚未见报道。因此,快速有效地提高多杀菌素的产量以达到工业化生产意义重大。
经过近十年的研究,人们对多杀菌素的结构性质、理化性质、生物合成途径等都有了较深入的研究。由于刺糖多孢菌的遗传背景复杂,分子生物学改造困难,常规选育方法仍然是获得高产菌株的有效手段[6]。但传统诱变育种高产频率极低,产量提高幅度小,筛选过程中的实验误差会抵消变异株产量提高的幅度,另外筛选工作量大,周期长,如果筛选方法不合理、不科学,筛选工作成效将很小[7]。抗生素抗性筛选是基于微生物对抗生素产生耐药性发展起来的菌株选育改良技术,它具有易操作、无需特殊设备、不需要菌株遗传背景知识且效果显著等特点[8]。国内外研究者围绕着抗生素抗性筛选技术选育抗生素高产菌株进行了大量相关研究,如HU H F和OCHI K[9]向天蓝色链霉菌A3中引入链霉素、庆大霉素和利福平的3种抗性,获得的抗性突变株放线紫红素的产量是野生株的48倍;HU H F[10]等人向变铅青链霉菌66的rpoB基因中引入利福平抗性突变,结果变铅青链霉菌66放线紫红素(Act)、十一烷基灵红菌素(Red)和钙依赖性抗生素(CDA)的生物合成被大幅激活,这些抗生素在变铅青链霉菌66引入抗性突变前是不产生或者产生极少的。本研究采用抗生素抗性筛选技术选育多杀菌素高产菌,通过在不同浓度梯度的链霉素(streptomycin,Str)、庆大霉素(gentamicin,Gen)、利福平(rifampicin,Rif)和氯霉素(chlorampenicol,Chl)平板上对刺糖多孢菌进行逐级抗性筛选,比较多杀菌素的发酵产量,以确认组合抗性筛选技术在选育多杀菌素高产菌株上的可行性。
出发菌株S.spinosaASAGF W2由国家粮食局科学研究院发酵生物技术实验室筛选和保藏。
斜面和平板培养基:葡萄糖5.0 g/L,牛肉膏3.0 g/L,酪蛋白胨0.25 g/L,琼脂15.0 g/L,pH 7.2。
摇瓶种子培养基:葡萄糖15.0 g/L,可溶性淀粉10.0 g/L,豆饼粉3.0 g/L,棉籽蛋白3.0 g/L,大豆蛋白胨25.0 g/L,MgSO4·7H2O 2.0 g/L,pH 7.2。
摇瓶发酵培养基:葡萄糖60.0 g/L,棉籽蛋白20.0 g/L,NaCl 3.0 g/L,K2HPO4·3H2O 0.2 g/L,FeSO4·7H2O 0.05 g/L,CaCO31.0 g/L,pH 7.2。
上述培养基均在121 ℃灭菌25 min。
CH3CN和CH3OH(色谱纯):德国Merck公司;spinosad标准品(纯度为98%):美国Sigma公司;链霉素、庆大霉素、氯霉素和利福平:生工生物工程(上海)股份有限公司。
SEM-X瑞士科耐摇床:瑞士阿道夫科耐公司;HPS-400生化培养箱:哈尔滨市东联电子技术开发有限公司;Eppendorf AG 22331 Hamburg型离心机:德国Eppendorf公司;Waters 515/2487型高效液相色谱仪:美国Waters公司。
1.4.1 孢子悬液的制备
取一支培养成熟的刺糖多孢菌新鲜斜面,用无菌水洗下孢子,滤除菌丝体,调整孢子浓度为108个/mL,孢子萌发备用。
1.4.2 最小抑制浓度(MIC)的测定
将高产菌株的孢子悬液涂布于不同浓度的抗生素平板,置于29 ℃培养箱中培养8~10 d,抗生素平板设计如表1所示。以不含抗生素平板上的菌落生长情况为对照,显著抑制菌落生长的抗生素最低浓度为最小抑制浓度(MIC)。
表1抗生素浓度梯度μg/mL

1.4.3 抗生素抗性筛选浓度的确定
郭卫寰[11]等人在实验中发现在自发突变情况下抗生素浓度大于最小抑制浓度很难有单菌落生长,即使处于最小抑制浓度下也鲜有单菌落生长。且在本次研究中发现,利福平和氯霉素对刺糖多孢菌的菌落形态改变较大,当分别达到最小抑制浓度时,菌落小、形态不规则且孢子不丰富,因此,本研究以不含抗生素平板上的菌落形态和数量为对照,抗生素的筛选浓度设计为有显著抑制作用且菌落形态良好的剂量浓度,抗生素浓度梯度如表2所示。
表2抗生素抗性筛选浓度μg/mL
1.4.4 抗生素抗性筛选方法
采用2种途径向出发菌株ASAGF W2引入低浓度链霉素、庆大霉素、利福平和氯霉素4种抗生素的抗性,流程如图1所示。途径一是将4种抗生素的抗性通过含有抗生素的平板逐级引入,标记为非GYM组;由于纯培养和纯种是决定突变效果的关键[12],因而途径二是将分离的抗性突变株经纯培养之后通过抗生素平板引入下一种抗性,标记为GYM组,利用摇瓶发酵培养进行多杀菌素高产菌株的选育。

图1 抗生素抗性筛选流程图
取一定体积发酵液,加入2倍体积的甲醇,振荡30 s后静置30 min,5 600×g离心20 min,取上清液进行HPLC分析,分析条件为C18反相柱(ZORBAX EcllipeXDB-C18,4.6 mm×100 mm,3.5 μm),流动相为V(甲醇)∶V(乙腈)∶V(水)=45∶45∶10(含0.05%乙酸铵),进样量10 μL,流速1.0 mL/min,检测波长244 nm。多杀菌素的主要活性成分是A组分 spinosyn A(85%~90%)和 D组分 spinosynD(10%~15%)[13],根据多杀菌素A和D组分的积分面积,参照标准品计算其质量浓度,A和D组分之和即为多杀菌素发酵产量。
将初筛选出的高产突变菌进行摇瓶产量验证,连续转接5次,验证突变菌的遗传稳定性。
采用Origin 8.6和SPSS 19.0统计软件进行比较处理和显著性分析。在系统误差存在的条件下,初筛突变菌发酵产量是出发菌株110%以上的菌株统计为正突变菌;发酵产量是出发菌株产量90%以下的菌株统计为负突变菌。计算公式为:
正(负)突变率=正(负)突变菌株数/初筛总菌株数×100%
(1)
RVP=P/CP×100%
(2)
公式(2)中RVP为初筛发酵产量相对值,P为初筛抗性突变菌的发酵产量,CP为出发菌株ASAGF W2发酵产量。
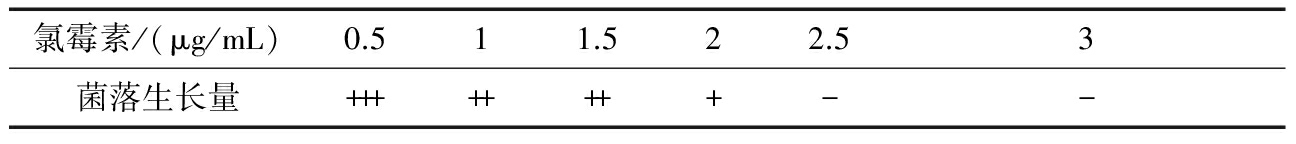
取一定量的ASAGF W2孢子悬液,涂布于不同浓度的抗性平板,获得链霉素、庆大霉素、利福平、氯霉素对ASAGF W2的最小抑制浓度分别为0.5、10、500、2.5 μg/mL,如表3~表6所示。
表3不同浓度链霉素对ASAGF W2菌落生长的抑制作用
注:“+”代表菌落数目的多少;“-”代表菌落数量非常稀少,约0~5个/平板。下同。
表4不同浓度的庆大霉素对ASAGF W2的抑制作用
表5不同浓度的利福平对ASAGF W2的抑制作用
表6不同浓度氯霉素对ASAGF W2菌落生长的抑制作用
本研究以4种抗生素最小抑制浓度为依据,每种抗生素设立2个筛选浓度,通过构建抗生素种类、浓度以及抗性引入顺序多样性的筛选组合进行实验设计,探索其对S.spinosa的多重抗性筛选效果。抗性突变菌的分离以抗生素平板上菌落的数目(10~20个)和菌落形态多样化为选择依据,实验中在非GYM组和GYM组各获得3条抗生素组合链,分别为A1、A2、A3和B1、B2、B3,共分离得到突变菌714株,结果如表7和图2所示。
表7抗生素筛选组合结果统计
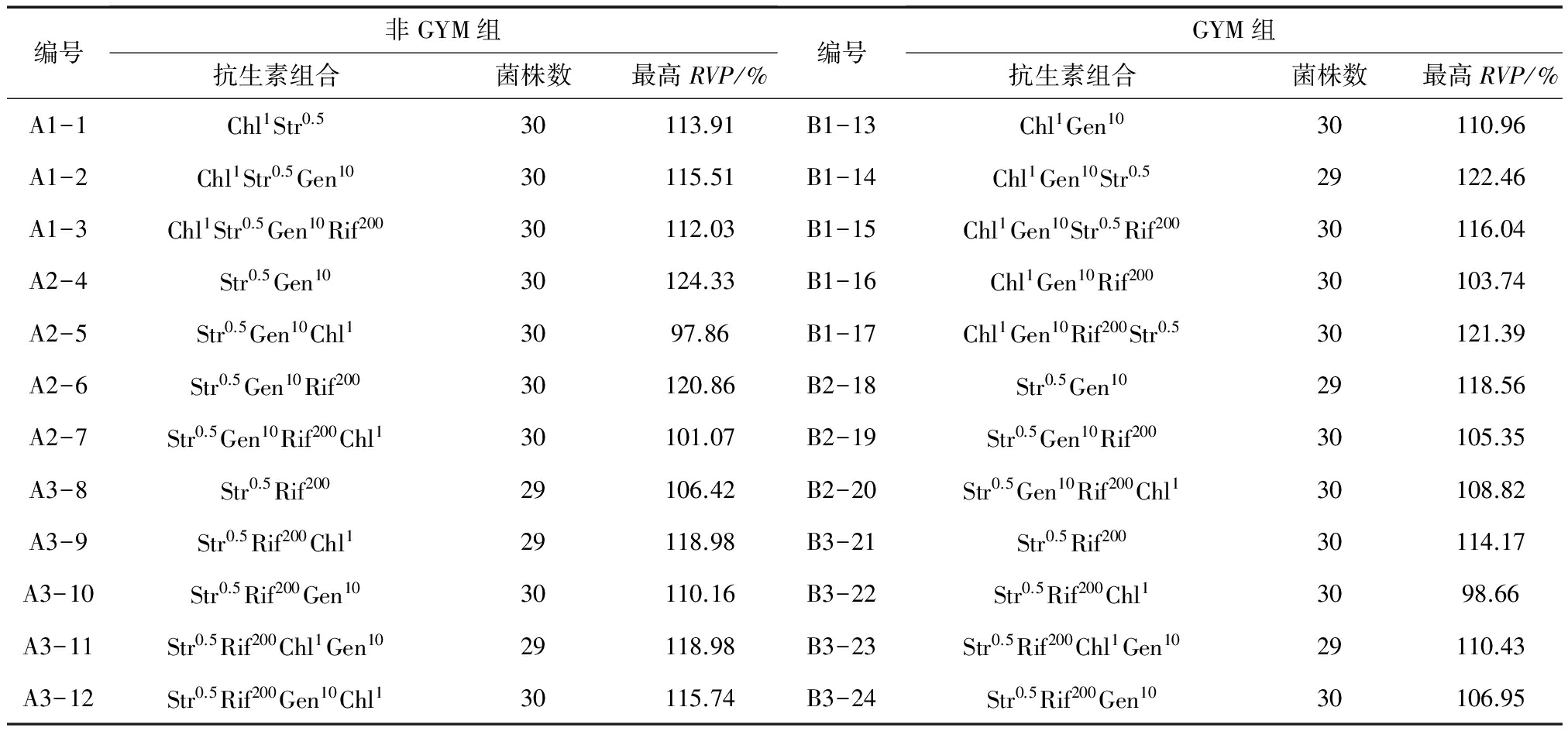
注:抗生素组合Aa中A表示抗生素种类,a表示抗生素的筛选浓度,单位为μg/mL,如Str0.5Gen10Rif200Chl1表示通过0.5 μg/mL链霉素平板、10 μg/mL庆大霉素平板、200 μg/mL利福平平板、1 μg/mL氯霉素平板逐级向出发菌株ASAGF W2引入对应的抗生素抗性。
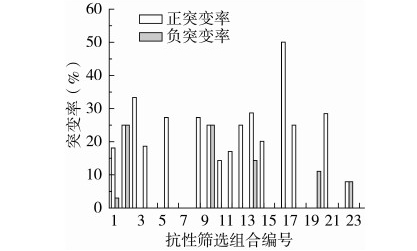
1~12为非GYM组筛选组合,13~24为GYM组筛选组合。
图2 不同抗生素组合的正负突变率
结果如图2所示,抗性筛选产生正突变率的抗生素组合共有16个,其中来源于编号17(Chl1Gen10Rif200Str0.5,GYM组)的4重抗性筛选正突变率最高,为50%;经过5轮复筛获得的1株遗传性状稳定的高产突变株来源于编号4(Str0.5Gen10,非GYM组),产量比出发菌株提高了23.87%;由表7和图2可看出编号为5、7、8、16、19、20、22和24的抗生素组合正突变率为0,编号20(Str0.5Gen10Rif200Chl1,GYM组)出现了11.11%的负突变率,且经过摇瓶发酵检测出的RVP最高值是108.82%,考虑实验误差因素,说明这8个抗生素组合对S.spinosa的产多杀菌素能力无明显的促进作用。
将GYM组和非GYM组中对应相同的抗生素组合进行统计,以每个组合分离出的突变菌的RVP值作为比较对象,以发酵的菌株数为样本量,应用SPSS 19.0统计学软件进行分析,结果如表8所示。只有Str0.5Gen10Rif200的最高RVP值差异显著(P<0.05),Str0.5Rif200Chl1Gen10的RVP值处于差异性不显著的临界(P=0.063>0.05),其余5个组合的RVP值差异性不显著(P>0.05)。
表8 GYM组和非GYM组抗性突变株发酵性能的比较
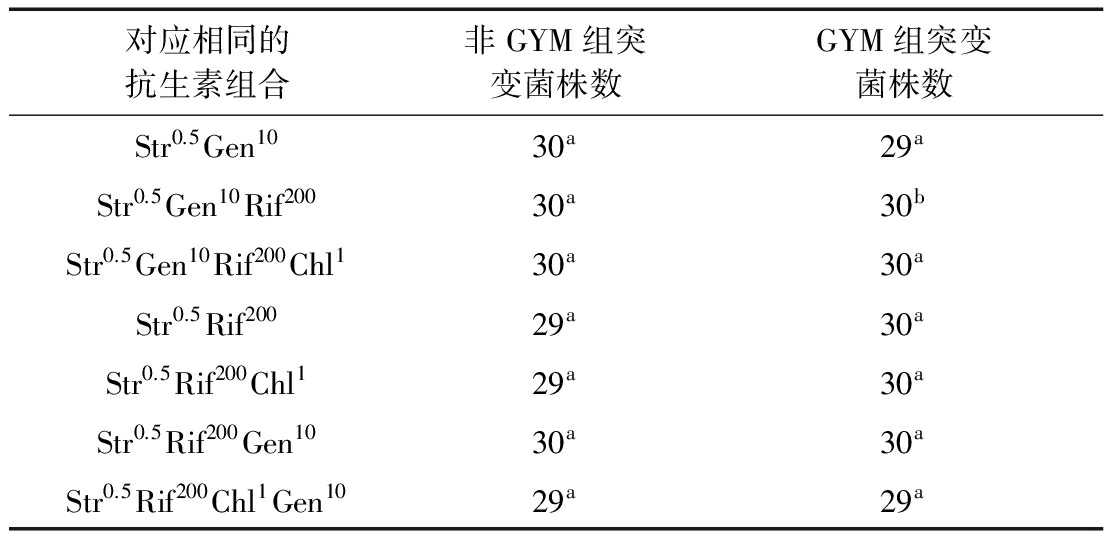
注:用比较均值中的独立样本T检验法进行两组数据比较。每行标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05)。
以抗生素组合对S.spinosa产多杀菌素的作用效果为依据,由表7和图2可知,有显著性差异的抗生素组合Str0.5Gen10Rif200在非GYM组和GYM组两种方法中的RVP最高值分别为120.86%和105.35%,正突变率分别为27.27%和0,可见非GYM组方法中的抗生素组合Str0.5Gen10Rif200对S.spinosa产多杀菌素的作用效果更显著。
从育种速率上进行比较发现,以抗生素组合Str0.5Gen10Rif200为例,GYM组和非GYM组2种方法完成3重抗性筛选,前者所需时间是后者的1.7倍。因此,非GYM组是较适的抗生素抗性筛选方法。
将出发菌株ASAGF W2进行抗生素抗性筛选,初筛共获得发生正突变的35株突变菌,结果如表9所示,由于突变体在传代中可能出现表型延迟现象,导致筛选到的高产菌株转接后发酵产量降低,因此,对初筛获得的35株高产突变菌连续转接5次进行遗传稳定性验证,结果如图3所示,获得4株多杀菌素发酵产量较出发菌株平均提高13%以上的突变菌,其中突变株13-8-1来源于非GYM组Str0.5Gen10的双重抗性筛选,多杀菌素平均发酵产量较出发菌株ASAGF W2提高了23.87%。连续转接5次,菌株13-8-1、I-8-1、I-8-3、F-24-1发酵产量提升值的标准偏差分别为1.22%、0.83%、1.44%、1.57%,组内个体间的离散程度总体在2%以内。结果表明,筛选获得4株遗传稳定的高产突变菌。
表9高产突变菌摇瓶初筛发酵产量


图3 摇瓶复筛验证遗传稳定性
为了进一步研究高产突变菌的特性,本实验将突变菌13-8-1和出发菌株ASAGF W2在同一发酵时间内生物量、葡萄糖消耗以及多杀菌素产量做比值,并以此为纵坐标进行曲线分析,结果如图4所示。
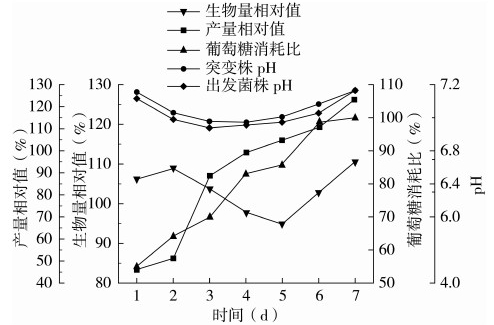
图4 突变菌13-8-1和出发菌株ASAGF W2发酵性能的比较曲线
根据图4分析发现,在发酵初期(第1~2 d)和发酵后期(第5~7 d),突变菌13-8-1生长速度优于出发菌株ASAGF W2,生物量增加至出发菌株的110%以上。
从2株菌的代谢曲线可知,生物量增长与多杀菌素的合成为半偶联型。具体表现在:从发酵中期开始(发酵第3 d),突变株13-8-1的多杀菌素发酵产量迅速增加并在发酵第4 d超越出发菌株ASAGF W2;在发酵后期,发酵产量相对值从104%上升至123%,突变株13-8-1表现出更加优越的产多杀菌素的能力。由以上推断突变株13-8-1的生长整体呈现出二次生长的现象,在发酵初期调整期较短,较快进入对数生长期,生物量迅速增加,进入稳定期后开始大量产生次级代谢产物多杀菌素。据此推测,在菌株二次生长过程中,提供充足的营养物质,增加菌体的生物量,并延长菌体生长稳定期,可能会进一步提高多杀菌素的产量。
此外,pH的变化和葡萄糖的消耗也反映出发酵液中菌丝体的生长和多杀菌素的生产周期。影响发酵液pH有2个因素:一是葡萄糖等营养物质快速被消耗,发酵液pH降低;二是氮源物质的利用及营养物质匮乏时菌体发生自溶会导致溶液中氨离子释放,发酵液pH升高。在整个发酵过程中,突变株13-8-1较出发菌株ASAGF W2耗糖速率慢,且前者的发酵液pH相较后者高。由此可推断突变菌 13-8-1对于碳源和氮源营养物质的利用较均衡,有利于菌体生物量的增加和多杀菌素的合成。
本研究考察了组合抗生素抗性筛选对S.spinosa产多杀菌素的作用效果,结果显示抗性筛选技术能够使菌株的遗传性状发生改变,抗生素筛选组合的正突变率与高产性状及其稳定性无明显的相关性。本研究对初筛获得的35株高产突变菌经过复筛验证,最终获取4株遗传稳定的高产突变菌。将抗生素抗性筛选应用于刺糖多孢菌的选育是一种简单易行且效果显著的方法。
参考文献:
[1]THOMPSON G D, MICHEL K H, YAO J S, et al. The discovery ofSaccharopolyspora spinosaand a new class of insect control products [J]. Down to earth, 1997, 52(1): 1-5.
[2]SALGADO V L. Studies on the mode of action of spinosad: insect symptoms and physiological correlates[J]. Pesticbiochemphys, 1998, 60(2): 91-102.
[3]CHIO E H. Spinosyn Insecticides: Part II. Triple winner of the US-EPA presidential green chemistry challenge award[J]. Formosan Entomol, 2011, 31(1): 15-23.
[4]陈园, 张晓琳, 黄颖, 等. 杀虫抗生素的研究进展[J]. 农业生物技术学报, 2014, 11(22): 1455-1462.
[5]柴洪新, 史大昕, 张奇, 等. 多杀菌素的研究进展[J]. 化工进展, 2011, 30(S2): 239-243.
[6]郭伟群, 邹球龙, 陈园, 等. 多杀菌素高产菌株的诱变选育及代谢曲线初步研究[J]. 中国抗生素杂志, 2014, 39(4): 245-248.
[7]施巧琴, 吴松刚. 工业微生物育种学[M]. 北京: 科学出版社, 2006.
[8]孙玉雯, 崔承彬. 抗生素抗性筛选在微生物菌株选育中的作用[J]. 国际药学研究杂志, 2008, 35(3): 213-217.
[9]HU H F, OCHI K. Novel approach for improving the productivity of antibiotic-producing strains by inducing combined resistant mutations[J]. Appl environ microb, 2001, 67(4): 1885-1892.
[10]HU H F, ZHANG Q, OCHI K. Activation of antibiotic biosynthesisby speci ed mutations in the rpoB gene (Encoding the RNA polymerase subunit) ofStreptomyces lividans[J]. J bacteriol, 2002, 184(14): 3984-3991.
ed mutations in the rpoB gene (Encoding the RNA polymerase subunit) ofStreptomyces lividans[J]. J bacteriol, 2002, 184(14): 3984-3991.
[11]郭卫寰, 李小兵, 元英进. 复合诱变和抗性筛选利迪链菌素高产菌株[J]. 微生物学通报, 2007, 34(5): 831-835.
[12]陈坚, 堵国成. 发酵工程原理与技术[M]. 北京: 化学工业出版社, 2012: 28-29.
[13]BOECK L D, CHIO H, EATON T E, et al. European Patent Aplication: EP, 375316[P]. 1990-06-27.●
WANG Hai-xia1,2, CHEN Yuan2, WANG Chao2, LI Qi2, CHEN Xin1, ZHANG Xiao-lin2
(1.School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan Hubei 430023;2. Academy of State Administration of Grain, Beijing 100037)
Abstract:The effect of antibiotic-resistance screening on breeding of spinosad high-producing strains was researched by leading streptomycin, gentamicin, rifampicin and chloramphenicol into strain ASAGF W2 with two approaches.The first one was inducing different resistance to antibiotics through antibiotic plates successively, which was marked as non-GYM group. The second one was inducing next kind of resistance to antibiotic by antibiotic plates after the mutants was isolated and purified through streak plate method, which was marked as GYM group. All mutants were bred by the shake flask culture. The results show that non-GYM group is more suitable method for antibiotic resistance screening. Four spinosad high-producing strains have been obtained through five rounds screening and mutant 13-8-1 was obtained from isolates of antibiotic combination Str0.5Gen10from non-GYM group and showed enhanced spinosad production by 23.87%, compared to original strain. The approach to screen spinosad high yield strains using multiple antibiotic-resistance screening is effective and easy in operation.
Key words:saccharopolyspora spinosa; spinosad; antibiotic; resistance screening
中图分类号:TS 201.3
文献标识码:A
文章编号:1007-7561(2017)04-0070-06
收稿日期:2016-02-05
基金项目:粮食公益性行业科研专项(201313002);农业科技成果转化资金项目(SQ2013EC4490009)
作者简介:王海霞,1988年出生,女,硕士.
通讯作者:张晓琳,1975年出生,女,博士.