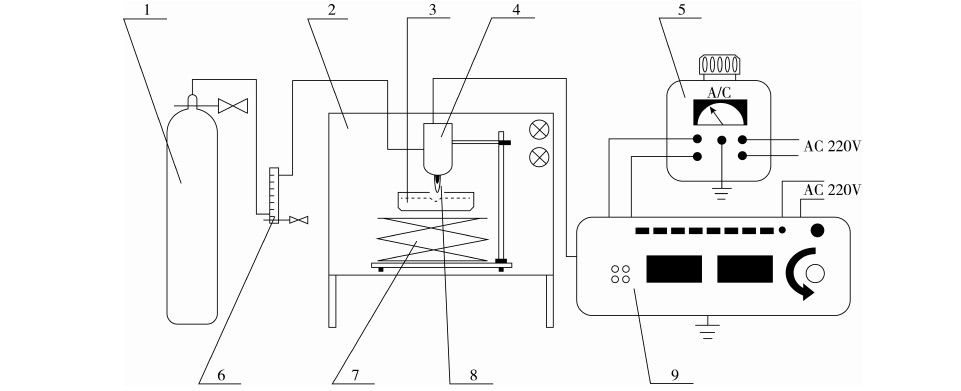
1-氩气瓶;2-超净工作台;3-样品;4-等离子体电极;5-TDGC2-2型接触调压器;6-LZB-10浮子流量计;7-高度调节器;8-等离子体火焰;9-高频电压交流电源
图1 常压等离子体装置图
任翠荣1,熊旭波2,王世清1,王振斌3,张 岩1,姜文利1
(1.青岛农业大学 食品科学与工程学院,山东 青岛 266109;2.青岛澳维康生物科技工程有限公司,山东 青岛 266109;3.江苏大学 食品与生物工程学院,江苏 镇江 212013)
摘 要:采用常压等离子体对乙腈中黄曲霉毒素B1(AFB1)进行降解。利用单因素实验,考察了放电间距、处理电压、放电时间以及AFB1初始浓度对AFB1降解率的影响,在此基础上进行了Box-Behnken的实验设计,选取AFB1降解率作为响应值,优化了AFB1的降解条件。结果表明:各因素对AFB1降解率的影响大小依次为处理电压>放电时间>AFB1初始浓度。常压等离子降解AFB1的最佳工艺条件为处理电压170 V、放电时间236 s、AFB1初始浓度5 mg/L、放电间距2 cm。AFB1的降解率高达92.45%,与预测值93.94%相接近,偏差为1.49%。
关键词:常压等离子体;黄曲霉毒素B1;降解率;响应面法
黄曲霉毒素(Aflatoxins,AFT)是由黄曲霉和寄生曲霉所产生的一种次生代谢物,具有急慢性毒性、致突变性、致癌性和致畸性[1]。常见的有黄曲霉毒素B1(Aflatoxin Bl,AFBl)、B2(AflatoxinB2, AFB2)、G1(Aflatoxin Gl,AFG2)、G2(Aflatoxin G2,AFG2)、Ml(Aflatoxin M1,AFM1)5种[2],其中AFB1毒性最强,其毒性是氰化钾的10倍,砒霜的68倍,被世界卫生组织(WHO)列为一级致癌物[3-5]。AFT是迄今为止发现最稳定的一类真菌毒素,耐受高温,一般的加热过程对AFT的结构没有影响。
国内外学者对AFT的脱除方法进行了大量研究,目前主要有化学法、生物法和物理法[6],但大部分方法存在着处理时间长、损害农产品营养品质、降解效率低、成本高、不易操作、实践应用受到限制等问题[7-9]。物理法是目前应用较多的一类AFT脱除方法,其中紫外线和γ-射线辐照是目前研究比较多的物理方法,它们具有操作容易、性能稳定、劳动强度小等优点,在AFT的脱除中受到了广泛关注[10]。
等离子体被称为物质的“第四态”,指部分或完全电离的气体,且自由电子和离子所带正、负电荷的总和完全抵消,宏观上呈现中性电[11-13]。本课题组自2007年以来,尝试采用减压等离子体处理AFB1,并取得了初步的成效。张岩等研究发现,200 W常压等离子体处理水中AFB1,时间为80 s时,其降解率达到51.67 %[14];120 W的减压等离子体处理乙腈中AFB1,时间为250 s时,其降解率达99.8%[15],且降解率均随等离子体处理功率的增大而增加。李玉鹏等利用低压等离子体技术也能有效降解农产品中的AFB1,但比纯水或纯乙腈中的AFB1的降解率低,当增大处理功率或延长处理时间时能增加AFB1降解率[16]。说明减压等离子体用于降解农产品中AFB1具有一定的可能性。
近些年出现的常压等离子体技术发展势头逐渐胜过了传统的减压等离子体技术,因为前者无需使用真空设备能够处理大面积物件,所以更适合在生产线上应用[18-19]。本实验利用常压等离子体处理AFB1,在单因素实验基础上进行了响应面优化设计,以期获得AFB1降解最优的工艺条件,为实际应用提供参考依据。
AFB1:美国Sigma公司;乙腈(色谱纯) : 德国默克公司。
常压等离子体:中国科学院等离子体物理研究所;针筒式滤膜过滤器:天津市津腾实验设备有限公司;一次性无菌注射器:侯马市康福莱医疗器械有限公司;HPLC液相色谱仪:德国默克公司;智能超声波清洗器:德国艾尔玛公司。
常压等离子体装置见图1。

1-氩气瓶;2-超净工作台;3-样品;4-等离子体电极;5-TDGC2-2型接触调压器;6-LZB-10浮子流量计;7-高度调节器;8-等离子体火焰;9-高频电压交流电源
图1 常压等离子体装置图
1.4.1色谱条件
Agilent液相系统。色谱柱:Waters Symmetry-C18,4.6 mm×250 mm;粒度5μm;柱温:30 ℃;流动相∶V(乙腈)∶V(水)=30∶70,流速:1 mL/ min,进样量:20 μL,荧光检测器:激发波长:365 nm,发射波长:440 nm。
1.4.2 标准曲线的绘制
准确吸取浓度分别0、5、10、15、20、30、40、50 mg/L的AFB1标准溶液各5 mL,采用HPLC分析,每个浓度重复3次,以AFB1的峰面积对AFB1标准溶液的浓度进行线性回归,标准曲线见图2。由标准曲线可知,线性方程为y=33.71x-20.634,R2=0.999 5。
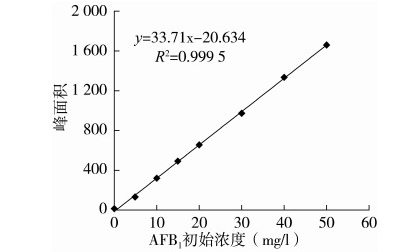
图2 AFB1标准曲线
1.5.1 单因素实验
1.5.1.1 常压等离子体放电距离的降解实验
用乙腈配制初始浓度为10 mg/L的AFB1溶液,置于等离子体上进行处理,放电距离设定为1、2、3、4、5 cm,电压设定为170 V,处理时间为100 s。
1.5.1.2 常压等离子体处理电压的降解实验
用乙腈配制初始浓度为10 mg/L的AFB1溶液,置于等离子体上进行处理,电压设定为150、155、160、165、170 V,放电间距设为2 cm,处理时间100 s。
1.5.1.3 常压等离子体处理时间的降解实验
用乙腈配制初始浓度为10 mg/L的AFB1溶液,置于等离子体上进行处理,处理时间设定为50、100、150、200、250 s,放电间距设为2 cm,电压设定为170 V,处理时间100 s。
1.5.1.4 AFB1初始浓度的脱毒实验
用乙腈配制初始浓度为10、20、30、40、50 mg/L的AFB1溶液,置于等离子体上进行处理,放电间距设为2 cm,电压设定为170 V,处理时间为100 s。
1.5.2 Box- Behnken实验设计
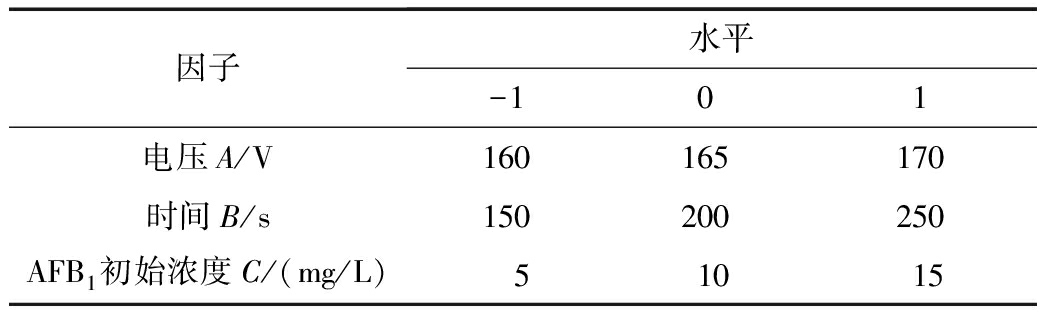
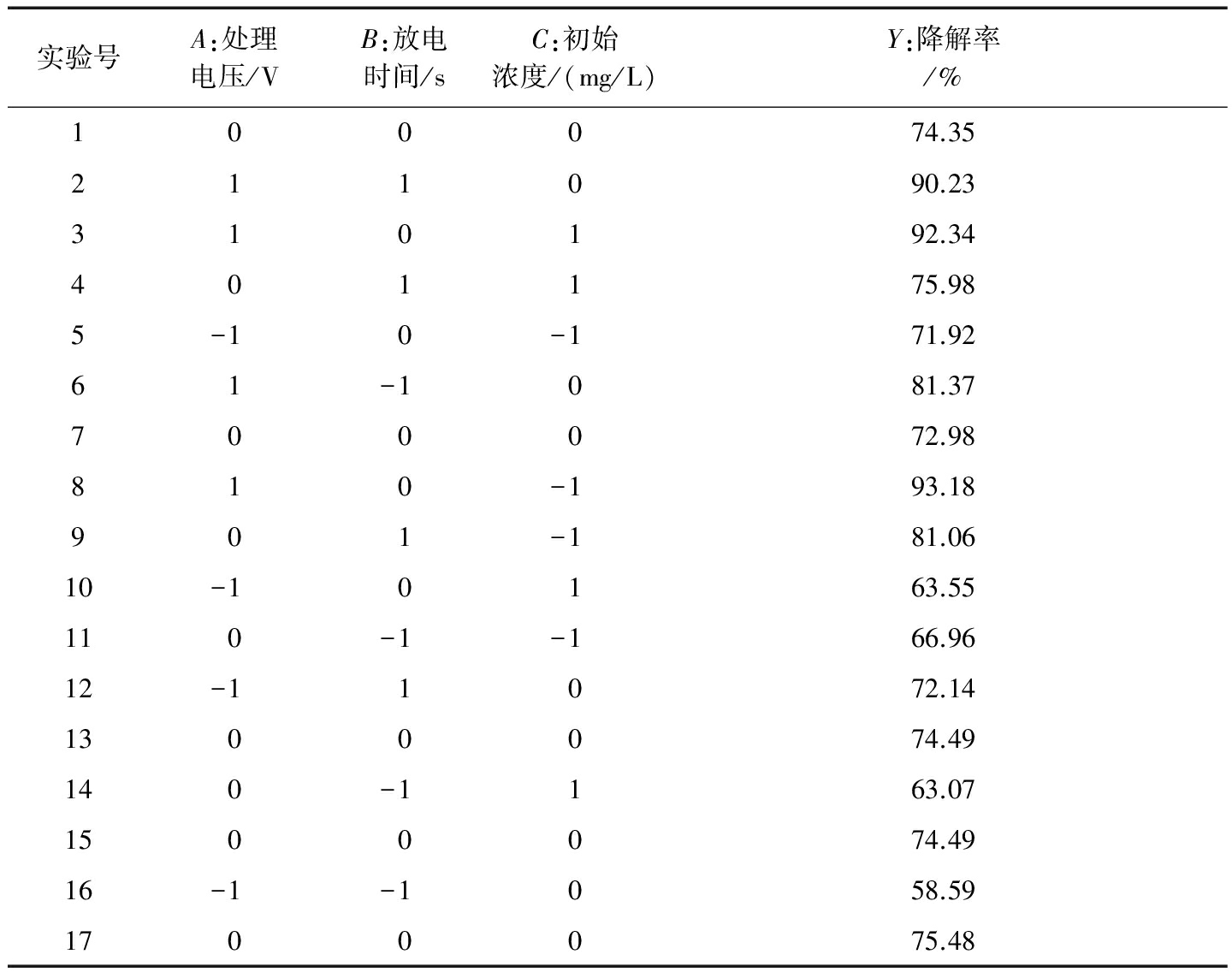
根据单因素实验结果,由于放电间距对常压等离子降解AFB1的降解效果已经非常明确,即放电间距越大,AFB1的降解率越小,放电间距不作为响应面法实验设计的主要因素。因此,选取处理电压、AFB1初始浓度、处理时间作为主要因子,以AFB1的降解率为响应值,采取3因素3水平的响应面分析法进行实验设计,以获得最优实验参数。实验设计的因子和水平见表1。
表1响应面法实验设计的因子和水平
降解率![]()
2.1.1 常压等离子体放电间距对AFB1降解率的影响
由图3可知,毒素在170 V的等离子体条件下,放电间距设为1 cm时,AFB1的降解率高达79.76%。放电间距设为5 cm时,AFB1的降解率达22.10%。可见,随着放电间距的增加,AFB1的降解率明显降低。这是由于常压等离子体的放电间距越大,带电粒子与AFB1之间的相互作用越小,毒素的降解率越低。
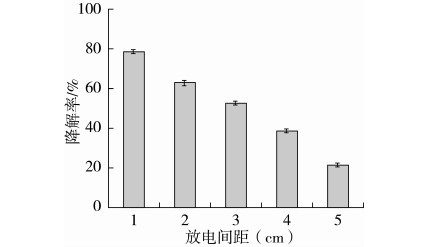
图3 常压等离子体放电间距对AFB1降解率的影响
2.1.2 常压等离子体处理电压对AFB1降解率的影响
由图4可知,在常压等离子体处理电压为150~170 V范围内,随着电压的升高,AFB1的降解率呈不断增大的趋势。原因是常压等离子体处理电压变大,带电粒子运动速度会加快,所以积累电子的速度就快,喷出的等离子体能量、密度均会升高,使得毒素的降解率增大[20]。综合考虑,选取处理电压160、165、170 V作为响应面实验设计的因素水平。
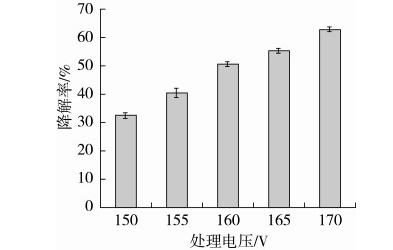
图4 常压等离子体处理电压对AFB1降解率的影响
2.1.3 常压等离子体放电时间对AFB1降解率的影响
由图5可知,毒素在170 V的等离子体条件下处理250 s时,AFB1的降解率达92.03%。可见,运用常压等离子体可有效降解AFB1。且在放电时间50~250 s范围内,随着时间的增加,AFB1的降解率不断增大,但增大幅度有所下降。综合考虑,选取放电时间150、200、250 s作为响应面实验设计的因素水平。
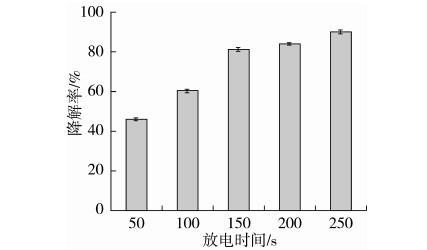
图5 常压等离子放电时间对AFB1降解率的影响
2.1.4 黄曲霉毒素初始浓度对AFB1降解率的影响
由图6可知,AFB1的降解率随着AFB1初始浓度的增大而减少。原因可能是当常压等离子体处理电压相同时,带电粒子的运动速度不变,喷出的等离子体能量一定,溶液的初始浓度越低,每个溶质分子接触到的等离子体能量越大,毒素的降解率越高。即AFB1初始浓度升高不仅使得AFB1的降解效果变差,而且增加成本。综合考虑,选取AFB1初始浓度5、10、15 mg/L作为响应面实验设计的因素水平。
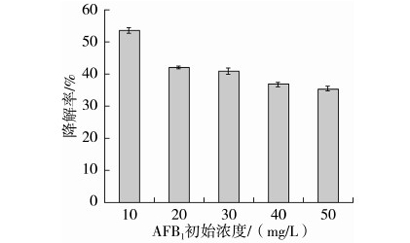
图6 AFB1初始浓度对AFB1降解率的影响
在单因素实验结果,以常压等离子体处理电压、放电时间、AFB1初始浓度为自变量,进行响应面分析实验,实验设计结果见表2 。
表2响应面实验设计及结果
由表3可知,回归模型极显著,失拟项不显著,R2=0.989 6>0.960 0,说明模型的拟合度较好。在所选的各因素水平范围内,对AFB1降解率影响的排序为:处理电压(A)>放电时间(B)>AFB1初始浓度(C)。
表3响应面方差分析结果
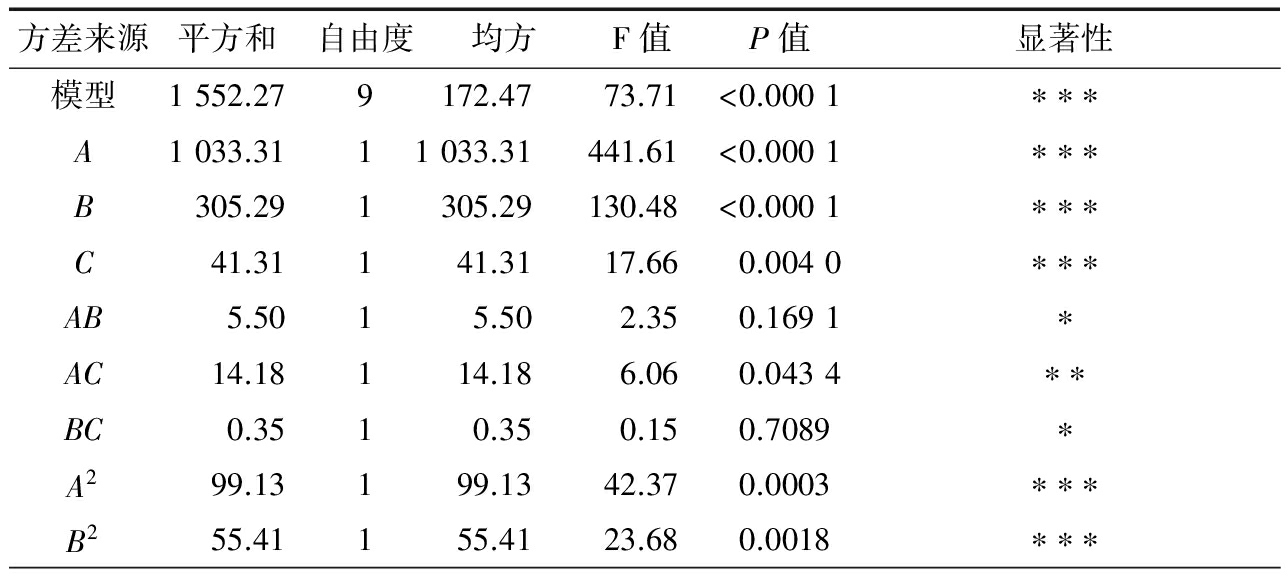
续表3
注:*为差异不显著(P>0.05);**为差异显著(P<0.05);***为差异极显著(P<0.01)。
应用Design-Expert 8.0.6进行回归分析拟合,可得各因素与AFB1降解率之间的回归方程:
Y=74.36+11.37A+6.18B-2.27C-1.17AB+1.88AC-0.30BC+4.85A2-3.63B2+1.04C2。
图7显示,在AFB1初始浓度为10 mg/L时,处理电压和放电时间对AFB1降解率的交互作用。可知,处理电压一定时,随着放电时间的增大,AFB1的降解率增大。当放电时间一定,处理电压增大时,AFB1的降解率呈上升趋势,而且响应面显示坡度较陡,表明放电时间和处理电压的交互作用显著。
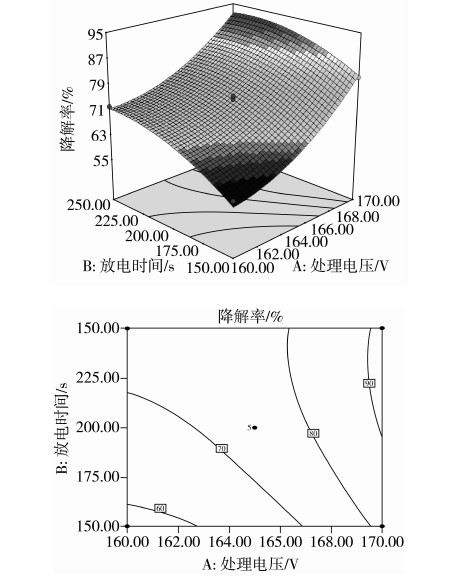
图7 处理电压与放电时间交互影响AFB1降解率的响应面图
图8显示,在放电时间为200 s时,处理电压和AFB1初始浓度对AFB1降解率的交互作用。处理电压一定时,随着AFB1初始浓度的增加,AFB1的降解率减少,但变化幅度不大。当AFB1初始浓度一定时,随着处理电压的增大,AFB1的降解率不断增大。因此,在AFB1初始浓度和处理电压两个因素相互影响下,处理电压对响应值的影响大。
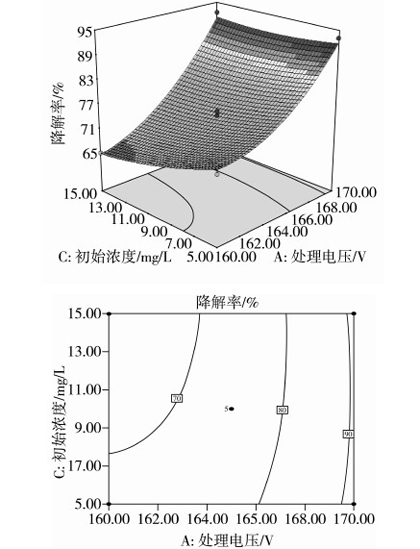
图8 处理电压与AFB1初始浓度交互影响AFB1降解率的响应面图
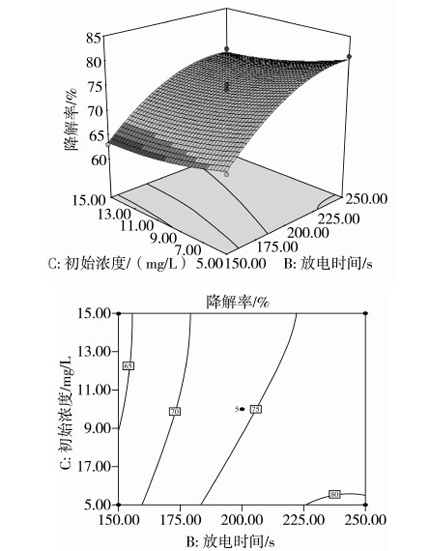
图9 放电时间与AFB1初始浓度交互影响AFB1降解率的响应面图
图9显示,在处理电压165 V时,放电时间和AFB1初始浓度对AFB1降解率的交互作用。当放电时间一定时,AFB1的降解率随着AFB1初始浓度的增大而减少。当AFB1初始浓度一定时,随着放电时间的增加,AFB1的降解率不断增大。
通过回归模型的预测,得到常压等离子体降解AFB1的最佳实验条件:处理电压170 V、放电时间236 s、AFB1初始浓度5 mg/L、放电间距2 cm,此时AFB1理论降解率的最大值为93.94%。在此最佳实验条件下进行实验操作,AFB1的降解效果达到92.45%,与模型预测值相接近,偏差为1.49%,得到AFB1降解前后的高效液相色谱图见图10。
图10显示,乙腈中AFB1经常压等离子体处理后有明显的降解效果。
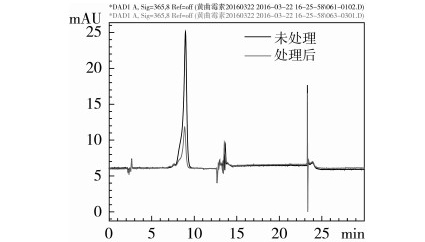
图10 常压等离子体降解前后乙腈中AFB1的高效液相色谱图
常压等离子体对乙腈中的AFB1具有很好的降解作用。AFB1的降解率与处理电压、放电时间呈正相关;与放电间距、AFB1初始浓度呈负相关关系。
常压等离子降解乙腈中的AFB1的最佳工艺条件为处理电压170 V、放电时间236 s、AFB1初始浓度5 mg/L、放电间距2 cm。AFB1的降解率高达92.45%,与模型预测值93.94%相接近,偏差为1.49%。说明该模型可用于常压等离子体对乙腈中黄曲霉毒素B1降解效果的预测。
参考文献:
[1]李建辉.花生中黄曲霉毒素的影响因子及脱毒技术研究[D].北京:中国农业科学院,2009.
[2]杨惠芬,李明元,沈文.食品卫生理化检验标准手册[M].北京:中国标准出版社,1997:274.
[3]丁小霞,李培武,白艺珍,等.中国花生黄曲霉毒素风险评估中膳食暴露非参数概率评估方法[J].中国油料作物学,2011,33(4):402-408.
[4]李培武,张道宏,杨扬,等.粮油制品中黄曲霉毒素脱毒研究进展[J].中国油料作物学报,2010,32(2) :315-319.
[5]Liu R, Chang M, Jin Q, et al. Degradation of aflatoxin B1in aqueous medium through UV irradiation[J].European Food Research and Technology,2011,233 (6) :1007-1012.
[6]王辰龙.花生油中黄曲霉毒素B1的降解及其安全性评价[D].合肥:安徽农业大学,2014.
[7]Alencar E R D, Faroni L R D, Soare s N F F, et al. Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J].Journal of the Science of Food and Agriulture,2012,92(4):899-905.
[8]Piva G, Galvano F, Pietri A, et al. Detoxification methods of aflatoxins [J].Nutrition Research,1995,15 (5):767-776.
[9]肖军霞,张岩,黄国清,等.黄曲霉毒素脱除方法研究进展[J]. 食品安全质量检测学报,2012,5(3):395 - 399.
[10]李国林,陈曦,陈梦玉,等.不同类型辐照处理对黄曲霉毒素脱除效果分析[J].核农学报,2015,29(11):2165-2171.
[11]张谷玲,敖玲,胡建芳,等.应用等离子体物理学[M].北京:首都师范大学出版社,2008:1-7.
[12]刘万东,等离子体物理导论[M].中国科技大学,2002:1-10.
[13]Chen F F, 等离子体物理学导论[M].北京:人民教育出版社,1980:1-11.
[14]张岩,董晓娜,姜文利,等.等离子体降解黄曲霉毒素B1的实验研究[J].中国粮油学报,2013,28(9): 114-118.
[15]张岩,王安妮,肖军霞,等.低温射频等离子体降解乙腈中黄曲霉毒素B1的效果与途径分析[J].中国粮油学报,2015,30(2): 80-85.
[16]李玉鹏,王世清,肖军霞,等.低温射频等离子体降解农产品中黄曲霉毒素效果的研究[J].粮油食品科技,2014,22(5):54-57.
[17]Wang S Q, Huang G Q, Li Y P, et al. Degradation of aflatoxin B1by low temperature radio frequency plasma and degradation product elucidation[J]. European Food Research and Technology, 2015, 241(1): 103-113.
[18]Yasuda H. Plasma for modification of polymers[J]. J. Macromol. Sci, A, 1976, 10, 383-420.
[19]Chen, J R. Study on free radicals of cotton and wool fibers treated with low-temperature plasma[J]. J. Appl. Polym . Sci, 1991, 42:2035-2037.
[20]刘文正,严伟,等.大气压射流等离子体放电特性及灭菌效果[J].强激光与离子束,2010,22(12):2984-2988.●
REN Cui-rong1, XIONG Xu-bo2, WANG Shi-qing1, WANG Zhen-bin3, ZHANG Yan1,JANG Wen-li1
(1.College of Food Science and Engineering, Qingdao Agricultural University, Qingdao Shandong 266109;2.Qingdao Aoweikang Biotechnology Engineering Co.Ltd., Qingdao Shandong 266109;3.College of Food and Biological Engineering, Jiangsu University, Zhenjiang Jiangsu 212013)
Abstract:Atmospheric pressure plasma was used to degrade the aflatoxin B1in acetonitrile. The influence of four independent variables, discharge distance, treatment voltage, discharge time and initial concentration of AFB1, on degradation rate of AFB1were investigated by single factor test. Based on this, Box-Behnken experiment was designed with degradation rate of AFB1as response value, the degradation conditions of AFB1was optimized. The experimental results showed that the factors influencing the degradation rate of AFB1in acetonitrile were in order as follows: treatment voltage>discharge time>initial concentration of AFB1.The optimum process parameters of degradation of AFB1by atmospheric plasma were obtained as: treatment voltage of 170 V, discharge time of 236 s, initial concentration of AFB1of 5 mg/L, discharge distance of 2 cm. Under the conditions, the degradation rate of AFB1can reach to 92.45%, which is close to predictive value of 93.94% with deviation of 1.49%.
Key words:atmospheric pressure plasma; aflatoxin B1; degradation rate; response surface methodology
中图分类号:TS 207.3
文献标识码:A
文章编号:1007-7561(2017)04-0064-06
收稿日期:2016-09-11
基金项目:国家自然科学基金资助项目(31271963)
作者简介:任翠荣,1992年出生,女,硕士研究生.
通讯作者:王世清,1961年出生,男,博士,教授.