单长松1,刘 锦2,赵子彤1,贾朝爽1,杨 艺1,刘 娟1,吴 澎1
(1.山东农业大学 食品科学与工程学院,山东 泰安 271018;2.苏州大学 生物医学研究院,江苏 苏州 215123)
摘 要:以红薯茎叶为原料,采用超声波辅助乙醇浸提法提取红薯茎叶中的绿原酸。在单因素实验基础上,以提取时间、提取温度、料液比和乙醇浓度为考察因素,以绿原酸得率为响应值,采用4因素3水平响应面设计组合实验,建立相应的二项式数学模型优化提取工艺。实验结果表明,红薯茎叶中绿原酸提取的最佳工艺条件为提取时间25 min、提取温度64.5 ℃、料液比1∶35(g/mL)、乙醇浓度45%,红薯茎叶中绿原酸的实际得率为3.442 1 mg/g,接近预测值。响应面法可用于红薯茎叶中绿原酸提取工艺的优化。
关键词:红薯茎叶;绿原酸;提取;响应面法
红薯又名白薯、甘薯、地瓜、番薯、山芋等,为旋花科一年生或多年生植物[1],历史悠久,在中国大部分地区都有种植,种植面积大、产量高,资源丰富,是中国4大粮食作物之一[2]。红薯茎叶富含糖、蛋白质、氨基酸、VC等营养成分,以及黄酮、绿原酸等生物活性成分[3-4],但其作为红薯产业的副产品一直未得到充分利用。随着科学技术的发展,红薯茎叶丰富的营养价值和良好的保健作用越来越受到人们重视,其营养与保健作用非常明显[5-7]。研究表明,绿原酸是植物经有氧呼吸过程中的莽草酸途径所形成的一种苯丙素类化合物,广泛存在于植物的茎、叶、花等部位,具有抗菌消炎、清除自由基、抗脂质过氧化、增加白血球及兴奋中枢神经系统等功能[8-10],是许多中草药及中成药的主要成分。近年来,国内外学者对红薯茎叶中的绿原酸、黄酮类等物质的研究,主要集中在黄酮类物质的抗氧化及绿原酸的抗菌消炎功效等方面[11-13],对提取工艺的研究也有报道,主要使用乙醇回流浸提法和超声波辅助水提法[14-17],均取得了一定的效果。提取工艺中使用超声波,可以利用其空化作用使原料局部高温或高压,加快浸提中固—液2相间的传质速率,达到提高提取率的目的,近年来被广泛应用于植物中天然产物的提取工艺[18-21]。本研究以红薯茎叶为原料,以乙醇为浸提液,使用响应面法对红薯茎叶中绿原酸提取工艺进行优化,为红薯茎叶绿原酸提取的工业化生产提供一定的理论依据。
红薯茎叶:采自山东泰安,洗净晾干,60 ℃烘干24 h,取烘干后的样品粉碎过80目筛。绿原酸标准品(纯度>98%):Sigma-Aldrich公司。无水乙醇(分析纯):上海国药集团化学试剂有限公司。
JA2003A电子天平:上海精密仪器有限公司;UV8000紫外分光光度计:上海元析仪器有限公司;BRANSON-B2510E超声波清洗机:美国艾默生电气集团必能信公司;HERMLE-Z206-A离心机:德国哈默公司;FZ102微型植物粉碎机:天津市泰斯特仪器有限公司。
1.2.1 绿原酸标准曲线的绘制
精确称取绿原酸标准品2.5 mg,用无水乙醇溶解,并定容于25 mL容量瓶中,得绿原酸标准溶液(0.1 mg/mL)。用移液枪准确吸取上述标准液0、1、2、3、4、5 mL分别于6只25 mL容量瓶内,用无水乙醇定容。在322 nm处测定其吸光度值,每组实验平行测定3次,取平均值。以绿原酸标准溶液浓度C(μg/mL)为横坐标,吸光度值A为纵坐标,绘制标准曲线并拟合回归方程。
1.2.2 样品绿原酸含量的测定
绿原酸经提取后,置于离心管中,以3 000 r/min离心10 min,将上清液定容至100 mL容量瓶中。准确量取1 mL溶液定容于25 mL容量瓶中,于322 nm处测定样品吸光度值,根据标准曲线计算绿原酸的浓度,然后根据公式(1)计算绿原酸得率,每组平行测定3次,取平均值。
(1)
式(1)中:α为绿原酸得率,mg/g;C为样品中绿原酸浓度,μg/mL;n为稀释倍数;V为提取液体积,mL;W为红薯茎叶干粉质量,g。
1.2.3 单因素实验设计
在张冕等[15]的研究基础上,以50%乙醇溶液为溶剂,料液比为1∶35,超声功率500 W,提取温度50 ℃,分别将提取时间设为10、15、20、25、30 min,考察提取时间对绿原酸提取率的影响。
提取时间25 min,料液比1∶35,超声功率500 W,提取温度分别为35、45、55、65、75 ℃,考察提取温度对绿原酸提取率的影响。
提取时间25 min,超声功率500 W,提取温度65 ℃,设置料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40,考察料液比对绿原酸提取率的影响。
提取时间设为25 min,料液比1:35,提取温度65 ℃,设置乙醇浓度分别为35%、45%、55%、65%、75%,考察乙醇浓度对绿原酸提取率的影响。
每组实验重复3次,取平均值。
绿原酸标准曲线如图1所示,其拟合的直线方程为:y=0.027 44x+0.003 48,相关系数为R2=0.999 2,表明绿原酸在0~20 μg/mL范围内与吸光值呈现良好的线性关系。

图1 绿原酸标准曲线
2.2.1 提取时间对绿原酸得率的影响
准确称取红薯茎叶粉末(80目)1.000 g,加入50%乙醇35 mL,使料液比为1∶35 g/mL,在微波功率500 W、提取温度50 ℃条件下,研究提取时间分别为10、15、20、25、30 min对红薯茎叶绿原酸得率的影响,每组实验重复测定3次。结果如图2所示,微波提取时间从10 min延长到25 min的过程中,绿原酸得率逐渐增大,这可能是由于随着时间的延长,在微波辅助条件下,绿原酸逐渐从红薯茎叶中扩散至浸提液中,绿原酸得率逐渐增大;当提取时间为25 min时,绿原酸的得率达到最大值;此后随着提取时间的继续延长,得率呈下降趋势。提取时间的延长可以促进红薯茎叶中绿原酸更好地溶出,使溶出更加完全,但是过长的提取时间可能会使溶出的绿原酸被氧化或被分解从而导致得率下降。因此,选择浸提时间为25 min。
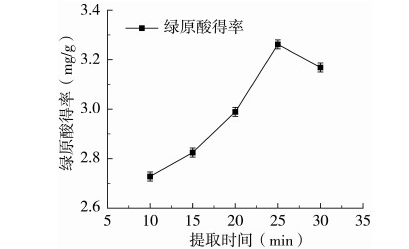
图2 提取时间对绿原酸得率的影响
2.2.2 提取温度对绿原酸得率的影响
准确称取红薯茎叶粉末(80目)1.000 g,加入50%乙醇35 mL,使料液比为1∶35 g/mL,在微波功率为500 W、提取时间为25 min的条件下,研究提取温度(35、45、55、65、75 ℃)对红薯茎叶绿原酸得率的影响,每组实验重复测定3次。结果如图3所示,由图3可知,在一定温度范围内,绿原酸的得率随提取温度的升高而提高。这与绿原酸的溶解性有关,低温条件不利于绿原酸的溶出,随着温度的升高绿原酸溶解性逐渐增强,浸提液中的分子运动速率也逐渐加快,红薯茎叶与乙醇的传质作用得到加强[24],绿原酸的得率逐渐升高。当温度为65 ℃时,绿原酸得率达到最大,之后,绿原酸得率随温度的升高呈现降低趋势。绿原酸本身不稳定,提取时高温条件会加速绿原酸的分解,并使其有效成分被破坏,绿原酸失活,从而使绿原酸的得率降低[18]。因此,本研究选择的提取温度为65 ℃。
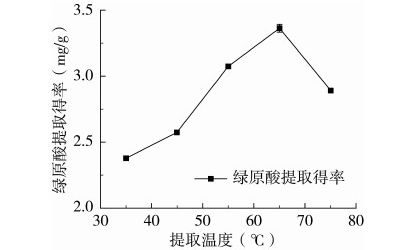
图3 提取温度对绿原酸得率的影响
2.2.3 料液比对绿原酸得率的影响
准确称取红薯茎叶粉末(80目)1.000 g,微波功率500 W,在提取时间为25 min、提取温度为65 ℃的条件下,通过向各组样品中加入不同体积的50%乙醇控制料液比,研究料液比(1∶20、1∶25、1∶30、1∶35、1∶40 g/mL)对红薯茎叶绿原酸得率的影响。结果如图4所示,当料液比为1:35 g/mL时,绿原酸的得率达到峰值,之后再继续增大乙醇溶液体积时,绿原酸得率下降,说明在一定范围内增大乙醇溶液的用量有利于绿原酸的萃取,当料液比达到一定值时,红薯茎叶中的绿原酸的溶出量达到最大值,此后随着乙醇溶液用量的增大,得率反而下降。这是由于乙醇溶液用量增大导致底物浓度减小,使分子间碰撞机会减少,从而使得率有所下降,此外,过大的溶剂用量也会造成资源浪费,增加后续处理的困难。因此,选择料液比为1∶35 g/mL。

图4 料液比对绿原酸得率的影响
2.2.4 乙醇浓度对绿原酸得率的影响
准确称取红薯茎叶粉末(80目)1.000 g,在微波功率500 W、提取温度65 ℃条件下提取25 min,向各组样品中加入相同体积不同体积分数的乙醇,使料液比为1∶35 g/mL,研究乙醇体积分数(35%、45%、55%、65%、75%)对红薯茎叶绿原酸得率的影响,每组实验重复测定3次,结果如图6所示。由图5可以看出,绿原酸得率随乙醇体积分数的增大呈先增大后减小的趋势,这是由不同浓度的乙醇溶液解吸红薯茎叶细胞内有效物质能力不同造成的[27];当乙醇体积分数为45%时,红薯茎叶中绿原酸的得率最高,提取效果最佳。当乙醇的浓度相对较高时,会使红薯茎叶细胞中其它醇溶性物质溶出的比例增多,造成有效成分所占比例减少,因此,当乙醇的体积分数大于45%时,随着乙醇体积分数的增加绿原酸的得率逐渐下降。因此,选择乙醇体积分数为45%用于提取绿原酸。
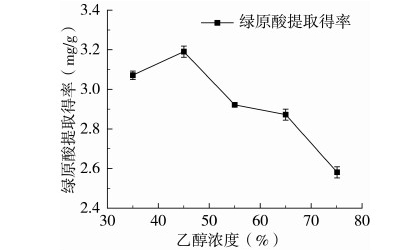
图5 乙醇浓度对绿原酸得率的影响
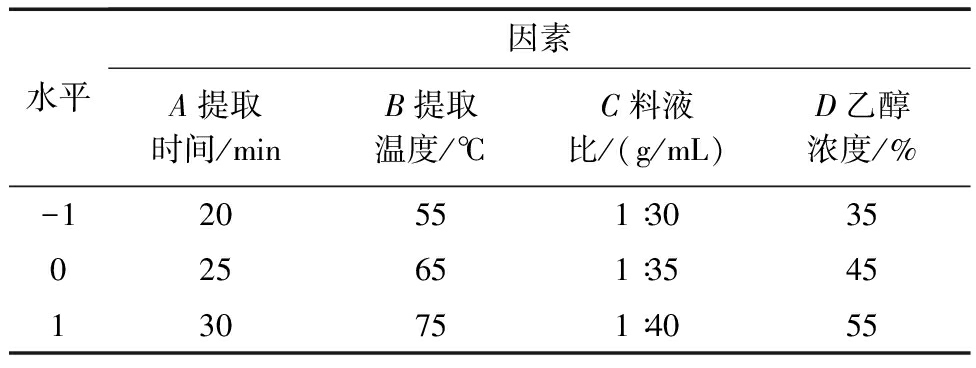
在单因素实验基础上,选取影响绿原酸得率的4个主要因素,即提取时间、提取温度、料液比和乙醇浓度,采用Box-Behnken实验设计进行响应面分析。每个因素取3个水平,分别以1、0、-1编码,使用Design-Expert 8进行数据分析,建立数学模型,进而确定红薯茎叶绿原酸提取的最佳工艺参数。实验自变量因素编码及水平设计见表1。
表1响应面分析因素与水平
响应面实验设计和结果如表2所示。
表2响应面分析实验设计及实验结果
续表2

应用Design Expert软件对实验数据进行多元回归拟合分析,得到红薯茎叶中绿原酸的得率与各因素的二次方程模型:
绿原酸得率:
R1=3.46+9.392×10-3A-2.1×10-3B-2.2×10-2C-4.167×10-4D+1.2×10-2AB+3.5×10-2-4.3×10-2AD-1.2×10-2BC-1.1×10-2BD-2.175×10-3CD-1.1×10-1A2-1.8×10-1B2-1.4×10-1C2-1.4×10-1D2
对表2中的实验结果进行统计分析,方差分析结果见表3。
表3响应面方差分析结果

注:*表示显著(P<0.05)。
由表3可知,用上述回归方程描述各因素与响应值的主次顺序为C>B>A>D,其因变量与全体自变量之间的线性关系显著(R2=0.855 2),当P<0.05时表示该指标显著,回归方差分析结果表明,整体模型的P=0.001 2<0.05,说明该二次方程模型达到显著水平;失拟项P=0.778 0>0.05,不显著,说明该方程拟合较好,回归方程能够较好地描述各因素与响应值之间的真实关系,该模型可用于红薯茎叶中绿原酸提取的最佳工艺条件的确定。
响应值和各实验因子构成的立体曲面图如图6所示,显示了提取时间、提取温度、料液比和乙醇浓度中任意2个变量取0水平时,其余2个变量对红薯茎叶中绿原酸提取率的影响。等高线图中同一椭圆区域内,绿原酸提取率是相同的,椭圆中心点为绿原酸提取率最高的点;由中心点向外缘延伸,绿原酸提取率逐渐减少。等高线的形状可以反映实验因子交互影响响应值的强弱,形状越接近圆形则交互作用越不显著。
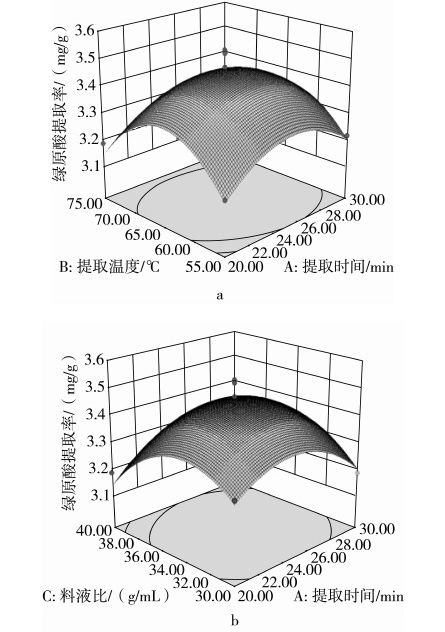

图6 各因素交互作用对绿原酸提取率影响的响应曲面
图6a、图6b、图6c和图6e中等高线的形状较图6d和图6f中的等高线的形状更趋于椭圆,因此提取时间与提取温度、提取时间与料液比、提取时间与乙醇浓度、提取温度与乙醇浓度的交互作用对红薯茎叶中绿原酸提取率的影响比提取温度与料液比、料液比与乙醇浓度2因素的交互作用更显著。
用Design Expert软件进行理论最佳工艺条件优化,结果为:提取时间为25.17 min,提取温度为64.43 ℃,料液比为1∶34.6,乙醇浓度为44.97%,在此最佳工艺条件下红薯茎叶中绿原酸的理论得率为3.460 6 mg/g。为验证该方法的可靠性,采用最优提取条件对红薯茎叶中绿原酸进行3次平行提取实验,为了便于操作,将最佳提取工艺条件修正为提取时间为25 min、提取温度为64.5 ℃、料液比为1∶35 g/mL、乙醇浓度为45%,在此条件下绿原酸的实际得率为3.442 1 mg/g,与预测值基本一致。表明该模型可以较好地预测红薯茎叶中绿原酸的提取率。
采用Design-Expert软件的Box-Behnken方法设计响应面实验,建立红薯茎叶中绿原酸提取工艺的二次多项数学模型。方差分析结果表明:红薯茎叶中绿原酸的提取率与提取时间、提取温度、料液比和乙醇浓度均有一定关系。结合响应面交互作用分析结果和验证实验结果,确定其最佳工艺参数:提取时间25 min,提取温度64.5 ℃,料液比1∶35g/mL,乙醇浓度45%,在此条件下得率达3.442 1 mg/g,与预测值基本相符。根据响应面分析法得到的红薯茎叶中绿原酸的提取工艺参数是真实可靠的。
参考文献:
[1]顾英,韩凤丽,王洪洋. 响应面法优化红薯叶类黄酮提取工艺的研究[J]. 食品工业科技,2012,3:286-289,333.
[2]FAO. Food and agricultural commodities production[S/OL].2013: [2016-11-20]. http://faostat.fao.org/site/339/default.aspx.
[3]Ishida H, Suzuno H, Sugiyama N, et al. Nutritive evaluation on chemical components of leaves, stalks and stems of sweet potatoes (Ipomoea batatas poir) [J]. Food Chemistry,2000,68(3):359-367.
[4]兰丹,文略,王小萍,等. 红薯叶中总黄酮提取工艺的研究[J].微量元素与健康研究,2007,1:47-48.
[5] Gharras H E I. Polyphenols: food sources, properties and applications-a review [J]. International Journal of Food Science & Technology. 2009,44:2512-2518.
[6]周增学.红薯的营养价值与保健功能[J].食品与药品,2006,8:75-76.
[7]伍军.红薯营养保健价值及综合利用[J].粮食与油脂,2004,1:18-19.
[8]Magdalena J, Ewa S, Maria P D P. Relationship between antioxidant capacity, chlorogenic acids and elemental composition of green coffee [J]. LWT - Food Science and Technology.2016,73:243-250.
[9]Zheng Z Y, Sheng Y C, Lu B, et al. The therapeutic detoxification of chlorogenic acid against acetaminophen-induced liver injury by ameliorating hepatic inflammation [J]. Chemico-Biological Interactions,2015,238:93-101.
[10]Wang Y, Li Z, Li J, et al. Effects of dietary chlorogenic acid on growth performance, antioxidant capacity of white shrimp Litopenaeus vannamei under normal condition and combined stress of low-salinity and nitrite[J]. Fish & Shellfish Immunology,2015,43(2):337-345.
[11]盛卸晃,刘文谦,盛卸晃,等.绿原酸体外抗单纯疱疹病毒作用[J].中国天然药物,2008,6(3):232-234.
[12]戚晓渊,史秀灵,高银辉,等.绿原酸抗肝纤维化作用的研究[J].中国实验方剂学杂志,2011,17(15):139-143.
[13]刘英,王之盛,周安国,等.橙皮苷和绿原酸的体内外抗氧化效应研究[J].食品科学,2009,30(23):196-198.
[14]魏锐,田慧玲,周建军,等.响应面分析法优化杜仲叶中绿原酸水提工艺[J].安徽农业科学,2011,39(7):3965-3967.
[15]张冕,胡晓莲,姚芳芳,等.Box-Behnken实验设计法优化红薯叶中绿原酸的提取工艺[J].德州学院学报,2013,29(4):56-60.
[16]乌兰,张泽生.金银花中绿原酸的提取及检测[J].食品科学,2005,26(6):130-134.
[17]肖怀秋,李玉珍.超声波辅助乙醇法萃取金银花中绿原酸[J].江苏调味副食品,2010,5:34-37.
[18]Saleh I A, Vinatoru M, Mason T J, et al. A possible general mechanism for ultrasound-assisted extraction (UAE) suggested from the results of UAE of chlorogenic acid from Cynara scolymus L. (artichoke) leaves [J]. Ultrasonics Sonochemistry,2016,31:330-336.
[19]向昌国.甘薯茎叶中绿原酸提取方法的研究及含量测定[J].食品科学,2007,28(1):126-130.
[20]Zhang B, Yang R Y, Liu C Z. Microwave-assisted extraction of chlorogenic acid from flower buds of Lonicera japonica Thunb [J]. Separation and Purification Technology,2008,62(2):480-483.
[21]彭密军.杜仲叶中高纯活性成分的分离制备新工艺研究[D].长沙:中南大学,2004.●
SHAN Chang-song1, LIU Jin2, ZHAO Zi-tong1,JIA Chao-shuang1, YANG Yi1, LIU Juan1,WU Peng1
(1.College of Food Science and Engineering, Shandong Agricultural University, Tai′an Shandong 271018;(2.Institutes of Biology and Medical Sciences, Soochow University, Suzhou Jiangsu 215123)
Abstract:Chlorogenic acid was extracted from sweet potato stems and leaves by microwave-assisted ethanol extraction method. The binomial mathematical model was obtained to optimize the extraction process by response surface methodology with four-factor, three-level based on single factor experiments with extraction time, temperature, solid-liquid ratio and ethanol concentration as the influence factors and the extraction yield of the chlorogenic acid as response value. The results showed that the optimum parameters were as follows: the extraction time was 25 min, the extraction temperature was 64.5 ℃, the solid-liquid ratio was 1∶35 g/mL and the ethanol concentration was 45%. Under the optimal conditions, the maximum extraction rate of chlorogenic acid was 3.4421 mg/g, which was close to the predictive value. The response surface methodology is applicable for the optimization of microwave-assisted ethanol extraction of chlorogenic acid from sweet potato stems and leaves.
Key words:sweet potato stem and leaf; chlorogenic acid; extraction; response surface methodology
中图分类号:TS 201.1
文献标识码:A
文章编号:1007-7561(2017)04-0046-06
收稿日期:2016-11-25
基金项目:泰安市大学生科技创新行动计划(2015D016)
作者简介:单长松,1990年出生,男,硕士研究生.
通讯作者:吴澎,1972年出生,女,副教授.