
郭丹丹1,成乐琴1,李 玲2,甘凤琴2,于秀茹1
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.通化百奥金森生物科技有限公司,吉林 通化 134000)
摘 要:以人参须根粉为原料,盐酸为催化剂,水饱和正丁醇溶液为提取溶剂,研究常压下加热回流直接提取人参须根粉中的人参皂苷Rg5,通过单因素实验和正交实验优化人参皂苷Rg5的提取工艺,同时进行精密度实验、稳定性实验、重复性实验和加样回收率实验,采用高效液相色谱法对人参须根粉提取物中的人参皂苷Rg5进行定量分析。结果表明,当固液比为1∶20 g/mL,酸浓度为0.06 mol/L,于70 ℃提取5 h,人参皂苷Rg5的得率为2.48%。人参皂苷Rg5在48 h内表现出良好的稳定性,加样回收率在99.32%~103.70%之间,RSD为1.33%。该方法较大地提高了人参皂苷Rg5得率、缩短了提取时间,操作简单、重现性好。
关键词:人参皂苷Rg5;人参须根粉;盐酸;提取;正交实验
人参为五家科属草本植物,在亚洲已有上千年的药用历史,具有抗衰老、提高免疫力、抗氧化的功效。人参皂苷被认为是人参中的主要活性成分,但其在人参中的含量较低[1-2]。人参皂苷Rg5是红参中天然存在的、极其微量的稀有人参皂苷[3],在抗肿瘤[4-5]、保护神经[6-8]、改善肺部炎症[9-10]、改善记忆[11-12]等方面具有显著效果。如图1所示,人参皂苷Rg5是由人参中的原人参二醇组(PPD)皂苷在C-20位选择性水解生成的人参皂苷-Rg3基础上,进一步在C-20位的-OH与C-22位的-H脱水而成的次级稀有人参皂苷,也可由丙二酸单酰基人参皂苷经过糖基修饰得到[13]。
关于人参皂苷Rg5制备的研究报道非常少[14-17],人参皂苷Rg5在制备过程中根据水解和脱水方式不同,常常伴随Rd、F2、Gypenoside XVII、Rh2、Rk1和Rz1等其他次级人参皂苷产生。人参皂苷Rg5可由Rg3脱水生成,两种构型(S/R)的Rg3在水中的溶解性存在一定的差异性,R构型的人参皂苷Rg3在水中易以固体形式析出,从而导致不能有效地转化为人参皂苷Rg5,导致人参皂苷Rg5得率较低。金银萍等[18]从红参的甲醇提取物中分离得到人参皂苷Rg5,其产率仅为0.012%;关大朋等[19]通过高温热裂解人参茎叶皂苷制备人参皂苷Rg5,其产率为13.17%;Soo Kyung Jo等[20]将白参置于98 ℃下蒸75 h后,分离得到人参皂苷Rg5,其得率为1.756%。目前,人参皂苷Rg5的制备途径主要包括两种,即先提取人参皂苷后转化制备人参皂苷Rg5和先制备含有人参皂苷Rg5的人参产品后提取人参皂苷。无论采用哪种制备方法,都有较大弊端,一方面制备所需时间长,需要几十甚至上百个小时;另一方面提取工艺较长,提取效率较低。因此,有必要开发一种简单易行、高效的人参皂苷Rg5制备方法。

图1 人参须根粉中人参皂苷Rg5的生成途径
本文以人参须根粉为原料,以盐酸为催化剂,利用常压下的加热回流提取方式,通过一步法将人参皂苷的提取、人参皂苷的选择性水解和定向脱水相融合制备人参皂苷Rg5,即在一步操作中完成“人参粉→人参皂苷→人参皂苷Rg3→人参皂苷Rg5”的转化,并以人参皂苷Rg5的得率为考察指标进行工艺优化。
1.1 材料与试剂
人参须根粉(GFRP):吉林省通化彩森仁生物有限公司提供;对照品人参皂苷20(S)-Rg3(批号MUST-12041211)、20(R)-Rg3(批号MUST-12080811)、Rg5(批号MUST-15051917):购自成都曼斯特公司,纯度≥98%。
乙腈(色谱纯):瑞典欧森巴克化学公司;甲醇(色谱纯):天津大茂化学试剂厂。正丁醇等溶剂为国产分析纯试剂,购自天津大茂化学试剂厂。
1.2 仪器与设备
高效液相色谱仪(配有P230P高压恒流泵、UV230+紫外-可见检测器、AT-350 Column Heater、EC-2000 LU工作站):大连依利特分析仪器有限公司;H2050R型高速离心机:湖南湘仪实验室仪器开发有限公司;L-760型化学合成反应仪:北京来亨科贸有限责任公司;RE-2000A型旋转蒸发仪:上海亚荣生化仪器厂;C18色谱柱(250 mm×4.6 mm,5 μm):月旭材料科技(上海)有限公司。
1.3 方法
1.3.1 色谱条件
根据文献[21],设置样品的色谱条件为:C18色谱柱(250 mm×4.6 mm,5 μm),检测波长为203 nm,进样量20 μL,柱温35 ℃,流速1 mL/min。流动相为乙腈(A)和水(B)。梯度洗脱:0~10 min,22%A;10~20 min,22%~27%A;20~25 min,27%~31%A;25~45 min,31%~38%A;45~60 min,38%~52%A;60~65 min,52%A;65~75 min,52%~55%A;75~82 min,55%~60%A;82~82.10 min,60%~90%A;82.10~100 min,90%A;100~100.10 min,90%~22%A;100.10~115 min,22%A。
1.3.2 混合对照品溶液的制备
准确称取适量干燥的人参皂苷20(S)-Rg3、20(R)-Rg3、Rg5对照品,用色谱纯甲醇定容至10 mL,配制成对照品贮备液[含人参皂苷-20(S)-Rg3 495.2 μg/mL、20(R)-Rg3 524.4 μg/mL、Rg5 264.767 μg/mL],移取不同体积的对照品贮备液加甲醇定容至10 mL,配制成不同质量浓度的对照品贮备液。
1.3.3 供试品溶液的制备
准确称取人参须根粉0.25 g,加入5 mL水饱和正丁醇溶液,并加入适量浓盐酸使得提取剂酸浓度为0.06 mol/L,80 ℃水浴加热提取4 h,提取一次。提取液冷却后,用Na2CO3溶液调pH值至6~7,8 000 r/min离心5 min。离心后固体加适量水饱和正丁醇溶液萃取,合并有机相,于45 ℃浓缩至干后用8 mL色谱纯甲醇溶解,从中取1 mL,用色谱纯甲醇定容至10 mL,即得供试品溶液,经HPLC定量分析,计算得率。
1.4 法学考察
1.4.1 线性关系考察
取不同浓度的混合对照品贮备液,在“1.3.1”色谱条件下进行定量分析,记录峰面积。以对照品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.4.2 精密度实验
取同一对照品溶液,在“1.3.1”色谱条件下重复进样5次,测定人参皂苷20(S)-Rg3、20(R)-Rg3、Rg5峰面积。
1.4.3 稳定性实验
取同一对照品溶液,在48 h内,每隔6 h,在“1.3.1”色谱条件下进样一次,测定人参皂苷Rg5峰面积。
1.4.4 重复性实验
准确称取0.25 g同一人参须根粉5份,按“1.3.3”操作方法制备供试品溶液,在“1.3.1”色谱条件下测定,记录峰面积,计算人参皂苷Rg5的平均质量浓度。
1.4.5 加样回收率实验
准确称取已知含量的样品9份,按“1.3.3”提取并定容。从中各取4 mL溶液于10 mL容量瓶中,精确加入样品中人参皂苷Rg5含量的80%、100%、120%的对照品,加入色谱纯甲醇定容,在“1.3.1”色谱条件下进样,记录峰面积,计算回收率。
1.5 单因素考察
称取人参须根粉0.25 g于平行合成仪的配套试管内,按照预设的提取液酸浓度、固液比、提取剂配比、提取温度和提取时间进行人参皂苷Rg5的提取。提取液冷却后,用Na2CO3溶液调pH值至6~7,8 000 r/min离心5 min。离心后固体加适量水饱和正丁醇溶液萃取,合并有机相,于45 ℃浓缩至干后用8 mL色谱纯甲醇溶解,从中移取1 mL,用色谱纯甲醇定容至10 mL,经HPLC定量分析,计算Rg5得率。
1.6 正交实验
在单因素实验基础上,以提取温度(A)、酸浓度(B)、提取时间(C)为考察因素,根据L9(34)正交表设计实验。因素水平见表1。
表1 正交实验因素水平
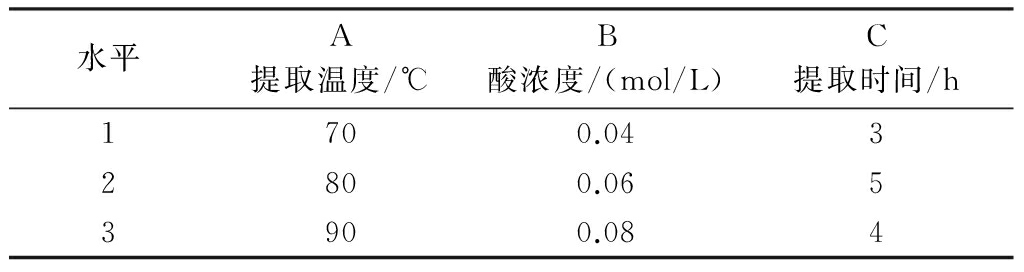
1.7 验证实验
称取人参须根粉5 g于圆底烧瓶中,在正交实验得出的最优条件下,进行三次平行实验。
2.1 线性关系考察
根据测定结果,人参皂苷20(S)-Rg3、20(R)-Rg3、Rg5的回归方程及线性范围分别为:YS-Rg3=6.501 3X+16.078,2.476 ~ 495.2 μg/mL,r=0.999 7;YR-Rg3=4.761 6X+12.252,2.622~524.4 μg/mL,r=0.999 7;YRg5=14.185X+40.192,7.925~264.767 μg/mL,r=0.999 9。在各自线性范围内呈现良好的线性关系。
2.2 精密度实验
测得人参皂苷20(S)-Rg3、20(R)-Rg3、Rg5峰面积的RSD分别为0.96%、1.25%、0.89%,说明仪器精密度良好。
2.3 稳定性实验
测得人参皂苷Rg5峰面积的RSD为0.63%,峰面积无明显变化,说明人参皂苷Rg5样品溶液在48 h内具有良好的稳定性。
2.4 重复性实验
按“1.3.3”操作方法制备供试品溶液,计算得到人参皂苷Rg5 的平均质量浓度为17.53 mg/g,RSD为1.68%,说明该方法的重现性较高。
2.5 加样回收率实验结果
加样回收率实验结果见表2。
表2 加样回收率实验结果

注:平均回收率为101.64%,RSD为1.33%。
结果显示,加样回收率在99.32%~103.70%之间,平均回收率为101.64%,RSD值为1.33%,说明该方法的准确度较高。
2.6 单因素实验结果分析
2.6.1 提取液酸浓度对人参皂苷Rg5得率的影响
人参皂苷Rg5的制备需要经过“人参须根粉→原人参二醇组皂苷→Rg3→Rg5”的转化过程,而酸在此转化过程中起到催化作用。为了考察酸浓度对人参皂苷Rg5得率的影响,固定提取温度为80 ℃、固液比1∶20 g/mL、提取时间4 h,只改变酸浓度(0、0.02、0.03、0.04、0.05、0.06、0.07、0.08 mol/L),进行提取。实验结果见表3。
表3 酸浓度对人参皂苷Rg5得率的影响
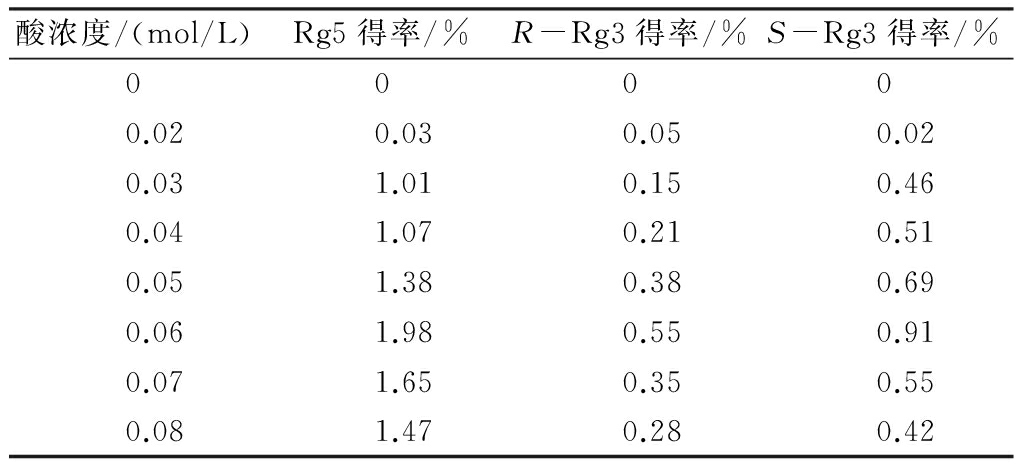
由表3可知,随着酸浓度的增大,人参皂苷Rg5的得率先逐渐增加,当酸浓度为0.06 mol/L时得率达到最大值,酸浓度进一步增加,得率反而减小。由图2可知,当酸浓度为0时,原人参二醇组皂苷Rb1(3)、Rc(4)、Rb2(5)、Rb3(6)、Rd(7)的含量很高,说明原人参二醇组皂苷在无酸催化条件下,转化成人参皂苷 Rg5的量极低,仅为8.06 μg/mL;当酸浓度为0.06 mol/L时,Rg5含量达到最大值,为61.99 μg/mL,Rg5的含量明显提高;当酸浓度过大时,人参皂苷Rg5会发生进一步的分解反应,导致其得率降低。故酸浓度以0.06 mol/L为宜。
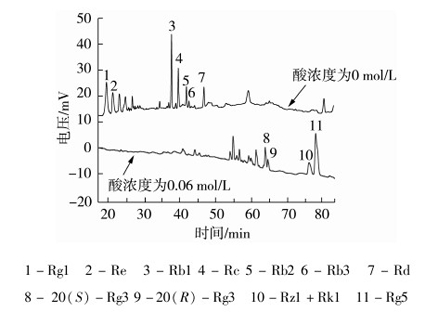
1-Rg1 2-Re 3-Rb1 4-Rc 5-Rb2 6-Rb3 7-Rd 8- 20(S)-Rg3 9-20(R)-Rg3 10-Rz1+Rk1 11-Rg5 图2 人参须根粉提取产物HPLC色谱图
2.6.2 固液比对人参皂苷Rg5得率的影响
由人参须根粉直接提取人参皂苷Rg5的过程中,水饱和正丁醇溶液的酸溶液不仅是人参皂苷的提取剂,也是人参皂苷通过水解、脱水等化学反应转化成人参皂苷Rg5的反应溶剂。为了考察人参须根粉和水饱和正丁醇溶液酸溶液的固液比对制备人参皂苷Rg5的影响,固定提取温度为80 ℃、提取液酸浓度0.06 mol/L、提取时间4 h,只改变固液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL),进行提取。实验结果见表4。
表4 固液比对人参皂苷Rg5得率的影响
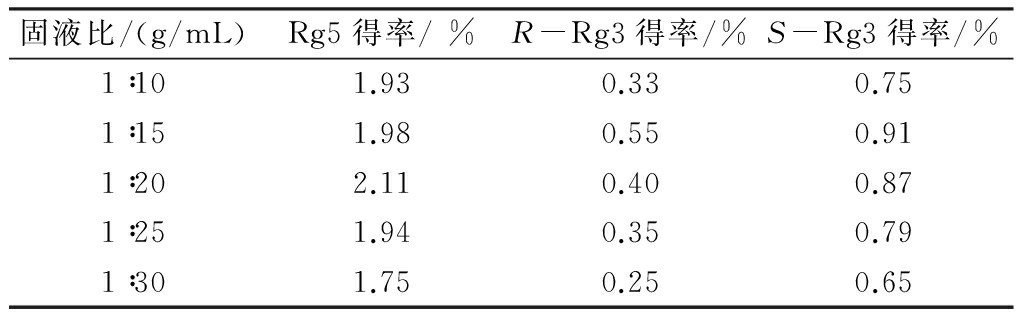
由表4可知,随着固液比的增大,人参皂苷Rg5的得率呈现先增加后减小的趋势。这是由于随着固液比的增大,即提取溶剂的用量增加,提取溶剂中溶解的PPD皂苷增加,因此,人参皂苷Rg5的得率增加。但当固液比大于1∶20 g/mL时,人参皂苷Rg5的得率反而降低,这是由于提取剂酸浓度一定但提取剂用量增大,相当于提取剂中电离出的H+数增加,导致生成的Rg5分解成其他物质,使其得率减小。
2.6.3 提取溶剂配比对人参皂苷Rg5得率的影响
根据相似相容原理,极性相似,溶解度好。为了考察不同极性的提取剂对人参皂苷Rg5得率的影响,在提取温度为80 ℃、提取时间4 h、酸浓度0.06 mol/L、固液比为1∶20 g/mL的条件下,只改变水与正丁醇的配比(分别为0∶100、水饱和正丁醇溶液、20∶80、40∶60、60∶40、80∶20、100∶0),进行提取实验。实验结果见表5。
表5 提取剂配比对人参皂苷Rg5得率的影响
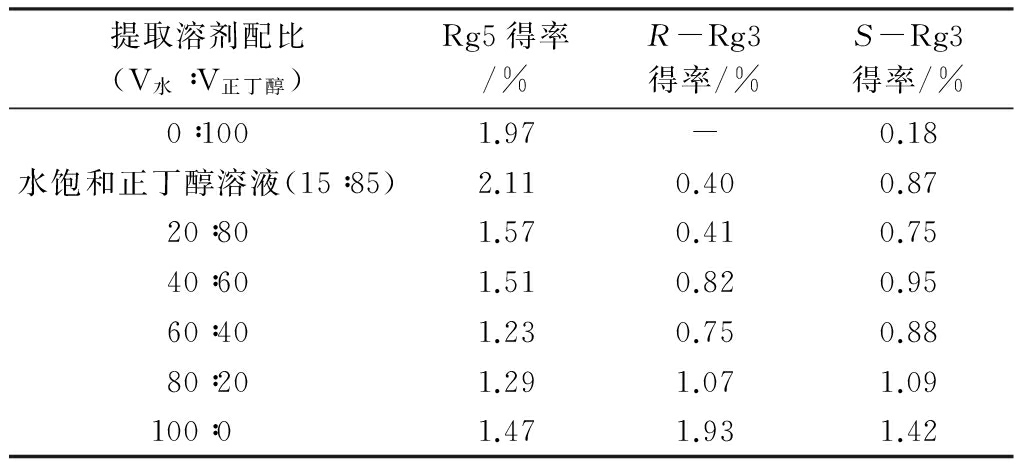
由表5可知,提取溶剂配比对人参皂苷Rg5得率的影响,呈现出两端高、中间低的趋势,这是因为在酸催化下,由人参须根粉制备人参皂苷Rg5是一个极其复杂的过程,不仅受PPD皂苷和丙二酸单酰基人参皂苷提取效果的影响,而且还受提取的PPD皂苷定向水解生成人参皂苷Rg3和人参皂苷-Rg3定向脱水生成人参皂苷Rg5的过程的影响。随着提取溶剂中水含量的增加,大量的Rg3以固体形式析出,溶解在提取溶剂中的Rg3减少,不能有效转化为人参皂苷Rg5,导致人参皂苷Rg5的得率逐渐降低,但随着提取溶剂中水含量的进一步增加,增大了提取溶剂的极性,促进了酸的解离,从而提高了强极性的丙二酸单酰基人参皂苷的提取率,同时使丙二酸单酰基人参皂苷转化成更多的人参皂苷Rg3,为人参皂苷Rg5的制备提供更多直接原料,因此人参皂苷Rg5的得率有所上升。实验结果表明,水饱和正丁醇溶液的提取效果最佳,因此以水饱和正丁醇溶液为最佳提取溶剂。
2.6.4 提取温度对人参皂苷Rg5得率的影响
提取温度不仅影响人参皂苷的提取,同时会影响人参皂苷的水解和脱水过程。为了考察温度对人参皂苷Rg5得率的影响,固定提取时间为4 h、酸浓度为0.06 mol/L、固液比1∶20 g/mL,分别在65、70、75、80、85、90 ℃下进行提取实验。实验结果见表6。
可以看出,随着提取温度的升高,人参皂苷Rg5的得率先增加后减小,这是因为随着提取温度的升高,一方面更多的原人参二醇组人参皂苷被提取,另一方面温度的升高又会加快原人参二醇组皂苷向人参皂苷Rg5转化,有助于提高人参皂苷Rg5的得率。但当温度近一步升高,特别是提取温度达到90 ℃时,人参皂苷Rg5的得率明显低于80 ℃时的得率,这表明过高的提取温度不利于人参皂苷Rg5的稳定性。因此,适宜的提取温度为80 ℃。
表6 提取温度对人参皂苷Rg5得率的影响

2.6.5 提取时间对人参皂苷Rg5得率的影响
为了考察提取时间对人参皂苷Rg5得率的影响,固定提取温度为80 ℃、酸浓度为0.06 mol/L、固液比1∶20 g/mL,只改变提取时间(2、3、4、5、6 h),进行提取实验。实验结果见表7。
表7 提取时间对人参皂苷Rg5得率的影响

由表7可知,提取开始阶段,由于体系中还不存在或只少量存在人参皂苷Rg5,使得人参皂苷Rg5生成速率大于人参皂苷 Rg5的分解速率,因此提取刚开始随着提取时间的延长,人参皂苷 Rg5的得率增加;当提取时间大于4 h后,随着原料中二醇组皂苷含量的降低,人参皂苷Rg5的分解速率快于其生成速率,人参皂苷Rg5得率降低。因此,提取时间以4 h为宜。
2.7 正交实验优化
为进一步优化人参皂苷Rg5的制备工艺条件,在单因素实验基础上,以提取温度(A)、酸浓度(B)、提取时间(C)为考察因素,根据L9(34)正交表设计实验,并对最优方案进行验证。正交实验结果见表8。
由表8可以看出,最佳实验方案为A1B2C2,即提取温度为70 ℃,酸浓度为0.06 mol/L,提取出时间为5 h,此时,人参皂苷Rg5的得率为2.47%(实验2),优于单因素的最优方案(实验5,2.18%)。由方差分析(表9)可知,影响人参皂苷Rg5得率的因素次序为A>B>C,即:提取温度>酸浓度>提取时间,对最优方案进行三次重复性验证实验,得出人参皂苷Rg5的得率分别为2.44%、2.52%、2.47%,平均得率为2.48%,是金银萍等[18]从红参中分离的人参皂苷Rg5得率的205倍,验证实验RSD值为1.63%,说明该方法的重现性较好。
表8 正交实验L9(34)设计和结果
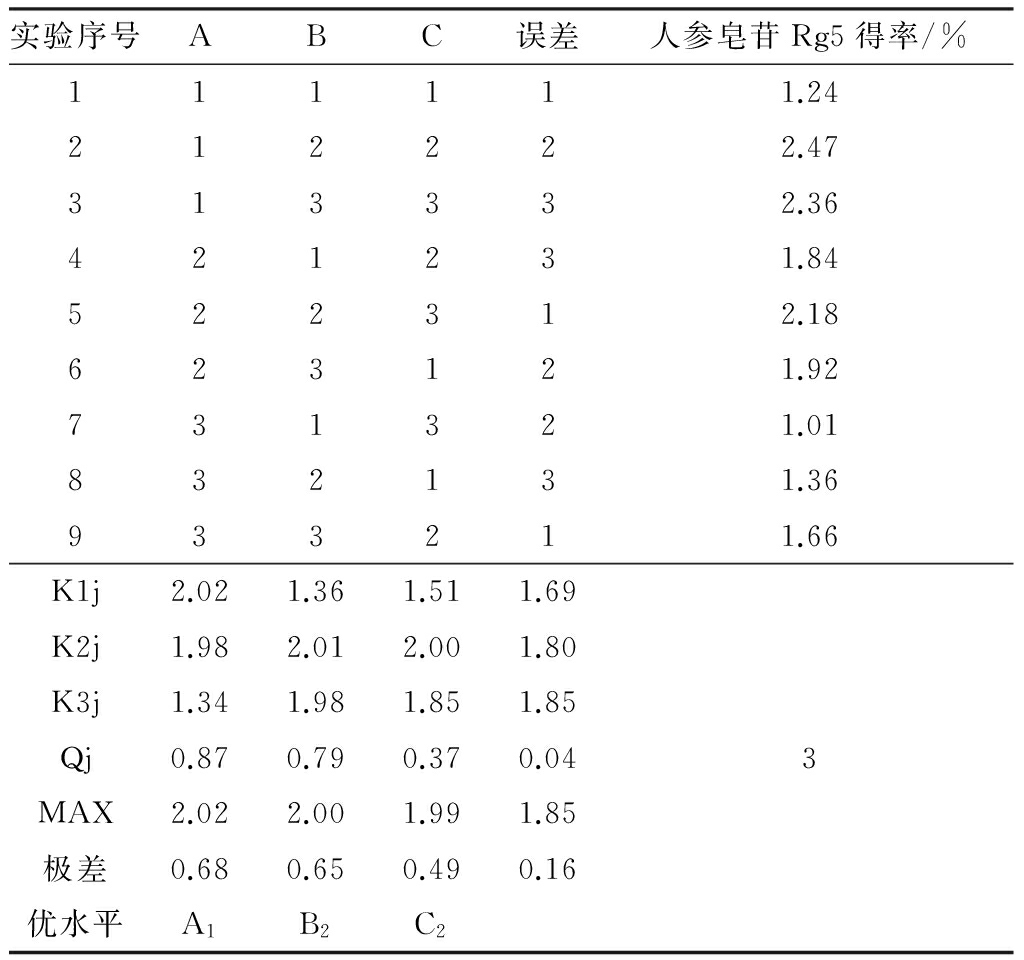
表9 方差分析表
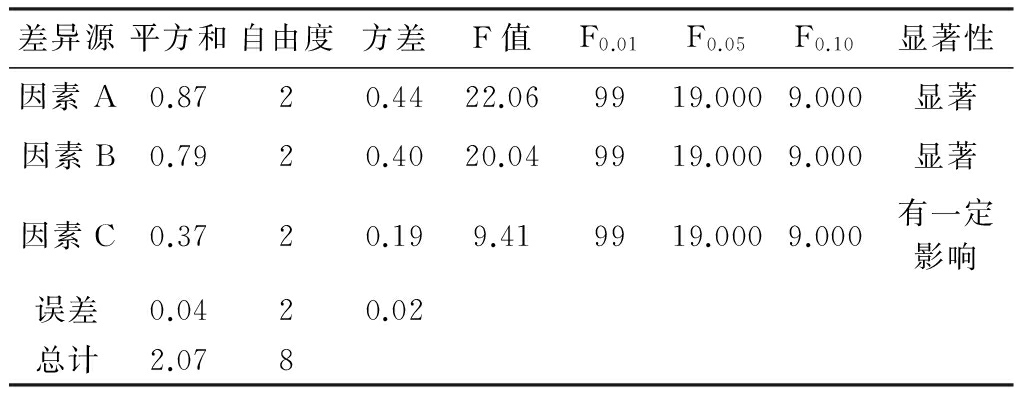
注:F>F0.01,极显著;F0.01< F<F0.05,显著;F0.05<F<F0.10,有一定影响;F<F0.10,无影响。
在最优方案条件下,对一次萃取后的人参渣进行二次萃取,HPLC分析谱图见图3。对人参皂苷Rg5的定量分析结果表明,按照本方法由人参须根粉直接制备Rg5,一次性得率为2.47%左右。将第一次提取的固体残渣,在同等条件下进行二次提取和三次提取,计算Rg5的二次得率为0.03%,第三次得率为0,计算可知第一次提取占三次提取总和的98.80%。通常人参皂苷需要三次提取,而通过本方法提取人参皂苷Rg5的一次提取效果基本达到三次提取的效果,提取效率较高。

图3 最优实验条件下第一次提取和第二次提取结果对比图
2.8 验证实验
在最优方案条件下,以5 g人参须根粉(放大20倍)为原料进行三次人参皂苷Rg5的制备平行实验。实验结果表明,人参皂苷Rg5的得率分别为2.20%、2.48%、2.46%,平均值为2.38%,RSD值为1.29%,说明放大条件下同样有较好的重现性。
本实验在单因素实验基础上,通过正交实验对人参皂苷Rg5的制备工艺进行优化,探索提取温度、酸浓度、提取时间及其相互作用对人参皂苷Rg5得率的影响,得最优工艺为提取温度70 ℃,酸浓度0.06 mol/L,提取时间5 h,在此条件下,人参皂苷Rg5得率为2.48%。
传统的人参皂苷Rg5制备方法一般采用长时间高温蒸制鲜参,得到含有人参皂苷Rg5的人参产品,再分离出人参皂苷Rg5;或者先将人参中的皂苷提取后,再将其转化成人参皂苷Rg5。无论采用何种传统方法,均存在制备时间长、制备效率低的缺点。本论文通过采用常压加热提取方法,融合人参皂苷的提取技术和人参皂苷的转化技术,直接从人参须根粉中一步制备人参皂苷Rg5,不仅简化了实验操作步骤,而且缩短了制备时间,提高了制备效率,为人参皂苷Rg5提供了简单易行的制备方法。
参考文献:
[1]吴少雄,王保兴,郭祀远,等.三七叶苷的提取分离与纯化[J].食品与发酵工业,2005,31(1):149-151.
[2]鱼红闪,陈琪,金凤燮.不同种类人参及其各部位中皂苷组成和比例的研究[J].食品与发酵工业,2002,28(2):24-28.
[3]周琪乐,徐嵬,杨秀伟,等. 中国红参化学成分研究[J].中国中药杂志,2016,41(2):233-249.
[4]Kim S J, Kim A K. Anti-breast cancer activity of Fine Black ginseng (Panax ginsengMeyer) and ginsenoside Rg5[J].Journal of Ginseng Research,2015,39:125-134.[5]高戎,徐建如,李仁奇,等.人参皂苷 Rg5 对脓毒血症大鼠急性肺损伤的保护作用[J].现代生物医学进展,2013,13(11):2062-2064.[6]Shin Y W, Bae E A, Kim D H. Inhibitory effect of ginsenoside Rg5 and its metabolite ginsenoside Rh3 in an oxazolone-induced mouse
chronic dermatitis model[J].Arch Pharm Res,2006,29(8):685-690.[7]金玲,金香淑. 红参皂苷Rg5对MPP-+所致SH-SY5Y细胞氧化应激损伤的保护作用[J].时珍国医国药,2015,26(4):878-880.
[8]Lee Y Y, Park J S, Jung J S, et al. Anti-Inflammatory Effect of Ginsenoside Rg5 in Lipopolysaccharide-Stimulated BV2 Microglial Cells[J].International Journal of Molecular Sciences,2013,14:9820-9833.[9]Kim T W, Joh E H, Kim B, et al.Ginsenoside Rg5 ameliorates lung inflammation in mice by inhibiting the binding of LPS to toll-like receptor-4 on macrophages[J]. Int Immunopharmacol,2012,12(1):110-116.
[10]张晶,王世荣,陈全成,等. 人参皂苷Rg3 (R) ,Rg3(S) ,Rg5/Rk1对乙醇致小鼠记忆阻碍改善作用的影响[J].吉林农业大学学报,2006,28(3):283-284.
[11]Kim E J, Jung I H, Le T K V, et al. Ginsenosides Rg5 and Rh3 protect scopolamine-induced memory deficits in mice[J].Journal of Ethnopharmacology,2013,146(1):294-299.
[12]姚华,金永日,杨洁,等. 密闭式微波降解法促进常见人参皂苷向稀有人参皂苷转化的规律[J].高等学校化学学报,2014,35(11):2317-2323.
[13]杨凌,何克江,杨义,等. 一种人参二醇型皂甙酸水解制备人参皂甙Rk1和Rg5的方法[P].中国专利:CN02109790.9, 2005-09-21.
[14]郑侑燮,崔镇华. 用于制备加工人参以获得增加的人参皂甙Rg5含量的新颖方法[P].中国专利:200680011768, 2006-04-11.
[15]金凤燮,鱼红闪.红参皂苷Rg3组合Rh2组混合皂苷的制备方法[P].中国专利:CN102352402A, 2012-02-15.
[16]咸政烨,姜奇成,郑凤哲,等. 通过微波辐照产生的具有提高的人参皂苷Rg3、Rg5和Rk1含量比的人参属植物提取物、制备所述人参属植物提取物的方法以及包含所述人参属植物提取物的组合物[P].韩国发明专利,CN104487079A, 2015.
[17]孙成鹏; 高维平;赵宝中,等.柠檬催化转化原人参二醇组皂苷制备人参皂苷Rg5的初步研究[J].中成药,2013,35(12):2694-2698.
[18]金银萍,郑培和,郑斯文,等. 人参皂苷20(S)-Rg3,20(R) -Rg3,Rg5,Rk1对照品的制备[J].吉林农业大学学报,2014,36(5):591-594
[19]关大朋,王欢,李伟,等. 高温热裂解人参皂苷Rk1和Rg5的制备工艺优化[J].上海中医药杂志,2015,49(1):91-95.
[20]Soo Kyung Jo, In Sook Kim, Keon Sang Yoon,et al.Preparation of ginsenosides Rg3, Rk1, and Rg5-selectively enriched ginsengs by a simple steaming process[J].European Food Research and Technology,2015,240(1):251-256.
[21]孙成鹏,高维平,赵宝中,等. 酒石酸催化转化原人参二醇组皂苷制备20(R)-人参皂苷Rg3[J].中草药, 2013,44(14):1893-1898.●完
Preparation of ginsenoside Rg5 with ginseng fibrous root powder
GUO Dan-dan1,CHENG Le-qin1,LI Ling2,GAN Feng-qin2,YU Xiu-ru1
(1.College of Chemistry and Pharmaceutical Engineering, Jilin Institute of Chemistry Technology,Jilin Jilin 132022;2.Tonghua Bai′aojinsen Biotechnology Co.,Ltd, Tonghua Jilin 134000)
Abstract:Taking ginseng fibrous root powder (GFRP) as raw material, hydrochloric acid as a catalyst and water-saturated n-butanol as the extraction solvent, respectively, the method of preparation of ginsenoside Rg5 from GFRP at atmospheric pressure by heating reflux was studied. The extraction process of ginsenoside Rg5 was optimized through one-factor experiment and orthogonal experiment, the precision test, stability test, repeatability test and sample recovery test were also carried out. High Performance Liquid Chromatography was applied to determine the content of ginsenoside Rg5 in ginseng fibrous root powder extracts. The optimum result obtained from orthogonal test was as follows: ratio of ginseng fibrous root powder to extraction solvent 1∶20 g/mL, acid concentration 0.06 mol/L, extraction temperature 70 ℃ and extraction time 5 h. Under the optimized conditions, the yield of ginsenoside Rg5 was 2.48%. Ginsenoside Rg5 showed good stability in 48 h, and the sample recovery rate was 99.32%~103.70%, RSD was 1.33%. The method has following characteristics such as high extraction yield, simple operation, good reproducibility and short extraction time.
Key words:ginsenoside Rg5; ginseng fibrous root powder; hydrochloric acid; extract; orthogonal experiment
收稿日期:2016-10-18
基金项目:吉林省科技厅公关项目(20140306003YY);吉林化工学院项目(吉化院合字[2015]第036号)
作者简介:郭丹丹,1991年出生,女,硕士研究生.
通讯作者:成乐琴,1969年出生,女,教授.
中图分类号:S 567.5+1
文献标识码:A
文章编号:1007-7561(2017)03-0070-07