张雪红1,刘利娜2,林翠梧3
(1.广西师范学院 化学与材料科学学院,广西 南宁 530001;2.华南理工大学 化学与化工学院,广东 广州 510641;3.广西大学 化学化工学院,广西 南宁 530004)
摘 要:以溶剂、反应时间、反应温度、三氯氧磷与果胶液固比为考察因素,磷含量为指标,研究果胶的磷酸化合成工艺,并对磷酸化修饰前后的果胶进行T淋巴细胞免疫增殖实验。结果表明:极性大的偶极溶剂和较高的反应温度有利于提高磷含量;随着溶剂用量、反应时间以及三氯氧磷用量的增加,磷含量先增加后下降。在反应温度50 ℃、反应时间3.0 h、三氯氧磷与果胶的液固比为3∶1的最佳合成工艺条件下,磷酸化果胶中的磷含量可高达11.52%。免疫增殖实验结果表明:苹果果胶、低磷含量和高磷含量的磷酸化苹果果胶没有免疫活性,中等磷含量的磷酸化苹果果胶有明显的免疫抑制活性。
关键词:果胶;磷酸化;磷含量;免疫活性
多糖具有抗肿瘤、抗病毒、免疫调节、抗氧化等多种生物活性[1-5]。多糖的生物活性与其分子结构有关,对多糖分子结构进行修饰,可提高或赋予多糖活性,降低其毒副作用[6]。多糖修饰的方法有硫酸化、磷酸化、乙酰化、烷基化、磺酰化、竣甲基化等[6-9],其中多糖的硫酸化研究较为成熟,而关于磷酸化方面的研究则相对较少。磷酸化多糖具有抗肿瘤、抗病毒、抗菌和免疫调节[10-15]等一系列生物活性。但由于从自然界分离得到的磷酸化多糖数目非常有限,严重影响到磷酸化多糖的研究与应用,因此多糖的磷酸化修饰显得尤为必要。
目前多糖的磷酸化研究主要集中在淀粉、壳聚糖和纤维素方面[16],关于香菇多糖[17]、牛膝多糖[13]和浒苔多糖[16]的磷酸化研究也有少许报道,但关于果胶的磷酸化研究还未见报道。果胶是从植物组织中提取的一种酸性多糖,广泛存在于绿色植物的细胞壁和内壁中。在食品工业中,果胶常用作胶凝剂、增稠剂、稳定剂和品质改良剂。以果胶为原料研究多糖的磷酸化,具有原料易得、价格低廉的优势。
本文以价廉易得的苹果果胶为原料,三氯氧磷为磷酰化试剂,详细考查了磷酸化果胶的合成工艺,并对合成得到的磷酸化果胶进行刀豆球蛋白ConA诱导的T淋巴细胞体外免疫增殖实验,以期为磷酸化多糖的合成及其生物活性研究提供依据。
1.1 实验动物与材料
雄性BALB/c纯系小鼠:5~6周龄,购自中国科学院上海实验动物中心,在SPF级环境下喂养。动物生产许可证号:SCXK(沪)2002-0010。
苹果果胶:烟台安德利果胶有限公司;RPML-1640培养基、胎牛血清、Hanks平衡盐溶液:美国Gibco公司。噻唑蓝(MTT)、丝裂霉素C、刀豆蛋白A(ConA):美国Sigma公司。其它所用试剂均为国产分析纯,实验用水为去离子水。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器、RE-5299旋转蒸发仪:巩义市予华仪器有限公司;FD-1A-50型冷冻干燥机:北京博医康实验仪器有限公司;CO2细胞培养箱:日本三洋;BD FACSCanto II流式细胞计数仪:美国BD公司;ELX-800自动酶标仪:美国Bio-Tek公司;XDS-1B倒置显微镜:重庆光学仪器;Libra S22 型紫外可见分光光度计:法国Biochrom 公司;3K15-高速冷冻离心机:德国Sigma公司。
1.3 实验方法
1.3.1 磷酸化果胶合成条件实验设计
采用单因素实验设计,改变其中一个反应条件,固定其它条件不变,考查对磷酸化果胶中磷含量的影响。再在单因素实验基础上,采用正交实验法确定果胶磷酸化修饰的最佳工艺条件。
磷酸化果胶的合成工艺如下:称取1.0 g苹果果胶(AP),将其分散于一定体积的磷酸三甲酯中,形成果胶分散液。将一定量的三氯氧磷,在冰浴下滴加到一定体积的二甲基亚砜/乙腈和吡啶混合液中。再将溶有三氯氧磷的混合液在一定温度下滴加到果胶分散液中,反应过程中用吡啶调节pH,保持pH约为6。反应一定时间后终止反应,抽滤,沉淀部分用水溶解后,自来水透析(截留分子量为3 500 Da)24 h,再用蒸馏水透析24 h,将透析液浓缩后冷冻干燥,即可得到磷酸化苹果果胶。
1.3.2 磷含量的测定
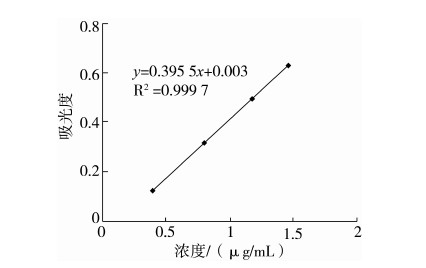
按照GB/T 22427.11—2008“淀粉及其衍生物磷总含量测定”[18]方法测定产品的磷含量,以浓度为横坐标,以吸光度为纵坐标,绘制标准曲线(见图1)。

图1 磷的标准曲线
磷含量(WP)计算公式:
公式中:A为吸光度值;V为样品溶液的体积,mL;f为样品溶液的稀释倍数;ms为样品质量, g。
1.3.3 磷酸化果胶的红外表征
充分干燥的苹果果胶(AP)和磷酸化苹果果胶(PAP)经KBr压片,在4 000~700 cm-1范围内进行红外光谱扫描,对果胶修饰前后的红外光谱图进行比较分析。
1.3.4 ConA诱导的T淋巴细胞体外增殖实验
在合成的系列磷酸化果胶中,选取高磷含量的磷酸化苹果果胶(HAP,磷含量为10.65%)、中磷含量的磷酸化苹果果胶(MAP,磷含量为6.93%)、低磷含量的磷酸化苹果果胶(LAP,磷含量为4.30%)以及未经修饰的苹果果胶,进行ConA诱导的T淋巴细胞增殖实验。具体做法为:将BALB/c纯系小鼠用乙醚麻醉,无菌取脾脏并机械分离脾细胞,用200目尼龙滤膜过滤细胞。加红细胞裂解液去除红细胞,预冷Hanks液洗涤细胞3次,2 000 r/min离心5 min,弃去上清液。然后用含有10%胎牛血清的RPMI 1640培养液,将细胞浓度调整至7×106个/mL。在96孔板中加入100 μL细胞培养液(每孔细胞7×105个)和50 μL 20 mg/L的ConA 溶液 。实验组加入50 μL样品溶液,使样品终浓度分别为20、50、100、200 μg/mL,同时设空白组(无细胞)和ConA对照组(加50 μL培养基,不加样品)。将96孔板放入培养箱,在37 ℃、5 % CO2、95%湿度条件下培养3 d。于培养结束前4 h加入50 μL 5 mg/L MTT溶液,继续培养4 h。2 000 r/min离心5 min,弃去上清液,加入100 μL二甲基亚砜,震荡10 min后在波长570 nm处测吸光度,每个浓度设5个复孔,结果以平均值±RSD表示。
2.1 单因素实验结果
2.1.1 溶剂种类对磷含量的影响
按照合成方法,考察不同溶剂对磷含量的影响,其它实验条件相同,结果如表1所示。
表1 不同溶剂对磷含量的影响

由表1可知,选用混合溶剂比单独使用磷酸三甲酯作溶剂,产品中的磷含量要高。当溶剂选用乙腈与磷酸三甲酯时,磷含量最高。原因可能是该反应是一个SN2反应,二甲亚砜和乙腈同为偶极溶剂,而偶极溶剂有利于SN2反应的发生,用乙腈比二甲亚砜效果好,可能是因为乙腈的极性比二甲亚砜大,极性大的溶剂可降低中间过渡态的活化能,增加反应速率[19]。因此,后续实验溶剂选用乙腈与磷酸三甲酯。
2.1.2 乙腈用量对磷含量的影响
按照合成方法,以乙腈和磷酸三甲酯为溶剂,磷酸三甲酯体积为10 mL,保持其它条件不变,考察不同乙腈用量(3、5、10、15 mL)对磷含量的影响。结果如表2所示。
表2 不同乙腈用量对磷含量的影响
由表2可知,当乙腈用量为5 mL,即磷酸三甲酯与乙腈体积比为2∶1时,产品的磷含量达到最大。继续增加乙腈用量,产品的磷含量不增反降。乙腈用量为15 mL时,产品磷含量有微弱回升,但仍大大低于乙腈用量为5 mL时的磷含量。原因可能是一定范围内增加乙腈用量,可以有效降低中间过渡态的活化能,增加反应速率,但继续增大乙腈用量,将使反应液体积增大,溶液变稀,使得反应物分子间的有效碰撞减少,反应完全程度下降,并最终导致磷含量下降。因此,后续实验乙腈体积设为磷酸三甲酯的50%。
2.1.3 三氯氧磷用量对磷含量的影响
按照合成方法,考察三氯氧磷与果胶不同液固比(1∶2、1∶1、2∶1、3∶1、4∶1)对磷含量的影响,保持其它条件不变,结果如图2所示。
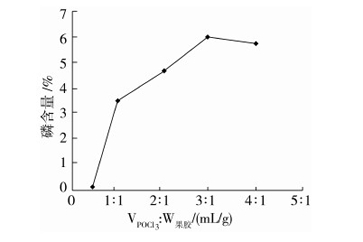
图2 POCl3用量对磷含量的影响
由图2可知,三氯氧磷与果胶不同液固比对磷含量的影响较大。当三氯氧磷与果胶的液固比为3∶1时,磷酸酯化苹果果胶的磷含量最高。此后继续增加液固比,磷含量反而略有下降。这可能是因为一开始时,三氯氧磷的用量没有达到计量比,反应不完全,因此磷含量较低。当三氯氧磷的用量达到计量比以后,再继续增加其用量,不仅不会增加反应完全程度。反而因为反应液体积增大,使得果胶分子与三氯氧磷分子之间的有效碰撞减少,反应完全程度下降,导致磷含量下降。因此,后续实验三氯氧磷与果胶的液固比选择3∶1。
2.1.4 反应温度对磷含量的影响
按照合成方法,考察不同反应温度(25、50、65、80 ℃)对磷含量的影响,保持其它条件不变,结果如图3所示。
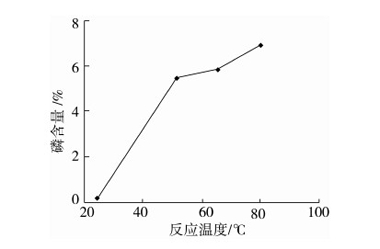
图3 反应温度对磷含量的影响
由图3可知,反应温度升高,磷含量增加。反应温度从25 ℃增加到50 ℃,磷含量增加了约16倍。当反应温度高于50 ℃以后,温度对磷含量的影响则趋于平缓。这可能是因为该反应是吸热反应,反应温度增高使得反应活化分子数增加,反应速度加快,产率增加。反应温度低时,活化分子数少,温度的增加对活化分子百分数的增加有明显作用。当温度升高到一定温度(此反应中为50 ℃)后,由于大部分分子已处于活化状态,继续增加反应温度,活化分子百分数变化不大。考虑到温度达到65 ℃以后,反应液变得粘稠难以搅拌,后续实验反应温度选择50 ℃。
2.1.5 反应时间对磷含量的影响
按照合成方法,考察不同反应时间(1、2、3、5、48 h)对磷含量的影响,保持其它条件不变,结果如图4所示。

图4 反应时间对磷含量的影响
由图4可知,当反应时间从1 h增加到3 h时,磷含量持续增加。这可能是由于延长反应时间,使得反应更充分。反应时间为3 h时磷含量最高,达10.18%,之后随着时间延长磷含量反而下降。可能是因为果胶在较高的温度下长时间反应,使果胶多糖产生了焦化作用,从而使磷含量下降。这一现象与张难[17]关于磷酸化香菇多糖以及周家春等[20]关于淀粉磷酸化的结论相似。
2.2 正交实验结果
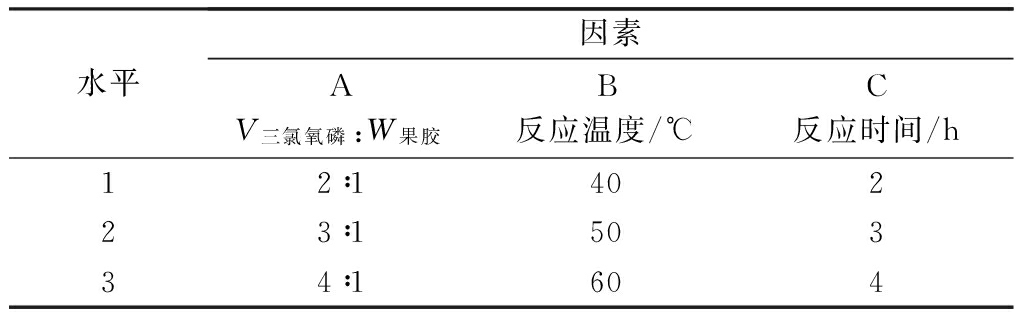
根据单因素实验结果,选取三氯氧磷与果胶的液固比、反应温度和反应时间为考察因素,每个因素选取三个水平进行正交实验。实验因素及水平设置见表3,正交实验结果见表4。
表3 果胶的磷酸化修饰工艺正交实验因素水平
由表4可看出,在所选水平内,三个因素对磷酸化果胶中磷含量的影响大小为:反应温度>反应时间>V三氯氧磷∶W果胶。最佳提取工艺参数为:A2B3C2,即反应温度60 ℃、反应时间 3.0 h、三氯氧磷与苹果果胶的液固比为3∶1。考虑到温度高于50 ℃后反应液变得粘稠难以搅拌,最终选取的最佳工艺条件为:反应温度50 ℃、反应时间3.0 h、三氯氧磷与苹果果胶的液固比为3∶1。在此最佳工艺条件下做验证实验,得到磷酸化苹果果胶PAP,其磷含量为11.52%,高于其它实验组。
表4 果胶的磷酸化修饰工艺正交实验方案与结果
2.3 苹果果胶磷酸化修饰前后的红外表征
苹果果胶原料(AP)及磷酸化苹果果胶(PAP)的红外谱图如图5所示。
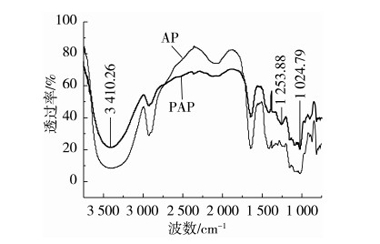
图5 AP及PAP的红外光谱图
从图5可以看出,2 925.95 cm-1处的-CH3伸缩振动,1 640.66 cm-1处的羰基伸缩振动,1 417.52 cm-1处的C-O伸缩振动,在修饰后均没有发生明显变化,说明磷酸化修饰并没有破坏苹果果胶本身的结构。但与未经修饰的苹果果胶相比,磷酸化苹果果胶的红外光谱显示了两个特征吸收峰,一个在1 253 cm-1处,该吸收峰是由于P=O伸缩振动引起的;另一个在1 024cm-1处,是由于P-O-C伸缩振动引起的。红外光谱结果说明磷酸根已被接枝到苹果果胶上。
2.4 ConA诱导的T淋巴细胞体外增殖实验
苹果果胶磷酸化修饰前后的T淋巴细胞体外免疫增殖实验结果见表5。
表5 果胶及磷酸化果胶的T淋巴细胞体外免疫增殖活性

注:*表示与对照组相比差异显著(P< 0.05),**表示差异极显著(P<0.01)。
淋巴细胞是一种重要的免疫细胞,它在分化和激活后能产生许多细胞因子,因此在免疫应答中起着关键作用。从表5可以看出,低磷含量和高磷含量的磷酸化苹果果胶没有明显的免疫活性,中等磷含量的磷酸化苹果果胶MAP(WP=6.93%)则有明显的免疫抑制活性,但其免疫抑制活性与浓度之间的关系不是很有规律,在20~200 μg/mL样品浓度范围内,除100 μg/mL外,磷酸化果胶的免疫抑制活性基本随浓度的升高而增加。
建立了以三氯氧磷为磷酰化试剂,以磷酸三甲酯和乙腈做溶剂的磷酸化果胶合成工艺。考查了反应温度、反应时间、三氯氧磷与果胶液固比对磷酸化果胶中磷含量的影响,得到最佳工艺条件为:反应温度50 ℃、反应时间3.0 h、三氯氧磷与果胶的液固比为3∶1。在此最佳工艺条件下,得到的磷酸化果胶磷含量高达11.52%。由红外光谱检测可知,磷酸根已成功被接枝到苹果果胶上,且磷酸化修饰后果胶本身的结构没有被破坏。免疫增殖实验结果表明,未经修饰的苹果果胶、低磷含量和高磷含量的磷酸化苹果果胶没有明显的免疫活性,而中等磷含量的磷酸化苹果果胶MAP有明显的免疫抑制活性。研究表明,磷含量对多糖的活性影响较大,但其免疫抑制机理,以及磷含量和免疫抑制活性之间的关系尚不清楚,有待进一步研究。
参考文献:
[1]Jin M L, Zhao K, Huang Q S, et al. Isolation, structure and bioactivities of the polysaccharides from Angelica sinensis (Oliv) Diels: A review[J]. Carbohydrate Polymers, 2012, 89(12):713-722.
[2]Li J W,Shan L, Liu Y F, et al. Screening of a functional polysaccharide from Zizyphus Jujuba cv. Jinsixiaozao and its property[J]. International Journal of Biological Macromolecules, 2011, 49(10): 255-259.
[3]WenZ S, Xiang X W, Jin H X, et al. Composition and anti-inflammatory effect of polysaccharides fromSargassum horneriin RAW264.7 macrophages[J]. International Journal of Biological Macromolecules, 2016, 88(7): 403-413.
[4]时潇丽, 姚春霞, 林晓, 等. 多糖药物应用与研究进展[J]. 中国新药杂志, 2014, 23(9):1057-1062.
[5]安晓娟, 冯琳, 宋红平, 等. 植物多糖的结构分析及药理活性研究进展[J]. 中国药学杂志, 2012, 47(16): 1271-1275.
[6]申林卉, 刘丽霞, 陈冠, 等. 多糖化学结构修饰方法的研究进展[J]. 药物评价研究, 2013, 36(6): 465-468.
[7]王兆梅, 李琳, 郭祀远, 等. 多糖结构修饰研究进展[J]. 中国医药工业杂志, 2002, 33(12): 616-620.
[8]赖萍, 林跃鑫. 天然多糖分子修饰研究进展[J]. 生命的化学, 2003, 23 (3):183-187.
[9]李玉华, 王凤山, 贺艳丽. 多糖化学修饰方法研究概况[J]. 中国生化药物杂志, 2007,28(1):62-65.
[10]陈晓明, 田庚元. 多糖磷酸酯化的研究进展[J]. 有机化学, 2002, 22(11): 835-839.
[11]李全才, 李春霞, 勾东霞, 等. 磷酸化多糖的研究进展[J]. 生命科学, 2013, 25(3): 262-268.
[12]Deng C, Fu H T, Xu J J, et al. Physiochemical and biological properties of phosphorylated polysaccharides from Dictyophora indusiata[J]. International Journal of Biological Macromolecules, 2015,72(1): 894-899.
[13]薛胜霞, 金丽琴, 叶发青, 等. 牛膝多糖硫酸酯和磷酸酯衍生物对人肺癌A549细胞的影响[J]. 中国生化药物杂志, 2007, 28(6): 406-408.
[14]Chen X Y, Xu X J, Zhang L N, et al. Chain conformation and anti-tumor activities of phosphorylated (1-3)-β-D-glucan from Poria cocos[J]. Carbohydr Polymer, 2009, 78(3):581-587.
[15]Toyoshima S, Iwata M, Osawa T. Kinetics of lymphocyte stimulation by concanavalin A[J]. Nature, 1976, 264(5585):447-449.
[16]孙雪, 潘道东, 增小群, 等. 浒苔多糖的磷酸化修饰工艺[J]. 食品科学, 2011, 32(24): 73-77.
[17]张难, 邱树毅, 吴远跟, 等. 磷酸化香菇多糖的制备及其部分理化性质的研究[J]. 食品研究与开发, 2008, 29(8): 21-25.[18]GB/T 22427. 11-2008,淀粉及其衍生物磷总含量测定[S].
[19]周连斌. 预测溶剂影响SN1与SN2反应速率的Hughes-Ingold规则[J]. 大学化学, 1997, 12(4): 28-31.
[20]周家春, 张达力, 曾翰权. 淀粉磷酸化及其抗冷冻脱水的研究[J]. 广州食品工业科技, 1999,16(1):43-45. ●完
Study on phosphorylation modification and immunocompetence of pectin
ZHANG Xue-hong1, LIU Li-na2, LIN Cui-wu3
(1. College of Chemistry and Materials Science, Guangxi Teachers Education University,Nanning Guangxi 530001; 2. College of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou Guangdong 510641;3. College of Chemistry and Chemical Engineering,Guangxi University, Nanning Guangxi 530004)
Abstract:Phosphorylation of pectin was researched with solvent, reaction time, reaction temperature and ratio of phosphorus oxychloride (POCl3)to pectin as factors, and phosphorus content as index. T lymphocyte immune proliferation was tested to investigate the immune activity of pectin with and without phosphorylation. The experiment results indicated that dipolar solvent with higher polarity and reaction temperature could improve the phosphorus content; while it increased firstly and then decreased with the increase of solvent volume, reaction time, and quantity of POCl3. Under the optimal synthetic technological conditions,i.e. reaction temperature 50 ℃, the ratio of POCl3to pectin 3∶1, and the reaction time 3 h, the phosphorus content of the phosphorylated pectin could reach 11.52%. The apple pectin, phosphorylated apple pectins with high and low phosphorus content had no immune activity, while phosphorylated apple pectin with middle phosphorus content had obvious immunosuppressive activity.
Key words:pectin; phosphorylation; phosphorus content; immunocompetence
收稿日期:2016-09-27
基金项目:广西自然科学基金(2011GXNSFA018051)
作者简介:张雪红,1973年出生,女,教授.
中图分类号:Q 539+.8
文献标识码:A
文章编号:1007-7561(2017)03-0065-05