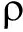 +0.020 4,相关系数为0.992 6,检出限为0.038 μg/mL。方法应用于食品中MDA的测定,测定结果的RSD为1.5%~2.7%,回收率在96.2%~106.9%。
+0.020 4,相关系数为0.992 6,检出限为0.038 μg/mL。方法应用于食品中MDA的测定,测定结果的RSD为1.5%~2.7%,回收率在96.2%~106.9%。杨秀军1,马 璐2,凌绍明3
(1.广西百色市粮油质量监督检验中心,广西 百色 533099;2.百色学院 预科教育学院,广西 百色 533099;3.百色学院 化学与环境工程,广西 百色 533099)
摘 要:在硫酸介质中,Fenton反应产生的羟基自由基使固绿褪色,丙二醛(MDA)对羟基自由基氧化固绿的反应具有抑制作用,据此提出了测定MDA含量的固绿褪色—分光光度法。在最优的实验条件下,方法的线性范围为0.083~3.33 μg/mL,回归方程为△A625nm=0.083 7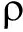 +0.020 4,相关系数为0.992 6,检出限为0.038 μg/mL。方法应用于食品中MDA的测定,测定结果的RSD为1.5%~2.7%,回收率在96.2%~106.9%。
+0.020 4,相关系数为0.992 6,检出限为0.038 μg/mL。方法应用于食品中MDA的测定,测定结果的RSD为1.5%~2.7%,回收率在96.2%~106.9%。
关键词:分光光度法;丙二醛;褪色反应;固绿
丙二醛(MDA)是脂质过氧化物的重要代谢产物,具有极强的生物活性,能够破坏生物大分子,对细胞具有严重的损伤作用[1],是一种衡量生物体内或食品中脂质过氧化程度的标志物;此外,丙二醛含量还与一些疾病如慢性胃炎、动脉硬化等有关联作用[2-3]。因此,建立一种准确、快速测定丙二醛的方法,对于了解生物体内脂质过氧化作用的程度以及研究某些疾病、药物或毒物的作用具有极为重要的意义。目前,丙二醛的检测方法主要有高效液相色谱法[4-5]、气相色谱—质谱法[6]、分光光度法[7]和荧光法[8]等。色谱法检出限低、灵敏度高,但前处理操作复杂,需要专人操作,检测成本较高。在酸性条件下,亚铁离子催化过氧化氢分解而产生高活性的羟基自由基的反应,通常称为Fenton反应[9]。Fenton反应产生的高活性羟基自由基具有较强的氧化能力,在有机染料废水处理工艺中有广泛的应用,基于Fenton反应的分光光度法具有较高的灵敏度而倍受关注[10-11]。本实验利用Fenton反应所产生的高活性羟基自由基能与固绿分子中的C=C和C=N基团发生氧化作用而使固绿体系发生褪色反应,而MDA对固绿体系褪色反应具有抑制作用,据此建立了一种测定MDA的分光光度法。
1.1 材料与试剂
面条:面条购自广西百色市东风菜市场某品牌清水面,规格为250 g。
100 μg /mL MDA标准储备液:用Eppendorf移液枪准确移取58 μL的1,1,3,3-四甲氧基丙烷(国药集团化学试剂有限公司生产,含量大于99.0%)溶于适量石英亚沸蒸馏水后转移至100 mL棕色容量瓶并定容,使用时稀释至25 μg /mL标准工作液浓度,4 ℃冰箱保存;固绿水溶液:120 μg /mL;硫酸亚铁水溶液:5.0 mmol/L(现配现用);过氧化氢水溶液:20 mmol/L(现配现用);硫酸水溶液:5.0 mmol/L;所用试剂为分析纯。
1.2 实验仪器
UV-2700型紫外分光光度计:日本岛津公司;L6S型紫外可见光分光光度计:上海仪表电分析仪器有限公司;HH-S2数显恒温水浴锅:江苏金坛市医疗仪器厂;ME204电子天平:梅特勒托利多(上海)仪器有限公司;SYZ-A型石英亚沸高纯水蒸馏器:常州国华电器有限公司。
1.3 实验方法
1.3.1 样品预处理
将面条磨成粉状,过100目筛后,准确称取100.0 g样品,用100 mL三氯乙酸混合液(75 g/L三氯乙酸和1.0g/L EDTA)震荡提取30 min,过滤,滤液于50 ℃下旋转浓缩至50 mL左右,用石英亚沸二次蒸馏水定容至100 mL,待测。
1.3.2 MDA的测定
在5.0 mL具塞刻度比色管中按顺序分别加入130 μL的120 μg /mL固绿水溶液,50 μL 5.0 mmol/L 硫酸亚铁溶液,一定量的样品待测液或MDA标准工作溶液,165 μL 20 mmol/L过氧化氢水溶液,175 μL 5.0 mmol/L硫酸水溶液,用石英亚沸蒸馏水定容至3.0 mL,震荡均匀,在40 ℃水浴中反应15 min后,用自来水流水冷却3 min,以试剂空白为参比,在波长625 nm处测定其吸光度,以不加丙二醛溶液作试剂空白,测定其吸光度Ab,计算ΔA=A-Ab值,利用线性方程式计算MDA含量。
1.3.3 单因素实验
硫酸用量对体系ΔA的影响:
根据1.3.2实验步骤,移取130 μL固绿水溶液、50 μL硫酸亚铁水溶液、200 μLMDA标准工作溶液、 165 μL过氧化氢水溶液,在反应温度40 ℃、反应时间15 min的条件下,考察硫酸的用量的影响。
硫酸亚铁用量对体系ΔA的影响:
根据1.3.2实验步骤,移取130 μL固绿、200 μL丙二醛标准工作溶液、165 μL过氧化氢水溶液、300 μL硫酸水溶液,在反应温度40 ℃、反应时间15 min的条件下,研究硫酸亚铁的用量对对体系的影响。
固绿用量对体系ΔA的影响:
根据1.3.2实验步骤,移取15 μL硫酸亚铁水溶液、200 μL丙二醛标准工作溶液、165 μL过氧化氢水溶液、300 μL硫酸水溶液,在反应温度40 ℃、反应时间15 min的条件下,考察固绿用量对体系的影响。
过氧化氢用量对体系ΔA的影响:
根据1.3.2实验步骤,移取130 μL固绿水溶液、15 μL硫酸亚铁水溶液、200 μL MDA标准工作溶液、300 μL硫酸水溶液,在反应温度40 ℃、反应时间15 min的条件下,考察过氧化氢用量对体系的影响。
反应温度对体系ΔA的影响:
根据1.3.2实验步骤,移取130 μL固绿水溶液、15 μL硫酸亚铁水溶液、200 μL MDA标准工作溶液、400 μL过氧化氢水溶液、300 μL硫酸水溶液,在反应时间15min条件下,考察温度对体系的影响。
反应时间对体系ΔA的影响:
根据1.3.2实验步骤,移取130 μL固绿、15 μL硫酸亚铁、200 μL丙二醛标准工作溶液、400 μL过氧化氢、300 μL硫酸水溶液,在反应温度40 ℃的条件下,考察反应时间对体系的影响。
2.1 吸收光谱
Fenton试剂也称芬顿试剂,是过氧化氢与亚铁离子组成的混合体系,该体系能产生高活性的自由基。固绿是一种酸性染料,其酸性水溶液在625 nm处有一最强吸收。实验发现,在硫酸介质中,Fenton反应产生的自由基能使固绿褪色,微量的MDA对自由基氧化固绿的反应具有抑制作用。按照实验方法,用分光光度计对不同浓度MDA的Fenton试剂—固绿—H2SO4体系进行扫描。图1结果表明,MDA浓度与体系的吸光度有线性关系。
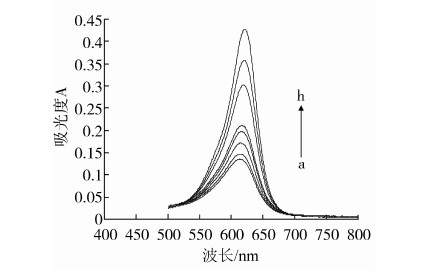
图1 吸收光谱图
注: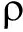 (FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,C(H2O2):2.67×10-3mol/L,50℃,9 min,
(FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,C(H2O2):2.67×10-3mol/L,50℃,9 min, (MDA)/ (μg·mL-1):a-0,b-0.0833,c-0.208,d-0.416,e-0.625,f-1.667,g-2.500,h-3.333
(MDA)/ (μg·mL-1):a-0,b-0.0833,c-0.208,d-0.416,e-0.625,f-1.667,g-2.500,h-3.333
2.2 单因素实验条件优化
2.2.1 硫酸用量的影响
Fenton反应体系需要在酸性介质中进行,为此实验选择硫酸为反应介质,并考察硫酸的用量的影响,结果见图2。
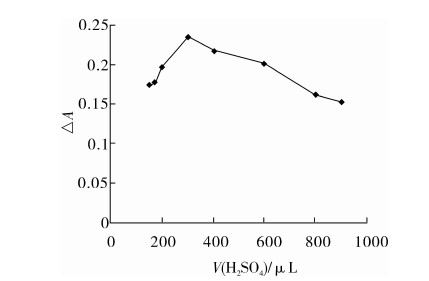
图2 硫酸用量的影响
注: (FG):5.2 μg/mL,C(FeSO4):8.3×10-2mmol/L,
(FG):5.2 μg/mL,C(FeSO4):8.3×10-2mmol/L, (MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
(MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
由图2可见,体系ΔA值随着硫酸水溶液用量的增加而增大,当硫酸水溶液用量为300 μL时,体系有最大ΔA值。这是因为硫酸用量不足时导致部分Fe3+水解为聚合态;硫酸用量过量时会抑制Fe3+还原,导致Fe2+活性不高[12]。因此,实验方法中5.0 mmol/L硫酸水溶液的用量为300 μL。
2.2.2 硫酸亚铁用量的影响
亚铁盐是Fenton反应体系中的重要组分,是过氧化氢分解的催化剂。实验以硫酸亚铁为催化剂,探讨研究硫酸亚铁的用量对体系的影响,结果见图3。
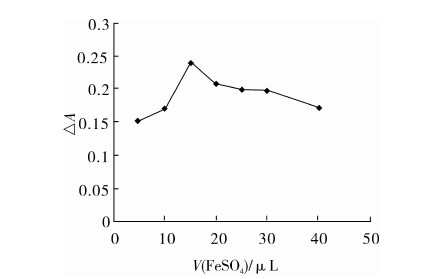
图3 硫酸亚铁用量的影响
注: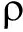 (FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,
(FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,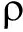 (MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
(MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
由图3可见,体系随着硫酸亚铁用量增加而增大,当硫酸亚铁的用量为15 μL时,体系的ΔA值最大。这是因为硫酸亚铁用量不足时链引发反应慢,产生的活性基团少;硫酸亚铁用量过大时会消耗过氧化氢和自由基,导致Fe2+活性降低。因此,实验方法中硫酸亚铁的用量为15 μL。
2.2.3 固绿用量的影响
固绿是测定反应体系的重要组分之一,实验考察了固绿用量对反应体系的影响,结果见图4。

图4 固绿用量的影响
注:C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,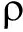 (MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
(MDA):1.67 μg/mL,C(H2O2):1.1 mmol/L,40 ℃,15 min
由图4可见,体系ΔA固绿的含量增加而增大,当固绿的用量增加为130 μL时,体系ΔA值最大。因此,实验方法中固绿的用量为130 μL。
2.2.4 过氧化氢用量的影响
过氧化氢分解产生羟基自由基,是Fenton反应体系中的重要组分。实验考察了过氧化氢用量对体系的影响,结果见图5。
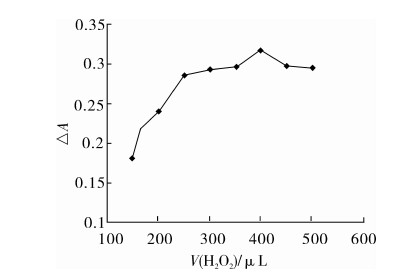
图5 过氧化氢用量的影响
注: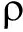 (FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,
(FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,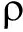 (MDA):1.67 μg/mL,40 ℃,15 min
(MDA):1.67 μg/mL,40 ℃,15 min
由图5可见,体系ΔA值随着过氧化氢用量的增加而增大,当过氧化氢的用量增加到400 μL时,体系ΔA值最大。因此,实验方法中过氧化氢的用量为400 μL。
2.2.5 反应温度的影响
体系温度对过氧化氢分解有促进作用。实验考察了温度对体系的影响,结果见图6。

图6 反应温度的影响
注: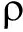 (FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,
(FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,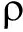 (MDA):1.67 μg/mL,C(H2O2):2.67 mmol/L,15 min
(MDA):1.67 μg/mL,C(H2O2):2.67 mmol/L,15 min
由图6可见,体系ΔA值随着反应温度升高而增大,当反应温度为50 ℃时,体系的ΔA值最大。因此,实验方法选用反应温度为50 ℃。
2.2.6 反应时间的影响
反应时间对反应体系影响较为明显,实验考察了反应时间对体系的影响,结果见图7。

图7 反应时间的影响
注: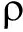 (FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,
(FG):5.2 μg/mL,C(H2SO4):0.5 mmol/L,C(FeSO4):2.5×10-2mmol/L,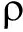 (MDA):1.67 μg/mL,C(H2O2):2.67 mmol/L,50 ℃
(MDA):1.67 μg/mL,C(H2O2):2.67 mmol/L,50 ℃
由图7可见,体系ΔA随着反应时间增加而增大,当反应时间为9 min时体系ΔA值最大。因此,选用的实验时间为9 min。
2.3 共存物质得影响
按照1.3.2实验方法考察了共存物质对测定0.9 μg/mL MDA的影响情况。结果发现910 μg/mL K+、900 μg/mL Na+、850 μg/mL NH4+、600 μg/mL Ca2+、500 μg/mL Mg2+、800 μg/mL PO43-、850 μg/mL SO42-、500 μg/mL CO32-不干扰测定。可见,方法具有较好的选择性。
2.4 线性方程
按照1.3.2实验方法,在反应体系中分别加入丙二醛标准工作液0、10、25、50、75、200、300、400 μL于5.0 mL具塞刻度试管中,用水定溶至3.0 mL,反应9 min后冷却,测定625 nm波长下的吸光度。以吸光度变化值△A(△A=A-Ab)对丙二醛质量浓度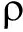 绘制工作曲线,得到回归线性方程为:△A=0.083 7
绘制工作曲线,得到回归线性方程为:△A=0.083 7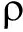 +0.020 4,相关系数(R2)为0.992 6,线性范围为0.083~3.33 μg/mL;检出限为0.038 μg/mL。
+0.020 4,相关系数(R2)为0.992 6,线性范围为0.083~3.33 μg/mL;检出限为0.038 μg/mL。
2.5 分析应用
取适量已处理过的待测液,按照1.3.2实验方法进行测定,实验结果见表1。
表1 面条中丙二醛含量及加标回收实验结果

根据丙二醛对Fenten试剂氧化固绿的反应具有抑制作用原理,建立了固绿褪色分光光度法测定面条中微量丙二醛的方法。方法具有操作简便、灵敏度较高、线性范围较宽、稳定性和选择性较好等优点,能满足食品中丙二醛含量分析要求。
参考文献:
[1]LI S J,KING A J.Structural changes of rabbit myosin subfragment altered by malonaldehyde,a byproduct of lipid oxidation[J].J Agric Food Chem,1999,47(8):3124-3129.
[2] KISHIDA E,KAMURA A,TOKUMARU S,et al. Re-evaluation of malondialdehyde and thiobarbituric acid-reactive substances as indices of autoxidation based on oxygen consumption[J].J Agric Food Chem,1993,41:1-6.
[3]PIKUL J,LESZCZYNSKI D E,KUMMEROW F A. Evaluation of three modified TBA methods for measuring lipid oxidation in chicken meat = Evaluation de trois méthodes modifiées à l'acide thiobarbiturique pour mesurer l'oxydation des lipides dans la viande de poulet[J]. J Agric Food Chem.1989,37:1309-1313.
[4]余巍,赵永锋,吴玉杰,等. 高效液相色谱法测定食品中丙二醛[J].分析实验室,2014,33(4):445-447.
[5]朱洪亮,葛芳芳,管佳丽. 高效液相色谱法检测食用油中的丙二醛[J]. 食品工业科技,2015,36(1):309-310.
[6]蒋小华,谢运昌,李娟,等.气相色谱-质谱法测定大鼠血浆和肝匀浆中丙二醛含量[J]. 理化检验(化学分册),2013,49(5):573-576.[7]高俊,陈季旺,周琦,等. 挂面中丙二醛含量测定方法的研究[J]. 中国粮油学报,2012,27(3):115-119.
[8]刘彬,齐云,李蒙,等. 分光光度法与荧光法测定肝组织丙二醛含量的比较研究[J]. 中国药理学通报,2010,26(12):1674-1677.[9]王亚深,谷麟,王妙琳,等. Fenton法制备污泥基活性炭及其性能表征[J]. 环境污染与防治,2014,36(8):43-48.
[10]凌绍明,欧阳辉祥,黄宝敬. 基于固绿褪色反应的分光光度法测定双酚A的含量[J]. 理化检验(化学分册),2016,52(6):625-628.[11]谢宇奇,凌绍明,农丽梅. 亚甲基蓝-Fenton体系光度法测定食品中没食子酸丙酯的含量[J]. 中国食品添加剂,2016(2):141-145.
[12]Yukio M,Toshiki M,Masahiro K,et al. Kinetic analysis of the Fenton reaction by ESR-SPIN trapping[J]. Biochem Mol Biol Int,1997,3(5):1107-1110.●完
Determination of malondialdehyde in food by color-fading reaction of fast green- spectrophotometry
YANG Xiu-jun1,MA Lu2,LING Shao-ming3
(1. Baise Grain and Oil Quality Supervision and Inspection Center, Baise Guangxi 533099;2. College of Preparatory Courses,Baise University,Baise Guangxi 533099;3. College of Chemical and Environmental Engineering, Baise University, Baise Guangxi 533099)
Abstract:In sulfuric acid solution,Fenton reaction was used to produce hydroxyl radical to discolor fast green. But malondialdehyde(MDA) could inhibit the oxidation of hydroxyl radical on fast green. Based on this fact,spectrophotometric method for determination of MDA by color-fading of fast green was proposed. In the optimal experimental conditions, in the linearity range of 0.083 μg/mL~3.33 μg/mL, the regression equation was △A625nm=0.083 7ρ+0.020 4,with correlation coefficient of 0.992 6 and detection limit of 0.038 μg/mL. For the determination of MDA in foods,this method presented RSD of 1.5%~2.7% and recovery of 96.2%~106.9%.
Key words:spectrophotometry;malondialdehyde;color-fading reaction;fast green
收稿日期:2017-02-16
作者简介:杨秀军,1975年出生,男,工程师.
通讯作者:凌绍明,1963年出生,男,教授.
中图分类号:TS 207.3
文献标识码:A
文章编号:1007-7561(2017)03-0061-04