 95%)。市售的大米粉碎后过60目筛(过筛率
95%)。市售的大米粉碎后过60目筛(过筛率 95%)。分别于4 ℃密封保存备用。
95%)。分别于4 ℃密封保存备用。陈 雪1,2,刘 明1,2, 汪丽萍2, 谭 斌2,刘艳香1,2, 吴娜娜2,于国萍1
(1.东北农业大学食品学院,哈尔滨 150030;2.国家粮食局科学研究院,北京 100037)
摘 要:建立柱前在线衍生—高效液相色谱法(HPLC)测定发芽糙米中γ-氨基丁酸(GABA)含量的方法。样品以料液比1:5、超声功率(占总功率)60%、在30 ℃下超声30 min,提取2次。衍生试剂OPA与样品在线混合10次、衍生2 min,用Agilent Eclipse Plus C18柱分离(流速1 mL/min,检测波长338 nm,柱温40 ℃)。GABA在5~50 mg/L范围内呈良好线性关系,相关系数大于0.999 0;最低检出限0.33 mg/L,最低定量限1 mg/L,方法添加回收率94.80%~98.40%,RSD为1.82%~2.58%。该方法简单快速、灵敏度高、精确,适合发芽糙米中GABA的检测。
关键词:在线衍生;高效液相色谱法;发芽糙米;γ-氨基丁酸
γ-氨基丁酸(GABA)是一种非蛋白质氨基酸,对哺乳动物中枢神经系统中的神经传达具有重要的抑制性作用[1]。研究表明,GABA具有降血压[2]、安定精神[3]、改善肝和肾机能[4]、促进酒精代谢、消臭及减肥等活性[5]。糙米发芽时内源酶激活被释放,产生GABA,是一种安全、健康的生物法合成GABA的过程[6]。进入21世纪以来,国内发芽糙米产业正在蓬勃发展,国内很多企业都在生产发芽糙米及其制品。国内外关于发芽糙米中GABA的测定方法有很多,主要有液质联用法、氨基酸自动分析仪法、纸层析法、比色法、毛细管电泳法、高效液相色谱法等[7]。其中液质联用法、氨基酸自动分析法价格昂贵,限制了其使用;纸层析法精准度低;比色法测定精度低,易受干扰、相对误差较大;毛细管电泳法操作过程复杂;高效液相色谱法因准确、高效而被广泛应用。但由于GABA本身对紫外光吸收小,需经衍生化后才可检测到。目前所用衍生试剂主要有苯二醛-2-巯基乙醇[8]、丹磺酰氯[9]、2,4,6-三硝基苯磺酸[10]、9-芴基甲基氯甲酸酯[11]以及邻苯二甲醛[12](OPA)等,其中邻苯二甲醛具有价格便宜、衍生时间短、简单易操作等优点作为本实验的衍生试剂。但OPA的衍生产物不稳定、需快速进样[13],柱前衍生法存在过多的人为因素不能严格控制衍生时间;柱后衍生法对设备要求高且需配置特殊装置;在线自动化衍生即采用自动进样器完成OPA在线衍生后直接进样测定,它可提高分析效率、减少误差、无需特殊装置,适宜作为测定方法推广应用。本研究在高效液相色谱法的基础上,优化超声前处理条件,建立OPA柱前在线衍生法,旨在快速、准确、简便检测GABA含量[14],为发芽糙米国家标准的制定提供支撑。
1.1 材料与试剂
稻谷:分别购于广东、湖北、江苏、湖南、陕西和黑龙江省等地;市售大米:安徽籼米;γ-氨基丁酸标准品(纯度≥99%):sigma试剂公司;超纯水:自制;结晶乙酸钠、临苯二甲醛、四氢呋喃、三乙胺、巯基乙醇、硼酸、醋酸、乙醇、氢氧化钠,均为分析纯,乙腈、甲醇(色谱级):北京瑞泽康生物科技有限公司。
1.2 仪器与设备
YQLQ-40型谷物筛选去石组合机:山东汶上凯华机械有限公司;LM400-3G垄谷脱壳糙米机:山东汶上凯华机械有限公司;PRX-350B智能人工气候箱:宁波海曙赛福实验仪器厂;DGG-9240B电热恒温鼓风干燥箱:上海森信实验仪器有限公司;FW177中草药粉碎机:天津市泰斯特仪器有限公司;安捷伦 1260 高效液相色谱仪:美国安捷伦公司;SC-3610低速离心机:安徽中科中佳科学仪器有限公司;SB 25-12 DTDN超声波清洗机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 原料粉的制备
稻谷经去石、垄谷得到糙米。筛选糙米,除去碎米及发霉米,用蒸馏水清洗3次,在30 ℃下浸泡6 h后,均匀摊于铺有4层纱布的浅盘中,加水,盖湿纱布于温度30 ℃、湿度95%下发芽,24 h后40 ℃鼓风干燥使水分小于13%,粉碎后过60目筛(过筛率 95%)。市售的大米粉碎后过60目筛(过筛率
95%)。市售的大米粉碎后过60目筛(过筛率 95%)。分别于4 ℃密封保存备用。
95%)。分别于4 ℃密封保存备用。
1.3.2 溶液的制备方法
衍生试剂的制备:称取0.1 g邻苯二醛(OPA),用1 mL乙腈溶解,加130 μL巯基乙醇,用0.4 mol/L的硼酸缓冲液定溶至10 mL,过0.22 μm滤膜备用。
GABA标准溶液的制备:准确称取0.05 g γ-氨基丁酸标准品(准确至0.000 1g),用水溶解定容至100 mL,得到浓度为0.5 mg/mL的标准溶液,待用。
1.3.3 样品前处理
准确称取1 g(精确至0.00 1 g)原料粉至25 mL试管中,加入60%(V/V)的乙醇溶液,摇匀后,盖好盖子,置于超声波清洗机中,用1种发芽糙米(湖南2014籼)分别考察料液比、超声功率、超声温度、超声时间、提取次数对GABA含量的影响,然后以4 000 r/min的转速离心10 min,取上清液,过0.22 μm滤膜备用。
1.3.4 HPLC测定GABA[15]
色谱条件:色谱柱为C18柱(4.6 mm × 100 mm,3.5 μm)。流动相:流动相A是乙酸钠溶液加三乙胺,用醋酸调pH值至7.2±0.02后加入四氢呋喃,混合后过滤;流动相B为乙酸钠溶液,用醋酸调pH值至7.2±0.02后,再按V(乙酸钠溶液)∶V(乙腈)∶V(甲醇)=1∶2∶2混合后过滤。流速为1 mL/min,梯度洗脱条件如表1所示,紫外检测波长338 nm,柱温40 ℃。自动进样器在线衍生程序为样品瓶1中抽取5 μL,样品中抽取5 μL,在空气中最大速度混合后等待进样。
表1 梯度洗脱表

1.3.5 GABA标准曲线的制作
分别移取0.5 mg/mL GABA标准溶液0.02、0.04、0.08、0.16、0.2 mL于2 mL离心管中,加超纯水稀释至刻度,摇匀,得5个浓度系列的GABA标准品溶液,过0.22 μm滤膜备用。用安捷伦 1260 高效液相色谱仪按1.3.4中的色谱条件进行测定。以GABA标准品浓度为横坐标,峰面积为纵坐标,制作标准曲线。
1.3.6 回收率实验
以大米粉为基质,进行3个质量浓度水平的加标回收实验,经1.3.3处理后在1.3.4中的色谱条件下测定GABA的含量,每个质量浓度重复实验3次,用外标法计算测定值,通过比较测定值与理论值,计算回收率。
1.3.7 实际样品检测
分别取广东、湖北、江苏、黑龙江、陕西几大地区的几种发芽糙米样品,每个样品取3份,经1.3.3处理后在1.3.4中的色谱条件下测定GABA的含量。
1.3.8 统计学分析
实验数据以平均值±标准差(Mean±SD)表示。采用 Microsoft Office Excel 2007 数据分析工具进行处理,并用 SPSS检验各处理平均数之间的差异显著性(P<0.05)。
2.1 GABA标准品及发芽糙米样品色谱图
在1.3.4中的色谱条件下,衍生的标样和发芽糙米样品组分得到了有效的分离。如图1,GABA的保留时间为 16.9 min左右,色谱峰分离度高,无拖尾,峰形左右对称,在发芽糙米样品中也能达到较好的分离效果。
2.2 GABA测定的标准曲线
以GABA标准品浓度为横坐标,峰面积为纵坐标,制得的GABA标准曲线。如图2,当GABA在5~50 mg/L范围时,进样浓度与峰面积呈良好的线性关系,相关系数R2为0.999 5,回归方程Y=8 737.6X-1.866。以3倍噪音所相当的待测物质的浓度作为方法的检出限,计算最低检出限质量浓度(LOD)为0.33 mg/L;以10倍噪音所相当的待测物质的浓度作为方法的定量限,计算最低定量限质量浓度为1 mg/L。可见本法LOD略优于超高效液相色谱法LOD[16](0.5 mg/L)及文献报道的HPLC法和Berthelot比色法测定发芽糙米中γ-氨基丁酸的含量的LOD(35 μg/mL 和60 μg/mL)。
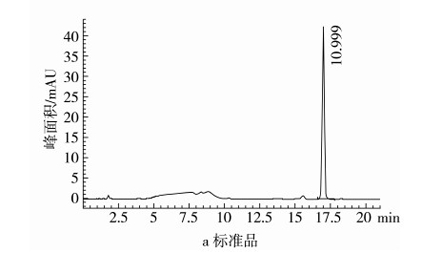
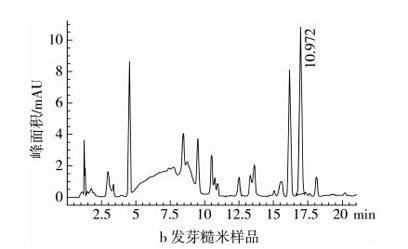
图1 GABA衍生物的HPLC图
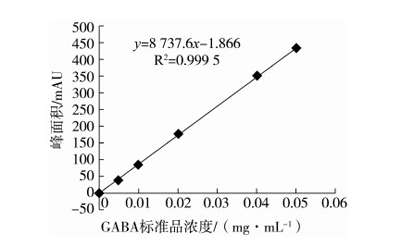
图2 GABA标准曲线
2.3 在线衍生条件优化
2.3.1 在线混合次数的影响
取0.05 mg/mL GABA标准溶液5 μL与衍生试剂5 μL,分别在线混合0、5、10、15、20次后等待2 min后进样,按1.3.4进行测定,记录峰面积,每种条件重复实验3次。结果见图3,可以看出标准品在混合10次后进样检测峰面积最大,当0、5次时可能混合不充分,导致峰面积明显低于混合10次及以上。混合10、15、20次峰面积差异不显著,混合10次可在短时间内达到最佳效果。因此,选择在线混合次数10次。
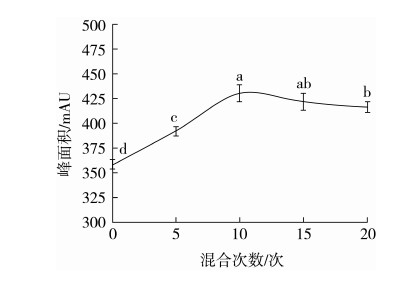
图3 不同混合次数下GABA的含量(n=3)
2.3.2 在线衍生时间的影响
取0.05 mg/mL GABA标准溶液5 μL与衍生试剂5 μL,在线混合10次后分别等待0、2、4、8、16 min后进样,在1.3.4中的色谱条件下测定,记录峰面积,每种条件重复实验3次。结果见图4,可以看出标准品在线衍生2 min后进样检测峰面积最大,不同在线衍生时间下峰面积差异显著(P<0.05)。因此,选择在线衍生时间2 min。这与胡春苗等人[16]得出的最佳衍生时间结果一致。
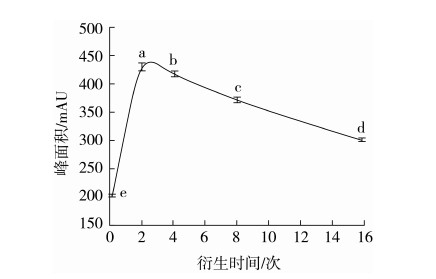
图4 不同衍生时间下GABA的含量(n=3)
2.4 前处理条件优化
2.4.1 料液比的影响
将料液比设定为1∶2、1∶5、1∶10、1∶15、1∶20,按1.3.3中方法提取发芽糙米中GABA,在1.3.4中的色谱条件下测定其含量,每种条件重复实验3次。结果见图5。当料液比为1∶5、1∶10时,GABA的测定值明显高于1∶2、1∶15、1∶20时的含量。溶剂过少时导致提取液浓度较高,固液两相浓度梯度小,使GABA不能完全溶出。随着料液比的增大,固液两相浓度梯度増大,GABA逐渐溶出、提取率不断增加,GABA含量不断增大;料液比1∶5时,GABA的测定值最高,含量为13.58 mg/100 g,且误差线较小(RSD=1.59%)。当料液比达到1∶10时,进一步增加溶剂的量,可能会溶解更多发芽糙米中其他的物质,妨碍GABA的提取分离,导致GABA的含量下降。而溶剂过多导致提取液浓度较低,不利于后续HPLC检测,增大测定结果的误差。同时也会造成资源浪费。因此,料液比选用1∶5。
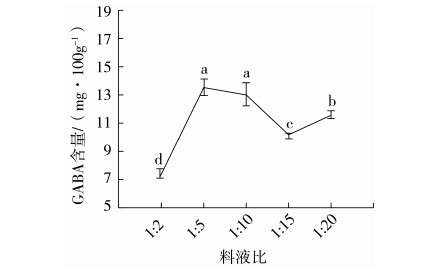
图5 不同料液比下GABA的含量(n=3)
2.4.2 超声功率的影响
将超声功率设定为总功率的40%、50%、60%、70%、80%、90%、100%,按1.3.3中方法提取发芽糙米中GABA,在1.3.4中的色谱条件下测定GABA含量,每种条件重复实验3次。结果见图6。当超声功率从40%增加到60%时,GABA含量有显著增加;继续提高超声功率GABA含量有显著降低。分析其原因,超声存在“空化”效应。在一定范围内,超声功率越大空化作用越明显,提取效果越好;但功率增加到一定程度就会出现饱和现象,提取效果反而下降。当超声提取的超声功率为总功率的60%时,提取效果最好,GABA含量最高。因此,超声功率选为总功率的60%。
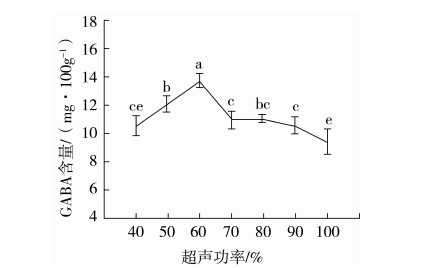
图6 不同超声功率下GABA的含量(n=3)
2.4.3 超声温度的影响
将提取温度设定为20、30、40、50、60 ℃,按1.3.3中方法提取发芽糙米中GABA,在1.3.4中的色谱条件下测定GABA的含量,每种条件重复实验3次。结果见图7。当提取温度从 20 ℃增加到30 ℃时,GABA含量随着温度的升高而升高,在 30 ℃时达到最大值;温度进一步升高,GABA含量下降。温度不断升高会使GABA的溶解度和扩散系数增加,进而检测出的GABA含量高。当温度达到30 ℃时,进一步提高温度可能会导致GABA分解损失或其他成分溶解,影响GABA的测定,引起GABA含量降低。当超声提取的超声温度为30 ℃,GABA含量最高。因此,超声温度选为30 ℃。本结果与刘振春等人[18]得到的超声温度50 ℃时GABA提取量最高不一致。

图7 不同超声温度下GABA的含量(n=3)
2.4.4 超声时间的影响
将提取时间设定为10、20、30、40、50 min,按1.3.3中方法提取发芽糙米中GABA,在1.3.4中的色谱条件下测定GABA的含量,每种条件重复实验3次。结果见图8。当超声时间10~30 min 时,GABA含量随着提取时间的延长而增加,提取时间为30 min GABA含量达到最大,此后随着时间的延长GABA的含量稍有下降。可能是超声存在热效应和较强的机械剪切作用,长时间处理会使热敏感组分降解甚至会使GABA的结构破坏,导致GABA的含量有所下降。因此,本实验选择超声时间为30 min。

图8 不同超声时间下GABA的含量(n=3)
2.4.5 提取次数的影响
按1.3.3中方法提取发芽糙米中GABA,分别提取1、2、3、4、5次后在1.3.4中的色谱条件下测定GABA的含量,每种条件重复实验3次。结果见图9。当提取次数低于2次时,GABA的测定值较低(13.28 mg/100 g);当提取次数为2次时,GABA的测定值较高(13.95 mg/100 g);超过2次时,GABA的测定值为14.18~14.31 mg/100 g,与提取2次时无显著差异。相比之下,提取3次会延长时间,使前处理操作更复杂,同时溶剂体积增大会造成资源浪费且GABA的浓度降低影响HPLC分析。因此,选择提取2次。另外,本实验不同提取次数下GABA含量RSD均小于5%(2.7%~4.86%),说明提取工艺较稳定。
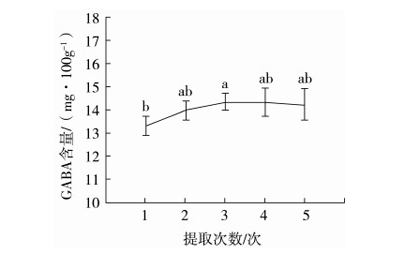
图9 不同提取次数下GABA的含量(n=3)
2.5 回收率实验
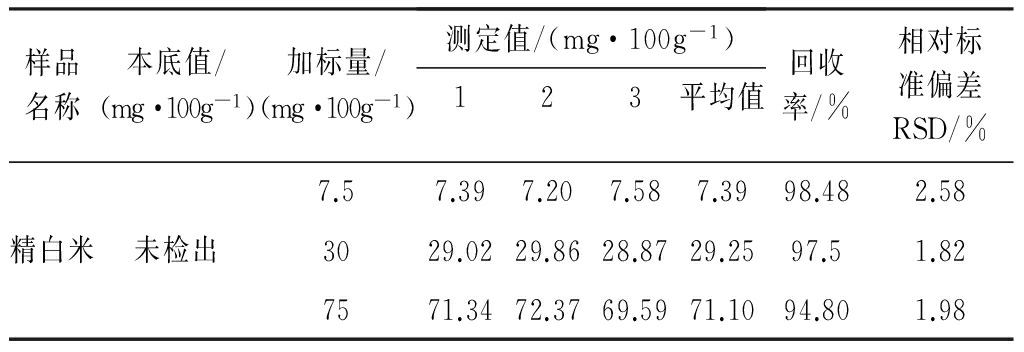
由表2可知,3种加量的回收率分别为98.48%、97.50%、94.80%,平均回收率96.93%,回收率良好。与王丽群[19]等人采用的柱后衍生法回收率(97.7%)相差不大。
表2 回收率实验结果
2.6 实际样品检测
用上述方法对几种发芽糙米样品的GABA含量进行检测,结果如图10,不同来源、不同年份、粳稻、籼稻、糯稻发芽糙米之间GABA含量差异显著(P<0.05)。其中GABA含量最高的品种是湖北15糯稻。表明本实验采用的高效液相色谱方法测定不同发芽糙米原料均能够较好的区分GABA的含量,因此可检测不同发芽糙米及其产品中 GABA 含量,建议制定为发芽糙米GABA检测国家标准方法。
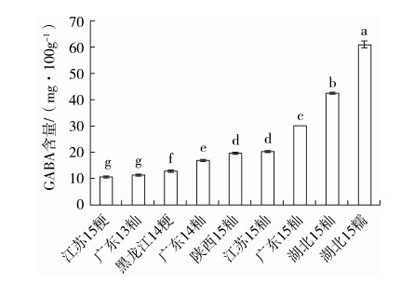
图10 不同品种发芽糙米中GABA含量(n=3)
用柱前在线衍生-HPLC法测定发芽糙米中的γ-氨基丁酸,样品以1∶5的料液比、超声功率(占总功率)60%、30 ℃下超声30 min,提取2次。衍生试剂OPA与样品在线混合10次、衍生2 min后,在Agilent Eclipse Plus C18色谱柱上分离(流速1 mL/min,检测波长338 nm,柱温40 ℃)。
GABA的保留时间为16.9左右,发芽糙米样品中的GABA和相邻的物质达到基线分离。GABA在5~50 mg/L范围线性关系良好(R2=0.999 5),最低检出限为0.33 mg/L,最低定量限为1mg/L;平均回收率为96.93%(RSD=2.13%),重现性、精密度良好。
该方法简单快速、灵敏度高、可精确测定发芽糙米中GABA含量,检测不同发芽糙米样品,满足日常分析需求。
参考文献:
[1]Chebib M, Johnston G A R. The ‘ABC’ of GABA receptors: A brief review[J]. Clinical & Experimental Pharmacology & Physiology, 1999, 26(11):937-940.
[2]Matsuo A, Sato K, Park E Y, et al. Control of amylase and protease activities in a phytase preparation by ampholyte-free preparative isoelectric focusing for unrefined cereal-containing bread[J]. Journal of Functional Foods, 2012, 4(2):513-519.
[3]Kim H. Functional foods and the biomedicalisation of everyday life: a case of germinated brown rice[J]. Sociology of Health & Illness, 2012, 35(6):842-857.
[4]Al-Wadei H A N, Ullah M F, Mohammed Al-Wadei ?. GABA (γ-aminobutyric acid), a non-protein amino acid counters the β-adrenergic cascade-activated oncogenic signaling in pancreatic cancer: A review of experimental evidence[J]. Molecular Nutrition & Food Research, 2011, 55(12):1745-1758.
[5]Xie Z, Xia S, Le G W. Gamma-aminobutyric acid improves oxidative stress and function of the thyroid in high-fat diet fed mice[J]. Journal of Functional Foods, 2014, 8(1):76-86.
[6]Zhang Q, Xiang J, Zhang L, et al. Optimizing soaking and germination conditions to improve gamma-aminobutyric acid content in japonica and indica germinated brown rice[J]. Journal of Functional Foods, 2014, 10(10):283-291.
[7]刘红梅, 魏淘涛, 刘行丹,等. 发芽糙米γ-氨基丁酸的检测及研究进展[J]. 作物研究, 2012, 26(1):88-92.
[8]Lee B J, Kim J S, Kang Y M, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis, BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1):271-276.
[9]Mazur R, Kovalovská K, Hudec J. Changes in selectivity of gamma-aminobutyric acid formation effected by fermentation conditions and microorganisms resources.[J]. Journal of Microbiology Biotechnology & Food Sciences, 2011, 1(2):164-171.
[10]Clarke G, O'Mahony S, Malone G, et al. An isocratic high performance liquid chromatography method for the determination of GABA and glutamate in discrete regions of the rodent brain[J]. Journal of Neuroscience Methods, 2007, 160(160):223-30.
[11]Roohinejad S, Omidizadeh A, Mirhosseini H, et al. Effect of hypocholesterolemic properties of brown rice varieties containing different gamma aminobutyric acid (GABA) levels on Sprague-Dawley male rats.[J]. Journal of Food Agriculture & Environment, 2009, 7(3&4):197-203.
[12]Youn Y S, Park J K, Jang H D, et al. Sequential hydration with anaerobic and heat treatment increases GABA (γ-aminobutyric acid) content in wheat[J]. Food Chemistry, 2012, 129(4):1631-1635.[13]邵金良, 杨东顺, 樊建麟,等. DABS-Cl柱前衍生-HPLC测定稻米中γ-氨基丁酸方法优化[J]. 作物杂志, 2016(1):135-140.
[14]杨晶晶, 曲媛, 崔秀明. γ-氨基丁酸的制备方法与含量测定研究进展[J]. 食品工业科技, 2014, 35(3):351-356.
[15]QB/T 4587—2013,中华人民共和国轻工行业标准[S].
[16]胡春苗, 陈丽娟, 谭亚玲. 超高效液相色谱法测定发芽糙米中γ-氨基丁酸含量[J]. 中国农学通报, 2016(8):50-53.
[17]石林娟, 曹磊, 宋玉,等. HPLC法和Berthelot比色法测定发芽糙米中γ-氨基丁酸的含量[J]. 粮食与饲料工业, 2015(1):61-65
[18]刘振春, 徐祎博, 孙江,等. 超声波辅助提取发芽糙米γ-氨基丁酸工艺[J]. 西北农林科技大学学报(自然科学版), 2016(2):201-206.
[19]王丽群, 潘媛媛, 孟庆虹,等. 基于柱后衍生发芽糙米中γ-氨基丁酸HPLC检测方法的建立及应用[J]. 中国酿造, 2016, 35(2):144-147.●完
Determination of γ-aminobutyric acid in germinated brown rice by online pre-column derivatization combined with HPLC
CHEN Xue1,2,LIU Ming1,2,WANG Li-ping2,TAN Bin2,LIU Yan-xiang1,2,WU Na-na2,YU Guo-ping1
(1.College of Food, Northeast Agricultural University, Harbin Heilongjiang 150030;2.Academy of State Administration of Grain, Beijing 100037)
Abstract:A HPLC method with online pre-column derivatization for determination of γ-amino butyric acid (GABA) in germinated brown rice was established. The germinated brown rice sample was extracted two times by ratio of solid to liquid 1∶5, ultrasonic power account for 60% of total power, at 30 ℃ for 30 min. Online pre-column derivation 2 min were reacted by using orthophthalaldehyde (OPA) derived reagents and sample after mixing 10 times. The sample was separated on an Agilent Eclipse Plus C18 column(at 1.0 mL/min, 338 nm and 40 ℃).Good linearity was observed in the range of 5~50 mg/L with the correlation coefficient>0.999 0; minimum detection limit 0.33 mg/L, minimum quantitative detection limit of 1mg/L, fortified recovery 94.80%~98.40%, RSD 1.82%~2.58%. The proposed method is simple, rapid, sensitive, accurate and suitable for the detection of GABA in germinated brown rice.
Key words:online derivatization; high performance liquid chromatography; germinated brown rice; γ-aminobutyric acid
收稿日期:2016-08-15
作者简介:陈雪,1993年出生,女,硕士研究生.
通讯作者:谭斌,1972年出生,男,博士,研究员.
中图分类号:TS 213.3
文献标识码:A
文章编号:1007-7561(2017)03-0048-06