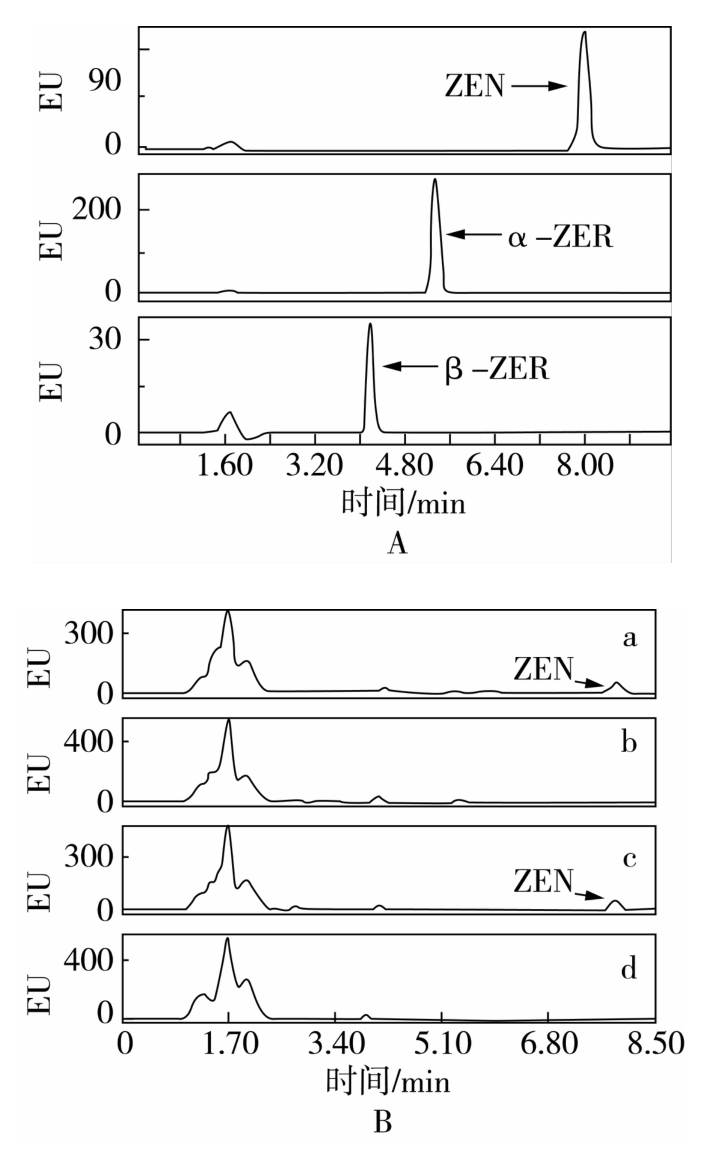
图1 不同样品的HPLC图
注:A,ZEN标品及其衍生物α-ZER和β-ZER;B(a),Fu2-3脱毒前;B(b),Fu2-3脱毒后;B(c),Fu41-3脱毒前;B(d),Fu41-3脱毒后。
张 倩1,2,熊 犍1,赵 晨2,汪 洋2,张晓琳2
(1.华南理工大学食品科学与工程学院,广东广州 510641;2.国家粮食局科学研究院,北京 100037)
摘 要:为筛选高效脱除玉米赤霉烯酮(Zearalenone,ZEN)的脱毒菌株,利用96孔板高通量筛选法,从135份赤霉病高发区域土壤样品中成功筛选出具有较强ZEN清除作用的两株芽孢杆菌Fu2-3和Fu41-3。经16S rRNA序列分析,菌株Fu2-3和Fu41-3分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和特基拉芽孢杆菌(Bacillus tequilensis)。对其降解机理的初步研究表明,两株菌对ZEN均具有一定程度的吸附作用,但主要脱毒作用仍为生物的降解作用。BLYES法研究结果表明,菌株Fu41-3的脱毒体系中仍具有较大雌激素毒性,菌株Fu2-3脱毒体系无雌激素响应,该菌可将ZEN转化为雌激素含量极低的代谢产物,脱毒效果更佳。筛选获得了两株ZEN降解芽孢杆菌,为ZEN的生物脱毒提供了一定的理论依据。
关键词:玉米赤霉烯酮;芽孢杆菌;生物脱毒
玉米赤霉烯酮(Zearalenone,ZEN),即6-(10-羟基-6-氧基-1-碳稀基)-β-雷锁酸内酯,是由镰刀菌属(Fusarium)产生的一种非甾体类雌激素毒素。ZEN主要存在于霉变的玉米、高粱、小麦、燕麦等谷类作物的籽粒及奶类中,是农副产品中污染范围最广的真菌毒素[1]。ZEN具有较强的生殖发育毒性,动物长期摄入会出现流产、死胎等问题;此外,该毒素还具有致癌性、肝肾毒性、血液毒性、免疫毒性和遗传毒性[2-4]。ZEN不仅影响食物安全,而且可以通过食物链在动物体或人体中造成蓄积,进而危害人和动物健康。因此,解决其对粮食和饲料的污染问题,对改善动物生产性能、提高人类食品安全有非常重要的意义。
ZEN的脱毒方法主要有物理法、化学法和生物法。生物脱毒法是指微生物产生的次级代谢产物或所分泌的酶分解、破坏毒素分子,产生无毒或低毒的降解产物[5],生物脱毒法专一性强,所需成本相对较低,且对谷类作物营养成分造成的损失少,相对其它脱毒方法而言,生物脱毒法具有更高的安全性和可实用性。研究发现,很多微生物都有降解ZEN的能力,如乳酸菌属[6]、芽孢杆菌属[7]、不动杆菌属[8]、红球菌属[9]等;一些有益微生物如瘤胃中的假单胞菌属TH-N1[10]、粘膜乳杆菌Im4208[11]及白蚁肠道中的毛孢子菌属新酵母菌(Trichosporon mycotoxinivorans)[12]也具有良好的降解能力。但微生物在降解ZEN的过程中可能产生其它具有雌激素毒性的代谢产物,如α-玉米赤霉醇(α-ZER)、β-玉米赤霉醇(β-ZER)等,进而不能起到真正的脱毒作用。因此,如何有效筛选ZEN降解菌,得到将ZEN降解成无雌激素毒性或低雌激素毒性降解产物的微生物,对ZEN的生物防治具有重大指导意义。
BLYES法由Sayler等人在2005年首次提出,是一种能够高效、快速、灵敏地检测样品中所有雌激素类物质含量的方法[13]。该方法是在酵母雌激素筛查法(Yeast Estrogen Screen,YES)的基础上发展起来的,利用雌激素类物质与酵母细胞内人类雌激素受体结合,诱导酵母细胞相关基因表达,产生荧光,且在一定雌激素浓度范围内,体系中雌激素物质含量与发光量成正比,从而达到准确定量的目的。近年来,BLYES法逐渐应用于饮用水、工业废水或其它水体的雌激素物质检测中[14-15],在打印纸双酚A类物质[16]检测及印刷电路板多氯联苯类物质检测[17]等方面也有一定应用,但极少用于ZEN脱毒菌株的筛选验证。生物降解ZEN因其降解产物未知、多样,用一般化学方法或免疫化学方法无法准确得知降解产物结构及其雌激素毒性,BLYES法对所有雌激素类物质都具有极强的信号感应,能高效灵敏地检测出不同微生物ZEN降解产物的总雌激素毒性,可用于对ZEN脱毒菌株代谢产物的雌激素毒性验证,准确排除假阳性降解菌,是目前ZEN降解菌株筛选验证的一种新兴方法。
本研究利用HPLC法与BLYES法相结合,从江浙地区的135份土壤样品中筛选具有高效清除ZEN能力的芽孢杆菌,探究其脱毒体系有无雌激素响应。对菌株进行分子生物学鉴定,并对其清除ZEN的特性进行初步研究,为ZEN的生物脱毒及应用奠定了理论基础。
1.1 实验材料
土壤样品:采自江苏、浙江等赤霉病高发地区,共135份。
LB培养基:每升培养基含酵母浸粉5 g,蛋白胨10 g,NaCl 10 g,琼脂20 g,pH 7.0~7.2。
色谱纯乙腈、甲醇:Dikma;ZEN标准品:Sigma。
高压细胞破碎仪(TS2/40/AA/AA):英国Constant Systems公司;高效液相色谱仪(Waters515/717/474):美国Waters公司;微孔板读数仪(Synergy HT):美国Biotek公司。
1.2 实验方法
1.2.1 ZEN脱毒菌株的筛选
96孔板高通量法筛选ZEN脱毒菌株:土样中加入适量无菌水后用均质机进行均质,均质完成后,静置30 min,取上清液80℃水浴1 h,10%接种量接种至含10 μg/mL ZEN的LB培养基中,37℃,200 r/min条件下培养48 h,以10%接种量转接至ZEN终浓度为15 μg/mL的培养基中继续培养,培养好的菌液逐级转接并增加96孔板中ZEN浓度(30、50、80 μg/mL),HPLC法检测96孔板培养后上清液中ZEN含量,以接入等体积无菌水的培养液为阴性对照。将有明显脱毒效果的菌液梯度稀释后涂布于LB平板上,37℃培养,挑取形态不同的单菌落接种于含20 μg/mL ZEN的LB液体培养基中,培养48 h后HPLC检测ZEN含量,进一步筛选具有清除ZEN活性的菌株。
1.2.2 玉米赤霉烯酮的HPLC检测
取待测样品,加入等体积甲醇,充分混匀后浸提1 h以上。检测条件:安捷伦C18柱(5.0 μm,150 mm×4.6 mm);流动相,乙腈∶水∶甲醇=23∶23∶4;流速:1.0 mL/min;进样量:10 μL;检测波长:激发波长274 nm,发射波长440 nm。
ZEN标准曲线:y=1 766 170x-430 675.069 47,R2=0.999 9,x为ZEN浓度(μg/mL),y为峰面积(mv·s),标准曲线在1.0~50.0 μg/mL浓度范围内线性关系良好。
1.2.3 脱毒菌株16S rRNA鉴定
16S rRNA基因PCR扩增引物为:27F(5′-AGAGTTTGATCTGGCTCAG-3′),1495R(5′-CTACGGCTACCTTGTTACGA-3′),由生工生物工程(上海)有限公司合成。PCR产物经纯化、转化、酶切验证后,获得阳性转化子,送样至英潍捷基(Invitrogen)公司进行测序。测序结果与NCBI中的
GenBank数据库进行BLAST比对[18],应用MEGA 6.0软件,采用邻位连接法(Neighbour-Joining)进行系统发育树构建和系统发育关系分析。
1.2.4 脱毒菌株生长曲线及脱毒曲线测定
将活化的菌株接种到LB液体培养基中(含10 μg/mL ZEN),使接种后的培养基初始OD600值为0.2左右(阴性对照为未接种的培养基),于37℃、220 r/min振荡培养,在600 nm波长下进行光电比浊测定,绘制生长曲线;同时取菌液加入等体积甲醇浸提,离心后取上清液,HPLC测定培养基中ZEN含量,绘制脱毒曲线,探究菌株生长状况与脱毒率之间的关系。
1.2.5 脱毒菌株ZEN吸附情况探究
将培养至稳定期的菌液等分为2份,1份于121℃条件下灭活15 min,另1份不做任何处理。2份样品离心得细胞沉淀,用生理盐水洗涤沉淀3次后重悬,加入ZEN,使其终浓度为10 μg/mL,37℃,220 r/min条件下培养,于不同时间取样(10 min,2、4、24、48 h),离心得细胞沉淀,用等量生理盐水洗涤3次,加入甲醇充分浸提残余细胞中ZEN,HPLC检测其含量(平行重复3次)。
1.2.6 ZEN脱毒菌株活性物质定位
取培养至稳定期的菌液,5 500 r/min离心20 min,菌液上清液4℃保存备用,下层细胞用Tris-HCl(pH 7.4)洗涤3次并重悬,重悬后菌体经细胞破碎仪充分破碎,12 000 r/min离心除去细胞碎片,所得上清液为细胞内容物。将菌液上清液与细胞内容物分别做如下处理:①上清液不做任何处理,4℃暂存;②上清液中加入蛋白酶K处理(100 μg/mL,58℃)后沸水浴处理(2 h);③细胞内容物不做任何处理,4℃暂存;④细胞内容物加入蛋白酶K处理后沸水浴处理。将处理好的样品在无菌条件下过0.22 μm水系滤膜充分除菌,加入终浓度为10 μg/mL的ZEN,37℃条件下培养,于0、24、48、72、96 h取样,HPLC检测残余ZEN含量。
1.2.7 BLYES测定脱毒菌液雌激素毒性
将脱毒菌株培养至稳定期,加入终浓度为10 μg/mL的ZEN后继续培养,定时取样,HPLC检测残余ZEN含量,ZEN基本脱除完全后,BLYES测定其中总雌激素毒性,阳性参照为加入ZEN后脱毒培养0 h样液,阴性参照为LB液体培养基。进行BLYES检测前,用色谱级甲醇对ZEN脱毒菌液上清液进行梯度稀释,获得50%、25%、10%、5%、2.5%、1%、0.5%的稀释液,同时,在28℃、200 r/ min条件下用YMM培养基将酵母培养至OD6000.6~0.8之间。测定时,吸取不同稀释度的上清液样品200 μL于酶标板中,待样品中水分及甲醇自然挥干后,在样品孔中加入200 μL BLYES酵母菌液,置于28℃条件下静置培养5~8 h,调节酶标板发光测定灵敏度为135,在该灵敏度下测定各样品的发光值。
2.1 ZEN脱毒菌株的筛选
将135份土壤样品按1.2.1方法进行筛选,结果表明,15份土壤中的微生物对ZEN具有明显的清除作用,重复验证(平行3次)后挑选出6孔ZEN清除率达到90%以上的阳性样品,经稀释后涂布平板,分离出34株单菌落,分离出的单菌落接种于含有10 μg/mL ZEN的LB培养基中培养,HPLC检测,筛选得到具有明显ZEN清除效果的菌株Fu2-3和Fu41-3。如图1所示,ZEN及其衍生物α-ZER与β-ZER的保留时间分别为7.978 min、5.329 min和4.178 min。菌株Fu2-3号和Fu41-3号与ZEN共培养后,ZEN峰基本消失,没有α-ZER与β-ZER峰出现,表明两株菌对ZEN清除效果明显,且产物中不含α-ZER与β-ZER。在本实验HPLC条件下,两株菌将ZEN清除后并未产生明显ZEN产物峰。

图1 不同样品的HPLC图
注:A,ZEN标品及其衍生物α-ZER和β-ZER;B(a),Fu2-3脱毒前;B(b),Fu2-3脱毒后;B(c),Fu41-3脱毒前;B(d),Fu41-3脱毒后。
2.2 脱毒菌株16S rRNA鉴定
菌株Fu2-3和Fu41-3测序片段大小均为1 515 bp。NCBI中Blast比对结果显示,菌株Fu2-3与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的同源性高达99.4%,菌株Fu41-3与特基拉芽孢杆菌(Bacillus tequilensis)的同源性高达99.7%。选取与其同源性较高的20株典型菌株建立系统发育树,结果如图2所示,菌株Fu2-3与解淀粉芽孢杆菌、菌株Fu41-3与特基拉芽孢杆菌在同一分枝,故暂定菌株Fu2-3为解淀粉芽孢杆菌、菌株Fu41-3为特基拉芽孢杆菌。
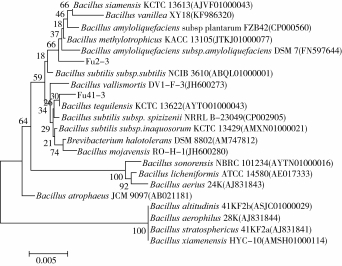
图2 菌株Fu2-3和Fu41-3系统发育树
2.3 ZEN脱毒菌株生长曲线及脱毒曲线
菌株生长曲线及脱毒曲线如图3所示。当菌株初始OD600为0.2时,两株菌在培养2 h后均进入对数生长期,菌株Fu2-3在13 h左右达到稳定期,且此时OD600较高,约为14;菌株Fu41-3在10 h左右达到稳定期,OD600约为8,此后两株菌OD600值均逐渐下降,细胞开始凋亡。两株菌的生长特点均符合芽孢杆菌生长特点。定时取样,HPLC检测体系中残余的ZEN含量,探究菌株生长时间与ZEN脱除率之间的关系,由图可知,菌株Fu41-3号的ZEN脱毒速率较高,在4 h内可脱除体系中95.24%的ZEN,菌株Fu2-3在8 h内ZEN脱除率可达93.92%。

图3 菌株Fu2-3和Fu41-3的生长曲线和脱毒曲线
2.4 ZEN脱毒菌株吸附情况
图4为不同处理条件下菌株对ZEN的吸附率,初始ZEN添加量为10 μg/mL,两种菌株对ZEN的吸附较快,加入ZEN后10 min即有一部分ZEN被吸附,且在4 h左右吸附率达到最大值,约为6%~8%,高温灭活细胞对ZEN的吸附能力略大于活细胞。
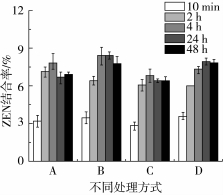
图4 不同处理方式的细胞ZEN吸附率
注:A,Fu2-3活细胞;B,Fu2-3灭活细胞;C,Fu41-3活细胞;D,Fu41-3灭活细胞。
芽孢杆菌为革兰氏阳性菌,肽聚糖层较厚,其C-O、OH、NH等基团空隙较大,利于ZEN进入[19],且磷壁酸等多元醇,容易失去磷酸二酯键使细胞壁表面带负电荷,结合ZEN[20],此外,细胞壁上某些多糖和蛋白的疏水相互作用也有利于ZEN的吸附[21]。本研究中,高温灭活细胞菌体对ZEN的吸附能力略高于活细胞菌体对ZEN的吸附能力,疑为热处理使菌体细胞壁肽聚糖和多聚糖的肽键或糖苷键断裂,使肽聚糖结构变薄、孔径增大,菌体对ZEN的吸附能力增强[22]。在本实验条件下,ZEN脱毒过程中,细胞壁对ZEN有一定的吸附作用,但整体吸附作用不高,对ZEN的脱毒主要为微生物的降解转化作用。
2.5 ZEN脱毒菌株功能物质定位
由图3可知,菌株Fu2-3和Fu41-3的细胞培养液均能在较短时间内清除绝大部分ZEN,但单取其菌液上清液或细胞内容物时,对ZEN的清除效果明显变弱(图5)。其中菌株Fu2-3的上清液及内容物均有一定程度清除ZEN的能力;而菌株Fu41-3的上清液在ZEN清除过程中起到了主要作用。
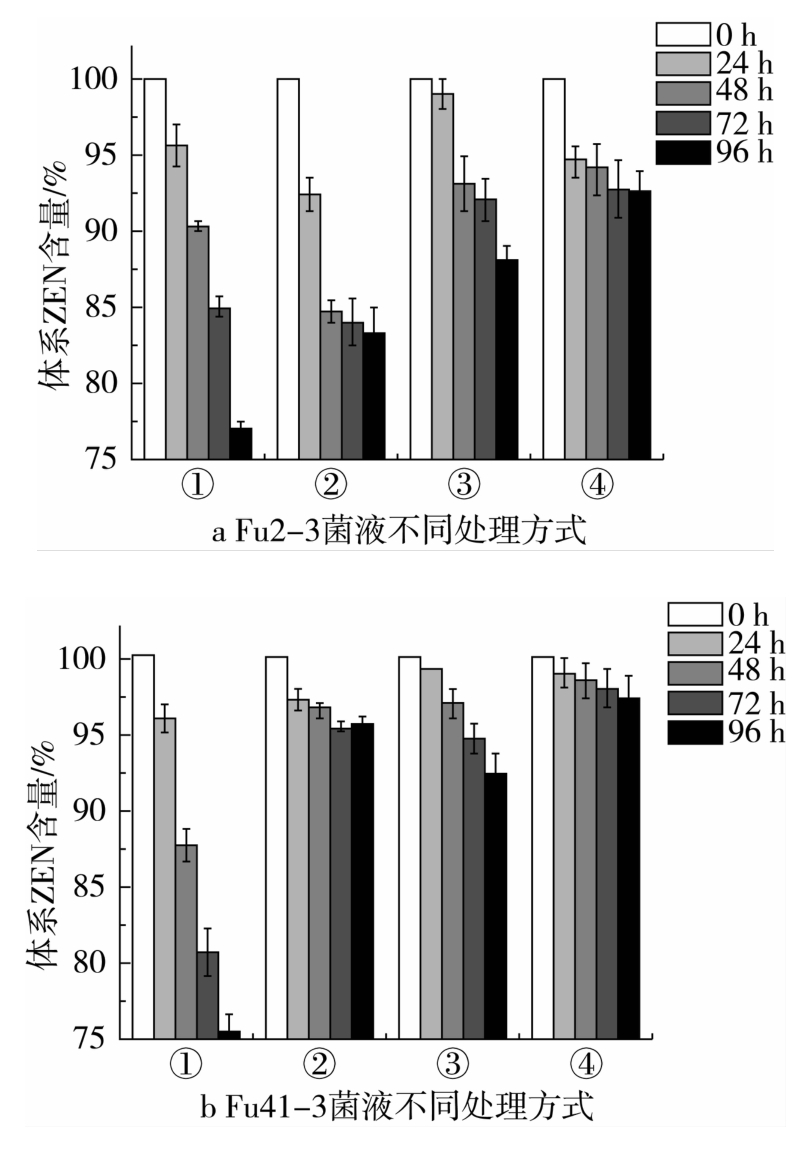
图5 不同处理方式菌液各组分的ZEN脱除能力
注:①上清液不做任何处理,4℃暂存;②上清液中加入蛋白酶K处理(100 μg/mL,58℃)后沸水浴处理(2 h);③细胞内容物不做任何处理,4℃暂存;④细胞内容物加入蛋白酶K处理后沸水浴处理。
总体上菌株Fu2-3与Fu41-3的上清液对ZEN的清除能力明显高于细胞内容物。Fu2-3菌株上清液经过蛋白酶K处理和加热处理后,清除ZEN能力减弱,但仍具有一定的清除效果,说明其ZEN清除作用可能是由于胞外酶作用,同时也可能是由于某种大分子物质与ZEN结合[20],且此种结合作用受蛋白酶K和加热处理效果影响不大。而Fu41-3菌液上清液在经过失活处理后其ZEN清除能力基本消失,说明菌株Fu41-3清除ZEN的主要活性物质为菌液上清液中的胞外酶。
2.6 BLYES测定ZEN共培养菌液雌激素毒性
向Fu2-3及Fu41-3菌液中加入终浓度为10 μg/mL的ZEN,摇匀后取样作为0 h脱毒对照组,脱毒组培养6 h后,Fu2-3的ZEN脱除率为99.41%,培养5 h后Fu41-3的ZEN脱除率为96.20%(液相结果见图1-B)。对以上脱毒率为99.41%和96.20%的两份脱毒样品进行BLYES检测,确定体系中残余雌激素毒性,检测前,用HPLC甲醇梯度稀释样品,稀释后对照组ZEN浓度为0~10 μg/mL,脱毒组稀释方法相同,BLYES测定前,酵母培养液OD600值为0.681。
BLYES测定结果如图6,脱毒组Fu2-3的发光值与对照组相比明显降低,在对照组ZEN浓度为0~10 μg/mL浓度范围内,Fu2-3脱毒后体系无雌激素响应,即当Fu2-3的ZEN含量减少99.41%后,体系中残余雌激素类物质基本清除,菌株Fu2-3在代谢ZEN的过程中将ZEN分解为无雌激素毒性的降解产物,或将ZEN与其它大分子物质结合使结合产物无法进入酵母细胞内部而失去雌激素毒性。脱毒组Fu41-3的发光值与对照组相比有所降低,在对照组ZEN浓度为0~10 μg/mL时,其酵母测定发光值降低60%~80%,结果表明,当脱毒组Fu41-3的ZEN含量减少96.20%后,其体系中总雌激素类物质减少60%~80%,故可推断在菌株Fu41-3作用下ZEN的脱毒产物仍具有较强雌激素毒性,由HPLC结果可知,菌株Fu41-3的代谢产物不是ZEN常见衍生物α-ZER和β-ZER,可能是其它具有雌激素活性的衍生物。将ZEN降解为无雌激素毒性或低刺激素毒性方面,菌株Fu2-3的脱毒效果优于菌株Fu41-3的脱毒效果。

图6 不同样品上清液雌激素活性测定
本研究通过96孔板高通量筛选土壤样品中的ZEN脱毒菌株,获得菌株Fu2-3和Fu41-3,16S rRNA鉴定两株菌分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和特基拉芽孢杆菌(Bacillus tequilensis)。对其生长曲线和脱毒曲线的测定结果表明,两株菌的生长均符合芽孢杆菌生长特点,且能在6 h内清除95%以上的ZEN,菌株Fu2-3和Fu41-3的细胞壁对ZEN均有一定的吸附作用,可能与其特殊的细胞壁结构组成有关,菌株Fu41-3脱除ZEN的功能物质主要存在于细胞外上清液中,且受蛋白酶K和加热的影响较大,可能为某种胞外酶;菌株Fu2-3脱除ZEN的功能物质在其上清液中存在稍多,且受蛋白酶K和加热的影响不大,因此其ZEN的生物脱除作用可能为某种大分子物质的结合作用。
研究采用HPLC检测法,并辅以BLYES验证,能高效快速排除脱毒体系中雌激素毒性仍较大的假阳性脱毒菌株,筛选出能将ZEN转化为雌激素毒性极低或无雌激素毒性物质的菌株,为ZEN脱毒菌株的筛选验证提供了新思路。本研究获得的高效脱毒菌株Fu2-3能将ZEN降解或转化为雌激素毒性极低的物质,为ZEN的生物脱毒机理研究及实际应用提供了实验材料和理论基础。
参考文献:
[1]Zinedine A,Soriano J M,Molto J C,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:An oestrogenic mycotoxin[J〛.Food and Chemical Toxicology,2007,45(1):1-18.
[2]Zaki M M,Midany S A,Shaheen H M,et al.Mycotoxins in animals:occurrence,effects,prevention and management[J].Journal of Toxicology and Environmental Health Sciences,2012,4(1):13-28.
[3]熊凯华,程波财,胡威,等.玉米赤霉烯酮降解的研究进展[J].中国粮油学报,2010,25(1):138-141.
[4]姜淑贞,杨维仁,杨在宾.玉米赤霉烯酮的代谢、毒性及其预防措施[J].动物营养学报,2011,23(2):196-202.
[5]唐语谦,钟凤,陈艺,等.玉米赤霉烯酮生物脱毒及关键酶作用机理的研究进展[J].现代食品科技,2013,29(7):1742-1746.
[6]Nezami H,Polychronaki N,Salminen S,et al.Binding rather than metabolism may explain the interaction of two food-grade Lactobacillus strains with zearalenone and its derivative α-zearalenol[J].Applied and Environmental Microbiology,2002,68(7):3545-3549.
[7]Yi P J,Pai C K,Liu J R.Isolation and characterization of aBacillus licheniformis strain capable of degrading zearalenone[J].World Journal of Microbiology&Biotechnology,2011,27(5):1035- 1043.
[8]Cheng B C,Jiang S Y,Wang M J,et al.Study on the degradation of Zearalenone by Micrococcus luteus[J].Chinese Journal of Microecology,2010,5:389-392.
[9]Cserhati M,Kriszt B,Krifaton C,et al.Mycotoxin-degradation profile ofRhodococcusstrains[J].International Journal of Food Microbiology,2013,166(1):176-185.
[10]Tan H,Zhang Z M,Hu Y C,et al.Isolation and characterization ofPseudomonas otitidisTH-N1 capable of degrading Zearalenone[J].Food Control,2015,47:285-290.
[11]Long M,Li P,Zhang W,et al.Removal of zearalenone by strains ofLactobacillus sp.isolated from rumen in vitro[J].Journal of Animal and Veterinary Advances,2012,11(14):2417-2422.
[12]Molnar O,Shatzmayr G,Elisabeth F,et al.Trichosporon mycotoxinivorans sp.nov.,A new yeast species useful in biological detoxification of various mycotoxins[J].Systematic and Applied Microbiology,2004,27(6):661-671.
[13]Sanseverino J,Gupta R K,Layton A C,et al.Use of Saccharomyces cereviciae BLYES expressing bacterial bioluminescence for rapid,sensitive detection of estrogenic compounds[J].Applied and Environmental Microbiology,2005,71(8):4455-4460.
[14]Chou P H,Lin Y L,Liu T C,et al.Exploring potential contributors to endocrine disrupting activities in Taiwan's surface waters using yeast assays and chemical analysis[J].Chemosphere,2015,138:814-820.
[15]Dias A C V,Gomes F W,Bila D M,et al.Analysis of estrogenic activity in environmental waters in Rio de Janeiro state(Brazil)using the yeast estrogen screen[J].Ecotoxicology and Environmental Safety,2015,120:41-47.
[16]Rajasarkka J,Koponen J,Airaksinen R,et al.Monitoring bisphenol A and estrogenic chemicals in thermal paper with yeast-based bioreporter assay[J].Anal Bioanal Chem,2014,406(23):5695-5702.
[17]Avobodova K,Plackova M,Novatna V,et al.Estrogenic and androgenic activity of PCBs,their chlorinated metabolites and other endocrine disruptors estimated with two in vitro yeast assays[J].Science of the Total Environment,2009,407(22):5921-5925.
[18]Chun J,Lee J H,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].International Journal of Systematic and Evolution Microbiology,2007,57(10):2259-2261.
[19]Tripathi P,Beaussart A,Andre G,et al.Towards a nanoscale view of lactic acid bacteria[J].Micron,2012,43(12):1323-1330.
[20]Vijayaraghavan K,Yeoung S Y.Bacterial biosorbents and biosorption[J].Biotechnology Advances,2008,26(3):266-291.
[21]Zoghi A,Khosravi D K,Sohrabvandi S.Surface binding of toxins and heavy metals by probiotics[J].Mini-Reviews in Medicinal Chemistry,2014,14(1):84-98.
[22]Rajendran R,Otha Y.Binding of heterocyclic amines by lactic acid bacteria from miso,a fermented Japanese food[J].Canadian journal of microbiology,1998,44(2):109-115.
Preliminary study on screen of detoxified strain of zearalenone and mechanism of detoxification
ZHANG Qian1,2,XIONG Jian1,ZHAO Chen2,WANG Yang2,ZHANG Xiao-lin2
(1.College of Food Science and Engineering,South China University of Technology,Guangzhou Guangdong 510641;2.Academy of State Administration of Grain,Beijing 100037)
Abstract:The study was aimed to screen the strain for efficiently detoxifying zearalenone(ZEN).Two strains named Fu2-3 and Fu41-3 with good performance in scavenging ZEN were screened out by 96-well plate high throughput screening among 135 soil samples collected from different areas where were highly infected by gibberellic disease.The strains were preliminarily identified as Bacillus amyloliquefaciens and Bacillus tequilensis based on 16S rRNA gene sequencing.The preliminary study on their detoxification mechanism showed that they were able to adsorb ZEN,but the main detoxification was bio-degradation.The result of BLYES assay indicated that the detoxification system of strain Fu41-3 still contained considerable estrogen toxicity,while strain Fu2-3 did not,by which ZEN would be transformed into metabolite with extremely low estrogenic toxicity.The two strains were isolated through screening,which provides theoretical evidence for bio-detoxification of ZEN.
Key words:zearalenone;Bacillus subtilis;bio-detoxification
中图分类号:TS 201.3
文献标识码:A
文章编号:1007-7561(2016)06-0076-06
收稿日期:2016-08-30
基金项目:国家自然科学基金(31302007)
作者简介:张倩,1991年出生,女,硕士研究生.
通讯作者:张晓琳,1974年出生,女,研究员.