表1 SRM模式下壬基酚的保留时间、监测离子及碰撞电压
吴维吉1,李 旭2,刘 佳2,李凤旭2,王晋威2,李 荃2
(1.中国天津粮油批发交易市场,天津 300171;2.天津市粮油质量检测中心,天津 300171)
摘 要:采用气相色谱—串联质谱(GC-MS/MS)研究植物油中壬基酚的测定方法。乙腈作为提取溶剂,通过涡旋提取和分散基质固相萃取净化。测定结果表明,该方法壬基酚含量在0.02~1 mg/L范围内呈良好线性关系,相关系数为0.999 2,在0.02、0.06和0.2 mg/kg三个水平上做加标回收实验,结果回收率为82.3%~94.7%。方法检出限为0.02 mg/kg。
关键词:植物油;气相色谱—串联质谱(GC-MS/MS);分散基质固相萃取;壬基酚
壬基酚(nonylphenol,NP,化学分子式C15H24O)是壬基酚聚氧乙烯醚(nonylphenol ethoxylates,NPEs)的生物代谢产物。是一种内分泌干扰物,对人体的内分泌系统、生殖系统和免疫系统有毒害作用。壬基酚作为增塑剂在食品包装工业中应用很广,它有可能从包装材料迁移到食品中,对人体健康造成损害[1]。目前,在水资源、土壤等环境样品中研究壬基酚污染现状的较多,而研究食品迁移的壬基酚相对较少。NIU[2]利用凝胶渗透色谱净化、同位素稀释—液相色谱—质谱联用技术,对某地的植物油样品进行了分析,结果为阳性的样品约占81%。植物油包装用各种塑料较多,有壬基酚迁移的可能性。因此,本实验开展植物油样品中壬基酚的初步筛查,探索其可能存在的安全隐患。
壬基酚检测方法有高效液相色谱法[3-4]、气相色谱—质谱法[5-6]、液相色谱—质谱法等[7-14]。本实验采用涡旋提取,基质分散固相萃取净化的样品前处理方法,可将固相萃取吸附剂直接分散到样品或者提取液中,吸附干扰物,保留目标物质,再采用气相色谱—三重四极杆串联质谱(GC-MS/MS)分析植物油中的壬基酚。
1.1 材料与仪器
1.1.1 仪器
TRACE 1310/TSQ QUANTUM XLS气相色谱—三重四极杆质谱联用仪:Thermo Fisher公司;XW-80A微型漩涡混合仪:上海沪西分析仪器厂;LD5-2B雷勃尔离心机:北京雷勃尔离心机有限公司。
1.1.2 试剂
壬基酚标准物质:Dr.Ehrenstorfer公司;乙腈、
甲醇(均为色谱纯):Fisher公司;PSA粉(40~63 μm),C18粉(40~63 μm):上海安谱仪器公司。
1.1.3 原料
塑料桶装18个食用植物油样品,来自厂家抽样。
1.2 测定方法
1.2.1 色谱条件
色谱柱:TR-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250℃;传输线温度280℃;不分流进样,进样量1 μL;载气:氦气,流速1 mL/min;升温程序:60℃保持1 min,以20℃/min升至280℃,保持4 min。
1.2.2 质谱条件
电子轰击离子源(EI),能量70 eV,灯丝电流50 μA,碰撞气为氩气,压力为1.0 mTorr。离子源温度250℃,溶剂延迟时间5 min,采取选择反应监测模式(SRM)进行数据收集。
1.2.3 样品前处理方法
在10 mL具塞玻璃离心管中称取2.0 g植物油试样,加入3 mL乙腈,涡旋提取3 min,在1 000 r/min下离心10 min。重复提取3次,合并3次提取的上清液,用乙腈定容至10 mL。取1 mL提取液至预先加入50 mg C18粉、50 mg PSA粉的玻璃净化管中,涡旋2 min,在1 000 r/min下离心5 min。用微量玻璃注射器取上清液600 μL至自动进样器的样品瓶中,上GC-MS/MS进样分析。
1.2.4 系列标准溶液的配制
称取100 mg壬基酚标准品(精确至0.1 mg)至100 mL容量瓶,加乙腈溶解并定容,配置成1 g/L的标准储备溶液。用乙腈分别稀释成0.02、0.05、0.1、0.2、0.5、1.0 mg/L的标准工作溶液,待上机测定。配置标准曲线时采用玻璃移液管而非移液枪。
2.1 质谱条件的确定
对标准溶液进行单四级杆全扫描,确定壬基酚的最大丰度碎片,将其作为母离子(Parent ion)。然后进行子离子扫描,在其产生的二级离子碎片中,选择丰度最大的作为子离子(Product ion)。最后改变电子碰撞能量,选择子离子强度最大的碰撞能量为最优碰撞能量。优化后的壬基酚的保留时间、监测离子(m/z)及碰撞电压(CE)见表1。总离子流图见图1。
表1 SRM模式下壬基酚的保留时间、监测离子及碰撞电压
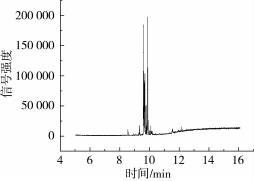
图1 壬基酚总离子流图
2.2 前处理条件的确定
2.2.1 实验器材选取
壬基酚作为增塑剂在塑料制品中普遍存在。实验中证明使用塑料材质的器具会产生比较高的本底,因此在前处理过程中应全部使用玻璃器具。所有玻璃器具放置于铬酸洗液中浸泡过夜,再用去离子水冲洗干净,烘干。
2.2.2 提取溶剂及次数确定
分别用乙腈、甲醇、乙腈丙酮1∶1混合溶液处理0.2 mg/kg的加标基质,对其回收率进行比较,见图2。结果表明,乙腈的提取效率最高,因此将乙腈确定为提取试剂。
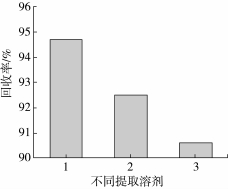
图2 不同提取溶剂的回收率对比图
1乙腈;2甲醇;3乙腈丙酮混合溶液
实验证明分别用3、3、3 mL乙腈进行三次涡旋提取,油脂中的壬基酚就可以被充分提取出来。图3是不同提取次数的回收率比较,可见提取次数为3次回收率最高。
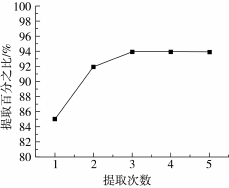
图3 不同次数下壬基酚提取的百分比
2.2.3 净化方法确定
植物油的提取液中主要干扰物为油脂和脂肪酸等极性杂质。比较了凝胶渗透色谱法、冷冻法、固相萃取柱法、分散基质固相萃取法四种净化方式。凝胶渗透色谱法和固相萃取柱法消耗的试剂较多,并且净化液需要浓缩方可进样,步骤较为繁琐。冷冻法能够较好的除去油脂,但是对极性杂质没有净化作用。最终采用分散基质固相萃取方式进行净化。
通过对C18粉、PSA粉、石墨化炭黑粉和弗洛里硅土粉四种净化物质的比较发现,石墨化炭黑粉和弗洛里硅土对壬基酚均有一定程度的吸附。C18粉和PSA粉的回收率均在100%左右。PSA能够吸附游离脂肪酸、色素等极性萃取物,C18的作用是吸附油脂。当PSA粉和C18粉的用量在50 mg(每mL提取液)时,就能取得比较好的净化效果。最终选择的净化物为50 mg PSA粉和50 mg C18粉。
2.3 线性范围及检出限
按照上述的GC-MS/MS条件,对各浓度的标准溶液进行测定,每个浓度的标准溶液平行测定两次,得到峰面积的平均值。以峰面积为纵坐标,浓度为横坐标进行线性拟合,得到标准曲线的回归方程、相关系数及检出限见表2。定量曲线见图4。方法在0.02~1 mg/L的含量范围内线性良好。逐渐减少空白样品中壬基酚的加标量,以仪器能够检测出的最小含量作为检出限。实验发现,油脂中壬基酚含量为0.02 mg/kg时能够被检出并准确定量,故以此作为方法检出限。
表2 回归方程、相关系数、检出限

图4 壬基酚标准曲线
2.4 方法的精密度和回收率
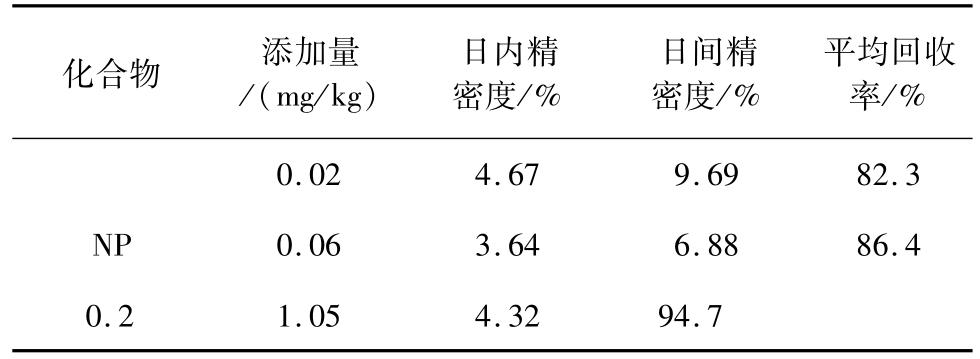
分别取40、120和400 μL浓度为1 mg/L的标准溶液,加入2.0 g空白植物油试样中(含量分别为0.02、0.06和0.2 mg/kg),按上述方法进行处理。在同一天内分别测定7次,计算日内精密度。连续测定5天,计算日间精密度。结果见表3。所测样品的日内精密度为1.05%~4.67%,日间精密度为4.32%~9.69%。计算回收率的平均值,均大于80%,满足食品中痕量污染物的检测要求。
表3 方法的精密度和回收率
2.5 实际样品验证检测
按照上述方法对18个食用植物油样品进行检测,结果阳性样品数为12个,占样品总数的67%。检出的壬基酚含量在0.038~0.089 mg/kg之间。目前我国对壬基酚的限量并无统一要求。丹麦环保署规定壬基酚的每日耐受量为5 μg/kg·bw· day[15]。按我国居民每日摄入食用油42 g计[16],则测得的壬基酚最高含量仅相当于0.062 3 μg/kg· bw,远远小于丹麦的安全标准。因此所检植物油样品中的壬基酚含量对人体是安全的。
本实验采用涡旋提取,基质分散固相萃取净化,GC-MS/MS检测植物油中的壬基酚。该方法壬基酚含量在0.02~1 mg/L范围内线性关系良好,相关系数为0.999 2,加标回收率为82.3%~94.7%,方法检出限为0.02 mg/kg。前处理简便、快捷,定量准确,适用于植物油样品的快速筛查。对实际样品的筛查发现,壬基酚在植物油中检出率较高,表明壬基酚能够从环境迁移到植物油中,对此应当引起关注。尽管目前壬基酚含量在人体的安全范围内,但不应忽视存在的安全隐患和风险。
参考文献:
[1]谢明勇,刘晓珍,陈泱杰,等.壬基酚在食品中的污染现状及其生物毒性概述[J].食品科学技术学报,2014,32(1):1-7.
[2]Niu Y,Zhang J,Wu Y,et al.Simultaneous determination of bisphenol A and alkylphenol in plantoil by gelpermeation chromatography and isotopic dilution liquidchromatography-tandem mass spectrometry[J].Journal of Chromatography A,2011,1218:5248-5253.
[3]陈素清,梁华定,黄微雅,等.流动注射在线预富集-高效液相色谱法测定水中的4-壬基酚和双酚A[J].分析化学,2008,36(7):959-963.
[4]蔡全英,黄慧娟,吕辉雄,等.超声提取/高效液相色谱法测定土壤中的4-壬基酚[J].分析测试学报,2012,31(2):185-189.
[5]黄会,邓旭修,张华威,等.凝胶渗透色谱—固相萃取—气相色谱—质谱法测定水产品中辛基酚、壬基酚和双酚A[J].食品科学,2013,34(24):116-120.
[6]ROS O,VALLEJO A,BLANCO-ZUBIAGUIRRE L,et al.Microextraction with polyethersulfone for bisphenol-A,alkylphenolsand hormones determination in water samples by meansof gas chromatography -mass spectrometry and liquidchromatography-tandem mass spectrometry analysis[J].Talanta 2015,134:247-255.
[7]HUERTA B,JAKIMSKA A,LLORCA M,et al.Development of an extraction and purification methodfor the determination of multiclass pharmaceuticalsand endocrine disruptors in freshwater invertebrates[J].Talanta 2015,132:373-381.
[8]ALEXANDROS G A,NIKOLAOS S T.BISPHENOL A.4-t-octylphenol,and 4-nonylphenol determinationin serum by Hybrid Solid Phase Extraction-Precipitation Technologytechnique tailored to liquid chromatography-tandem massspectrometry[J].Journal of Chromatography B,2015,986-987:85-93.
[9]张奎文,叶赛,那广水,等.高效液相色谱—串联质谱法测定环境水体中双酚A、辛基酚、壬基酚[J].分析试验室,2008,27(8):62-66.
[10]牛宇敏,张晶,张书军,等.同位素稀释液相色谱—串联质谱法测定动物性食品中的双酚A、壬基酚及辛基酚[J].分析化学,2012,40(4):534-538.
[11]马强,白桦,王超,等.液相色谱—串联质谱法同时测定纺织品和食品包装材料中的壬基酚、辛基酚和双酚A[J].分析化学,2010,38(2):197-201.
[12]邵兵,韩灏,李冬梅,等.加速溶剂萃取—液相色谱—质谱/质谱法分析动物组织中的壬基酚、辛基酚和双酚A[J].色谱,2005,23(4):362-365.
[13]郭新东,冼燕萍,陈立伟,等.液相色谱串联质谱法测定化妆品中的双酚A、辛基酚及壬基酚[J].分析测试学报,2012,31(7):848-852.
[14]罗纪军.液相色谱串联质谱法测定乳制品中双酚A和壬基酚[J].现代农业科技.2015(1):288-289,291.
[15]ELSA N,GRETE Ø,INGER T,et al.EnvironmentalProject,Toxicological evaluation and limit values for nonylphenol,nonylphenol ethoxylates,tricresyl phosphates and benzoic acid[M].Danish Environmental Protection Agency,Copenaghen,DK,2000.
[16]翟凤英,何宇纳,马冠生,等.中国城乡居民食物消费现状及变化趋势[J].中华流行病学杂志,2005,26(7):485-488.
Determination of nonylphenol in vegetable oil by gas chromatography-tandem mass spectrometry
WU Wei-ji1,LI Xu2,LIU Jia2,LI Feng-xu2,WANG Jin-wei2,LI Quan2
(1.China Tianjin Grain&Oil Wholesale Trade Market,Tianjin 300171;2.Tianjin Grain&Oil Quality Inspection Center,Tianjin 300171)
Abstract:A method based on gas chromatography-tandem mass spectrometry(GC-MS/MS)was developed for the determination of nonylphenol(NP)in vegetable oil.The oil sample was extracted by ocean eddies with acetonitrile as solvent and purified by dispersive solid phase extraction.The results showed a good linear relationship when the content of nonylphenol was in the range of 0.02~1 mg/L,correlation coefficient was 0.999 2,The recovery rate on 0.02 mg/kg,0.06 mg/kg and 0.2 mg/kg were in the rage of 82.3%~94.7%.The limit of detection was 0.02 mg/kg.
Key words:vegetable oil;gas chromatography tandem mass spectrometry(GC-MS/MS);dispersive solid phase extraction;nonylphenol
中图分类号:TS 207.3
文献标识码:A
文章编号:1007-7561(2016)06-0067-04
收稿日期:2016-05-12
作者简介:吴维吉,1964年出生,男,高级工程师.
通讯作者:刘佳,1982年出生,男,高级工程师.