朱东奇1,李道明1,王卫飞2,杨 博3,王永华1
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.华南理工大学化学与化工学院,广东广州 510640;3.华南理工大学生物科学与工程学院,广东广州510006)
摘 要:米根霉脂肪酶(Rhizopus oryzae lipase)是一种具有广泛用途的工业化脂肪酶,对重组米根霉脂肪酶(rProROL)的酶学性质进行考察,发现其水解甘油三酯时具有明显的sn-1,3位置专一性;催化二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)酯化时其活力分别为催化油酸酯化活力的37.42%和8%。鳀鱼油是天然EPA/DHA主要来源之一,在鳀鱼油中DHA含量为12.1%。13C核磁共振波谱分析表明,鳀鱼油中DHA主要分布在甘油酯的sn-2位,利用重组米根霉脂肪酶(rPro-ROL)催化鳀鱼油部分水解富集其中的DHA时,得到的1,2-甘油二酯中DHA的含量可以达到19.7%,甘油单酯中DHA的含量可以达到25.2%,DHA的回收率为65.6%。表明rProROL脂肪酶具有水解鳀鱼油富集DHA的应用潜能。
关键词:重组米根霉脂肪酶;水解;鳀鱼油;DHA
米根霉(Rhizopus oryzae)脂肪酶广泛应用于食品和油脂加工领域,野生型的Rhizopus oryzae脂肪酶由三段组成:一段由26个氨基酸组成的信号肽序列,一段由97个氨基酸组成的前肽序列和一段由269个氨基酸组成的成熟肽序列。前肽序列处于信号肽序列和成熟肽序列之间,前肽序列非常重要,能
辅助成熟肽序列蛋白的折叠和酶的分泌,同时前肽序列能增强酶的活性和热稳定性;信号肽序列会影响成熟肽序列蛋白的折叠。野生型米根霉脂肪酶因其表达量少、酶活低等缺点限制了其在食品和油脂化工领域的应用。因此,国内外学者在米根霉脂肪酶基因克隆及在不同微生物中表达等方面做了大量的研究以获得高产量和高活力的重组米根霉脂肪酶[1-2]。重组米根霉脂肪酶在催化醇解反应制备生物柴油中显示较好的稳定性[3],并可用于制备中链结构脂、人乳脂、甘油二酯等具有特殊功能的酯类物质[4]。然而,目前对于重组米根霉脂肪酶在催化油脂水解、富集DHA方面的报道较少。本研究使用的脂肪酶是将天然的米根霉脂肪酶信号肽序列去除,在前序列肽羧基端添加由28个氨基酸组成的先导序列后,得到的重组米根霉脂肪酶(rProROL),其表达量和催化油脂水解的活力大大提高。
鳀鱼是一种重要的海洋经济鱼类,其年产量约为海洋鱼类总渔获物的20%,是年捕捞量排在前10位的海洋鱼类之一。在中国、俄罗斯、南非、智力、秘鲁等地均有分布。秘鲁鳀鱼是世界上最大渔业资源,每年捕量达到500~1 000万t,占秘鲁总起捕量的80%。鳀鱼中油脂含量高(湿基含油量约为5%~8%),鳀鱼油富含二十碳五烯酸(EPA,C20∶5)和二十二碳六烯酸(DHA,C22∶6),是深海鱼油保健食品加工的重要原材料。天然鳀鱼油中的DHA含量一般在4.3%~18.4%的范围内,以其为原料进行深加工时可以通过物理化学法或生物法对DHA进行分离纯化。常用的工艺为将天然鱼油乙酯化,然后通过分子蒸馏和尿素饱和等方法将乙酯型的DHA、EPA纯化到一定浓度[5]。此外,根据天然鱼油中脂肪酸分布特点及脂肪酶的选择性,可以通过酶促水解或醇解的方式获得甘油酯型的高EPA、DHA产物,所得甘油酯产品中一般以甘油二酯和单甘油酯为主,甘油三酯含量较少[6-7]。
本文以含有一个来自米根霉的先导序列的重组米根霉脂肪酶(rProROL)为研究对象,考察其催化油脂水解时的位置专一性和催化脂肪酸酯化时脂肪酸特异性。利用超导核磁共振(600 M)对DHA在鳀鱼油甘油酯中的位置分布进行分析;根据DHA在甘油酯中的分布特点,以重组米根霉脂肪酶(rPro-ROL)为催化剂,催化鳀鱼油限制性水解富集DHA。为酶法富集海洋鱼油中DHA提供参考。
1.1 主要材料与试剂
鳀鱼油:舟山新诺佳生物工程有限公司提供。rProROL[Rhizopus oryzae脂肪酶前肽基因序列与成熟肽基因序列(ProROL)在重组Pichia pastoris中表达],实验室自制[4]。氘代氯仿,核磁级,购于Sigma-Aldrich(中国)有限公司。37种脂肪酸甲酯混合标准品(CAS no.113 47885-U)、甘油二酯(15%的1,2-甘油二酯和85%的1,3-甘油二酯,CAS no.25637-84-7)、甘油三酯(CAS no.122-32-7)、甘油单酯(CAS no.113 47885-U)及三油酸甘油酯标准品:购于Sigma-Aldrich(中国)有限公司。正己烷、异丙醇、甲酸均为色谱纯。石油醚、三氟化硼—乙醚、乙酸、甲醇、氢氧化钠、氢氧化钾均为分析纯。
1.2 主要仪器设备
Waters 2695型高效液相色谱仪(配备Waters 2414型示差检测器):美国Waters公司;气相色谱仪:安捷伦7890A;超导核磁共振谱仪:德国Bruker公司;BS201S Sartorius精密天平:赛多利斯(上海)贸易有限公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限公司。
1.3 实验方法
1.3.1 rProROL的位置选择性分析
称取1.00 g三油酸甘油酯于25 mL的锥形瓶中,加入0.2 mL磷酸盐缓冲液(pH 7),添加30 U/g的rProROL(相对于油的质量),置于恒温磁力搅拌器(40℃,200 r/min)中反应10 min。每分钟取样于-20℃冰箱保存。反应结束后,取1 mL反应混合物于10 000×g下离心5 min,取上层油相0.02 mL于2 mL EP管中,加入0.5 g的无水硫酸钠,1 mL的流动相(正己烷∶异丙醇∶甲酸=15∶1∶0.003,体积比),于10 000×g离心1 min,取0.8 mL上层有机相进行高效液相色谱分析水解产物中甘油酯和脂肪酸的组成,通过对比标准样品的保留时间确定酶促三油酸甘油酯水解反应中各组分的出峰位置。
1.3.2 rProROL的脂肪酸特异性分析
将33.49 mmol的甘油与16.74 mmol的等摩尔脂肪酸加入25 mL的具塞锥形瓶中,并加入50 mg的rProROL和370 μL磷酸盐缓冲液(0.1 mol/L,pH 7),于40℃下反应10 min。反应结束后,离心,取一定量的上层油样(准确记录质量)加入到含25 mL异丙醇的100 mL锥形瓶中,然后加入两滴1%的酚酞溶液,再用KOH滴定,记录消耗的KOH体积;剩余油相转入分液漏斗中,加入4 mL 30%KOH-乙醇溶液,混匀,再加入10 mL正己烷萃取,去掉下层,倒出上层于25 mL的圆底烧瓶中,将正己烷于
30℃旋蒸除掉后,对得到的甘油酯混合物进行甲酯化,气相色谱检测脂肪酸甲酯的组成,每种脂肪酸的转换程度计算为[8]:
其中,AV0和AVt分别为0时间和t时间的酸价,Fn为酰基甘油中各脂肪酸的摩尔百分比。
通过不同脂肪酸结合到甘油的程度来计算脂肪酸的竞争因子(α),从竞争因子(α)的大小即可评价rProROL的脂肪酸特异性,竞争因子(α)其倒数(1/α)称为底物专一性常数(kcat/Km),用于评价脂肪酶的脂肪酸特异性。将Rangheard等[9]提出的反应底物的竞争因子用于描述脂肪酶的脂肪酸特异性。α的计算公式为:
式中,A0和B0分别代表底物A和底物B在0时间的浓度,At和Bt分别代表底物A和底物B在t时间的浓度。在本研究中,通过测定酯化反应产物中脂肪酸组成来间接反映rProROL的脂肪酸特异性,在公式(1)的基础上,酯化反应体系中脂肪酸的竞争因子可表示为:
式中,Cref和Cn分别表示参照脂肪酸和待考察脂肪酸结合到甘油上的结合率。
1.3.3 鳀鱼油中DHA位置分析
利用超导核磁共振对鳀鱼油中DHA在甘油酯中的位置分布进行分析,参考文献[10]中分析鱼油中脂肪酸组成及位置分布的检测方法,将200 mg的鳀鱼油溶于600 μL的CDCl3,然后转移到核磁管中,利用13C核磁共振波谱(NMR)进行检测。
1.3.4 rProROL催化鳀鱼油水解
将10 g鳀鱼油与10 g磷酸盐缓冲液(pH 7)加入到50 mL的具塞锥形瓶中,置于恒温磁力搅拌器中并预热到反应温度(40℃),添加30 U/g底物油的rProROL,每隔一段时间取样分析反应混合物的组成。
1.3.5 水解产物组成分析
利用高效液相色谱法(HPLC)分析鳀鱼油水解产物,高效液相色谱为配备Waters 2414示差折光检测器的waters2695系统;色谱柱为Phenomenex Luna Silica(2)(4.6 mm i.d.×250 mm,5 μm particle size),流动相为正己烷∶异丙醇∶甲酸=15∶1∶0.003(体积比),色谱柱温为30℃,流动相流速为1.0 mL/min。物质的出峰顺序为:甘油三酯、脂肪酸、1,3-甘油二酯、1,2(2,3)-甘油二酯、1(3)-甘油单酯、2-甘油单酯,不同组分利用标准品进行定性,各个组分含量按面积归一化法进行计算。rProROL的位置选择性可通过1,2(2,3)-甘油二酯与1,3-甘油二酯的比值来确定。
1.3.6 甘油酯中脂肪酸组成分析
甘油酯分离:反应结束后,离心,取上层油样,将20 μL油样用毛细管点在层析板(100 mm×200 mm,0.20~0.25 mm)底部距边缘约1.5 cm处。将点好的层析板置于装有展开剂的层析缸中展开,展开剂为石油醚∶乙醚∶乙酸(体积比)=80∶20∶2,展开后将层析板从层析缸中取出,在通风橱中晾干,用0.1%的2,7-二氯荧光素染色,然后在254 nm紫外灯下观察酰基甘油酯和脂肪酸所对应的条带。将各对应的条带从层析板上刮下进行甲酯化,以检测脂肪酸组成。
样品甲酯化:采用快速甲酯化方法,将经薄层色谱(TLC)分离得到的甘油酯条带和脂肪酸条带刮下后置于50 mL的圆底烧瓶中,加入5 mL 0.5 mol/L的NaOH-甲醇液,置于75℃水浴中回流皂化反应10 min。取出适当冷却2 min后,再加入3 mL 14%的BF3-乙醚甲醇溶液,75℃恒温水浴反应5 min,使甲酯化完全。取出冷却,加入正己烷2.5 mL,轻轻摇荡促进甲酯在正己烷中溶解。加入饱和食盐水溶液,使正己烷上升至瓶口。静置、分层,取上层正己烷相于离心管中,并加入少量无水硫酸钠除水后,进行气相色谱分析。
气相色谱(GC)分析:采用Agilent7890A气相色谱进行分析;色谱柱:FFAP(30 m×0.25 mm i1d× 0.20 μm);载气:N2,流量1.1 mL/min,压力0.5 MPa;燃气:H2,流量38 mL/min,压力0.25 MPa;助燃气:空气,流量350 mL/min,压力0.5 MPa;柱前压:20 psi,分流比30∶1;进样量1 μL;进样口温度250℃,检测器温度300℃。程序升温方法:170℃维持2 min,以5℃/min升温至200℃维持2 min,10℃/min升温至230℃维持40 min。计算采用面积归一化法。
2.1 rProROL的位置选择性分析
天然的ROL在水解甘油三酯时,具有显著的sn-1,3位专一性,因此可以用于甘油二酯的制备和结构脂质的定向合成。重组ROL(rProROL)活力
更高,但分子结构的改变,可能会影响其位置专一性;本研究以三油酸甘油酯为底物,通过分析rPro-ROL在短时间内的水解产物考察其位置专一性,结果如图1所示。

图1 rProROL水解三油酸甘油酯
由图1可知,rProROL催化水解反应10 min后的产物组成为:87.59%的甘油三酯;0.28%的1,3-甘油二酯;7.48%的1,2(2,3)-甘油二酯;0.24%的2-甘油单酯和4.42%的脂肪酸;没有检测到1(3)-甘油单酯。在催化水解反应起始后10 min内1,2(2,3)-甘油二酯与1,3-甘油二酯的比值从最初1 min时的3.28[1,2(2,3)-甘油二酯1.31%,1,3-甘油二酯0.4%]升高到10 min时的26.71[1,2(2,3)-甘油二酯7.48%,1,3-甘油二酯0.28%]。这是由于rProROL催化三油酸甘油酯时先将甘油三酯中sn-1和sn-3位的脂肪酸水解,生成大量的1,2-甘油二酯,这表明rProROL在催化水解甘油三酯时表现出明显的1,3位专一选择性。
2.2 rProROL的脂肪酸特异性分析
天然的ROL脂肪酶对中长链脂肪酸具有很好的催化活性,特别是对C8~C18的脂肪酸。对ROL脂肪酶进行重组可以提高其催化活力,也可能会改变其对不同脂肪酸的催化活性。本研究以等摩尔量的11种脂肪酸的混合物为底物,与甘油进行酯化反应,通过分析不同脂肪酸酯化的程度来计算脂肪酸的竞争因子(α),从α的大小即可评价rProROL的脂肪酸特异性,α的倒数(1/α)称为底物专一性常数(kcat/Km),用于评价脂肪酶的脂肪酸特异性,结果如图2所示。
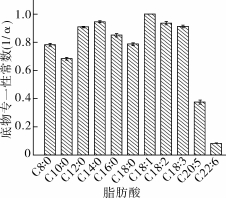
图2 rProROL对脂肪酸的专一性常数
由图2可以看出,rProROL催化中链脂肪酸辛酸(C8∶0)与甘油反应其竞争因子的倒数(1/α)可以达到0.781 4,催化长链脂肪酸棕榈酸(C16∶0)与甘油反应其竞争因子的倒数(1/α)可以达到0.849 3,催化长链脂肪酸EPA、DHA与甘油反应其竞争因子的倒数(1/α)仅可以达到0.374 2和0.08。rProROL对中长链脂肪酸如辛酸(C8∶0)、癸酸(C10∶0)、月桂酸(C12∶0)、肉豆蔻酸(C14∶0)、棕榈酸(C16∶0)、油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3)等选择性较强,而对EPA、DHA的选择性较弱,特别是对DHA的选择性很弱,其对EPA和DHA的酯化活力分别为其催化油酸酯化活力的37.42%和8%。鳀鱼中含有大量的C18和C16脂肪酸,因此,可以利用rProROL对不同脂肪酸的特异性来水解鳀鱼油富集DHA。
2.3 鳀鱼油甘油酯中DHA位置分析
13C NMR法分析脂肪酸的位置分布是一种无损、快速、准确的方法,Tengku Mohamad Tengku-Rozainaand[10]等通过13C NMR方法分析了金枪鱼油中EPA和DHA在甘油三酯中的位置分布,具有良好的准确性。本研究用600 MHz的超导核磁共振波谱仪对鳀鱼油进行13C波谱分析,结果如图3所示。
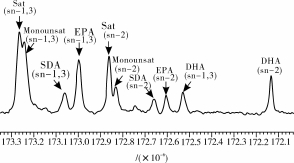
图313C NMR分析鳀鱼油各脂肪酸的位置分布
注:Sat,饱和脂肪酸;Monounsat,单不饱和脂肪酸。
利用MestReNova软件对鳀鱼油甘油酯13C波谱进行处理,发现13.98%的EPA分布在sn-1,3位,3.39%的EPA分布在sn-2位,6.38%的SDA(十八碳四烯酸,C18∶4)分布在sn-1,3位,2.97%的SDA分布在sn-2位,5.78%的DHA分布在sn-1,3位,6.36%的DHA分布在sn-2位。鳀鱼油中DHA主要分布在甘油三酯骨架的sn-2位上,
而EPA、SDA、饱和脂肪酸(Sat)、单不饱和脂肪酸(Monounsat)则随机分布在甘油三酯的骨架上。可以利用具有sn-1,3位置专一性的脂肪酶水解鳀鱼油的sn-1,3位脂肪酸,将DHA富集在1,2-甘油二酯和单甘油酯中。
2.4 rProROL催化水解鳀鱼油富集DHA的研究
由rProROL水解三油酸甘油酯可知,rProROL具有明显的sn-1,3位置专一性。核磁共振波谱分析鳀鱼油中甘油酯中脂肪酸的位置分布,发现DHA主要分布在甘油骨架的sn-2位。本研究利用rProROL水解鳀鱼油的sn-1,3位脂肪酸,将DHA富集在1,2-甘油二酯和甘油单酯中,结果如图4所示。
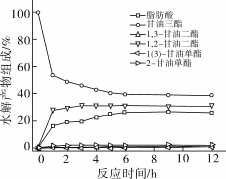
图4 rProROL水解鳀鱼油
由图4可以看出,在反应开始的1 h内,鳀鱼油水解迅速,产生大量的脂肪酸和1,2-甘油二酯。随着反应的进行,到6 h时基本达到平衡,此时产物中含有:甘油三酯(39.38%),1,2-甘油二酯(30.93%),1,3-甘油二酯(1.16%),2-甘油单酯(2.16%),1(3)-甘油单酯(0.44%),脂肪酸(26.06%)。将水解产物利用TLC分离后,利用GC分析分离得到1,2-甘油二酯和甘油单酯的脂肪酸组成,发现1,2-甘油二酯中DHA含量达到19.7%,单甘酯(主要为2-单甘酯)中DHA含量达到25.2%,较未水解鳀鱼油中DHA(12.1%)的含量有大幅提升,分别是其1.63倍和2.08倍,DHA的回收率可以达到65.6%。这主要是因为鳀鱼油中DHA主要分布在sn-2位,当sn-1,3位专一脂肪酶rProROL作用于鳀鱼油时,DHA在水解产生的大量的1,2-甘油二酯和甘油单酯中得以富集。
本研究考察了重组米根霉脂肪酶(rProROL)的位置特异性和脂肪酸选择性,发现rProROL水解三油酸甘油酯时具有显著的sn-1,3位置专一性,且其催化EPA和DHA酯化时其活力分别为催化油酸酯化活力的37.42%和8%。13C NMR分析结果表明,鳀鱼油中DHA主要分布在甘油骨架的sn-2位,将rProROL应用于水解鳀鱼油富集DHA研究表明,水解6 h后,反应基本达到平衡,此时产物中含有:甘油三酯(39.38%),1,2-甘油二酯(30.93%),1,3-甘油二酯(1.16%),2-甘油单酯(2.16%),1(3)-单甘酯(0.44%),脂肪酸(26.06%)。气相色谱分析表明,水解产生的1,2-甘油二酯中DHA含量达到19.7%,单甘酯(主要为2-甘油单酯)中DHA含量达到25.2%,较未水解鳀鱼油中DHA(12.1%)的含量有大幅提升,DHA的回收率可以达到65.6%。rProROL水解鳀鱼油富集DHA具有一定的研究价值与前景,本研究为将来rProROL应用于水解鳀鱼油富集DHA提供了依据。
参考文献:
[1]LI Z,LI X,WANG Y,et al.Expression and characterization of recombinant Rhizopus oryzae lipase for enzymatic biodiesel production[J].Bioresource Technology,2011,102(20):9810-9813.
[2]DI LORENZO M,HIDALGO A,HAAS M,et al.Heterologous production of functional forms of Rhizopus oryzae lipase in Escherichia coli[J].Applied and Environmental Microbiology,2005,71(12):8974-8977.
[3]DURATE S H,DEL PESO HERN NDEZ G L,CANET A,et al.Enzymatic biodiesel synthesis from yeast oil using immobilized recombinant Rhizopus oryzae lipase[J].Bioresource Technology,2015,183:175-180.
[4]LI D,QIN X,WANG J,et al.Hydrolysis of soybean oil to produce diacylglycerol by a lipase from Rhizopus oryzae[J].Journal of Molecular Catalysis B:Enzymatic,2015,115:43-50.
[5]WANG W F,LI T,NING Z X,et al.A process for the synthesis of PUFA-enriched triglycerides from high-acid crude fish oil[J].Journal of Food Engineering,2012,109(3)366-371.
[6]杨博,杨继国,吕杨效,等.脂肪酶催化鱼油醇解富集EPA和DHA的研究[J].中国油脂,2005,30(8):64-67.
[7]宋诗军,夏松养,林晓坪,等.酶法制备高含量EPA、DHA甘油酯[J].农业机械,2013(11):47-51.
[8]QIN X L,HUANG H H,WANG Y H,et al.Typoselectivity of Crude Geobacillus sp.T1 Lipase Fused with a Cellulose-Binding Domain and Its Use in the Synthesis of Structured Lipids[J].Journal of the American Oil Chemists′Society,2014,91(1):55-62.
[9]RANGHEARD M S,LANGRAND G,TRIANTAPHYLIDES C,et al.Multi-competitive enzymatic reactions in organic media:a simple test for the determination of lipase fatty acid specificity[J].Biochimica et Biophysica Acta,1989,1004(1):20-28.
[10]TENGKU-ROZAINAAND T M,BIRCH E J.Positional distribution of fatty acids on hoki and tuna oil triglycerides by pancreatic lipase and13C NMR analysis[J].European Journal of Lipid Science and Technology.2014,116:272-281.
Enzymatic properties of recombinant rhizopus oryzae lipase and its application in concentration of DHA by hydrolysis of anchovy oil
ZHU Dong-qi1,LI Dao-ming1,WANG Wei-fei2,YANG Bo3,WANG Yong-hua1
(1.College of Food Sciences and Engineering,South China University of Technology,Guangzhou Guangdong 510640;2.School of Chemistry and Chemical Engineering,South China University of Technology,Guangzhou Guangdong 510640;3.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou Guangdong 510006)
Abstract:Rhizopus oryzae lipase is one of the widely used industrial lipase.The enzymatic properties of recombinant rhizopus oryzae lipase were evaluated and it displayed strong 1,3 regiospecificity in hydrolyzing triglyceride;meanwhile,it showed 37.42%and 8.0%relative activity towards eicosapentaenoic acid(EPA)and docosahexenoic acid(DHA)compared with oleic acid in esterification reaction.Anchovy oil is one of the main sources of natural EPA/DHA and it contains 12.1%DHA.The result of13C nuclear magnetic resonance spectrum showed that DHA in anchovy oil was preferentially located at sn-2 position of the glyceride.Based on above,recombinant rhizopus oryzae lipase was employed to hydrolyze anchovy oil to concentrate DHA,and the contents of DHA in produced 1,2-diacylglycerol and monoacylglycerol reached to 19.7%and 25.2%accompanying with a recovery yield of 65.6%.The results demonstrated that recombinant rhizopus oryzae lipase was a prospective lipase which could be used in enrichment of DHA by hydrolysis of anchovy oil.
Key words:recombinant rhizopus oryzae lipase;hydrolysis;anchovy oil;docosahexaenoic acid(DHA)
中图分类号:TQ 925+.6
文献标识码:A
文章编号:1007-7561(2016)06-0021-05
收稿日期:2016-03-23
基金项目:国家高技术研究发展计划(863计划)(2014AA093601);广东省产学研项目(2013B090200015)
作者简介:朱东奇,1990年出生,男,硕士研究生.
通讯作者:王永华,1973年出生,女,教授.