朱 凤1,2,都启晶1,2,满兆红1,2,3,王玉燕1,2,赵宏坤1,2,3
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.山东省肉类食品质量安全工程技术研究中心,山东青岛 266109;3.青岛千迪慷食材净化科技有限公司,山东青岛 266100)
摘 要:从表型特征和益生特性两方面研究嗜铅乳酸菌JT1在优化后的M1培养基和加入魔芋粉的M2培养基中连续传代的稳定性。结果表明,嗜铅乳酸菌JT1在两种培养基中,连续传至1 000代时,形态并没有发生改变,菌落呈不透明白色突起,表面光滑,与原始菌株的菌落形态一致;连续传代并没有改变培养周期内总生物量和周期末活菌数的变化;菌株JT1对pH为2.5的人工胃液、pH为8.0的人工肠液以及0.3%的胆盐的耐受能力基本保持稳定;菌株所特有的吸附PB2+功能在传代过程中没有受到很大的影响,吸附率基本稳定在60%左右。为嗜铅乳酸菌JT1的可持续性生产提供了可靠依据。
关键词:嗜铅乳酸菌JT1;传代培养;稳定性;吸附率
1.1 菌株来源
嗜铅乳酸菌JT1:由青岛农业大学“食品风险分析与防控”山东省肉类食品质量控制工程技术研究中心重点实验室提供,通过实验室筛选强化得到耐铅菌株JT1(Genebank登录号:KM233626)。
1.2 培养基试剂
优化改良的M1培养基:蔗糖2%,蛋白胨0.5%,牛肉膏0.75%,酵母膏0.3%,磷酸氢二钾0.15%,柠檬酸铵0.3%,硫酸镁0.15%,氯化钠0.75%,吐温80 1 mL。
加入魔芋粉的M2培养基:魔芋粉0.01 g/mL,MRS营养肉汤。
盐酸、氢氧化钠、乙酸铅、甘油为分析纯试剂;LB营养肉汤,北京陆桥技术有限责任公司;胰蛋白酶(Trypsin 1∶250),WOLSEN;胃蛋白酶(Pepsin 1∶3 000),Amresce;胆盐3号,国药集团化学试剂有限公司;MRS琼脂培养基,北京陆桥技术有限责任公司。
1.3 实验仪器
TGL-20bR型高速冷冻离心机,上海安亭科学仪器厂;高压蒸汽灭菌锅,三洋电机(广州)有限公司;水浴恒温振荡器,金城国胜实验仪器厂;摩尔超纯水机,重庆摩尔水处理设备有限公司;电子分析天平,上海越平科学仪器有限公司;电热恒温鼓风干燥箱,上海市精宏DHG-9036A;精密pH计,德国赛多利斯股份公司;紫外分光光度计,北京普析通用仪器有限公司;实验所用的玻璃器皿用30%硝酸溶液浸泡24 h以上,然后用超纯水洗3遍,烘干备用。
1.4 实验方法
1.4.1 绘制生长曲线
将嗜铅乳酸菌JT1的原始菌种活化后按接种量为1%(v/v)分别接种于M1和M2培养基中,37℃培养24 h后按1%(v/v)分别接种到相应的两种培养基试管中,于37℃恒温箱中振荡培养。每3 h取样测定OD600值和pH值。
1.4.2 菌株传代培养
将保存-80℃冰箱中的嗜铅乳酸菌JT1在室温条件下自然解冻,活化24 h后划线于固体培养基上,37℃培养24 h随机选取2个单菌落,每个单菌落分别接种于M1培养基和M2培养基中,以5%的接种量转接于相应的培养基中,为确保菌株的稳定,传代选在稳定期,同时为了便于连续传代的长久操作,选择24 h为一个传代周期[2]。
1.4.3 菌株培养代数计算嗜铅乳酸菌JT1作为单细胞微生物,一个单倍体细胞即一个单倍体生物,细菌是以二分裂的方式增殖,即经过n次分裂增殖后细菌数为2n个。在每个培养周期内,菌体是以100倍增殖,即每个培养周期内的生长代数为loG2100≈6.64代(24 h即为6.64代,一个月可以传到200代[2])。
1.4.4 传代过程中菌种保藏
在菌株传代的过程中,每周进行一次菌种保藏。将传代处于稳定期的菌株离心(12 000 r/min离心5 min,0~10℃),弃掉上清液,在所收集的菌体中加入20%(v/v)灭菌甘油LB,充分震荡均匀,分装于2 mL无菌离心管中,置于-20℃保藏。
1.4.5 嗜铅乳酸菌JT1传代期间表型特征分析方法
1.4.5.1 菌落形态观察在嗜铅乳酸菌JT1连续传代过程中,每培养一周进行革兰氏染色、油镜查看,观察传代过程中菌株的细胞形态。划线于固体培养基上,将划线平板倒置于厌氧培养箱中37℃恒温培养48 h,观察菌落大小、形态和颜色等,并记录,拍照。
1.4.5.2 活菌数变化
每培养200代测定菌株JT1传代过程中培养周期末的活菌数[3]。
1.4.5.3 OD600值变化
每培养200代测定菌株JT1传代过程中培养周期末的OD600值。
1.4.6 嗜铅乳酸菌JT1传代期间益生特性检测
1.4.6.1 菌种供试菌液的制备
将传代周期末的菌体离心(2 mL,12 000 r/min离心5 min,0~10℃)收集,用灭菌的生理盐水洗涤2次后,将菌体悬浮生理盐水中,而后梯度稀释至合适倍数后,采用平板倾注法计算菌落总数,同时测定相应稀释度菌液的0D600值。依据各稀释度0D值与所对应的近似菌落数(CFU/mL)的线性关系,调整菌体的0D600值,确定供试液菌体的浓度约为5.5× 108CFU/mL左右[4-5]。
1.4.6.2 人工胃液和肠液的制备与测定
配制稀盐酸,取稀盐酸16.4 mL,加水500 mL左右,再加入胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL即得人工胃液,pH约为2.5;取胰蛋白酶10 g,磷酸二氢钾6.8 g,加水溶解,用NaOH溶液调pH约为8,即得人工肠液。
传代过程(每200代测定)中取1.0 mL供试菌液添加到9.0 mL的人工胃液中,37℃消化3 h,同时分别于0 h和3 h取样,平板倾注法计数。之后,取1.0 mL已消化3 h的人工含菌胃液添加到9.0 mL的人工肠液中,继续37℃消化培养,分别于4 h和8 h取样,平板倾注法计数,每个样品做3个平行。
菌株存活率/%[6]![]() ,式中:
,式中:
N1,菌株处理后活菌数;N0,菌株初始活菌数。
1.4.6.3 胆盐耐受能力测定
益生菌产品中发挥益生作用的主要是活菌制剂,而胆盐会破坏活菌体的细胞膜,所以对胆盐耐受能力的测评是重要指标之一[7-8],然而消化道中胆盐浓度并不是固定不变的,在消化初始1 h时浓度可达到1.5%~2.0%(w/v),随后浓度下降到0.3%左右[8]。研究表明,嗜铅菌JT1可以耐受0.8%胆盐,能顺利到达肠道发挥作用[9]。
菌株JT1在传代过程中,每培养200代测定菌株的耐胆盐能力。将处于稳定期的菌株以5%接种量接入含0.3%胆盐的MRS培养基中,以不加胆盐的MRS作为对照。将菌株JT1置于37℃水浴中培养,每1 h取样于600 nm测定其吸光值,至吸光值增加0.3个单位为止。菌株JT1耐受胆盐的能力以延滞期的长短为测评标准,其中实验组与空白组菌株吸光值增加0.3个单位所需的时间差即为延滞期。
1.4.6.4 吸附铅能力的测定
将离心后的菌体加入10 mL含Pb2+100 mg/L的液体培养基中,振荡吸附10 min后,12 000 r/min离心5 min,取上清液定容至10 mL,用ICP-OES测定Pb2+的浓度。

式中:C0为不加菌空白对照中铅的测定值,Ce为加菌处理后铅的测定值。
2.1 生长曲线及pH值的变化
2.1.1 嗜铅乳酸菌JT1在M1培养基中
以1%(v/v)的接种量,将活化后的JT1接种于M1培养基中,37℃恒温培养36 h的OD600值和pH值变化情况如图1所示,菌株JT1在M1培养基中培养12 h左右开始进入对数生长期,18 h之后进入稳定期,生长曲线呈“S”型。另外,从图中可以看出,在整个培养过程中pH值在12 h时降到了4.3,18 h后趋于稳定,维持在3.7左右直到培养结束,在此过程中pH值共下降了2.8。
2.1.2 嗜铅乳酸菌JT1在M2培养基中以1%(v/v)的接种量,将活化后的JT1接种于M2培养基中,37℃恒温培养36 h的OD600值和pH值变化情况如图2所示,菌株JT1在M2培养基中培养12 h左右也开始进入对数生长期,18 h之后进入稳定期,其生长曲线仍呈“S”型,说明加入魔芋粉后并没有影响该菌株的生长规律。在整个培养过程中pH值在18 h时降到了4.1,18 h后趋于稳定,维持在3.7左右直到培养结束,与图1相比pH值下降的较多为3.3,这可能是由于菌株能够利用魔芋多糖里的碳源,进一步发酵产生了更多的乳酸,进而使pH下降的更多。
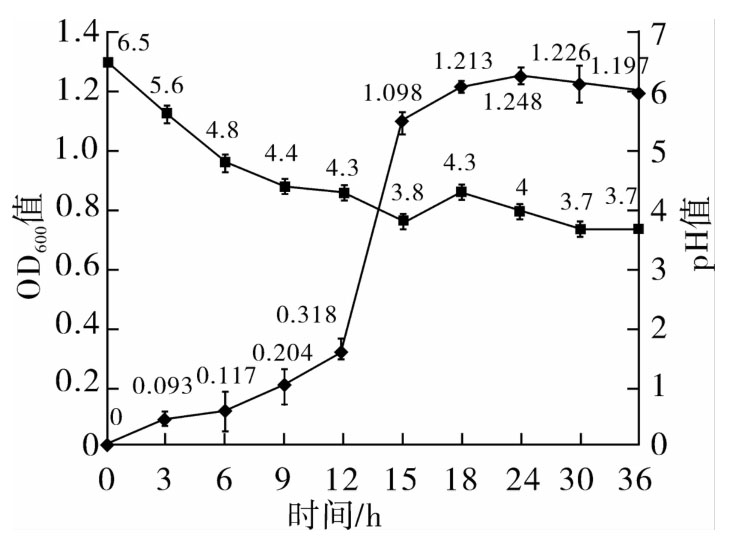
图1 嗜铅乳酸菌JT1原始菌株在M1培养基中生长曲线及pH 值的变化
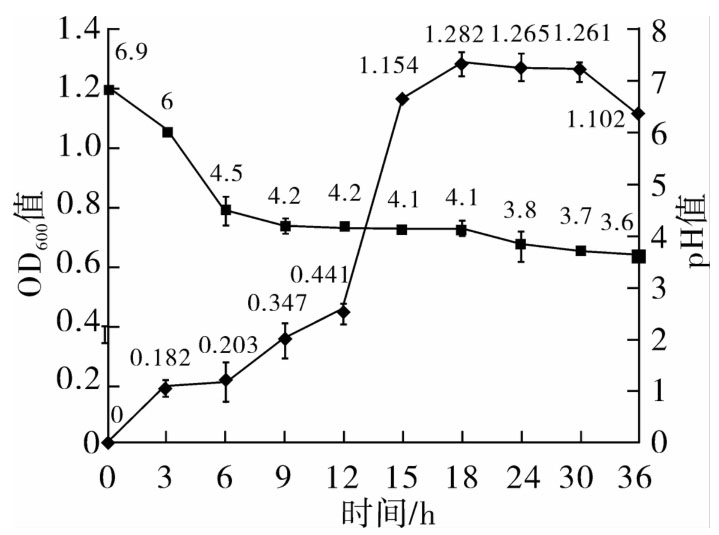
图2 嗜铅乳酸菌JT1原始菌株在M2培养基中生长曲线及pH 值的变化
上述结果说明,优化后的培养基M1、M2并没有改变菌株的生长规律,且在两种培养基中的生长情况有所不同。根据生长规律及传代方便确定传代时间为24 h。
2.2 传代期间表型特征分析
2.2.1 菌落形态观察
图3为嗜铅乳酸菌JT1的原始菌株和连续传至第1 000代的菌落照片。从图中可以看出,对于原始菌株,在M1培养基和M2培养基中培养的菌落形态是基本一致的,即菌落呈白色不透明突起,表面光滑,边缘整齐。选取代表性的原始菌株和第1 000代菌株做对照,结果表明,在两种培养基中连续培养至1 000代时,菌落形态与最初时分离株的菌落形态一致。
2.2.2 生长周期末活菌数变化
如图4所示,在两种培养基中,嗜铅菌JT1的活菌数在传代过程中有波动,且差异显著(P<0.05),但没有特定的变化规律。总体来看,在两种培养基中菌株的活菌数基本保持稳定,都在108CFU/mL的数量级上。
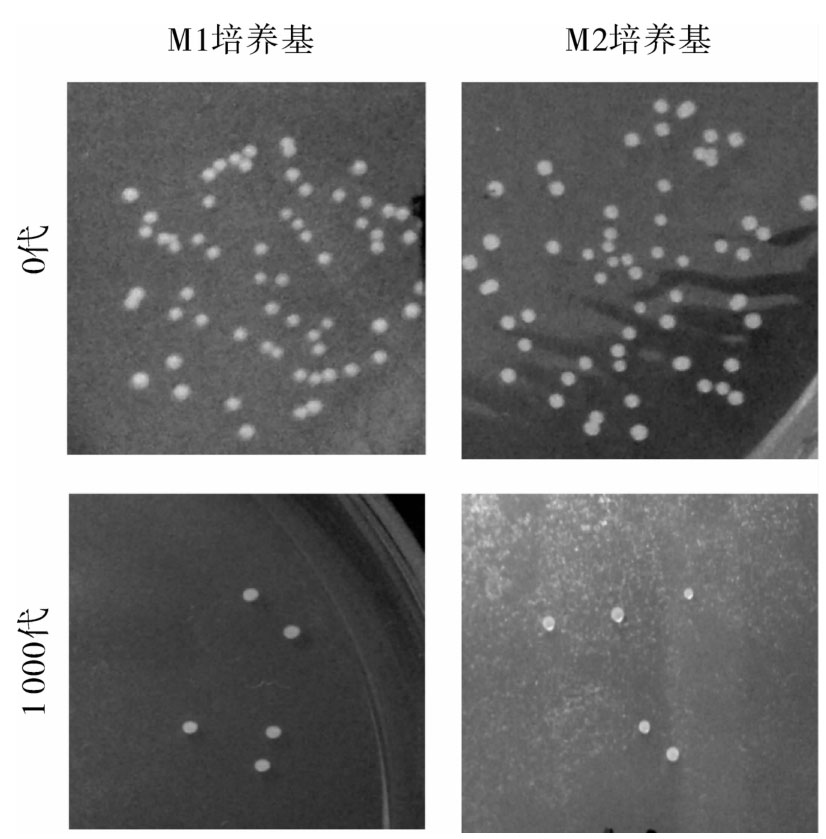
图3 嗜铅乳酸菌JT1原始菌株和第1000代的菌落形态对比
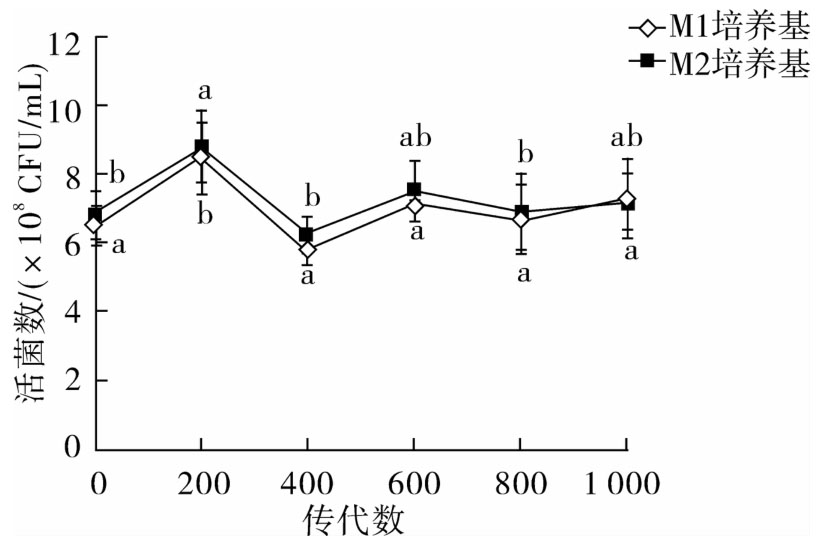
图4 嗜铅乳酸菌JT1在连续培养时生长周期末活菌数变化
注:不含相同字母表示差异显著(P<0.05),以下各图表同。
2.2.3 生长周期末OD600值变化
培养基中浑浊度的变化反应了总生物量的变化。如图5所示,在连续传代过程中,嗜铅菌JT1在两种培养基中的OD600值都有所波动,且差异显著(P<0.05),同活菌数的变化类似,变化趋势没有规律,但总生物量相对稳定。对于连续传代的菌株而言,在接种量为5%(v/v)的一个培养周期内,总生物量保持平衡,说明菌株的OD值在连续培养过程中没有改变。
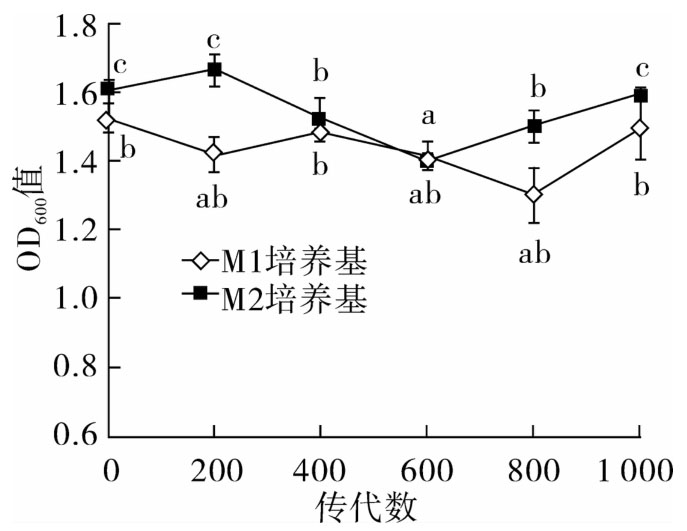
图5 嗜铅乳酸菌JT1在连续培养时生长周期末OD值变化
2.3 传代期间益生特性稳定性
耐酸耐胆盐是用来筛选益生菌的首要标准,由于益生菌进入人体后,在肠道内的存活能力直接关系到菌株能否发挥其益生特性,而嗜铅乳酸菌JT1特有的清除体内铅离子的能力也是衡量该菌株稳定性的重要标准。
2.3.1 人工胃液中耐受能力
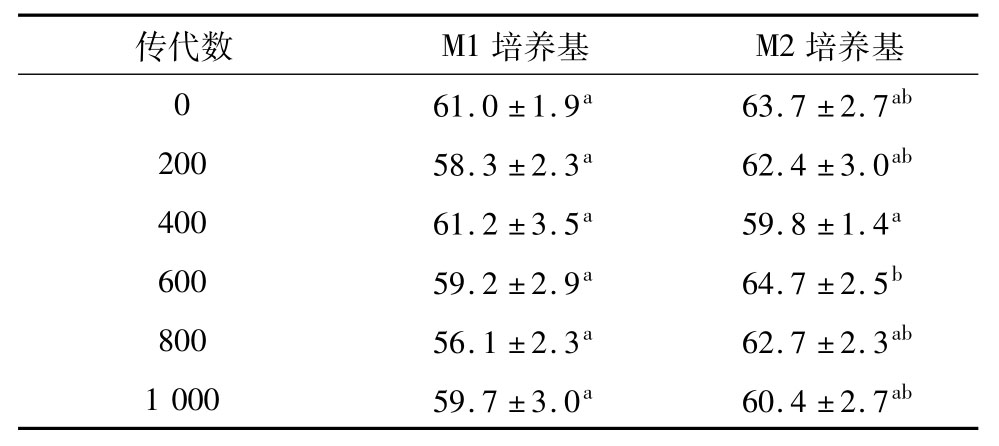
在胃肠转运过程中,菌株耐受低pH值的能力是一个非常重要的因素,而耐受胃内低酸环境是菌株抵达肠道发挥其作用的第一道关卡[10]。从表1中可以看出,在连续传至1 000代过程中,M2培养基中的菌株JT1
在人工胃液中消化3 h后的存活率有显著性变化(P<0.05),而在M1中差异不显著(P>0.05)。在此期间M1培养基中菌株的存活率变化是波动的,范围为56.1%~61.2%,没有特定的变化趋势;M2培养基中的存活率变化同样不稳定,范围在59.8%~64.7%之间。但总体来看,在两种培养基中各代存活率没有太大的差异,说明菌株JT1的胃液耐受能力并没有因为连续传代而发生改变。
表1 嗜铅乳酸菌JT1连续培养1 000 代在人工胃液中存活率的变化 %
2.3.2 人工肠液中耐受能力
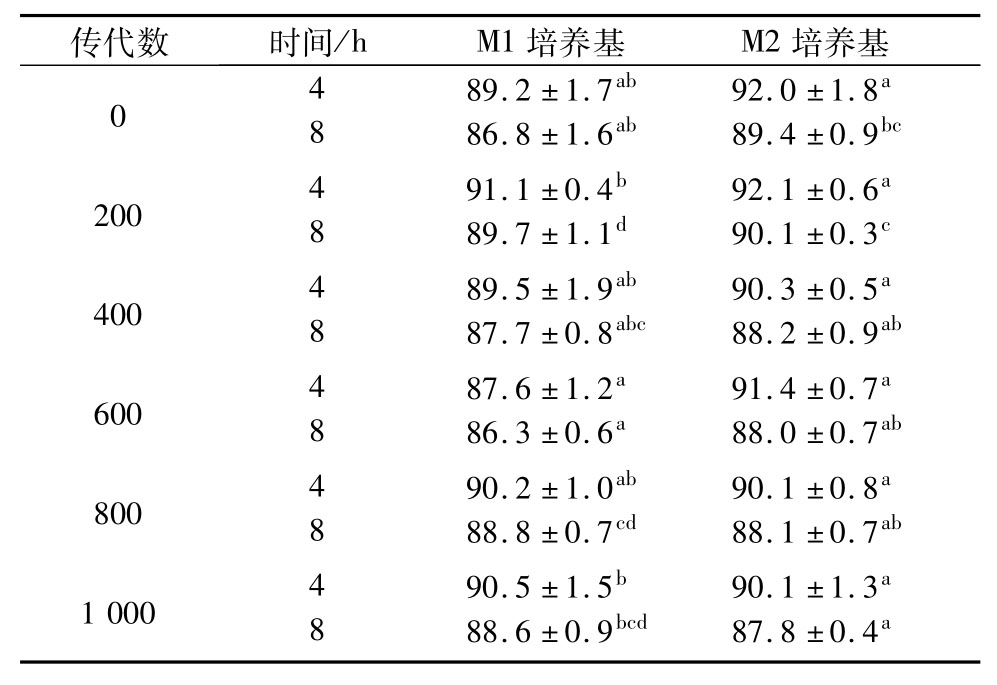
从表2中可以看出,嗜铅乳酸菌JT1在两种培养基中连续传至1 000代过程中,在pH值为8.0的人工肠液中分别消化4 h和8 h后的存活率存在显著性差异(P<0.05),但总体来看消化8 h后的存活率基本维持在88%左右,说明该菌株对人工肠液的耐受性在传代过程中可以很好地保持稳定。
表2 嗜铅乳酸菌JT1连续培养1 000 代在人工肠液中存活率的变化 %
2.3.3 胆盐耐受能力
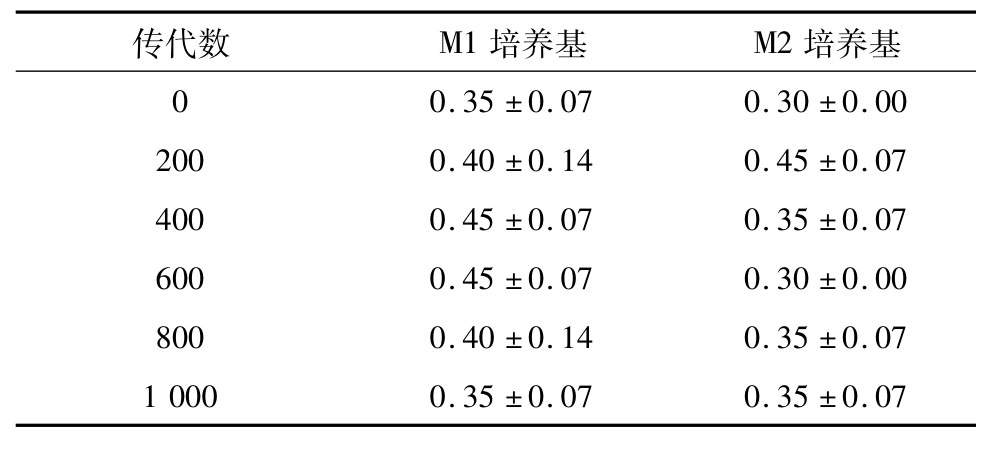
胆盐具有抑菌作用,能在高渗透压的条件下使菌体的质壁分离从而抑制其生长或致其死亡,菌株能否耐受肠道内的胆盐是其在消化道中存活和发挥益生作用的必要条件[11]。从表3中可以看出,在连续传至1 000代过程中,嗜铅菌JT1在两种培养基中耐0.3%胆盐的延迟时间并没有显著性差异(P>0.05),均在0.3~0.5 h范围内变化,这与之前研究的可以耐受0.8%胆盐的结果一致[9-12]。研究表明菌株JT1的胆盐耐受能力较稳定,在两种养基中传至1 000代不会影响菌株对胆盐的耐受性。
表3 嗜铅乳酸菌JT1连续培养1 000 代在0. 3%胆盐中延迟时间的变化h
2.3.4 吸附铅能力的效果
从图6可以看出,嗜铅乳酸菌JT1传到400代时菌株的吸附能力在两种培养基中均有所下降,但之后吸附率趋于平衡;而且在M2培养基中的菌株对铅离子的吸附率整体较高,与M1培养基相比吸附率波动更为平缓。实验数据表明,菌株JT1对铅离子的吸附能力在1 000代培养过程中可以较好地保持。
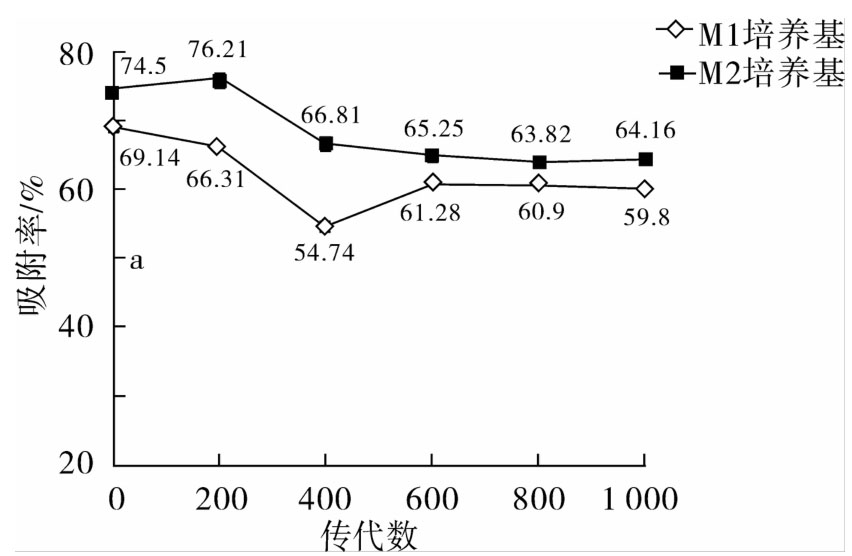
图6 嗜铅乳酸菌JT1连续培养1 000代过程中对铅离子吸附能力的变化
本研究通过观察嗜铅乳酸菌JT1在M1和M2培养基中的传代培养情况,得出:菌株连续传至1 000代时,形态没有发生改变,菌落呈白色不透明突起,表面光滑,边缘整齐,与原始分离株菌落形态一致。在两种培养基的传代过程中,菌株JT1的活菌数和生长周期末的OD值都有所波动,但并不是随着代数的增加而呈现规律性变化,且差别不明显,这说明嗜铅乳酸菌JT1在连续培养传代过程中,菌液的总生物量和菌种的活力都基本保持不变,没有出现衰退;嗜铅乳酸菌JT1的益生特性研究表明,在人工胃液、人工肠液以及0.3%的胆盐中耐受能力基本保持不变;菌株所特有的吸附铅离子的功能在传代过程中没有受到很大影响。综上所述,嗜铅乳酸菌JT1在连续培养1 000代期间,其表型特征和基本益生特性均没有发生改变,相对稳定,是一种可长期使用的安全菌种。
参考文献:
[1]张文羿,白梅,张和平.益生菌Lactobacillus casei Zhang在常规培养条件下连续传代1000代过程中稳定性研究[J].中国乳品工业2013,41(11):16-18.
[2]盛祖嘉.微生物遗传学(第三版)[M].北京:科学出版社,2007.
[3]GUO Z,WANG J,YAN L,et al.In vitro comparison of probiotic properties of Lactobacillus casei Zhang,a potential new probiotic,with selected probiotic strains[J].LWT-Food Science and Technology,2009,42(10):1640-1646.
[4]GOKAVI S,ZHANG L,HUANG M K,et al.Oat-based Symbiotic Beverage Fermented by Lactobacillus plantarum、Lactobacillus paracasei ssp.casei,and Lactobacillus acidophilus[J].Journal of food science,2005,70(4):216-223.
[5]TUOMOLA E M,OUWEHAND A C,SALMINEN S J.The effect of probiotic bacteria on the adhesion of pathogens to human intestinal mucus[J].FEMS Immunology k Medical Microbiology,1999,26(2):137-142.
[6]ZHOU Q,WANG J,GUO Z,et al.Fermentation characteristics and transit tolerance of Lactobacillus casei Zhang in reconstituted mare milk during storage[J].International Journal of Dairy Technology, 2009,62(2):249-254.
[7]NORIEGA L,CUEVAS I,MARGOLLES A,et al.Deconjugation and bile salts hydrolase activity by Bifidobacterium strains with acquired resistance to bile[J].International Dairy Journal,2006,16(8):850-855.
[8]SUCCI M,TREMONTE P,REALE A,et al.Bile salt and acid tolerance of Lactobacillus rhamnosus strains isolated from Parmigiano Reggiano cheese[J].FEMS microbiology letters,2005,244(1):129-137.
[9]满兆红.鸡源耐前乳酸菌的筛选鉴定及体内外吸附性能研究[D].青岛:青岛农业大学,2014.
[10]白梅.益生菌Lactobacillus casei Zhang长期连续传代过程中遗传稳定性研究[D].呼和浩特:内蒙古农业大学,2012.
[11]SANZ Y.Ecological and functional Implications of the acid-adaptation ability of Bifidobacterium:A way of selecting improved probiotic strains[J].International Dairy Journal,2007,17(11):1284-1289.
[12]TUOMOLA E,CRITTENDEN R,PLAYNE M,et al.Quakity assyrance eriteria for probiotic bacteria[J].Am J Clin Nutr,2001, 73:386-392.
Stability of lead-resistant lactic acid bacteria JT1in subculture
ZHU FenG1,2,DU Qi-jinG1,2,MAN Zhao-honG1,2,3,WANG Yu-yan1,2,ZHAO Hong-kun1,2,3
(1.College of Food Science&Engineering,Qingdao Agricultural U,niversity,Qingdao Shandong ;266109;
2.Shandong Research Center for Meat Food Quality Sa,fetyQ,ingdao Shandong 266109)
3.Qingdao Qiandikang Food Purification Technology Co.Ltd.Qingdao Shandong 266100
Abstract:The stability of the continuous subculture of lead-resistant lactic acid bacteria JT1in the optimized medium(M1)and MRS medium added with konjac flour(M2)was researched in the aspects of the phenotypic characteristics and probiotic characteristics.The results showed that the form of lead-resistant lactic acid bacteria JT1did not changed in both M1and M2after the 1 000 generations.The modality of colonies was opaque white protuberance with smooth surFAce and consistent with the original isolated colony.Continuous culture didn′t change the total biomass in culture cycle and the living bacteria number at the end of the culture cycle.The tolerance of JT1kept stable in artificial gastric juice(pH 2.5),artificial intestinal juice(pH 8.0)and 0.3%bile salts.In particular,the specific function of adsorption of Pb2+was nearly not affected during the passage,and the adsorption rate was basically stable at around 60%.These results provide the reliable basis for the sustainable production of lead-resistant lactic acid bacteria JT1.
Key words:lead-resistant lactic acid bacteria JT1;subculture;stability; adsorption rate微生物在多次连续传代中容易发生退化,遗传稳定性也会发生改变,导致其生理生化特征的变化,从而使菌株质量不能得到保障。连续传代往往是菌株退化的直接原因,传代越频繁,次数越多,菌株发生变化的几率也就越大。嗜铅菌JT1如果作为长期连续使用的产业化菌种,不仅应具备优异的益生特性,更应具备较好的稳定性,即保证菌株在连续生产过程中仍保持筛选时所具有的优良品质,所以,对于菌株JT1稳定性的探究是必要的,这也是菌株实现连续化生产的前提[1],而且对于乳酸菌来讲,其稳定性能会直接影响到对人体健康的促进作用,尤其是菌株JT1的嗜铅性能。因此,研究嗜铅乳酸菌JT1在传代培养中的稳定性能为以后实现产业化生产提供重要理论依据。
中图分类号:Q 93-335
文献标识码:A
文章编号:1007-7561(2016)05-0087-05
收稿日期:2016-04-14
基金项目:国家“十二五”科技支撑项目(2012BAD39B05,2012BAD 28B03);山东省自主创新成果转化专项项目(2014CGZH 0704);青岛农业大学实验技术研究项目(SYJK14-18)
作者简介:朱凤,1991年出生,女,硕士研究生.
通讯作者:赵宏坤,1957年出生,男,教授.