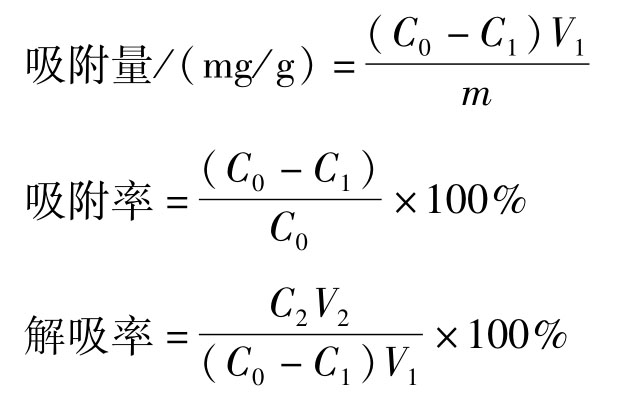
黎 英,刘春艳,李子月,曾珍清,郑兰香
(龙岩学院生命科学学院,福建龙岩 364012)
摘 要:以红腰豆黄酮粗提物为原料,比较6种树脂对红腰豆黄酮的静态吸附和解吸性能,筛选出XDA-1进行分离纯化实验,并考察红腰豆黄酮纯提物对食用油脂(猪油和花生油)的抗氧化效果。结果表明:最佳的分离条件为上样液质量浓度1.5 mg/mL,吸附流速2 BV/h,上样液pH值6,上样量3 BV,洗脱速度2 BV/h,乙醇体积分数为60%洗脱,洗脱量3 BV。在此工艺条件下,黄酮得率及纯度分别为73.86%和22.65%。红腰豆黄酮提取物可有效延缓油脂氧化,且对猪油的抗氧化效果优于花生油。
关键词:红腰豆;黄酮;分离;大孔树脂;抗氧化
红腰豆(Phaseolus vulgaris Linn.)为蝶形花科菜豆属,缠绕植物,外形似“鸡腰子”,色泽红润,富含蛋白质、碳水化合物、维生素及多种微量元素,且含有较高黄酮类、多糖类和红色素类等活性物质,是乾豆中营养最丰富的一种[1-5],红腰豆味甘平,性温,现代研究证明其具有补血益气、消肿、软化血管、降血脂、抗风湿、抗辐射等作用[6]。
树脂吸附分离技术是近年来广泛应用的一种分离、纯化天然产物有效成分的方法,可显著提高有效成分的相对含量,具有价廉、选择性好、吸附容量大、吸附迅速、解吸容易及可重复使用等优点[7-9]。近年来,对红腰豆的开发利用研究主要集中在营养保健、休闲食品和食疗等方面,而红腰豆黄酮提取物的纯化及对油脂的抗氧化作用尚未见报道。本文在前期实验获得红腰豆黄酮提取物基础上,采用大孔吸附树脂对红腰豆黄酮提取物进行分离,通过树脂静态筛选和动态实验研究红腰豆黄酮的分离纯化工艺,同时与油脂常用的VE抗氧化剂进行比较,探讨红腰豆黄酮化合物对不同油脂的抗氧化效果,以期为红腰豆黄酮作为新型天然食品抗氧化剂的开发利用和研发具有保健功效的含油食品提供科学依据。
1.1 材料与试剂
红腰豆:由龙岩市上杭县农科所提供;芦丁:美国Sigma公司;树脂(AB-8、XDA-1、ADS-7、ADS -17、DM-13、D101):厦门柏嘉生物科技有限公司;亚硝酸钠、硝酸铝、VE、三氯甲烷、碘、冰乙酸、碘化钾等均为国产分析纯;花生油、猪油:市购。
1.2 设备与仪器
UV-1800型紫外可见分光光度计:日本岛津公司;SHB-3型循环水多用真空泵、RE-2002型旋转蒸发器:郑州杜甫仪器厂;PHS-3C型精密pH计:上海雷磁仪器厂;TB-114型电子分析天平:北京赛多利斯仪器系统有限公司;DK-S24型电热恒温水浴锅:上海精宏实验设备有限公司;ø10× 300 mm玻璃层析柱、BSZ-100自动部分收集器、DHL-A恒流泵:上海沪西分析仪器厂。
1.3 方法
1.3.1 红腰豆黄酮提取、鉴定及含量测定
1.3.1.1 红腰豆黄酮粗提液的制备
按文献[5]制备红腰豆黄酮,即称取5.0 g预处理过的红腰豆粉,采用微波提取(乙醇体积分数71%、液料比40∶1 mL/g、微波功率560 W、微波时间8 min),滤渣重复提取2次后减压抽滤,合并滤液,旋转蒸发浓缩,备用。
1.3.1.2 黄酮的定性检验
以氢氧化钠溶液、三氯化铁溶液、盐酸镁粉反应作为黄酮的定性鉴定反应,3个反应均显色即可确定提取物含有黄酮类化合物[10]。
1.3.1.3 黄酮含量测定
以芦丁为标准品,按照文献[5]方法绘制标准曲线,标准曲线的回归方程为:A=11.982C+0.003 6,R2=0.999 4。取1 mL浓缩液稀释100倍后测吸光度值(3次平均值为0.432),计算所得浓缩粗提液的质量浓度为3.58 mg/mL,浓缩液冷冻干燥备用。提取量和纯度分别为70.85 mg/g、5.05%。
1.3.2 红腰豆黄酮的分离纯化
1.3.2.1 大孔树脂的预处理
将AB-8、XDA-1、ADS-7、ADS-17、DM-13、D101大孔树脂用95%乙醇浸制,搅拌,待树脂沉淀,倾去上层悬浮小颗粒。选取(ø10×300 mm)玻璃层析柱,湿法装柱。先用95%乙醇以2 BV/h洗脱至流出液加等量蒸馏水不变浑浊后,再用蒸馏水洗脱至无醇味。再依次用5%HCl和5%NaOH溶液以3 BV/h洗脱4 h后,蒸馏水洗至中性,用蒸馏水浸泡备用。
1.3.2.2 大孔树脂的静态筛选
分别称取2.0 g 6种处理好的大孔树脂(AB-8、XDA-1、ADS-7、ADS-17、DM-13、D101),于150 mL具塞磨口锥形瓶中,依次加入50.0 mL质量浓度为0.358 mg/mL的红腰豆黄酮粗提液,振荡(25℃,120 r/min,24 h),将树脂过滤,测定滤液吸光度并计算平衡质量浓度。用蒸馏水冲洗树脂3~5次,加入体积分数为95%的乙醇50.0 mL振荡2 h,测定各树脂解吸液吸光度并计算解吸液质量浓度,按公式计算各树脂吸附量、吸附率和解吸率,选出分离纯化红腰豆黄酮最佳的大孔树脂。
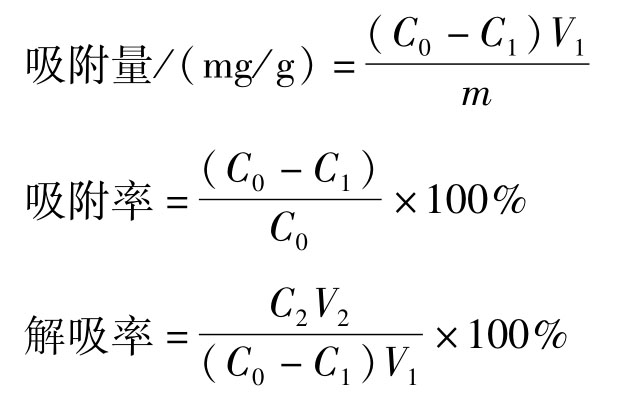
式中:m为树脂质量,g;C0为粗提液质量浓度,mg/mL;C1为平衡质量浓度,mg/mL;C2为解吸液质量浓度,mg/mL;V1为吸附液体积,mL;V2为解吸液体积,mL。
1.3.3 XDA-1树脂分离红腰豆黄酮工艺
室温条件下,对红腰豆黄酮提取液进行动态吸附实验,将预处理好的XDA-1树脂湿法装入(ø10×300 mm)玻璃层析柱中(约3/4柱高,树脂用量为20 g),上柱,洗脱,收集。分别考察上样液的质量浓度、吸附流速、上样量、pH值、洗脱流速、洗脱剂浓度和用量对树脂性能的影响程度,确定最佳工艺参数。
1.3.4 红腰豆黄酮对油脂抗氧化实验
油脂中的过氧化物在无水酸性条件下,使I-定量氧化成I2,I2与I-结合生成易溶于水的I3-,利用标准碘液吸光值与I3-的吸光值进行比较定量。采用GB/T 5538—2005标准推荐的碘量法和参考文献[11-12]的方法处理,在25 mL具塞比色管中,依次加入冰醋酸—氯仿2.0 mL和1%淀粉溶液1.0 mL,分别取0、0.1、0.2、0.3、0.4、0.5、0.6 mL已标定过的KI-I2标准溶液(含碘0~1.26 μg),加去离子水定容至刻度,摇匀,取上层清液,以去离子水为参比,在353 nm波长处测定吸光度,I2含量(m)对吸光度值(A)的线性回归方程为:m=224.215 3A+ 56.078 5,R2=0.998 5。
在100 mL三角瓶中加入48 mL油液溶液,即溶剂(黄酮溶液)∶(油)=1∶5,油为猪油或花生油。采用国际上通用的Schall烘箱强化贮存法考察红腰豆黄酮提取物对油脂的抗氧化作用[13],在一定条件下反应,间隔一段时间取定量待测试油样于15 mL干燥的比色管中,加入冰醋酸—氯仿混合溶液3 mL混匀,再加入饱和KI碱液0.2 mL轻摇30 s,然后置暗处3 min,去离子水加至刻度后加塞,颠倒混匀2~3次,静置约5~10 min,待水相澄清后,取上清液于石英比色皿中,以空白作参比,在353 nm处读取吸光值A,并由回归方程计算出碘含量。每个样品做3次平行实验取平均值。按公式计算油脂过氧化值(POV)及黄酮提取液对油脂的氧化抑制率(η):

式中含碘量和样品量单位分别为μg和g, POV0、POV1和POV2分别为初始时、添加黄酮强化氧化后和未添加黄酮强化氧化后的过氧化值。
2.1 黄酮提取物的鉴定结果
取3份提取液于白色点滴板上,各分别加入几滴质量浓度为1%的三氯化铁、氢氧化钠和盐酸镁粉溶液,反应后依次显深绿色、黄色和橙红色,表明提取液中含有黄酮类化合物。
2.2 大孔树脂类型的确定
为了筛选出适合红腰豆黄酮的最优树脂,比较不同型号树脂的极性、孔径大小、比表面积,通过静态吸附解吸实验考察红腰豆黄酮的吸附和解吸特性,结果如表1所示。
表1 不同树脂对红腰豆黄酮的吸附和解吸作用
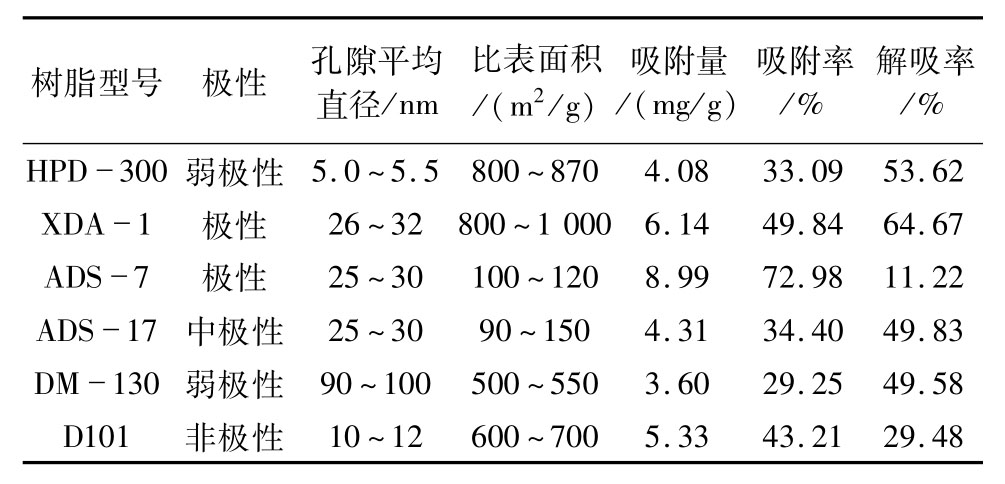
从表1可知,6种树脂的吸附和解吸性能差异较大,其中吸附量最大的为ADS-7,XDA-1次之,DM-130最小;解吸率最大的是XDA-1,ADS-7最小。可能是因为红腰豆黄酮类化合物主要由小分子组成,孔径较小的树脂对其吸附量相对较高,比表面积大的树脂解吸率相应较大。考虑到树脂对红腰豆黄酮类化合物的分离富集效果、洗脱难易及解吸率高低,选定XDA-1大孔树脂作进一步研究。
2.3 红腰豆黄酮XDA-1树脂分离工艺参数的确定
2.3.1 上样液质量浓度的确定
分别取0.5、1.0、1.5、2.0、2.5、3.0 mg/mL质量浓度的红腰豆黄酮提取液各50 mL,以2 BV/h流速通过树脂柱,进行动态吸附,待样品液全部通过树脂柱后,控制流速,先用蒸馏水洗至流出液无色后用95%乙醇洗脱,用分部收集器收集洗脱液,测定吸光度并计算吸附率。
由图1可知,随着质量浓度的增加,吸附率先上升后下降。当质量浓度为1.5 mg/mL时,吸附率值达到最大。这可能是由于样品质量浓度过低时,被吸附分子与树脂吸附基团之间接触的机会少,致使吸附率低;而当质量浓度增大到一定值后,则会发生多层吸附,导致树脂内部微孔堵塞,使内孔的利用率降低,吸附率也会下降[14]。考虑到树脂的吸附性能和效率,选择1.5 mg/mL为上样液质量浓度。
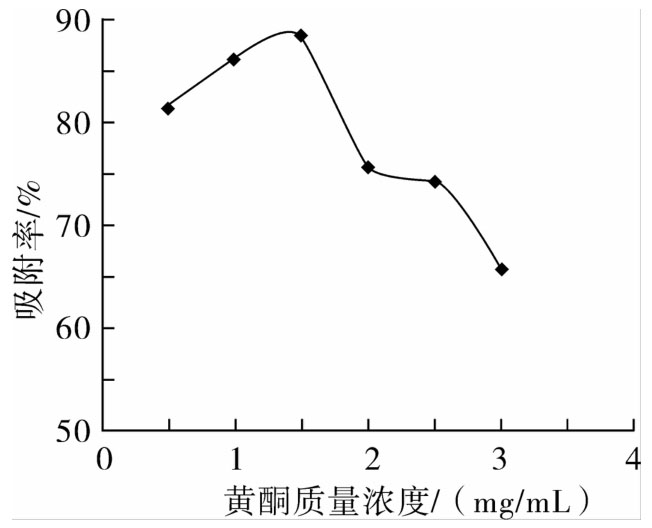
图1 上样液质量浓度对红腰豆黄酮吸附率的影响
2.3.2 吸附流速的确定
将质量浓度为1.5 mg/mL的红腰豆黄酮提取液50 mL,分别以1、2、3、4、5、6 BV/h流速通过树脂柱,其他操作同2.3.1节。
由图2可看出,吸附量随上样流速的增加而下降,这可能是因为在相同时间内,流速越小,黄酮提取液与树脂接触时间越长,越有利于提取液向树脂表面扩散,吸附量也就越大;反之,流速越大,接触时间越短,泄漏点就越早。流速为1 BV/h时,流速慢吸附效果最好,但泄漏点出现的最迟,造成操作周期延长。故选择2 BV/h为吸附流速。

图2 吸附流速对红腰豆黄酮吸附量的影响
2.3.3 上样液pH值的确定
取6份质量浓度为1.5 mg/mL的红腰豆黄酮溶液各50 mL,pH值分别配制成3、4、5、6、7、8,其他操作同2.3.1节。
由图3可知,吸附量随pH值的增大而呈现先增加后下降趋势,在pH为6左右时达最大值。可能与大孔树脂吸附原理有关,因吸附过程中碱性化合物在碱性溶液中易吸附,酸性化合物在酸性条件下易吸附。考虑到红腰豆黄酮上样液的pH值为5.97,呈弱酸性,欲达到较好的吸附效果,选择弱酸性条件比较合适,故选择pH值为6。
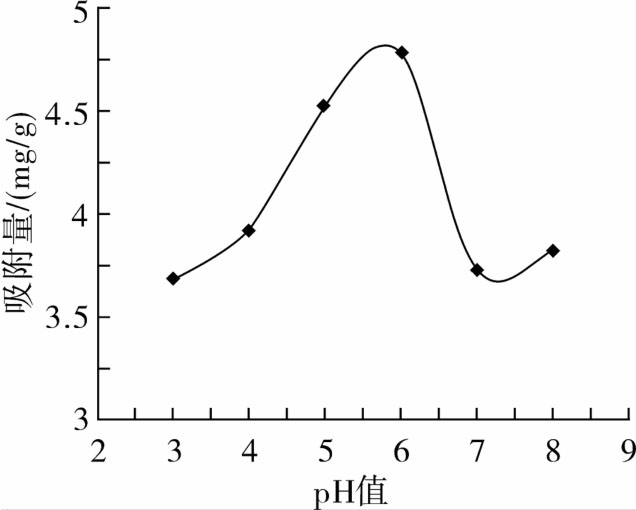
图3 pH值对红腰豆黄酮吸附量的影响
2.3.4 上样量的确定
将1.5 mg/mL的红腰豆黄酮溶液(pH 6)分别以1、2、3、4、5、6、7、8 BV体积上柱,其他操作同2.3.1节,每1 BV体积收集l管并进行测定和计算,绘制红腰豆黄酮质量浓度变化曲线。
由图4可看出,随着进样液体积的增加,流出液中红腰豆黄酮含量先快速增加,体积超过6 BV后,其泄漏量基本趋于稳定增幅不明显,这可能是因为此时树脂的吸附量基本达到饱和。而一般情况下,目标物质量浓度在流出液为上样液的1/10左右时,认为基本达到了目标物的泄漏点[15]。所以选择上样量为3 BV以达到最佳吸附效果。
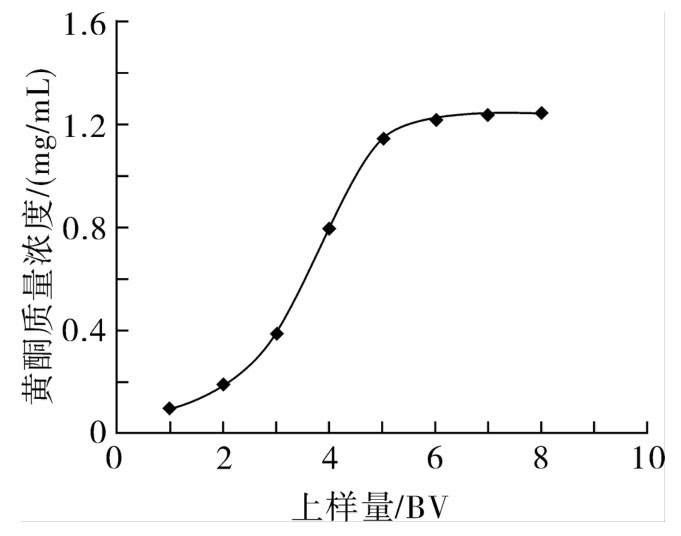
图4 上样量对红腰豆黄酮吸附性能的影响
2.3.5 洗脱流速的确定
将3 BV、质量浓度为1.5 mg/mL的红腰豆黄酮溶液(pH 6),以2 BV/h的流速通过树脂柱,待吸附完全后,用50 mL蒸馏水,以3~4 BV/h流速冲洗树脂柱至流出液无色(除多糖及蛋白质等杂质)后。用2 BV、95%的乙醇溶液分别以1、2、3、4、5、6 BV/h的洗脱流速进行洗脱,用分部收集器收集洗脱液,测定吸光度并计算。
由图5可看出,解吸率在1~2 BV/h区间时变化不大,超过2 BV/h后随洗脱流速的增加而剧降。说明洗脱流速越慢,解吸的效果越好,这可能是由于流速太快,使洗脱剂与被吸附黄酮接触时间过短,导致深层吸附的黄酮不能很好地被置换出来;而流速太慢,耗时,不利于工业化生产。因此,在解吸率不受影响的情况下,洗脱速度选择2 BV/h较为合理。
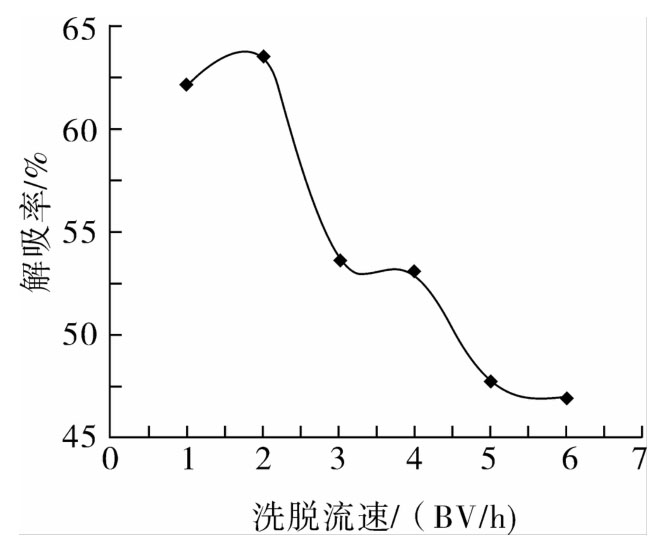
图5 洗脱流速对红腰豆黄酮解吸率的影响
2.3.6 乙醇体积分数的确定
按2.3.5节条件操作,以2 BV/h的速度,用体积分数为40%、50%、60%、70%、80%、90%的乙醇溶液洗脱,收集洗脱液测定并计算解吸率。
由图6可知,解吸率随乙醇体积分数的增加呈先增大后减小趋势,当乙醇体积分数达60%时解吸效果最好。这可能是由于乙醇体积分数较低时,红腰豆提取液中混杂的糖类、蛋白质等水溶性物质大量溶出不利于总黄酮类物质的洗脱;而乙醇体积分数过大时,提取液中的醇溶性杂质和亲脂性强的成分溶出量加大,与黄酮类化合物形成竞争,造成黄酮物质的溶解量减小。故选择体积分数为60%的乙醇溶液进行洗脱。
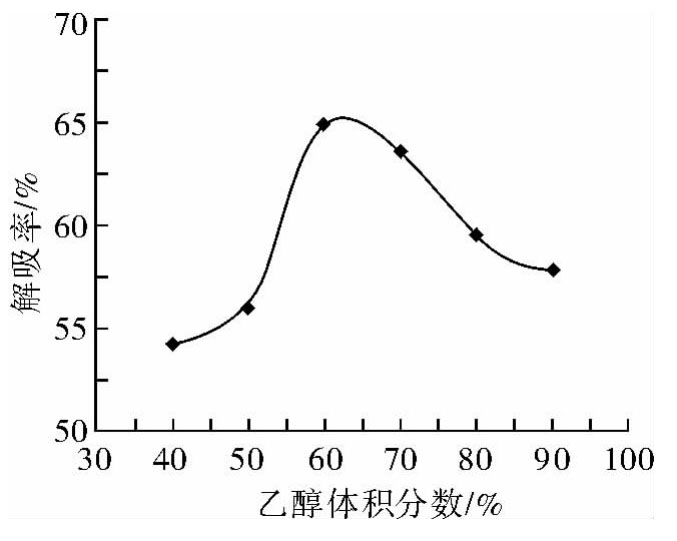
图6 乙醇体积分数对红腰豆黄酮解吸率的影响
2.3.7 洗脱剂用量的确定
按2.3.5节条件操作,70%乙醇溶液分别以0.5、1、1.5、2、2.5、3、3.5、4、4.5 BV体积的用量,以2 BV/h的速度洗脱,每0.5 BV体积收集1管,测定、计算并绘制变化曲线。
由图7可知,洗脱液用量在0.5~2.0 BV时,流出液中黄酮质量浓度大幅度上升。当洗脱液用量超过2.0 BV后,随洗脱液用量的再增加,流出液中黄酮质量浓度逐渐减小;且在洗脱液用量达到3.5 BV时,黄酮质量浓度趋于稳定,之后再增加洗脱剂用量,黄酮质量浓度无明显变化,说明此时黄酮已基本洗脱下来。因此洗脱剂用量选择3 BV即可。
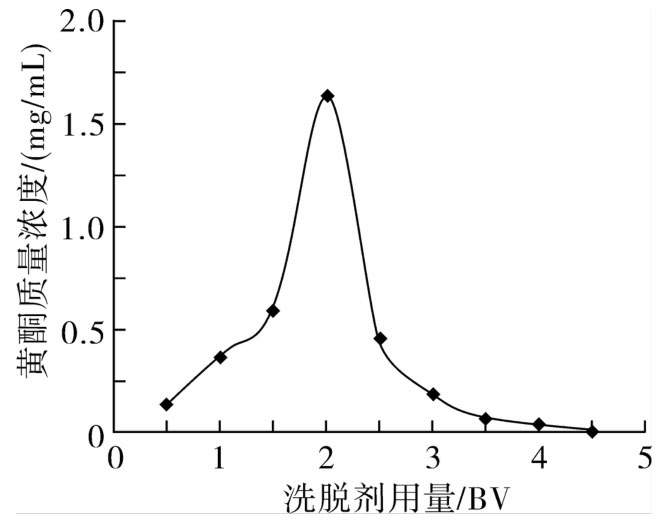
图7 洗脱剂用量对红腰豆黄酮解吸性能的影响
2.3.8 工艺验证结果
每次以50.00 mg红腰豆黄酮上样,按最佳工艺条件操作,结果收集量分别为36.96、37.06、36.77 mg,测定并计算得纯度为22.65%,平均得率为73.86%。说明该工艺条件下分离纯化实验具有良好的重复性。
2.4 红腰豆纯化黄酮对油脂的抗氧化作用
2.4.1 温度对油脂抗氧化效果的影响
加入0.20 mg/g纯化后的红腰豆黄酮提取物,在40、50、60、70℃的不同烘箱温度下,每60 min搅拌测定并变换它们在恒温箱中的位置,考察温度对油脂的氧化抑制率的影响,结果见图8。
从图8可明显看出,温度对测定结果的影响较大,在40~70℃温度范围内,随时间的延长,红腰豆黄酮纯提物对猪油的氧化抑制作用效果愈加明显,而对花生油的保护率却逐渐降低。且相同时间段,红腰豆黄酮纯提物对油脂的保护率随温度的升高而逐步降低,这可能是因为随温度上升,一方面油脂发生自氧化反应程度更加剧烈;另一方面较高温度使红腰豆黄酮纯提物的活性成分减少,导致其抗氧化能力降低。说明在相同条件下红腰豆黄酮纯提物作为抗氧化剂更适合动物油,升温会降低其活性。
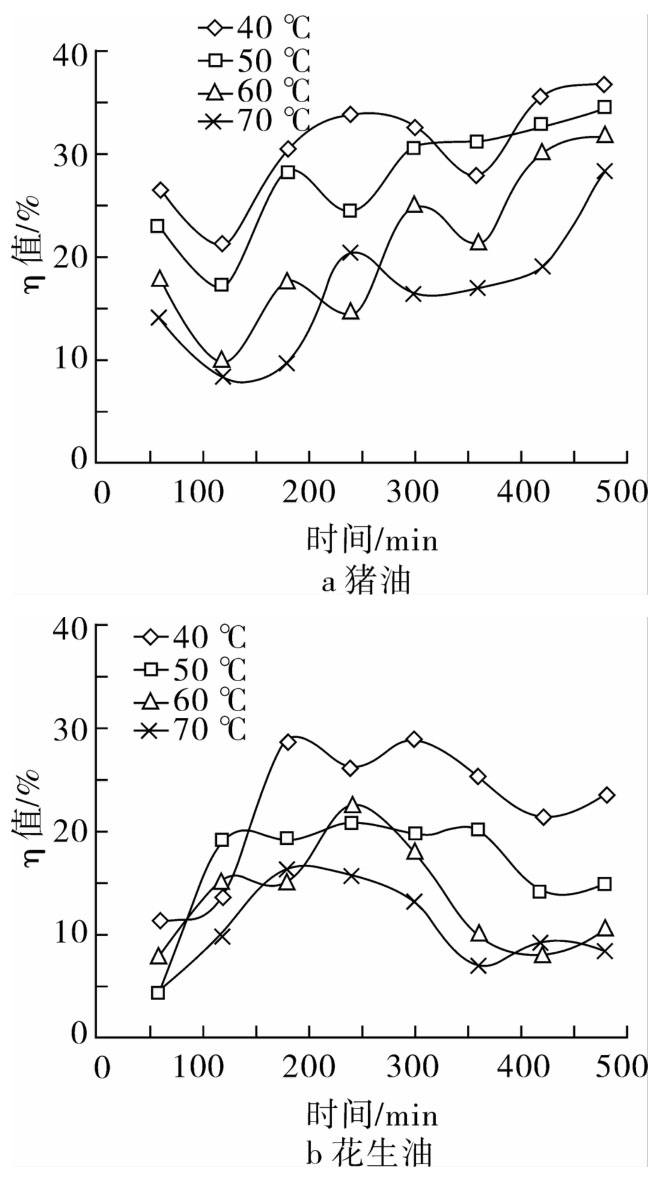
图8 不同温度下黄酮提取物对油脂的保护率
2.4.2 质量浓度对油脂的抗氧化性比较
将按0.05、0.10、0.15、0.20 mg/g比例加入纯化后红腰豆黄酮提取物的油脂与含0.10 mg/g的VE的油脂置于烘箱中[16-19],同时设置空白组,在(40±1)℃下保存,每2 d搅拌测定,并变换它们在恒温箱中的位置,考察红腰豆黄酮提取物对油脂的抗氧化能力。
从图9结果可看出,添加红腰豆黄酮提取物后,油脂的过氧化值低于空白组,而高于VE对照组。在0~0.20 mg/g质量浓度范围,过氧化值随质量浓度增大而逐渐降低,具有剂量相关效应;在降低过氧化值效果方面,花生油组都不及猪油组明显,这可能与猪油主要由饱和脂肪酸组成,相对植物油中不饱和脂肪酸更难氧化有关。
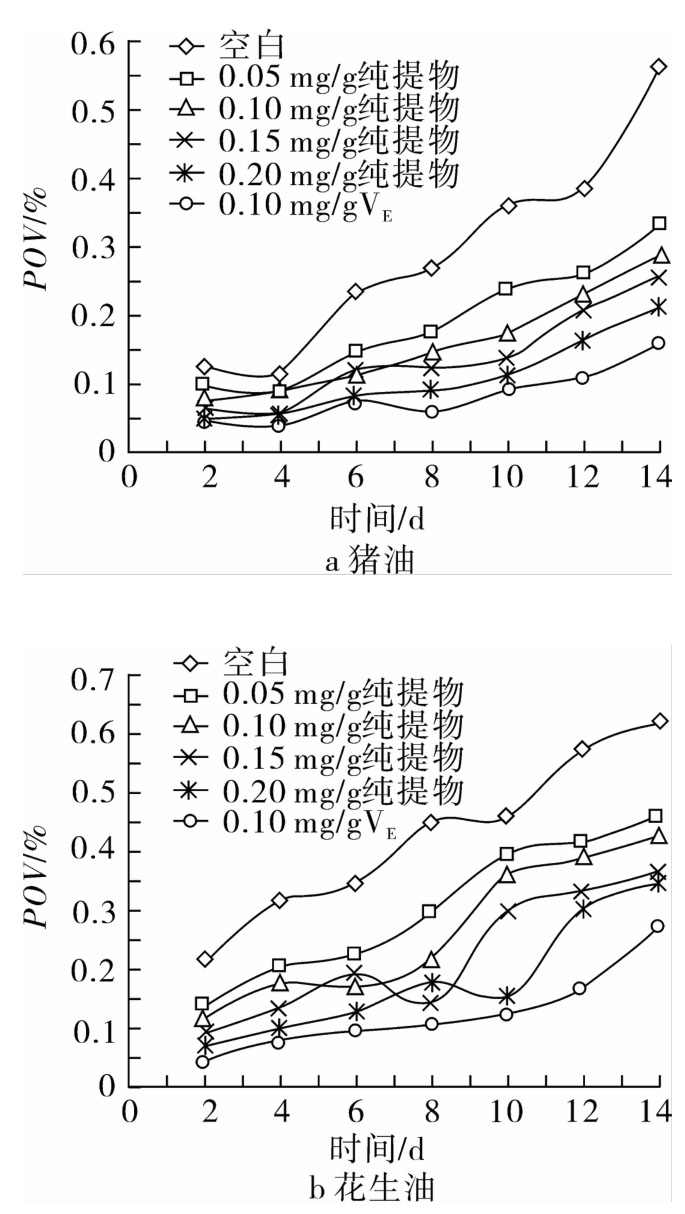
图9 不同抗氧化剂对油脂的抗氧化作用
通过6种不同型号大孔吸附树脂的静态吸附和解吸实验,得出XDA-l型大孔吸附树脂比较适合吸附和解吸红腰豆黄酮类化合物,吸附率达49.84%,吸附量6.14 mg/g,解吸率64.67%。较佳的分离条件为:上样液质量浓度1.5 mg/mL,吸附流速2 BV/h,上样液pH值6,上样量3 BV,洗脱速度2 BV/h,洗脱剂的乙醇体积分数为60%,洗脱量3 BV。在此工艺条件下,黄酮得率为73.86%,且纯度由5.05%提高到22.65%,纯度提高了4.49倍。
红腰豆黄酮纯化后对植物油和动物油均有一定的抗氧化效果,总体而言,在降低过氧化值效果上猪油组明显好于花生油组。红腰豆黄酮可作为一种新型的绿色食品抗氧化剂,抑制油脂氧化,延长保质期,又能起到保健作用,有望在含油食品及保健食品中推广应用,具有广阔的开发前景。
参考文献:
[1]张莉萍,杨俊霞.红腰豆无公害高产栽培技术[J].农村科技,2010(11):47.
[2]刘军.腰豆栽培技术要点[J].新疆农业科技,2011(11):48, 50.
[3]翁维健.中医饮食营养学[M].上海:上海科学技术出版社,1992.
[4]黎英,陈雪梅,严月萍,等.超声波辅助酶法提取红腰豆多糖工艺优化[J].农业工程学报,2015,31(15):293-301.
[5]黎英,严月萍,饶龙英,等.微波辅助提取红腰豆总黄酮工艺及抑菌研究[J].闽南师范大学学报(自然科版),2015,89(3):67-75.
[6]中国药典委员会.中国药典[M].北京:中国医药科技出版社,2010.
[7]罗悠,陈莉华,梁玄,等.金银花叶茎藤中黄酮与绿原酸同时提取分离工艺[J].吉首大学学报(自然科学版),2011,32(5):91-94.
[8]陈莉华,张俊生,朱士龙.大孔吸附树脂对湘西节节草多糖的吸附特性及机理[J].林产化学与工业,2013,33(5):55-60.
[9]易建华,朱振宝.芹菜黄酮在LSA-10树脂上的吸附特性[J].农业工程学报,2008,24(9):258-262.
[10]张国珍,吴汗民,崔铁军,等.食品生物化学[M].北京:农业出版社,1992:117-118.
[11]张俊生,陈莉华,段琛圭,等.车前子中黄酮提取物对油脂的抗氧化活性研究[J].中国粮油学报,2012,27(2):62-67.
[12]赵新淮,张娜,王琳.油脂过氧化值的碘量测定法比较研究[J].中国油脂,2003,28(4):60-62.
[13]GB/T 5009.37-2003.食用油脂卫生标准的分析方法[S].
[14]OUESLATI S,KSOURI R,FALLEH H,et a1.Phenolic content,antioxidant,anti-inflammatory and anticancer activities of the edible halophyte Suaeda fruticosa Forssk[J].Food Chemistry,2012, 132(2):943-947.
[15]刘长江,栾云峰,王菲,等.大孔吸附树脂分离纯化软枣猕猴桃总黄酮[J].食品科学,2011,32(12):145-148.
[16]王晓静,陈莉华,黄玉龙.火棘果黄酮对油脂的抗氧化活性[J].天然产物研究与开发,2015,27:909-914.
[17]GB 2760-2007.食品添加剂使用卫生标准[S].
[18]GB 1534-2003.食用花生油卫生标准[S].
[19]GB 10146-2005.食用动物油卫生标准[S].
Research on extraction of flavone from red kidney bean and the antioxidation
LI ying,LIU Chun-yan,LI Zi-yue,ZENG Zhen-qing,ZHENG Lan-xiang
(College of Life Science,Longyan University,Longyan Fujian 364012)
Abstract:Using crude flavonoids extracted from red kidney beans as the raw materials,the adsorption and desorption efficiencies of flavonoids with six different macroporous resins were compared,and XDA-1 resin was selected as the most efficient adsorbent as it had good adsorption and desorption capacity for flavonoids from red kidney beans.The antioxidation effect of flavonoids extract from red kidney beans on edible oils and FAts(lard and peanut oil)was investigated.The results showed that the optimal separation condition was:sample liquid concentration 1.5 mg/mL,adsorption flow rate 2 BV/h,sample pH value 6,sample volume 3BV,elution speed 2 BV/h,and ethanol volume fraction 60%,elution volume 3BV. Under the optimal separation condition the flavonoids yield and purity were 73.86%and 22.65%,respectively.The flavonoids extract can effectively defer the lipid oxidation,and moreover its antioxidant effect on lard was better than that on peanut oil.
Key words:red kidney bean;flavone;separation;macroporous resin; antioxidation
中图分类号:TS 201.4
文献标识码:A
文章编号:1007-7561(2016)05-0029-06
收稿日期:2016-03-15
基金项目:龙岩学院产学研项目(LC2015011)
作者简介:黎英,1974年出生,女,高级实验师.