α-半乳糖苷酶固定化的研究进展
解婉莹1,董墨思2,李苏红3
(1.沈阳师范大学粮食学院,辽宁沈阳 110034;2.沈阳师范大学化学与生命科学学院,辽宁沈阳 110034;3.沈阳农业大学食品科学学院,辽宁沈阳 110161)
摘 要:α-半乳糖苷酶催化α-半乳糖苷键的水解,可将豆制食品及饲料中的抗营养因子α-半乳糖苷类转化分解,改善营养成分使其易于消化吸收。近年,α-半乳糖苷酶的固定化更是成为研究的热点。作为固定化酶技术的重要组成部分,载体及固定化方法的选取在很大程度上直接影响着固定化酶的活性及稳定性。综述了近些年国内外有关α-半乳糖苷酶固定化方法、固定化载体材料的研究现状和发展趋势,以期对固定化α-半乳糖苷酶的酶活性及稳定性提高提供参考。
关键词:α-半乳糖苷酶;固定化酶;载体材料;固定化方法
α-半乳糖苷酶(α-Galactosidase.EC 3.2.1.2)也称蜜二糖酶,广泛分布于动物、植物、微生物中,能催化非还原性末端以α键结合的半乳糖苷类化合物水解。常被应用于含抗营养因子(α-半乳糖苷类物质)的豆类食品及饲料中,能够改善其营养成分使其易于消化吸收[1]。
豆类作为一种传统作物,在世界范围内被广泛种植,是食品与饲料工业的重要原料。豆类含有丰富的必需氨基酸[2]、蛋白质、脂肪、磷脂、异黄酮等营养和功能性成分[3],同时也具有保健功能如减少心血管疾病、骨质疏松症和癌症风险等[4]。但由于豆类中含有无法被人类及其他单胃动物消化的半乳糖苷类低聚糖如蜜二糖、棉子糖、水苏糖和毛蕊花糖等[5-6],所以摄食后会在小肠内部经厌氧发酵形成胃肠胀气[7],导致豆类制品的吸收利用率无法达到最大。而通过添加α-半乳糖苷酶进行酶解,则可显著改善营养吸收,提高产能[8]。
经研究发现,游离态α-半乳糖苷酶对所处反应体系要求较高,在强酸、强碱、高温、高离子浓度等条件下均会产生酶蛋白构象变化、酶活性值降低甚至完全丧失。同时,游离态α-半乳糖苷酶在反应后难以实现与产物及底物的高效分离,既影响了高纯度反应产物的获取又影响了酶制剂的重复使用,一定程度上局限了酶促反应的大规模应用[9]。对此,将α-半乳糖苷酶进行固定化操作成为解决现状的主要途径之一。固定化后,α-半乳糖苷酶除保持其原有的识别、结合、催化及理化活性外,还提高了α-半乳糖苷酶的稳定性,使α-半乳糖苷酶可反复连续使用,且效率高,成本低[10-11],能够实现酶促反应的连续生产及酶反应过程的严格控制。
α-半乳糖苷酶固定化效率主要取决于固定化方法和固定化载体的选取。固定α-半乳糖苷酶的理想载体材料本身应具备良好的热稳定性、化学稳定性、耐生物降解性和机械强度,在反应过程中应保持与酶的高度亲和性并能够使酶发挥高效的催化活性[12-16]。所以,在α-半乳糖苷酶的研究中设计、开发并制备出性能优异的α-半乳糖苷酶固定化载体,使固定化操作后的酶发挥高效稳定的催化活性已成为关键的研究点。目前,我国酶固定化方面的资料较为多见,但针对于α-半乳糖苷酶这一特定酶类的固定化载体及方法的研究鲜见报道,本文综述了近几年国内外关于α-半乳糖苷酶固定化研究的新趋势,以期为α-半乳糖苷酶的有效利用提供参考。
1 α-半乳糖苷酶的固定化方法
固定化酶技术从1957年发展至今,虽已出现多种固定化方法并成功应用于多种酶类,但截至目前,还未有一种方法可用于所有酶的固定化。针对于α-半乳糖苷酶这一特定酶类而言更是如此,由于产物用途不同、载体材料不同,所选用的固定方法也会大有不同。在实验过程中,如何依据产物需求及载体材料,选取相对应的方法使α-半乳糖苷酶的固定化操作简便、高效、低耗,固定化α-半乳糖苷酶活性高、稳定性好,已成为α-半乳糖苷酶固定化研究的关键所在。
依据游离态酶的理化特性和用途,酶的固定化方法可分为物理法及化学法两类。物理法原理主要是包埋固定[17]和吸附固定[18];化学法原理主要是化学交联固定[19]和共价结合固定[20]。各种方法优缺点及适用载体如表1所示。
表1 常用的酶固定化方法

方法名称原理优点缺点适用载体或方法吸附法[17]通过氢键、疏水键、电子亲和力等作用力实现酶的固定化工艺简单、吸附条件温和、酶活力回收率高、载体选择范围较大酶与载体结合力弱,受外界因素影响,酶易与载体分离物理吸附:活性碳、几丁质、多孔玻璃;离子吸附:DEAE(二乙氨基乙基)一纤维素、TEAE(四乙氨基乙基)-纤维素、DEAE一葡聚糖凝胶和阳离子交换剂(如羧甲基纤维素CMC)包埋法[18]通过物理作用将酶分子包埋于载体的一定空间内,实现对酶的固定化化学交法[19]利用双功能试剂或多功能试剂,使酶分子之间发生交联,实现对酶分子的固定化不需要酶蛋白氨基酸残基进行结合反应,很少改变酶的高级结构,可以得到活性较高的固定化酶。方法工艺简单、使用范围较广应用最广的双功能试剂是戊二醛,它能够与游离的酶分子所带的氨基形成吸附碱,从而实现对酶的固定。固定的酶能够牢固地固定在载体上,不易脱离只适用于催化底物为小分子的反应。因为酶分子被包裹住,大分子很难通过包裹酶分子底层,而与酶分子接触,这样酶分子就起不到催化的作用由于交联需要酶分子参加化学反应,所以酶的失活比较严重凝胶交联聚丙烯酞胺凝胶(包埋首例)、藻酸盐、卡拉胶、微囊包埋戊二醛共价结合[20]固相载体表面的官能团与酶分子上的官能团发生化学反应,形成共价键,酶分子与载体之间通过共价键的作用实现对酶分子的固定固定的酶比较牢固,并且不宜脱落,具有很好的稳定性和较高的重复使用率共价结合酶的载体表面的官能团一般有羧基、氨基、羟基、羰基等;由于反应条件比较剧烈,酶活力有所降低,工艺复杂,操作难度较大纤维素、琼脂糖凝胶、葡聚糖凝胶、甲壳素、氨基酸共聚物、甲基丙烯酸共聚物等
酶固定化的一般方法同样适用于α-半乳糖苷酶,同时应考虑到方法的物理化学过程、载体选择范围、操作经济性等各个方面,结合实际情况因地制宜地确定固定化方法。另一方面,固定化载体材料对α-半乳糖苷酶的活性及稳定性影响显著,对于α-半乳糖苷酶固定化来说适宜的方法和载体材料都是实验成功的关键性的因素。
2 α-半乳糖苷酶固定化载体
固定化酶载体材料种类繁多,如何选取、改性并最终成功应用于α-半乳糖苷酶固定化成为目前α-半乳糖苷酶固定化研究的技术难点。由于酶本身的环境敏感性、易失活等问题导致适合作为α-半乳糖苷酶固定化的载体材料较少。现阶段已应用于α-半乳糖苷酶固定化的载体如表2所示。
表2 α-半乳糖苷酶固定化载体材料及方法

注:Dynabeads®M-280 Tosylactivated[27]:链霉亲和素磁珠-2.8μm疏水;MyOneTMTosylactivated[27]:表面活化磁珠-1μm甲苯磺酰基;Dynabeads®TALONTM[27]:超顺磁性磁珠。
半乳糖苷酶来源改性剂固定化方法残存酶活性重复利用率石墨烯[21]鹰嘴豆戊二醛多点共价连接84%10次载体名称α-次52%海藻酸钙[23]黑曲霉戊二醛亲和固定(包埋)82%8 60%壳聚糖[22]鹰嘴豆吸附交联法62%12次77.9%二氧化硅[24]青霉属戊二醛共价连接33%8次33%*75%明胶[25]米曲霉甲醛64.3%4次45% MB-150[22]次22% EC-EA[26]番茄乙二胺A:戊二醛共价固定化B:戊二醛交联吸附鹰嘴豆吸附交联法51%12 A:52.3% B:38.1% Dynabeads®M-280 Tosylactivated[27]A:47.6% B:36.2% EC-HA[26]番茄茶酚胺A:戊二醛共价固定化B:戊二醛交联吸附人类化学耦合4次15% MyOneTMTosylactivated[27]人类化学耦合4次25% Dynabeads® TALONTM[27]人类化学耦合4次15%
2.1 功能化氧化纳米石墨烯
纳米材料作为一种新型固定化载体因其良好的生物相容性、较大的比表面积(能有效地提高载酶量)、较小的颗粒直径(具有很小的扩散限制,在溶液中能稳定存在)、易于在其表面偶联一些特异性配体,调控酶的结构和功能等优势,已成功应用于多种酶的固定化[28-29]。功能化氧化纳米石墨烯具有紧密结合的二维蜂窝状晶体碳原子,使载体材料拥有高导电性、机械强度和大的反应表面积[30];大量的亲水基团如环氧基、羟基、羧基酸,使载体表面积呈亲水性[31-32],此外,其耐热特性及良好的生物相容性,使其作为新型酶固定化载体材料在α-半乳糖苷酶固定化过程中首次使用并受到广泛关注[33]。
N.singh等人[21]将鹰嘴豆α-半乳糖苷酶固定到功能化石墨烯载体上并进行了扫描电子显微镜(SEM)和透射电子显微镜(TEM)测定,结果如图1所示,a、c中所呈现的功能化的石墨烯粒子透明、形状规整,而在b、d中所表现的粒子形状模糊、不完整、折叠状突起较多,这是由于功能化氧化纳米石墨烯经改性剂改性后表面结构改变,增加了酶的结合位点。实验表明功能化氧化纳米石墨烯适合α-半乳糖苷酶的固定化操作。功能化氧化石墨烯作为α-半乳糖苷酶的固定载体,所得固定化酶的酶活性值较高、稳定性较好(详见表2),连续使用10次后可保持初始活性的60%。但由于石墨烯材料的稀有性导致载体材料价格昂贵、目前仍难以适应工业化生产。

图1 功能化纳米石墨烯结构图[25]
a功能化氧化石墨烯载体(SEM);b功能化氧化石墨烯载体+α -半乳糖苷酶(SEM);c功能化氧化石墨烯载体(TEM);d功能化氧化石墨烯载体+α-半乳糖苷酶(TEM)
2.2 壳聚糖
壳聚糖是一种丰富、可再生的天然资源,属自然界中罕见的带正电荷的碱性多糖,具有生物兼容性、可降解性、生理惰性、亲水性、蛋白质亲和性、抗菌性及无毒性[34-37]。基于上述优势,壳聚糖的酶载体化研究受到多方关注。
目前,Neelesh Singh等人[22]已成功将鹰嘴豆中α-半乳糖苷酶固定到壳聚糖上,固定化酶残留活性及稳定性较好(见表2),在连续使用12次后可保持初始值的52%,下降率较低,且壳聚糖廉价易得,该法操作简单,适合于大规模生产操作。
2.3 树脂
树脂是一种廉价易得,物理稳定性、化学稳定性和机械渗透稳定性均极佳的固定化载体材料。树脂有天然树脂和合成树脂之分,其中在现代化工业生产领域应用最广泛的当属合成树脂。现阶段,α-半乳糖苷酶已成功固定到合成树脂类中的凝胶树脂[22]及大孔吸附树脂[26]上。其中凝胶型树脂与大孔型树脂的主要区别在于它们的孔隙度不同。凝胶型树脂的孔隙度很小,一般都在3 nm以下,而且严格地讲这些孔隙并不是真正的孔,而是交联与水合多聚物凝胶结构之间的距离,它随运行条件的改变而改变[22];而大孔型树脂则不同,它的“孔”大于原子距离,而且不是凝胶结构的一部分,所以这个孔是真正的孔,其大小及形状不受环境条件影响,因而在水溶液中不显示溶胀[26]。
2.3.1 安博莱特MB-150凝胶树脂
凝胶树脂是工业上应用广泛的材料之一,其价格便宜,机械性能好,再生容易,在酶工程领域作为固定化载体的应用日益广泛[38]。Neelesh Singh等人[22]成功将鹰嘴豆中的α-半乳糖苷酶固定到安博莱特MB -150凝胶树脂上。图2a为安博莱特凝胶树脂,b为将酶固定到安博莱特凝胶树脂上的实物高清图。

图2 安博莱特凝胶树脂高清图[34]
a安博莱特凝胶树脂;b安博莱特凝胶树脂+α-半乳糖苷酶
安博莱特凝胶树脂为α-半乳糖苷酶固定化载体,固定后残留酶活性虽与使用壳聚糖作为载体时相差不大为51%,但是当同样连续进行12次操作后其固定化酶酶活性值大幅度降低仅为22%,相比之下,选用壳聚糖为α-半乳糖苷酶固定化载体更有利于α-半乳糖苷固定化酶的稳定性保持。
2.3.2 SEPABEADS系列大孔树脂(EC-EA、ECHA)
SEPABEADS系列大孔吸附树脂是日本三菱化学享誉全球的品牌材料,它以吸附量高、颗粒均匀、机械强度好、不易破碎、残留物少,预处理方便而闻名世界。目前,以聚甲基丙烯酸酯(sepabeads EC)为基础的载体已成功地用于α-半乳糖苷酶固定化。Hasan Bayraktar等人[26]将番茄α-半乳糖苷酶固定到SEPABEAD EC-EA和SEPABEAD EC-HA两种大孔树脂上,两种固定化载体分别通过乙二胺和茶酚胺进行活化。然后进行不同温度点、不同酸碱度、不同重复次数后的残留酶活性测定,再分别与游离态酶进行比较,结果显著:固定化操作后其酶活性稳定明显优于游离态酶。具体数值如表2所示。
2.4 磁性材料
磁性粒子是指可均匀分散于一定基液中的胶态复合材料,具有超顺磁性、较高的比表面积、可修饰功能基团等。因此,通常会将抗原/抗体、酶、核酸/寡核苷酸、小分子药物等固定在其表面。磁性粒子的空间分布(MPS)可以实现远程区域控制,提供了一种独特的粒子精确控制[39]。在α-半乳糖苷酶固定化研究中,由于磁性粒子的载体化使α-半乳糖苷固定酶能够借助外部磁性从反应体系中快速简便富集、分离、回收,做到酶促反应的可操纵,极大地提高了固定化α-半乳糖苷酶的使用效率。
José L.Corcheroa等人[27]现已首次通过化学耦合(共价键和金属亲和吸附)手段成功地将α-半乳糖苷酶固定到不同型号的微型磁性粒子上(见表3),得出:固定化α-半乳糖苷酶与其对应的游离态酶相比具有更高的特异活性,而且通过与磁性定位粒子的耦合加强了酶本身的稳定性和重复利用性。最终以α-半乳糖苷酶残存酶活为考察指标,得出:固定化载体性能Dynabeads®TALONTM>MyOneTMTosylactivated>Dynabeads®M-280 Tosylactivated。
表3 磁性离子特性[27]
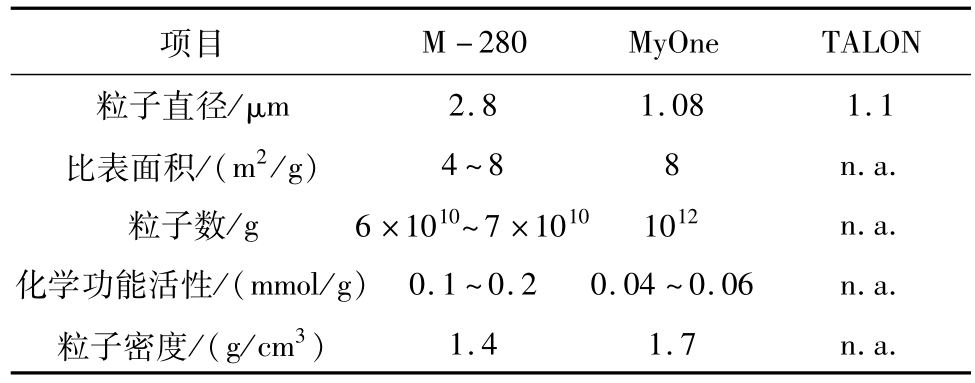
注:n.a.表示未从商品供应商处获取数据。
2.81.081.1比表面积/(m2/g)4~88n.a.粒子数/g6×1010~7×10101012n.a.化学功能活性/(mmol/g)0.1~0.20.04~0.06n.a. __粒子密度/(g/cm3)________________________M-280MyOneTALON粒子直径/μm项目_____________________________________________ 1.41.7________________ ____n.a.
2.5 海藻酸钙
海藻酸钠的分子链上含有大量的羟基和羧基,用氯化钙溶液作为交联剂,可形成交联的海藻酸钙聚合物,具有良好的生物降解性和生物相容性,可用于食品加工、制药,也是一种良好的α-半乳糖苷酶固定化载体材料[40]。
在海藻酸钙固定α-半乳糖苷酶的实验中,其固定化操作后残留酶活性为82%,8次操作后酶活性值为初始酶活性的77.9%,固定化α-半乳糖苷酶较为稳定,且载体材料廉价易得,操作简便,适合作为α-半乳糖苷酶固定化载体。
2.6 二氧化硅
二氧化硅作为一种传统无机材料,因其安全、稳定、廉价易得受到α-半乳糖苷酶固定化研究者的关注。α-半乳糖苷酶可与二氧化硅载体直接进行吸附也可与化学改性后的二氧化硅进行共价结合[41],从而实现α-半乳糖苷酶的固定化。有研究指出以二氧化硅为载体所获得的固定化α-半乳糖苷酶酶活性值较低且稳定性较差(如表2),针对实验方法及操作仍需进一步优化。
2.7 明胶
明胶是一种廉价、丰富、安全的载体材料,在食品领域常用作添加剂。与其他高分子载体材料相比,明胶拥有更多优势。天然明胶可供α-半乳糖苷酶固定化操作选择。材料本身在实验过程中稳定性强、可控性强、与α-半乳糖苷酶的结合性强。
目前研究多集中于将α-半乳糖苷酶包埋固定于甲醛改性后的明胶载体上,并最大限度提高游离酶加载量及固定化操作后的酶活性值。
K.Naganagouda等人已将[25]米曲霉中的α-半乳糖苷酶固定于甲醛改性的明胶上,通过连续反应模式将固定化酶作用于底物(豆浆),观察底物中棉子糖等寡糖类物质的水解率,评定α-半乳糖苷酶固定化效率。由表2数据可知,以明胶为载体固定α-半乳糖苷酶其酶活值较高,稳定性较强,表明明胶作为α-半乳糖苷酶固定化载体较为合适。
3 结论
以固定化α-半乳糖苷酶残留酶活值作为考察指标,发现功能化氧化纳米石墨烯、壳聚糖、海藻酸钙和明胶均可以作为α-半乳糖苷酶的固定化载体。但考虑到载体材料价格、来源及可操作性,壳聚糖、海藻酸钙和凝胶三种载体材料更适合大规模生产固定化α-半乳糖苷酶。
未来α-半乳糖苷酶的应用会更加广泛,固定化操作的必要性会体现的更加明显。结合无机载体材料及天然高分子载体材料特性,加以改性剂改良修饰、人为设计合成等方法开发新型α-半乳糖苷酶固定化载体,最大可能地提高固定化α-半乳糖苷酶的酶活值及稳定性,已成为α-半乳糖苷酶研究的重要方向。通过固定化方法提高固定化α-半乳糖苷酶的应用优势,扩大α-半乳糖苷酶工业化生产。
参考文献:
[1]NAUMOFF D G.Hierarchical classification of glycoside hydrolases[J].Mol Biol,2004,3(8):388-399.
[2]ZHOU L,JIANG Y,GAO J,et al.Oreiented immobilization of glucose oxidase on graphene oxid[J].Biochem Eng J,2012,69:28-31.
[3]郭顺堂,徐婧婷.大豆食品品质、功能性成分研究进展[J].农产品加工,2009,7:39-43.
[4]FALKOSKI D L,GUIMARA V M,CALLEGARI C M,et al. Rezende ST Processing of soybean products by semipurified plant and microbial a-galactosidases[J].J Agric Food Chem,2006,5(4): 10184-10190.
[5]KOTIGOUDA G,SHANKAR S K,DHANANJAY S K,et al.Degradation of Raffinose Oligosac charides in soymilk by immobilized agalactosidase of Aspergillus Oryzae[J].J Microbiol Biotechnol,2007,17(9):1430-1436.
[6]LESKE K L,JEVNE C J,COON C N.Effect of oligosaccharides additions on Nitrogen corrected true metabolizable energy of soy protein concentrate[J].Poult Sci,1993,72:664-668.
[7]蒋小丰,方热军.α-半乳糖苷酶在畜禽日粮中的应用研究[J].饲料工业,2009,30(10):18-21.
[8]RATTO M,SIIKA-AHO M,BUCHERT J,et al.Enzymatic hydrolysis of isolated and fibre-bound galactoglucomannans from pine wood and pine kraft pulp[J].Appl Microbiol Biotechnol,1993,40: 449-454.
[9]ENG C M,GUFFON N,WILCOX W R.,et al.Safety and Efficacy of Recombinant Human α-Galactosidase A Replacement Therapy in Fabry's Disease Desnick[J].R.J.N.Eng.J.Med.2001,345: 9-16.
[10]罗贵民.酶工程[M].北京:化学工业出版社,2003,251-253.
[11]王君虹,陈新峰,周利亘.乳酪蛋白肽的固定化酶法制备工艺研究[J].保鲜与加工.2008,8(4):41-44.
[12]TRAVASCIO P,ZITO E,PROTACCIO M,et al.Advantage of U-sing Non-Isothermal Bioreactors for the Enzymatic Synthesis of Antibiotics:The Penicillin G Acylase as Enzyme Model[J].Bio-tech.Prog,2002,18:975-985.
[13]TORRES C F,HILL C G.Lipase-Catalyzed Acidolysis of Butter Oil with Conjugated Linoleic Acid:A Kinetic Study Involving Multiple Reuse of the Immobilized Enzyme[J].Jr Ind Eng Chem Res,2004,43:3714-3722.
[14]张宪锋,郑裕国.酶法拆分手性化合物HPBE[J].生物加工过程.2003,1(2):34-38.
[15]KAMORI M,HORI T,YAMASHITA Y,et al.Immobilization of lipase on a new inorganic ceramics support,toyonite,and the reactivity and enantioselectivity of the immobilizedlipase[J].J Mol Catal B -Enzym,2000,9:269-274.
[16]陈陶声,居乃琥,陈石根.固定化酶理论与应用[M].北京:轻工业出版社,1987,98-102.
[17]MAKVICHEVA,ELENA A.Immobilized enzyme and cells in poly(N-vinyl caprolactam)based hydrogels[J].Appl Biochem Biotech,2000,88(1):145-157.
[18]奎斯特国际有限公司.乳糖酶在乳品中的应用[J].中国乳品工业,2003(1):51.
[19]FERNANDO L G,LORENA B,CESAR M,et al.Enzyme stabilization by glutaraldehyde crosslinking of adsorbed proteins on amiinated supports[J].J Biotechnology,2005,119(1):70-75.
[20]沈斌.木瓜蛋白酶的柔性固定化研究[D].南京:南京工业大学,2004,134-137.
[21]SINGH N,SRIVASTAVA G,TALAT M,et al.Cicer α-galactosidase immobilization onto functionalized graphene nanosheets using response surface method and its applications[J].Food Chem,2014,142:430-438.
[22]SINGH N,ARVIND M.,KAYASTHA.Cicer a-galactosidase immobilization onto chitosan and Amberlite MB-150:optimization,characterization,and its applications[J].Carbohydr.Res,2012,38:61-66.
[23]SHANKAR S K,PRAVEEN KUMAR V H,MULIMANI.Calcium alginate entrapped preparation of a-galactosidase:its stability and application in hydrolysis of soymilk Galactooligosaccharides[J].J Ind Microbiol Biotechnol,2011,38:1399-1405.
[24]JIANG Y,ZHANG Q,LI L F,et al.Glucose oxidase and graphene nanobiocomposite bridged by ioni liquid unit of glucose biosensing application[J].Sens.Actuators B,2012,161:728-733.
[25]NAGANAGOUDA K,PRASHANTH S J,SHANKAR S K,et al. ImmobiLization of Aspergillus oryzae a-galactosidase in gelatin,and its application in removal of flatulence-inducing sugars in soymilk[J].World J Microbiol Biotechnol,2007,23:1131-1137.
[26]KUBITZKI T,NOLL T,LUTZ S.Immobilisation of bovine enterokinase and application of the immobilised enzyme in fusion protein cleavage[J].Bioprocess Biosyst Eng,2008,31:173-182.
[27]JOSE L,CORCHEROA B C,ROSA MENDOZAA B.Enzymatic characterization of highly stable human alpha-galactosidase A displayed on magnetic particles[J].Biochem Eng J,2012,67: 20-27.
[28]VERMA M,BARROW C,PURI M.Nanobiotechnology as a novel paradigm for enzyme Immobilizatio and stabilization with potential applications in biodiesel production[J].Appl.Microbiol.Biotechnol,2003,97:23-39.
[29]GUPTA M N,KALOTI M,KAPOOR M,et al.Nanomaterials as matrices for enzyme immobilization Artif[J].Cells Blood Substitues Biotechnol,2011,39:98-109.
[30]DU D,WANG L,SHAO Y,et al.Functionalized graphene oxide as a nanocarrier in a multienzyme labeling amplification strategy for ultrasensitive electrochemical immunoassay of phosphorylated[J]. Anal Chem,2011,83:745-746.
[31]PARK S,RUOFF R S.Chemical methods for production of graphenes[J].Nat.Nanotechnol.2009,4:217-224.
[32]ZHANG J,ZHANG F,YANG H,et al.Graphene oxide as matrix for enzyme immobilization[J].Langmuir,2010,26(9):6083-6085.
[33]PHADTARE S,KUMAR A,VINOD V P,et al.Direct assembly of gold nanoparticles shells on polyurethane microspheres cores and their applications as enzyme immobilization templates[J].Chem Mater,2002,15:1944-1949.
[34]BRUGNEROTTO J,LIZARDI J,GOYCOOLEA F M,et al.An infrared investigation in relation with chitin and chitosan characterization[J].Polymer,2001,42:3569-3580.
[35]KRAJEWSKA B.Application of chitin-and chitosan-based materials for enzyme immobilizations:a review Enzyme[J].Microb. Technol,2004,35:126-139.
[36]TRIPATHI P,KUMARI A,RATH P,et al.Immobilization of aamylase from mung beans(Vigna radiata)on Amberlite MB 150 and chitosan beads:A comparative study[J].J Mol Catal B:Enzym,2007,49:69-74.
[37]DWEVEDI A,KAYASTHA A M.Lactose nano-probe optimized using response surface Methodology[J].J Agric Food Chem,2009,57:682-688.
[38]ESTER J,TOMOTANI,VITOLO M.Catalytic performance of invertase immobilized by adsorption on anionic exchange resin[J]. Process Biochemistry,2006,41(6):1325-1331.
[39]CORCHERO J L,VILLAVERDE A.Biomedical applications of distally controlled magnetic nanoparticles[J].Trends Biotechnol,2009,27:468-476.
[40]SALEEMUDDIN M.Bioaffinity based immobilization of enzymes[J].Adv Biochem Eng Biotechnol,1999,64:203-226.
[41]杨勇,李彦锋,拜永孝,等.酶固定化技术用载体材料的研究进展[J].化学通报,2007,4:257-263.
Research progress on α-galactosidase immobilization
XIE Wan-ying1,DONG Mo-si2,LI Su-hong3
(1.College of Grain Science and Technology,Shenyang Normal University,Shenyang Liaoning 110034;2.College of Chemistry and Life Science,Shenyang Normal University,Shenyang Liaoning 110034;3.Food Science College,Shenyang Agricultural University,Shenyang Liaoning 110161)
Abstract:α-galactosides catalyzes the hydrolysis of α-galactosidic linkage,it is advantageous to decompose α-galactosides(an anti-nutritional factor)in soybean foods and feeds for improving soybean′s nutrition composition and promoting assimilation.As an important part of the immobilization,the selection of the carrier material and the immobilization method directly affect the activity and stability of the immobilized enzyme.Recent research progress of the immobilization method and carrier materials for the immobilized α-galactosides were reviewed in order to provide reference for further research on activity and stability of the immobilized α-galactosides.
Key words:α-galactosides;immobilized enzyme;carrier material;immobilization method
中图分类号:TQ 464.8
文献标识码:A
文章编号:1007-7561(2016)03-0092-06
收稿日期:2015-11-09
基金项目:国家自然科学基金面上项目(31271819)
作者简介:解婉莹,1991年出生,女,研究生.
通讯作者:李苏红,1968年出生,女,教授.




