杨 涛,刘婷婷,杨 芬,王 芳,刘品华
(曲靖师范学院化学化工学院,云南曲靖 655011)
摘 要:检测了小黑药的多糖含量和抗氧化活性。结果表明:小黑药地上、地下部分多糖含量分别为2.155、2.329 g/100 g;多糖浓度大于100.8 μg/mL时其还原能力超过芦丁;随着质量浓度的增加小黑药多糖抑制超氧阴离子自由基的能力逐渐增大,浓度高于13.44 μg/mL时其抑制率大于芦丁;多糖质量浓度大于42.00 μg/mL时,清除DPPH能力大于芦丁;清除羟基自由基的能力明显高于芦丁,质量浓度为8.06 μg/mL时,多糖对羟基自由基的清除能力达到95.40%。小黑药多糖具有很好的抗氧化活性。
关键词:小黑药;多糖;抗氧化活性
小黑药(Sanicula astrantiifolia Wolff)伞形科,山芹菜属,又名:叶三七、大补药、变豆菜,主要分布在云南等地,其根茎叶均可烹调食用,是民间药食两用的保健食品,以根茎为药,具有抗菌抑菌、镇痛、解痉、抗肿瘤、利胆、降血糖、降血清胆固醇、利尿,补肺益肾、治疗肺结核、肾虚腰痛、头昏等功效[1-5]。多糖在很多方面都发挥着重要的生物活性作用,如抗肿瘤、抗病毒、抗炎、降血糖、抗衰老、免疫调节等[6-12]。同时多糖联系着细胞与细胞及细胞与外界的能量和物质传递,决定着大分子与细胞及其它分子之间的相互作用[13]。由于抗氧化剂能防止食物腐败、保护人体免于活性氧的损伤,人们对抗氧化剂的作用越来越关注[14]。因此研究无毒、营养的天然抗氧化物具有重要的意义[15]。为此我们检测了小黑药的多糖含量和抗氧化活性,为进一步认识小黑药的作用和价值提供依据。
1.1 实验仪器
AL204-IC型分析天平,梅特勒—托利多仪器上海有限公司;DHG-9075A型电热鼓风恒温干燥箱,上海齐欣科学仪器有限公司;N-1100型旋转蒸发仪,上海爱朗仪器有限公司;TU-1810型紫外分光光度计,北京普析通用仪器有限责任公司。
1.2 材料与试剂
小黑药全株,曲靖陆良农贸市场购买,洗净、晒干,经植物粉碎机粉碎后得小黑药粉末备用;DPPH,日本和光纯乐工业株式会社;芦丁,光谱纯,中国药品生物制品检定所;三羟甲基胺基甲烷(Tris),进口分装;葡萄糖(分析纯),天津市化学试剂三厂;邻苯三酚(分析纯),遵义市第二化工厂。
1.3 实验方法
1.3.1 葡萄糖标准曲线的建立
参照NY/T 1676中的硫酸-苯酚法,称取105℃烘干至恒重的葡萄糖0.101 0 g定容至1 000 mL的容量瓶中得标准葡萄糖溶液。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL的标准葡萄糖工作液置于20 mL具塞玻璃试管中,用蒸馏水补至1.0 mL。向试液中加入1.0 mL重蒸馏苯酚配置的5%苯酚溶液,然后快速加入5.0 mL硫酸(注意:硫酸应与液面垂直加入,切勿接触试管壁,以便与反应溶液充分混合),静置10 min。涡旋振荡混合,然后将试管置于30℃水浴中反应20 min,在490 nm波长处测其吸光度。质量浓度与吸光度经线性回归,得标准曲线回归方程为:y=0.010 5x+0.083 8,相关系数R2= 0.999 1。
1.3.2 小黑药中多糖含量的测定
称取1.021 0 g(m2)粉碎过的小黑药样品,置于50 mL比色管中,加入5 mL水后再缓慢地加入20 mL无水乙醇,用涡旋振荡器振摇,使其混合均匀,置于超声提取器中提取30 min。提取结束后于4 000 r/min离心10 min,弃去上层清液。不溶物用10 mL乙醇溶液洗涤、离心。然后用水将上述不溶物转入圆底烧瓶,加入50 mL蒸馏水,回流提取2 h。冷却至室温,过滤,将上述清液转移至100 mL容量瓶中,残渣洗涤2~3次,洗涤液转移至容量瓶中,加水定容。取定容溶液1 mL于5支20 mL具塞试管中,向试液中加入1.0 mL 5%苯酚溶液,然后快速加入5.0 mL硫酸,同时做空白对照实验,静置10 min后涡旋振荡器充分混合,然后将试管置于30℃水浴中反应20 min,490 nm下测其吸光度。由回归方程计算多糖含量为m1,多糖含量质量分数w,计算公式为:
w/(g/100 g)=![]() ×0.9×10-4,其中0.9为葡萄糖换算成葡聚糖的校正系数。
×0.9×10-4,其中0.9为葡萄糖换算成葡聚糖的校正系数。
1.3.3 小黑药多糖的提取[16]
将粉碎的小黑药用乙醇回流处理3次,每次约1 h,渣用水提取3次,每次约1 h,水提取液于80℃浓缩除去大部分水,然后于高速离心机中离心、上层清液加入三氯乙酸(占溶液总体积的10%),放置过夜,离心、上层清液在80℃浓缩至100 mL左右,浓缩后的清液加无水乙醇调整浓度为85%,放置过夜后离心,固体用85%乙醇洗涤4次,固体干燥得小黑药实验用多糖。考虑到与芦丁的对比实验,所以配制成质量浓度为0.336 mg/mL的实验样液(与芦丁浓度一致)供测试抗氧化活性使用。
1.3.4 还原能力的测定[16]
分别取水提取多糖实验样液0.05、0.10、0.15、0.20、0.25 mL,于25 mL的比色管中,并补充水至0.50 mL(即得样液测试质量浓度为33.6、67.2、100.8、134.4、168.0 μg/mL)。考虑到实验样液的可能影响,采用不加铁氰化钾为对应空白样。分别加入0.2 mol/L的磷酸缓冲液(pH=6.6)2.50 mL和1%的铁氰化钾2.50 mL,混合均匀,于50℃水浴中反应20 min后快速冷却,加入10%的三氯乙酸溶液2.50 mL,混合均匀(澄清无需离心)。取清液2.50 mL于试管中,加入2.50 mL蒸馏水,再加入0.1%的三氯化铁溶液0.50 mL,混合均匀,于室温下静置反应10 min,1 cm石英比色皿在700 nm处测定吸光度值。采用上述方法测定对照样芦丁的还原能力,芦丁质量浓度为0.336 mg/mL。
1.3.5 抑制超氧阴离子自由基实验[16]
分别取水提取多糖实验样液0.10、0.20、0.30、0.40、0.50、0.60 mL,于25 mL的比色管中,补充水至5 mL。各加入4.70 mL pH 8.2的Tris-HCl缓冲溶液,0.30 mL 3 mmol/L邻苯三酚溶液,即得样液测试质量浓度为3.36、6.72、10.08、13.44、16.8、20.16 μg/mL。用1 cm石英比色皿在320 nm波长下测试,吸光值为Ax,以10 mmol/L HCl溶液0.30 mL代替邻苯三酚溶液测定的吸光值为Axo。用纯水代替实验样液测得的吸光值为Ao,用纯水代替实验样液和邻苯三酚的吸光值为Aox。采用质量浓度为0.336 mg/mL的芦丁作对照,实验方法同上。对超氧阴离子自由基的抑制率计算公式为:
1.3.6 清除DPPH实验[16]
称取20 mg的DPPH,用无水乙醇溶解定容于250 mL容量瓶中,配制成质量浓度为2×10-4mol/L的DPPH溶液,0~4℃下避光保存。分别取水提取多糖实验样液0.10、0.20、0.30、0.40、0.50、0.60 mL于比色管中,补充乙醇至2 mL,然后加入配制好的DPPH溶液2 mL混匀,即样液测试质量浓度为8.40、16.80、25.20、33.60、42.00、50.40 μg/mL。置于室温暗处反应30 min,在517 nm下测得的吸光值为A1,用2 mL纯水代替样液所测得的吸光值为A2,用2 mL乙醇代替DPPH溶液测得的吸光值为A3;以质量浓度为0.336 mg/mL的芦丁作对照,实验方法同上。DPPH的清除率计算公式为:
1.3.7 清除·OH实验[16]
分别取0.10、0.20、0.30、0.40、0.50、0.60 mL的水提取多糖实验样液放于25 mL的比色管中,各加入2 mL 6 mmol/L硫酸亚铁,2 mL 6 mmol/L过氧化氢,放置25 min后用6 mmol/L 的水杨酸-乙醇溶液定容至25 mL,即得样液测试质量浓度为1.34、2.69、4.03、5.08、6.72、8.06 μg/mL。在36~37℃恒温水浴中反应15 min,1 cm石英比色皿于510 nm处测定吸光度值Ax,以水代替实验样液测得吸光度值为Ao,以乙醇代替水杨酸-乙醇组测得吸光度值Axo,以乙醇代替实验样液、水杨酸-乙醇的为空白管。以质量浓度为0.336 mg/mL的芦丁作对照,实验方法同上。实验样液对羟基自由基的清除率为:

由表1可知,平行四次实验,地上、地下部分极差分别为0.01、0.007,极差与平均值之比分别为0.46%、0.30%,精密度较高。小黑药地上、地下部分多糖含量分别为2.155、2.329 g/100 g。小黑药地下部分的多糖含量高于地上部分。
表1 小黑药地上、地下部分多糖含量
由表2可知,多糖质量浓度在67.2 μg/mL以下时小黑药多糖的还原能力比芦丁的弱;随着多糖质量浓度的增加还原能力逐渐增强,在100.8 μg/ mL浓度以上时多糖的还原能力比芦丁的强,且随着浓度的增加其还原能力的增加幅度大于芦丁,高浓度时表现出较强的还原能力,与在油脂中表现出的抗氧化能力相一致[2]。
表2 小黑药多糖的还原能力

由表3可知,小黑药多糖和芦丁的质量浓度越大,对O2
-·的抑制率越强。随着时间的延长抑制率逐渐减弱。当多糖浓度高于13.44 μg/mL时小黑药多糖的抑制率高于芦丁,且随着浓度的增加多糖的抑制率增加幅度优于芦丁,与表2的还原能力表现一致。
表3 小黑药多糖对超氧阴离子自由基的抑制率 %

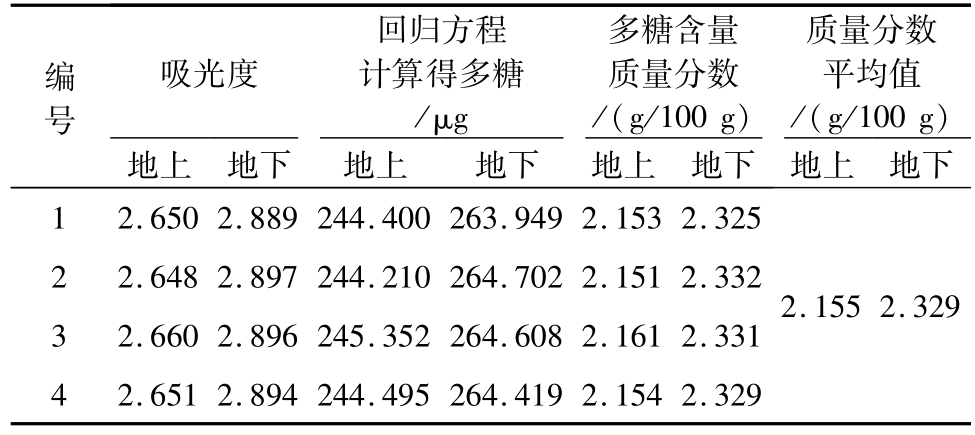
N,N-二苯基-2-三硝基苯肼自由基(DPPH),是一种以氮为中心的很稳定的自由基,在517 nm波长处有强吸收,当有自由基清除剂存在时,由于与它的单电子数配对而使其吸收逐渐消失,褪色程度与所接受的电子成定量关系,所以通过测定物质对DPPH自由基的清除能力,可以迅速地评价物质的抗氧化能力[16]。由表4可知,小黑药多糖对DPPH自由基的清除能力随质量浓度的增加逐渐提高,在小黑药多糖质量浓度为42.00 μg/mL时多糖的清除能力超过芦丁。芦丁对DPPH自由基的清除能力在浓度高于33.60 μg/mL时上升幅度减小,多糖随浓度的增加清除率上升幅度大于芦丁,高浓度时具有较强的清除率。
表4 小黑药多糖对DPPH自由基的清除能力%
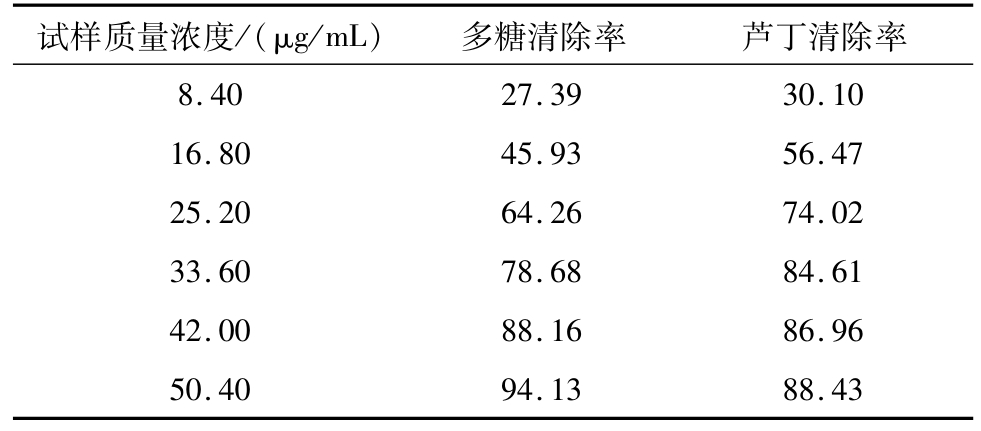
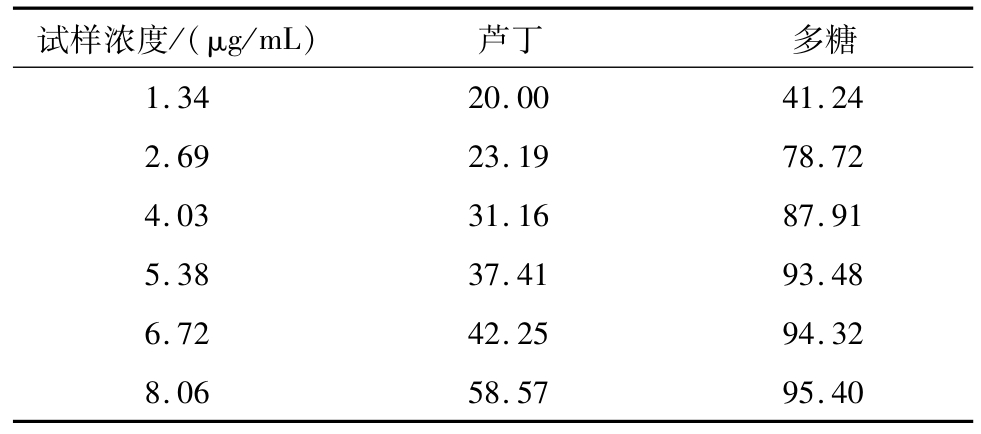
羟基自由基是目前所知活性氧中对生物体毒性最强、危害最大的一种自由基,它可以通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,造成糖类、氨基酸、蛋白质、核酸和脂类等物质的氧化性损伤,使细胞坏死或突变[17]。由表5可知,小黑药多糖对羟基自由基的清除能力在实验质量浓度范围内明显优于芦丁,浓度为8.06 μg/mL时多糖对羟基自由基的清除能力达到95.40%,表现出较强的清除能力。
表5 小黑药多糖对羟基自由基的清除能力%
小黑药地上、地下部分多糖含量分别为2.155、2.329 g/100 g。浓度分别大于100.8、13.44、42.00 μg/mL时多糖的还原能力、抑制超氧阴离子自由基的能力、对DPPH自由基清除能力大于对照样芦丁,并表现出随浓度的增加抗氧化能力上升幅度大于芦丁。对羟基自由基表现出较高的清除率。小黑药多糖具有较好的抗氧化活性,验证了传统用小黑药在药物和保健方面的作用,也表明小黑药有较高的应用和开发价值。
参考文献:
[1]杨光红,张鸭关,汪帆,等.小黑药中营养成分及有毒成分研究的综合设计性实验探讨[J].安徽农业科学,2011,39(31): 19648-19649.
[2]刘品华,杨光红,田雪莲,等.小黑药抗油脂氧化及抑菌效果研究[J].食品工业科技,2011,32(10):187-189.
[3]云南省卫生局革命委员会.云南中草药[M].昆明:云南人民出版社,1971:98-99.
[4]张鸭关,曾国荣,刘品华,等.小黑药食用安全性的毒理学评价[J].贵州农业科学,2014,42(11):184-186.
[5]赵丽,辛克勤,李永秋.显脉旋复花[J].食品与药品,2007,9(5):53-54.
[6]王蓉,吴剑波.多糖生物活性的研究进展[J].国外医药.抗生素分册,2001,22(3):97-100.
[7]Kong F L,Zhang M W,Kuang R B,et al.Antioxidant Activities of Different Fractions of Plysaccharide Purified from Pericarp Tissue of Litchi(Litchi Chinensis Sonn)[J].Carbohydrate Polymers,2010,81(3):612-616.
[8]Li X M,Ma Y L,Liu X J.Effect of the Lycium Barbarum Polysaccharides on Age-Related Oxidative Stress in Aged Mice[J].Journal of Ethnopharmacology,2007,111(3):504-511.
[9]Lin C L,Wang C C,Chang S C,et al.Antioxidative Activity of Polysaccharide Fractions Isolated from Lycium Barbarum Linnaeus[J]. International Journal of Biological Macromolecules,2009,45(2): 146-151.
[10]Wang C C,Chang S C,Stephen I B,et al.Isolation of Carotenoids,Flavonoids and Polysaccharides from Lycium Barbarum L. And Evaluation of Antioxidant Activity[J].Food Chemistry,2010,120(1):184-192.
[11]Sun Y X,Li T B,Liu J C.Structural Characterization and Hydroxyl Radicals Scavenging Capacity of a Polysaccharide from the Fruiting Bodies of Auricularia Polytricha[J].Carbohydrate Polymers,2010,80(2):377-380.
[12]Chen R Z,Meng F L,Liu Z Q et al.Antitumor Activities of Different Fractions of Polysaccharide Purified from Ornithogalum Caudatum Ait[J].Carbohydrate Polymers,2010,80(3):845-851.
[13]郭忠武,王来曦.糖化学研究进展[J].化学进展,1995,7(1):10-29.
[14]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2006,32(3):92-98.
[15]赵雪,董诗竹,孙丽萍,等.海带多糖清除氧自由基的活性及机理[J].水产学报,2011,35(4):531-538.
[16]刘品华,黄玉梅,金亚蓉,等.臭参多糖含量的测定及抗氧化活性的研究[J].食品科技,2013,38(8):282-286.
[17]刘品华,金亚蓉,刘明研,等.臭参地上部分总黄酮含量及抗氧化活性的研究[J].西南农业学报,2014,27(5):1894-1898.
[18]张燕平,戴志远,陈肖毅.紫苏提取物体外清除自由基能力的研究[J].食品工业科技,2003,24(10):67-71.
Polysaccharides contents and antioxidant activity of Sanicula astrantiifolia Wolff
YANG Tao,LIU Ting-ting,YANG Fen,WANG Fang,LIU Ping-hua
(College of Chemistry and Chemical Engineering,Qujing Normal University,Qujing Yunnan 655011)
Abstract:The polysaccharides contents and antioxidant activity of Sanicula astrantiifolia Wolff were detected.The results showed that:the polysaccharides contents in aboveground and underground part of Sanicula astrantiifolia Wolff were 2.155 and 2.329 g/100 g respectively;when the polysaccharides concentrations were more than 100.8 μg/mL,the reducing ability of polysaccharides was higher than rutin;the inhibition ability to the superoxide anion free radical(O2-·)gradually increased with the increasing of mass concentration;when the polysaccharides concentrations were more than 13.44 μg/mL,the inhibition rate was higher than rutin;The scavenging capacity of DPPH radical was higher than rutin when the polysaccharides concentrations were more than 42.00 μg/mL;the scavenging ability to hydroxyl radical(·OH)was significantly higher than rutin,and when the mass concentration was 8.06 μg/mL,the ability reached 95.40%;the polysaccharides of Sanicula astrantiifolia Wolff have good antioxidant activity.
Key words:Sanicula astrantiifolia Wolff;polysaccharides;antioxidant activity
中图分类号:TS 201.2
文献标识码:A
文章编号:1007-7561(2016)03-0055-04
收稿日期:2015-11-11
基金项目:曲靖师范学院资源与环境化学重点实验室项目资助(SYS2010BX01)
作者简介:杨涛,1992年出生,男,本科.
通讯作者:刘品华,1963年出生,男,教授.