韩健飞1,单长松2,王少刚1,宋占华1,吴 澎2,李法德1
(1.山东农业大学机械与电子工程学院,山东泰安 271018;2.山东农业大学食品科学与工程学院,山东泰安 271018)
摘 要:采用通电加热和传统(油浴)加热两种方式处理豆浆样品,研究通电加热过程中电源电压、电源频率和保温时间对豆浆中脂肪氧化酶活性的影响。结果表明:采用的电源电压越高,通电加热处理后的豆浆中脂肪氧化酶活性越高;较高的电源频率对脂肪氧化酶的钝化具有显著的促进作用,但是当电源频率超过500 Hz后,电源频率的提高对脂肪氧化酶的活性影响较小;延长保温时间会促进脂肪氧化酶的钝化,通电加热过程中电场的存在会促进脂肪氧化酶的钝化。各因素对脂肪氧化酶活性的作用规律,可以对通电加热设备的设计与生产产生积极的指导作用。
关键词:通电加热;豆浆;脂肪氧化酶;钝化
大豆中含有多种酶,其中脂肪氧化酶活性最高[1]。并且大豆中脂肪氧化酶的含量也比较大,约占大豆中蛋白质总含量的1%~2%[2-3]。脂肪氧化酶主要催化不饱和脂肪酸中含双顺式1,4-戊二烯结构,通过加分子氧,生成多种过氧化物[4]。在催化反应中,不仅生成具有共扼双键的过氧化物,还继续分解产生醛、酮等具有挥发性的物质,导致了豆腥味的产生[1],从而影响了豆浆的品质。
在豆浆的传统加工过程中,为使豆浆达到饮用条件,需要在93~100℃下加热30 min[5]。这种加热方式条件要求相对较高,并且容易造成氨基酸和维生素的损失[6-9]。通电加热也被称为焦耳加热,基本原理是把食品物料作为电路的一部分[10],当电流通过食品物料时,由于食品物料固有的阻抗特性而将电能直接在食品内部转换成热能,从而达到加热食品的目的[11],通电加热的能量转化过程(电能转化为热能)在材料内部,无加热面,所以具有加热快速、易控制、电能转化率可达95%和环境友好,并能实现固体食品和含有颗粒的液固混合食品的高温快速杀菌等优点[12]。利用通电加热方法对豆浆进行加热具有促进豆浆中的一些活性物质如脲酶、胰蛋白酶抑制剂钝化的作用[13],能够在更短的加热时间以及更低的能耗下使豆浆达到饮用的条件。在测定脂肪氧化酶活性的诸多方法[14]中,分光光度法具有快速、简便、易于连续测定的优点[15],其原理是脂肪氧化酶与底物亚油酸发生酶促反应[16],生成的过氧化物在234 nm[17]波长处有特征吸收峰,因此可用234 nm处的吸光度的增加来考察酶活。实验中采用控制变量法来探究各因素对脂肪氧化酶活性的影响,通过对比实验来研究电场对脂肪氧化酶活性的作用。
1.1 材料
大豆:荷豆12,山东农业大学农场,室温下干燥处存放。
1.2 实验方法
1.2.1 硼酸缓冲液的制备
准确称量9.530 g四硼酸钠(分析纯,天津市永大化学试剂有限公司),用去离子水溶解后定容于500 mL容量瓶中。准确称量3.091 g硼酸(分析纯,天津市凯通化学试剂有限公司),用去离子水溶解后定容于250 mL容量瓶中。使用时将上述两种溶液按4∶1的体积比混合[18]。
1.2.2 底物的制备
取60 μL亚油酸(60%~74%纯度,上海原叶生物科技有限公司)和60 μL 吐温-20(分析纯,天津市巴斯夫化工有限公司)混合于具塞试管(50 mL)中,加入8 mL pH 9的0.2 mol/L硼酸缓冲液,混合均匀,加入0.2 mol/L硼酸缓冲液40 mL,使溶液稀释6倍[19]。
1.2.3 脂肪氧化酶标准液制备
用电子天平准确称量脂肪氧化酶(L-7395,l-B,美国Sigma公司)10 mg,用脱氧蒸馏水溶解后,转移至50 mL容量瓶中,去离子水定容后得到的溶液为脂肪氧化酶标准液,其浓度为0.2 mg/mL。
1.2.4 豆浆的制备
称量无破碎、虫咬、变质籽粒的大豆40 g,用去离子水冲洗3次后沥干,放入250 mL烧杯中,然后按1∶3的豆水比加入去离子水,在室温25℃下浸泡18 h左右。浸泡结束后,用去离子水冲洗3遍,沥干。磨浆时按干大豆与水的质量比为1∶10的比例用磨浆机(MB-KS0601,江苏松桥电器有限公司)研磨120 s,然后用100目滤布过滤[13]。豆浆中固形物含量为6.37%。
1.2.5 大豆脂肪氧化酶标准曲线
大豆脂肪氧化酶标准曲线的绘制是参照蒋和体等提出的实验方法[1]进行。实验在25℃、光径为1 cm、容积为3 mL的石英比色皿中进行。实验组比色皿中加入2 mL底物溶液,0.9 mL pH 9的硼酸缓冲液,(100-X)μL pH 9的硼酸缓冲液和X μL脂肪氧化酶标准液,其中X的量分别为60、70、80、90、100 μL。对照组为1 mL pH 9的硼酸缓冲液,2 mL底物溶液。盖上盖子,同时翻转10次,时间控制在20 s,快速放入分光光度计中进行测量。记录样品在234 nm处的OD值变化情况,时间为3 min,时间间隔为0.1 s,每个样品测定2次。
对数据进行分析得到OD值变化随时间变化的直线关系,并计算出ΔOD/Δt值。以脂肪氧化酶标准品的浓度为横坐标,以ΔOD/Δt值为纵坐标,绘制出大豆脂肪氧化酶标准曲线。
1.2.6 生豆浆脂肪氧化酶浓度和活性的测定
脂肪氧化酶粗酶液的制备:取5 mL生豆浆在25℃、10 000 g的条件下离心15 min。取上清液1 mL于50 mL的容量瓶中定容。
实验同样参照蒋和体等提出的实验方法[1]进行,实验组比色皿中加入2 mL底物溶液,0.9 mL pH 9的硼酸缓冲液,100 μL粗酶液。对照组为1 mL pH 9的硼酸缓冲液,2 mL底物溶液。后续操作按1.2.5中的方法进行计算出ΔOD/Δt值。
豆浆中的脂肪氧化酶活性为:
式中:Q为脂肪氧化酶的活性;A为ΔOD/Δt值;B为稀释的倍数。
酶活单位定义为:用亚油酸作底物,在容积为3.0 mL(光径1 cm比色皿)中、pH 9.0、25℃的环境下,一个单位酶活力可以引起在234 nm处吸光值每分钟提高0.001。
1.2.7 电压对豆浆中脂肪氧化酶活性的影响
图1为本研究所采用的通电加热实验装置示意图。该实验装置由小型通电加热装置和数据采集系统组成。通电加热装置的加热槽由厚15 mm的聚丙烯板制成,电极采用304不锈钢板制成。将极板放入加热槽后,极板间距离为100 mm、有效宽度为100 mm,当300 mL豆浆加入后,极板的有效高度为30 mm。数据采集系统由HP数据采集器(HP34970A,HP公司)、霍尔电流传感器(A2-20A-3V,北京石新技术研究所)、T型热电偶和安装有Agilent BenchLink Data Logger软件的计算机等组成。通电加热的电压、频率及温度由数据采集器测量,测量时间间隔为10 s。电源的频率范围为1 Hz~20 kHz,电压范围0 V~250 V,波形为方波,其占空比为50%。
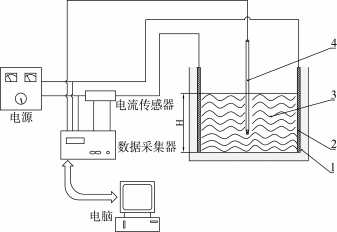
图1 通电加热装置示意图[5]
1-加热槽 2-极板 3-豆浆试样 4-热电偶
取300 mL豆浆放入加热槽中,研究表明电化学反应在低频时反应速率加快[20-22],为了降低电化学反应对实验的干扰,调节电源的频率为5 kHz,加热槽两端的电压分别为125、140、155、170 V,对豆浆进行加热,当温度达到75℃时,取出5 mL豆浆于离心管中,并快速放入事先准备好的冰水中进行冷却。采用1.2.6中的方法对各样品进行脂肪氧化酶活性的测定。
1.2.8 频率对豆浆中脂肪氧化酶活性的影响
取300 mL豆浆放入加热槽中,电源的电压设定为140 V,电源的频率分别设定为50 Hz、500 Hz、5 kHz、20 kHz,对豆浆进行加热,当温度达到75℃时,取出5 mL豆浆于离心管中,并快速放入事先准备好的冰水中进行冷却。采用1.2.6中的方法对各样品进行脂肪氧化酶活性的测定。
1.2.9 保温时间对豆浆中脂肪氧化酶活性的影响
取300 mL豆浆放入加热槽中,设定电源的频率为5 kHz、电源电压为140 V、加热终止温度为75℃。当达到加热终止温度时,通电加热装置将通过自动控制系统对豆浆进行保温。保温过程中,用秒表记录时间,分别在0、2、4、5、6 min时取出5 mL豆浆样品于离心管中并迅速放入冰水中冷却。采用1.2.6中的方法对各个样品进行脂肪氧化酶活性的测定。
酶活性的钝化采用一级动力学模型分析,模型表示为
式中:A-保温时间为t时的脂肪氧化酶活性,U;A0+A1-达到终止温度时的脂肪氧化酶活性,U;k-钝化速率常数,min-1;t-保温时间,min。
数据进行方差分析,显著性差异采用t检验测定,可信度为95%。动力学分析和拟合使用Software Microcal Origin 8.0软件。
1.2.10 对比油浴加热和通电加热对豆浆中脂肪氧化酶活性的影响
将油浴锅(DF-101S,河南宇科自动化仪器仪表设备有限公司)的油温加热到100℃,取300 mL豆浆放入烧杯中,在烧杯内加入磁力搅拌转子,同时将T型热电偶由玻璃棒固定在烧杯中豆浆的中下部,并避免与烧杯壁相接触。启动磁力搅拌器,确保豆浆的温度均匀。用Agilent BenchLink Data Logger软件记录豆浆的温度变化情况。在温度达到65、70、75、80、85℃时,分别取出5 mL豆浆样品至离心管中,迅速放入冰水中冷却。
取300 mL豆浆放入加热槽中,设定电源的频率为5 kHz。通过控制电源电压,使豆浆在通电加热条件下的加热历程与在油浴锅加热条件下的加热历程保持一致。同样在豆浆温度为65、70、75、80、85℃时,取出5 mL豆浆样品至离心管中,迅速放入冰水中冷却。
采用1.2.6中的方法对各样品进行脂肪氧化酶活性的测定。
2.1 大豆脂肪氧化酶标准曲线与生豆浆中脂肪氧化酶活性
图2显示了吸光度值随脂肪氧化酶浓度变化的关系曲线,如图所示,吸光度值与酶浓度呈线性关系,其回归方程如下:
式中:Y为ΔOD/Δt值,min-1;X为脂肪氧化酶标准液的浓度,mg/mL。
经测定生豆浆样品中,ΔOD/Δt值=0.005 77±0.000 12 min-1,根据公式(3)计算出生豆浆中脂肪氧化酶的浓度为0.150 mg/mL。有研究表明栽培大豆的蛋白含量为36%~54%[20],而脂肪氧化酶含量可以占到蛋白质含量的1%~2%,本文按照1∶10的豆水比制得的豆浆从理论上可以计算出脂肪氧化酶的浓度为0.36~1.08 mg/mL。在豆浆制备过程中,浸泡大豆和研磨打浆过程都会对脂肪氧化酶造成影响[21],所以本文测出的豆浆中脂肪氧化酶浓度合乎理论推断。由公式(1)计算可以得出,生豆浆脂肪氧化酶活性为:(2 885±6)U。

图2 标准酶浓度对吸光度值变化速率的影响
2.2 不同电压条件对豆浆中脂肪氧化酶活性的影响
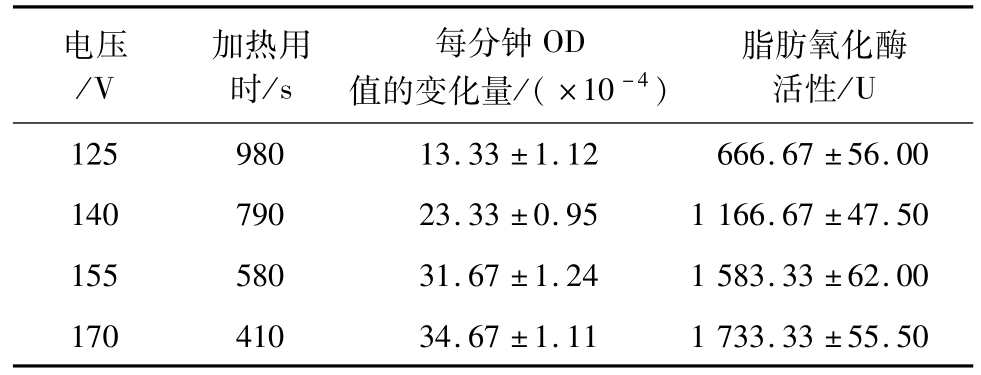
如表1所示,在不同的电源电压条件下,豆浆达到相同加热终止温度的时间具有较大差异。电压越高,豆浆加热到相同的温度所需要的时间就越短,豆浆中脂肪氧化酶活性越高。这是热效应和电场效应共同造成的结果。但并不能说明电场的强弱对脂肪氧化酶活性的影响。
表1 不同电压条件对豆浆中脂肪氧化酶活性的影响
2.3 相同加热历程条件下,不同加热方法对脂肪氧化酶活性的影响
图3显示了豆浆的加热终止温度为75℃时两种加热方法的加热历程。如图所示,通过调整电源电压可以保持豆浆的加热历程基本一致。
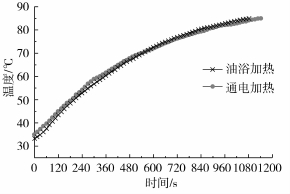
图3 两种加热方式的加热历程对比
图4显示了相同加热历程和相同加热终止温度条件下,不同加热方法对豆浆中脂肪氧化酶活性的影响。如图4所示,随着加热终止温度的提高,经两种加热方式处理后的豆浆脂肪氧化酶活性都逐渐降低,且降低趋势逐渐变缓,这是因为脂肪氧化酶包括3种同工酶,这3种同工酶的热稳定性不同,当脂肪氧化酶受热时,LOX3同工酶最易钝化,LOX2同工酶较易钝化,而LOX1同工酶的热稳定性最好[22]。随着终止温度的提高,LOX1在脂肪氧化酶中的比例逐渐增大,脂肪氧化酶的热稳定性变强。两种加热方式相比较可以看出,在每一个终止温度点,经通电加热处理的豆浆样品的脂肪氧化酶活性都明显低于经油浴加热处理的豆浆样品。如图3所示,经两种加热方式处理豆浆时,两种加热方式的加热历程是基本一致,热效应对于豆浆脂肪氧化酶活性的影响是相同的,由此可以证明,经两种加热方式处理的豆浆的脂肪氧化酶活性差异主要来自于电场对于脂肪氧化酶的影响。对比图4中的两条曲线可以看出,电场对脂肪氧化酶的钝化具有促进作用。在脂肪氧化酶中铁含量非常高,1 mol脂肪氧化酶中含有1 mol铁[14]。在脂肪氧化酶三种同工酶蛋白质分子结构中,肽链的C-末端均有一段40个氨基酸组成的保守区域,其中包括6个组氨酸和2个酪氨酸,作为酶蛋白的活性中心与Fe3+结合,从而调节酶的活性[23]。当铁离子从高自旋的Fe2+静态转变为高自旋的Fe3+态时,具有较高的催化活性[24-25]。通电加热方式处理豆浆样品时,电场可能作用于脂肪氧化酶活性中心的Fe3+,造成了铁离子价态的变化,从而使脂肪氧化酶的活性降低。通过两种加热方式的对比,表明电场处理对脂肪氧化酶的钝化具有促进作用。
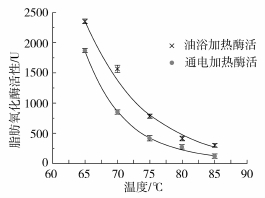
图4 两种不同加热方式下脂肪氧化酶活性随温度的变化
2.4 不同频率对豆浆中脂肪氧化酶活性的影响
实验中,4组样品均在设定的140 V电源电压下加热,但实际测得电源电压在140±2 V波动。导致4个样品的加热时间为836±14 s,误差为1.67%,认为加热的历程大致相同。
在相同的电源电压条件下,4个样品所经历的加热历程相同。可以排除热效应对脂肪氧化酶活性的影响。表2显示了在电源电压相同的条件下,电源频率对脂肪氧化酶活性的影响。对表2中4种样品的脂肪氧化酶活性进行显著性差异分析,可以得出当电源频率为50 Hz时通电加热处理的豆浆脂肪氧化酶活性极显著高于其他三个频率处理的样品的脂肪氧化酶活性。
表2 不同电场频率条件对脂肪氧化酶活性的影响

注:同列不含相同字母表示差异极显著(P<0.01)。
由此可以得出,加热电源频率对豆浆中脂肪氧化酶活性有影响,即较高的电源频率的通电加热方式对脂肪氧化酶的钝化有促进作用。许多研究发现,通电加热过程中会发生电化学反应,电化学反应在低频时反应速率加快[26-27]。当通电加热频率较高时,电化学反应速率下降,电极腐蚀减弱[28]。当电源频率处于50 Hz时,经通电加热方式处理后,样品的脂肪氧化酶活性较高。可能的原因是由于当电源频率较低时,通电加热过程中电化学反应相对剧烈,原本应当全部作用于豆浆的电能,其中的一部分在极板的电化学反应中消耗掉了,从而减少了电场对脂肪氧化酶钝化的作用,导致了豆浆在低频电场条件下脂肪氧化酶的活性较高。当电源的频率大于500 Hz时,电源电场频率的改变对于脂肪氧化酶活性影响较小。原因可能是当电源的频率大于500 Hz时,电源频率的改变并没有引起电化学反应速率的较大变化。
2.5 保温时间对豆浆中脂肪氧化酶活性的影响
如图5所示,电压为140 V、频率为5 kHz时豆浆在通电加热过程和保温过程中温度随时间的变化关系。从图5中可以看出,利用通电加热技术对豆浆进行加热时,可实现豆浆加热温度的精确控制。当豆浆加热至75℃时,脂肪氧化酶活性随保温时间的变化关系如图6所示,由图6可以看出,脂肪氧化酶活性与保温时间呈现出负指数关系,钝化过程符合一级动力学模型。利用公式(2)对通电加热处理后豆浆保温阶段脂肪氧化酶失活动力学进行拟合,拟合结果如表3所示。
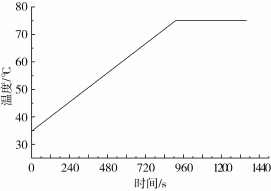
图5 通电加热处理豆浆样品的加热历程

图6 通电加热处理后,不同保温时间条件下豆浆中脂肪氧化酶活性随保温时间的变化
由表3可以看出,在通电加热处理条件下,利用一级动力学模型拟合脂肪氧化酶的钝化动力学的决定系数R2为0.999 6,表明通电加热处理对脂肪氧化酶钝化动力学与豆浆中脲酶的钝化动力学[29]类似,符合一级动力学模型。
表3 通电加热处理对豆浆中脂肪氧化酶热钝化动力学参数
以大豆(荷豆12)为实验材料,按1∶10的豆水比制备的生豆浆中,脂肪氧化酶的浓度为0.15 mg/ mL,活性为2 885 U。利用通电加热方法处理豆浆时,当加热终止温度相同时,较低的电源电压有利于脂肪氧化酶钝化。在保温阶段,脂肪氧化酶的钝化符合一级动力学方程,活性随保温时间的延长而降低,并且脂肪氧化酶活性的钝化速率逐渐地变慢。较高的电源频率能够促进脂肪氧化酶的钝化,而当电源频率高于500 Hz时,电源频率的改变对脂肪氧化酶活性的影响并不显著。电场对豆浆中脂肪氧化酶的钝化具有促进作用,其机理可能是电场作用于脂肪氧化酶活性中心的Fe3+,造成了铁离子价态的变化,从而使脂肪氧化酶的活性降低。
参考文献:
[1]蒋和体,今泉勝己,佐藤匡央.大豆脂肪氧化酶酶活性变化研究[J].中国粮油学报,2006,21(3):133-135.
[2]DAVIES C S,NIELSEN N C.Genetic analysis of a null-allele for liPoxygenase-2 in soybean[J].Crop Sci,1986,27(3):370-371.
[3]KITAMURA.K.Biochemical characterization of lipoxygenase lackingmutants,L-1-Iess,L-2-less and L-3-less soybeans[J]. Agric Biol Chem,1984,48(9):2339-2346.
[4]张福彦,陈锋,张建伟,等.小麦籽粒脂肪氧化酶研究进展[J].麦类作物学报,2014,8:1067-1075.
[5]陈晨.豆浆连续通电加热工艺与装置优化设计[D].泰安:山东农业大学,2015.
[6]KATO Y,MATSUDA T.Glycation of proteinous inhibitors:loss in trypsin inhibitory activity by the blocking of arginine and lysine residues at their reactive sites[J].Journal of Agricultural&Food Chemistry,1997,45(10):3826-3831.
[7]VASCONCELOS I M,MAIA A A B,SIEBRA E A,et al.Nutritional study of two Brazilian soybean(Glycine max)cultivars differing in the contents of antinutritional and toxic proteins[J].Journal of Nutritional Biochemistry,2001,12(1):55-62.
[8]BAUR C,GROCH W,WIESER H,et al.Enzymatic oxidation of linoleic acid:formation of bittertasting fatty acids[J].Zeitschrift fur Lebensmittel-Untersuchung und-Forschung,1977,164(2): 171-176.
[9]OBATA A,MATSUURA M,KITAMURA K.Degradation of sulfhydryl groups in soymilk by lipoxygenases during soybean grinding[J].Bioscience Biotechnology Biochemistry,1996,60(8): 1229-1232.
[10]李里特.食品物性学[M].北京:中国农业出版社,1998:264-268.
[11]SASTRY S K,BARACH J T.Ohmic and inductive heating[J]. Journal of Food Science,2000,65(s8):42-46.
[12]KNIRSCH M C,SANTOS C A,VICENTE AA M D S,et al.Ohmic heating-a review[J].Trends Food Sci Tech,2010,21(9): 436-441.
[13]LI FADE,CHENCHEN,REN JIE,et al.Effect of ohmic heating of Soymilk on Urease Inactivation and Kinetic Analysis in Holding Time[J].Journal of Food Science,2015,80(2):E307-E315.
[14]张雪丹.大豆脂肪氧化酶的鉴定、纯化及其漂白β-胡萝卜素的酶学特性研究[D].南京:南京农业大学,2008.
[15]KANOFSKY J R,AXELROD B.Singlet oxygen production by soybean lipoxygenase ioszymes[J].Biol Chem,1986,261(3): 1099-1104.
[16]王璋.食品酶学[M].北京:中国轻工业出版社,1994:279-291.
[17]石胜尧,张延坤,郭大发,等.大豆脂肪氧化酶活性的测定[J].营养学报,1996,3:354-357.
[18]李迎秋.脉冲电场对大豆蛋白理化性质和脂肪氧化酶的影响[D].无锡:江南大学,2007.
[19]王韧.超高压对大豆脂肪氧合酶、营养抑制因子和蛋白性质的影响[D].无锡:江南大学,2008.
[20]王芳,冯冲,简在荣,等.大豆蛋白含量多样性分析[J].安徽农业科学.2012,40(11):6403-6405.
[21]赵晓园.大豆脂肪氧化酶活性影响因素研究及其应用[D].合肥:合肥工业大学,2007.
[22]ASSIRY A,SASTRY S K,SAMARANAYAKE C.Degradation kinetics of ascorbic acid during ohmic heating with stainless steel electrodes[J].Journal of Applied Electrochemistry,2003,33(2): 187-196.
[23]SHIBATA D,STECZKO J,DIXON J E,et al.Primary structure of soybean liPoxygenase L-2[J].Journal of Biology and Chemistry,1988,263(14):6816-6821.
[24]SRINIVASULU S.The detection of kinetic intermediates during the unfolding of liPoxygenase-1 by Urea or guanidine hydrochloride[J].Biochim BioPhys Acta,1996,1294(2):115-120.
[25]蔡琨.大豆脂肪氧合酶好氧催化合成亚油酸氢过氧化物[D].无锡:江南大学,2004.
[26]MERCALI G D,JAESCHKE D P,TESSARO I C,et al.Study of vitamin C degradation in acerola pulp during ohmic and conventional heat treatment[J].LWT-Food Science and Technology,2012,47(1):91-95.
[27]QIHUA T,JINDAL V K,VAN WINDEN J.Design and performance evaluation of an ohmic heating unit for liquid foods[J].Computers and Electronics in Agriculture,1993,9(3):243-253.
[28]BANSAL B,CHEN X D.Effect of temperature and power frequency on Milk fouling in an ohmic heater[J].Food and Bioproducts Processing,2006,84(C4):286-291.
[29]ILLEOVA V,POLAKOVIC M,STEFUCA V,et al.Experimental modeling of thermal inactivation of urease[J].Journal of Biotechnology,2003,105(3):235-243.
Effects of ohmic heating on the activity of lipoxygenase in soymilk
HAN Jian-fei1,SHAN Chang-song2,WANG Shao-gang1,SONG Zhan-hua1,WU Peng2,LI Fa-De1
(1.College of Mechanical and Electronic Engineering,Shandong Agricultural University,Tai′an Shandong 271018;2.College of Food Science and Engineering,Shandong Agricultural University,Tai′an Shandong 271018)
Abstract:To investigate the effects of power voltage,frequency and holding warm time on the activity of lipoxygenase in soymilk,ohmic heating and conventional heating(oil bath heating)for the soymilk were employed.The results showed that by ohmic heating the lipoxygenase activity of soymilk increased with the increasing of voltage;the higher power frequency had a significant effect on the passivation of lipoxygenase;but a little effect on lipoxygenase activity when power frequency exceeded 500 Hz;extending holding warm time and the electric field accelerated the passivation of lipoxygenase.This investigation could have positive instructive effects on the design and production of ohmic heating equipment.
Key words:ohmic heating;soymilk;lipoxygenase;inactivation
中图分类号:TS 214.2
文献标识码:A
文章编号:1007-7561(2016)03-0049-06
收稿日期:2015-11-21
基金项目:国家自然科学基金(31171759);山东省自然科学基金(ZR2011CM028);山东省科技发展计划(2013GNC11307)
作者简介:韩健飞,1990年出生,男,硕士研究生.
通讯作者:李法德,1965年出生,教授,博导.